SEMANA No 6 ESTEQUIOMETRA ESTEQUIOMETRA Parte de la

















- Slides: 17

SEMANA No. 6 ESTEQUIOMETRÍA

ESTEQUIOMETRÍA Parte de la química que se encarga del estudio de las relaciones cuantitativas entre elementos o compuestos que participan en reacciones químicas. La palabra se deriva de los vocablos griegos: STOICHEION: elemento o sustancia. METRON: medir.

Las relaciones cuantitativas, se expresan generalmente en unidades de masa: mol, g, lb etc. (gases: indicadores de volumen y presión). En las soluciones se puede utilizar la concentración para hacer los cálculos estequiométricos.

PESO ATÓMICO: Masas relativas de los elementos, que son el promedio de los pesos de los isótopos del elemento. Se obtiene en la tabla periódica en uma, pero puede ser expresado en cualquier unidad de masa.

� MOL: cantidad de una sustancia cuya masa en gramos es igual al peso molecular de la sustancia. Un peso molecular= 1 mol Un mol= 6. 022 x 1023 átomos, moléculas, fórmulas unitarias o iónes (No. De Avogadro).

PESO MOLECULAR: Es la suma de las masas atómicas de todos los átomos de una molécula de un compuesto específico. Ej. H 2 SO 4 2 H 1 x 2 2. 0 S 32. 0 4 O 4 x 16 64. 0 PM 98. g (1 MOL)

Ej. N 2(g) + 3 H 2(g) 2 NH 3(g) Los coeficientes numéricos que permiten balancear la ecuación indican que 1 mol de N 2 gaseoso, reacciona con 3 moles de H 2 gaseoso para producir 2 moles de amoníaco.

Leyes Ponderales de la Materia Con la aplicación de éstas leyes, se pueden realizar los cálculos estequiométricos. • Ley de la Conservación de la Masa: Enunciada por el químico francés Antonio Lavoissier originalmente como “La masa no se crea, no se destruye, solamente se transforama”.

Por lo tanto no hay un cambio detectable en la masa durante el transcurso de una reacción química. N 2(g) + 3 H 2(g) 2 NH 3(g) • Ley de las Proporciones definidas: Propuesta por Joseph Proust, nos dice que “un compuesto puro consiste siempre en los mismos elementos combinados en la misma proporción de peso”. Ej. H 2 SO 4 2 H: 1 S: 4 O

Ejercicios 1. Cuál es el peso atómico gramo de: a. S b. Al 2. Cuál es el peso molecular gramo de: C 6 H 12 O 6 3. Cuál es el peso fórmula de: Na 2 SO 4 4. A cuántos moles corresponden : a. 2 g de Ag b. 22 g de Na. Cl

5. A cuántos milimoles corresponden: a. 0. 253 moles de KCl b. 12 g de NH 3 6. Cuantos g hay en: a. 0. 753 moles de Fe 7. Cuantos g hay en: a. 0. 5 m moles de H 2 O b. 3. 5 moles de Mg(OH)2

� Cálculo de Moles a Moles (trabajar con coeficientes) Para la siguiente ecuación calcule: N 2(g) + 3 H 2(g) 2 NH 3(g) � Cuántos moles de NH 3 se producen a partir de 10. 8 moles de H 2? 3 moles H 2 10. 8 moles H 2 2 moles NH 3 X NH 3

� Cálculo de Gramos a Gramos � Cuántos gramos de oxígeno gaseoso se necesitan para quemar 10 gramos de alcohol etílico, C 2 H 5 OH? C 2 H 5 OH + 3 O 2(g) 2 CO 2 + 3 H 2 O

Resolución 10 g ¿ g? C 2 H 5 OH + 3 O 2 2 CO 2 + 3 H 2 O 46 g 96 g 10 g x R. 20. 86 g de O 2

Cálculo de Moles a Gramos Calcule cuántos gramos de sulfuro de plomo(II) se pueden oxidar con 5. 22 moles de oxígeno gaseoso. � 2 Pb. S(s) +3 O 2(g) 2 Pb. O(s) + 2 SO 2(g)

Porcentaje de Composición % = Peso del elemento en el compuesto * 100 Peso del compuesto 1. Calcule el porcentaje de composición de cada uno de los elementos que forman el HNO 3.

FIN
 Estequiometra
Estequiometra 20000x160
20000x160 Estequiometra
Estequiometra Te invitamos a participar
Te invitamos a participar Este parte aquele parte
Este parte aquele parte Comprobacion de multiplicacion
Comprobacion de multiplicacion Partes da missa
Partes da missa A semana cv
A semana cv Y el primer dia de la semana biblia
Y el primer dia de la semana biblia Modulo 23 semana 2 fase 3
Modulo 23 semana 2 fase 3 Adonde vas ahora a la clase de matematicas
Adonde vas ahora a la clase de matematicas Forno a lenha tem crase
Forno a lenha tem crase Gracias en kichwa
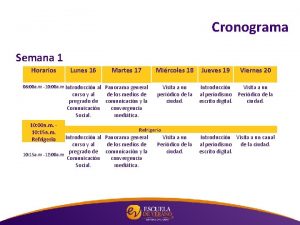
Gracias en kichwa Cronograma de la semana
Cronograma de la semana Ascentofsafed
Ascentofsafed Gastrulacion
Gastrulacion Y el primer dia de la semana biblia
Y el primer dia de la semana biblia Semana internacional esan
Semana internacional esan