SEMANA 6 ESTEQUIOMETRA QUMICA 2021 1 SEMANA 06




















- Slides: 21

SEMANA 6 ESTEQUIOMETRÍA QUÍMICA 2021 1

SEMANA 06 - ESTEQUIOMETRÍA Definición de mol y Número de Avogadro. Masa molar, milimol (mmol). Ley de la Conservación de la Masa. Ley de las Proporciones definidas. Porcentaje de composición. Cálculos estequiométricos. Laboratorio: Leyes Estequiométricas 2

Estequiometría: Parte de la Química que estudia las relación entre las cantidades de reactivos y productos que intervienen en las reacciones químicas. Estas cantidades las trabajaremos en gramos, moles, milimoles y porcentaje. En una ecuación química ¿donde encontramos la información de estas cantidades? En los coeficientes y los subíndices. 4 Fe + 3 O 2 2 Fe 2 O 3 3

¿Que es Mol ? • Es la medida básica en química. • Un mol contiene 6. 02 x 10 23 unidades de sustancia. • Estas unidades de sustancia pueden ser de átomos, iones ó moléculas. 6. 02 x 10 23 se conoce como Número de Avogadro • Además, 1 mol corresponde a: - 1 peso atómico en gramos si es un elemento ó - 1 peso molecular en gramos si es un compuesto. (se busca en la tabla periódica) 4

¿A que equivale un MOL? • 1 mol de átomos de H = 6. 02 x 10 23 átomos de H y también 1 mol de H = 1 gramo de H (o sea su peso atómico). • 1 mol de moléculas H 2 = 6. 02 x 10 23 moléculas de H 2 y también 1 mol de H 2 = 2 gr de H 2 • 1 mol del compuesto H 2 O = 6. 02 x 10 23 moléculas de H 2 O y también es = 18 g. de H 2 O (o sea su peso molecular o PM) • 1 mol de iones fosfato PO 4 -3 = 6. 02 x 10 23 de iones fosfato = 94. 97 g de PO 4 -3 1 mol = 1000 milimoles (o mmol). . 5

MASA O PESO MOLAR (es el peso de 1 mol) • Peso ó masa atómica: es el peso de un elemento expresado en gramos y se encuentra en la Tabla Periódica. Ej: Ca = 40. 04 gramos (es el peso de 1 mol de Calcio). • Peso molecular: es la suma de los pesos atómicos de todos los átomos de un compuesto. Se multiplican por los subíndices. Ej: Fe 2 O 3 = 159. 6922 = 159. 69 (peso de 1 mol de Fe 2 O 3). 6

Todas estas cantidades de sustancia equivalen a 1 mol S 32 g S Fe 55. 9 g Fe Na. Cl 58. 5 g Na. Cl K 2 Cr 2 O 7 294 g K 2 Cr 2 O 7 SACAROSA O AZUCAR C 12 H 22 O 11 342 g C 12 H 22 O 11 7

Ejercicio: Calcular el peso molecular ( 1 PM) de estos compuestos: C 12 H 22 O 11 : C = 12. 011 g x 12 = 144. 132 g + H = 1. 0079 g x 22 = 22. 174 g + O = 15. 999 g x 11 = 175. 99 g Total 342. 29 g = 1 peso molecular (PM) 1) KCl. O 3 = 2) Mg 3(PO 4)2 = 3) Mg(OH)2 = 4) C 6 H 12 O 6 = 8

Ejercicios de convertir moles ↔ gramos 1) ¿Cuantos gramos y cuantos milimoles (mmoles) hay en un mol de los siguientes compuestos? a) C 12 H 22 O 11 =1 mol= 342 g =1000 mmoles b) H 2 SO 4 2) ¿Cuantos moles y milimoles (mmoles) hay en? a)50 g de H 2 O b)75 g de Zn. SO 4 c)18 g de KMn. O 4 2 b) 161. 39 g de Zn. SO 4 ------1 mol de Zn. SO 4 75 g de Zn. SO 4 -----X mol 3) ¿Cuantos gramos hay en? a) 538 milimoles CO 2 b) 0. 3 moles de NH 3 c) 87. 3 milimoles de H 2 CO 3 3 c) 1000 mmoles de H 2 CO 3 -----62 g de H 2 CO 3 87. 3 mmoles de H 2 CO 3 ------- X g X= 75 x 1 = 0. 46 mol de Zn. SO 4 161. 39 x 1000 = 460 mmoles de Zn. SO 4 X= 87. 3 x 62 = 5. 41 g H 2 CO 3 1000 9

Leyes Estequiométricas • Ley de la Conservación de la Materia: La materia no se crea ni se destruye, solo se transforma. En las reacciones químicas (ecuaciones balanceadas) la masa ó peso inicial de los reactivos debe ser igual a la masa o peso de los productos. 4 Fe + 3 O 2 2 Fe 2 O 3 gramos de reactivos = gramos de productos 159. 69 g = 159. 69 g 10

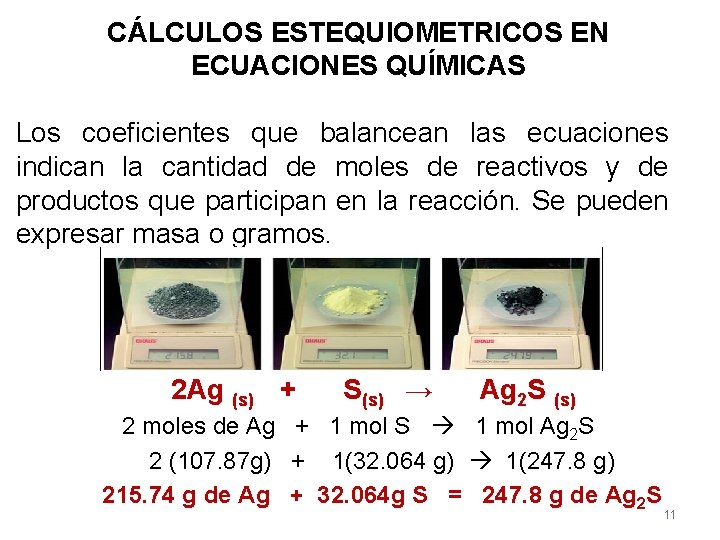
CÁLCULOS ESTEQUIOMETRICOS EN ECUACIONES QUÍMICAS Los coeficientes que balancean las ecuaciones indican la cantidad de moles de reactivos y de productos que participan en la reacción. Se pueden expresar masa o gramos. 2 Ag (s) + S(s) → Ag 2 S (s) 2 moles de Ag + 1 mol S 1 mol Ag 2 S 2 (107. 87 g) + 1(32. 064 g) 1(247. 8 g) 215. 74 g de Ag + 32. 064 g S = 247. 8 g de Ag 2 S 11

Cálculos estequiométricos Mg + H 3 PO 4 Mg 3(PO 4)2 + H 2 Para hacer cálculos estequiométricos la ecuación (reacción) debe estar BALANCEADA 3 Mg + 2 H 3 PO 4 Mg 3(PO 4)2 + 3 H 2 La ecuación dice lo siguiente: • 3 moles de Mg reaccionan con 2 moles de H 3 PO 4 y forman o producen 1 mol de Mg 3(PO 4)2 y 3 moles de H 2 12

También dice lo siguiente: • 72. 93 gramos de Mg reaccionan con 195. 94 g de H 3 PO 4 y producen 262. 87 g de Mg 3(PO 4)2 y 6 g de H 2 3 Mg + 2 H 3 PO 4 Mg 3(PO 4)2 + 3 H 2 Calcular lo siguiente: 1. ¿Cuántos moles de H 2 se producen al reaccionar 7. 5 moles de H 3 PO 4 con suficiente Mg? 2 moles de H 3 PO 4 ------ 3 moles de H 2 7. 5 moles de H 3 PO 4 ------ X moles de H 2 X= 7. 5 x 3 = 11. 25 moles 2 otra forma: 2 = 7. 5 X= 3 x 7. 5 =11. 25 mol 3 X 2 13

3 Mg + 2 H 3 PO 4 Mg 3(PO 4)2 + 3 H 2 2. ¿Cuántos gramos de Mg 3(PO 4)2 se producen al reaccionar 0. 6 moles de Mg con suficiente H 3 PO 4? 3 moles de Mg ----262. 81 g de Mg 3(PO 4)2 X= 0. 6 x 262. 81 = 52. 56 gramos 0. 6 moles Mg ------- X g de Mg 3(PO 4)2 3 3. ¿Cuántos gramos de Mg deben de reaccionar para producir 2, 500 milimoles de Mg 3(PO 4)2 ? 72. 94 g de Mg ------1000 mmol de Mg 3(PO 4)2 X g de Mg ----- 2500 mmol de Mg 3(PO 4)2 X= 2500 x 72. 94 = 182. 35 g de Mg 1000 4. ¿Cuántos moles de Mg se necesitan para reaccionar con 6. 2 moles de H 3 PO 4? 3 moles de Mg ------2 moles de H 3 PO 4 X moles de Mg ----- 6. 2 mol de H 3 PO 4 X= 6. 2 x 3 = 9. 3 moles de Mg 2 5. ¿Para producir 100 gramos de H 2 ¿Cuántos gramos de H 3 PO 4 deben de reaccionar? 195. 94 g de H 3 PO 4 ------- 6 g de H 2 X g de H 3 PO 4 -------100 g de H 2 X= 100 x 195. 94 = 3265. 66 g de H 3 PO 4 6 14

Los cálculos estequiométricos se hacen en la ecuación BALANCEADA EJERCICIOS: 1. Cuántos moles y milimoles de sulfuro de plata (Ag 2 S) se producen cuando reacciona 0. 4 moles de Ag con suficiente S en la siguiente reacción? 2 Ag (s) + S(s) → Ag 2 S (s) (balancearla) 15

2. ¿Cuántos moles de NO se producen a partir de 50 milimoles de Cu en la ecuación: 3 Cu + 8 HNO 3→ 3 Cu(NO 3)2 + 2 NO + 4 H 2 O 3. El oxido de hierro (III) reacciona con carbono para producir hierro y monóxido de carbono. En la siguiente reacción. Fe 2 O 3 (s) + 3 C (s) → 2 Fe (s) + 3 CO(g) a) ¿Cuántos gramos de C se necesitan para reaccionar con 2. 5 moles de Fe 2 O 3 ? con RFRRrrrrrrr 2. 5 moles de Fe 2 O 3? 16

b) ¿Cuantos gramos de CO se producen cuando reaccionan 16 g de C? 4. Según la ecuación 2 C 2 H 6+ 7 O 2→ 4 CO 2+ 6 H 2 O a) ¿Cuántos mmoles de C 2 H 6 se necesitan para producir 75 g de CO 2? b) ¿Cuantos gramos de H 2 O pueden producirse a partir de 62. 5 g de C 2 H 6 ? 17

5. De acuerdo a la siguiente reacción: C 3 H 8 + O 2 CO 2 + H 2 O (balancearla) a) Calcule los moles de H 2 O formados (producidos) a partir de 320 g de C 3 H 8 b) Los g de O 2 necesarios para combinarse (reaccionar) con 100 g de C 3 H 8 18

Ley de las proporciones definidas: • Un compuesto siempre estará formado por los mismos elementos y en la misma proporción de masa o peso. Se demuestra con el Porcentaje de composición. • Ej: el agua (H 2 O) sea del chorro, de rio, de glaciar, de mar, de pozo, ya sea de 1 vaso, 1 gota, 1 mililitro, 1 garrafón, etc, • Siempre estará formada por una proporción de: 88. 81 % de oxígeno y 11. 19 % de hidrógeno. 19

Porcentaje de composición (%): (Ley de las proporciones definidas) Ej: Calcule el % de composición de cada elemento en el siguiente compuesto: Ba(NO 3)2 • % de Ba, N y O • El 100% de composición del Ba(NO 3)2 corresponde a su peso molecular (suma de los pesos atómicos de cada uno) = 1 Ba + 2 N + 6 O= 137. 33 g + 28 g + 96 g = 261. 33 g Si el 100% de composición del Ba(NO 3)2 corresponde a 261. 33 g entonces: 100% de Ba(NO 3)2 ------261. 33 g X % de Ba ------- 137. 33 g X= 137. 33 x 100 = 52. 55 % de Ba 261. 33 137. 33 g de Ba corresponden al 52. 55 % 28 g de N corresponden al 10. 71 % 96 g de O corresponden al 36. 74 % TOTAL: 100. 00 % 20

Calcule el % de composición de cada elemento en los siguientes compuestos: 1. 2. 3. 4. 5. % de Na en el Na. OH % de O en Mg(OH)2 % de Mn en KMn. O 4 % de H en H 2 SO 4 % de Mg, P y O en Mg 3(PO 4)2 5) ¿% O? 100% de Mg 3(PO 4)2 ------262. 87 g X % de O ------- 128 g X= 128 x 100 = 48. 69 % de O 262. 87 21







































