Estequiometra 2 PSU Qumica Miss Romina Vergara C















- Slides: 21

Estequiometría 2 PSU Química Miss Romina Vergara C 2020

Contenido de la Clase Reactivo Limitante Reactivo en Exceso Porcentaje Rendimiento Análisis % compuestos químicos Determinación Fórmula Empírica y Molecular

Objetivos • Determinar el reactivo limitante en una ecuación química. • Diferenciar entre el rendimiento teórico y real de una reacción química. • Determinar el % de rendimiento de una reacción química. • Determinar la Fórmula Empírica y Molecular.

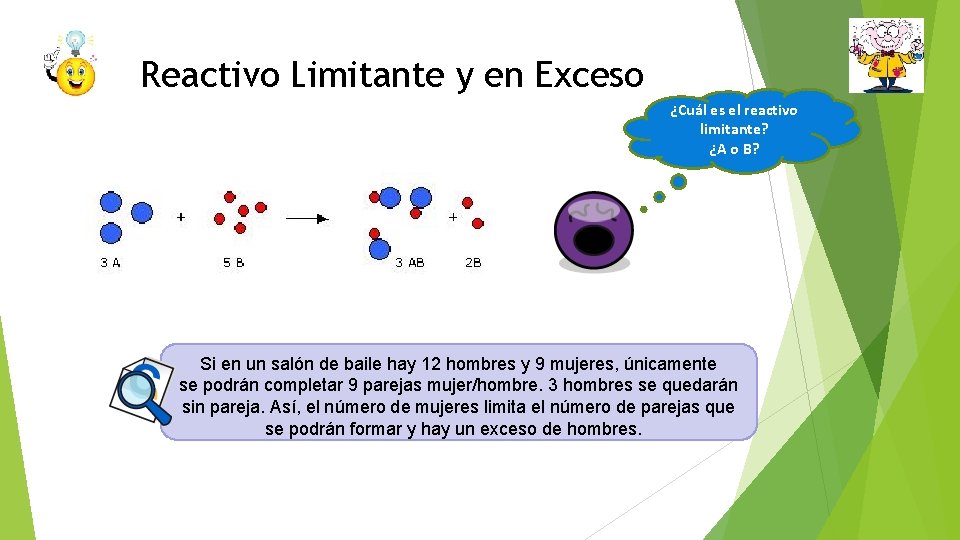
Reactivo Limitante y en Exceso El reactivo que se consume primero en una reacción, recibe el nombre de reactivo limitante, ya que la máxima cantidad de producto que se puede formar depende de la cantidad de este reactivo que hay inicialmente. Cuando este reactivo se consume, no se puede formar más producto. Los reactivos en exceso son los reactivos que se encuentran presentes en mayor cantidad que la necesaria para reaccionar con la cantidad de reactivo limitante.

Reactivo Limitante y en Exceso ¿Cuál es el reactivo limitante? ¿A o B? Si en un salón de baile hay 12 hombres y 9 mujeres, únicamente se podrán completar 9 parejas mujer/hombre. 3 hombres se quedarán sin pareja. Así, el número de mujeres limita el número de parejas que se podrán formar y hay un exceso de hombres.

Ejemplo En una reacción, 135 g de aluminio (Al) reaccionan con 640 g de óxido férrico (Fe 2 O 3) 2 Al + Fe 2 O 3 → Al 2 O 3 + 2 Fe Calcule los gramos de Al 2 O 3 formado e identifique el reactivo limitante.

Ejemplo Transformamos los gramos de ambos compuestos a mol: Teniendo la siguiente relación estequiométrica,

Ejemplo • Todos los mol de Al (5 mol) reaccionan con 2, 5 mol de Fe 2 O 3, por lo que el reactivo limitante es el aluminio (Al). • Sobran 1, 5 mol de Fe 2 O 3 (inicialmente se tenían 4 moles de Fe 2 O 3), por lo tanto este compuesto es el reactivo en exceso. • El reactivo limitante es el que se utiliza para calcular la cantidad de producto obtenido a partir de las relaciones estequiométricas:

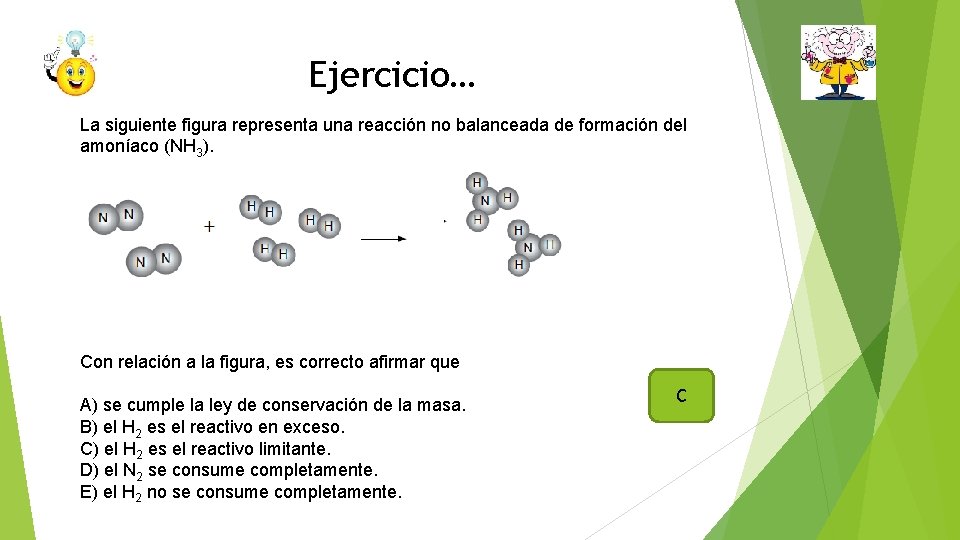
Ejercicio… La siguiente figura representa una reacción no balanceada de formación del amoníaco (NH 3). Con relación a la figura, es correcto afirmar que A) se cumple la ley de conservación de la masa. B) el H 2 es el reactivo en exceso. C) el H 2 es el reactivo limitante. D) el N 2 se consume completamente. E) el H 2 no se consume completamente. C

Rendimiento de una Reacción La cantidad de producto que debiera formarse si todo el reactivo limitante se consumiera en la reacción, se conoce con el nombre de rendimiento teórico A la cantidad de producto realmente formado se le llama simplemente rendimiento o rendimiento de la reacción. Es claro que siempre se cumplirá la siguiente desigualdad Rendimiento de la reacción ≤ rendimiento teórico

Ejemplo La reacción de 6, 8 g de H 2 S con exceso de SO 2, según la siguiente reacción, produce 8, 2 g de S. ¿Cual es el rendimiento? 2 H 2 S + SO 2 → 3 S + 2 H 2 O En esta reacción, 2 mol de H 2 S reaccionan para dar 3 mol de S. 1) Se usa la estequiometría para determinar la máxima cantidad de S que puede obtenerse a partir de 6, 8 g de H 2 S. 2 mol de H 2 S → 3 mol de S 0, 2 mol de H 2 S → X mol de S X= 0, 3 mol de S m =0, 3 mol x 32 g/mol = 9, 6 g de S

Ejemplo 2 H 2 S + SO 2 → 3 S + 2 H 2 O En esta reacción, 2 mol de H 2 S reaccionan para dar 3 mol de S. 1) Se usa la estequiometría para determinar la máxima cantidad de S que puede obtenerse a partir de 6, 8 g de H 2 S. 2 mol de H 2 S → 3 mol de S 0, 2 mol de H 2 S → X mol de S X= 0, 3 mol de S m =0, 3 mol x 32 g/mol = 9, 6 g de S

Ejemplo 2) Se divide la cantidad real de S obtenida por la máxima teórica, y se multiplica por 100. ¿Por qué razón las reacciones químicas no tienen un 100% de rendimiento? ü Es posible que no todos los productos reaccionen ü Es posible que haya reacciones laterales que no lleven al producto deseado ü La recuperación del 100% de la muestra es prácticamente imposible

Ejercicio El ácido bromhídrico (HBr) y el ácido sulfúrico (H 2 SO 4) reaccionan según la ecuación H 2 SO 4 + 2 HBr → SO 2 + Br 2 + 2 H 2 O Considerando que la reacción tiene un rendimiento del 90%, ¿cuántos mol de Br 2 se obtendrán a partir de 6 mol de HBr? A) 2, 7 mol B) 3, 0 mol C) 5, 4 mol D) 6, 0 mol E) 10, 8 mol A

Composición % de Compuestos Químicos La composición porcentual establece el porcentaje en masa de cada elemento presente en un compuesto. % = n x PM elemento x 100 PM compuesto A partir de la fórmula química se calcula la masa molecular o la masa de fórmula de la sustancia

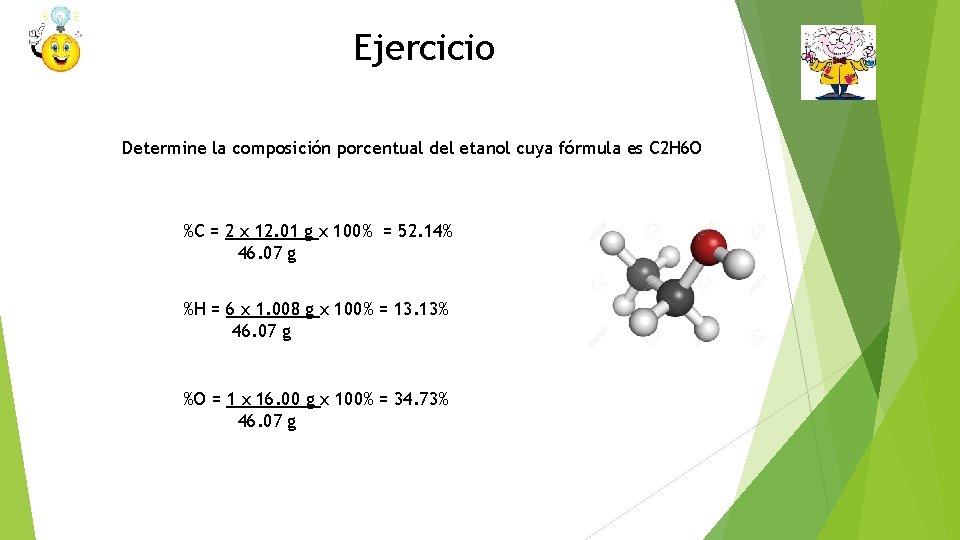
Ejercicio Determine la composición porcentual del etanol cuya fórmula es C 2 H 6 O %C = 2 x 12. 01 g x 100% = 52. 14% 46. 07 g %H = 6 x 1. 008 g x 100% = 13. 13% 46. 07 g %O = 1 x 16. 00 g x 100% = 34. 73% 46. 07 g

Fórmula Empírica Es la fórmula de una sustancia escrita con los subíndices enteros más pequeños. Para la mayoría de las sustancias iónicas la fórmula empírica es la fórmula del compuesto, con frecuencia este no es el caso para las sustancias moleculares.

Ejercicio Determine la fórmula de un compuesto que tiene la siguiente composición porcentual en peso: 24. 75 % K, 34. 77 % Mn, 40. 51 % O 24. 75 g K x 1 mol K = 0. 6330 mol K 39. 10 g K 34. 77 g Mn x 1 mol Mn = 0. 6329 mol Mn 54. 94 g Mn 40. 51 g O x 1 mol O = 2. 532 mol O 16 g O 0. 6330 ~ 1. 0 0. 6329 = 1. 0 0. 6329 2. 532 ~ 4. 0 0. 6329 Fórmula mínima = KMn. O 4

Fórmula Molecular La fórmula molecular del compuesto es la que contiene la cantidad real de los átomos de cada elemento presente en una molécula del compuesto. La fórmula molecular se determina a partir de la fórmula empírica y de la masa molecular del compuesto La fórmula molecular es un múltiplo de la fórmula mínima. La fórmula molecular se puede obtener entonces multiplicando los subíndices de la fórmula empírica por n. n = masa molecular masa formular empírica

Ejercicio La masa molar de un compuesto formado por carbono e hidrógeno es 28 g/mol. Si tiene un 14, 28% de hidrógeno, determine su fórmula empírica y molecular. Debemos obtener los moles de átomos de cada componente, considerando que si tiene un 14, 28 % de hidrógeno, tendrá 85, 72% de carbono n. C = 85, 72 g de C × 1 mol de C = 7, 14 ����� C 12 g C n. H = 14, 28 gramos de H × 1 mol de H = 14, 28 ����� H 1 g. H Después de que tenemos los moles, dividimos por el número menor de moles. En este caso 7, 14 Carbono: 7, 14 = 1 7, 14 Hidrógeno: 14, 28 = 2 7, 14

Ejercicio Entonces la relación de masas es 1: 2, siendo la fórmula empírica: C 1 H 2, que se escribe CH 2. Si determinamos la masa molar podemos verificar si la fórmula empírica es igual a la fórmula molecular. La masa molar del CH 2 es 14 g/mol, y nos están diciendo que nuestro compuesto tiene masa molar 28 g/mol (en el enunciado). Como debemos obtener 28 g/mol, solamente es necesario amplificar los valores de los subíndices, por dos, ya que: 28 g mol (masa formula molecular) = 2 14 g mol (masa formula empiica) La fórmula empírica es CH 2 (masa molar= 14 g/mol) y la fórmula molecular es C 2 H 4 (masa molar=28 g/mol). Fórmula molecular = C 2 H 4
 Romina vergara
Romina vergara Estequiometra
Estequiometra 20000x160
20000x160 Estequiometra
Estequiometra Ana mara
Ana mara Dante vergara
Dante vergara Ubaldo roldan vergara
Ubaldo roldan vergara Eider oñate vergara
Eider oñate vergara Mara vergara
Mara vergara Ing. segundo fausto roncal vergara
Ing. segundo fausto roncal vergara Pedagohiya
Pedagohiya Romina graiver
Romina graiver Boklunder sausage review
Boklunder sausage review Romina rot
Romina rot Romina ghassemi
Romina ghassemi Dr terrasi romina
Dr terrasi romina Kinisio
Kinisio Adriana ascencio
Adriana ascencio Romina gingaşu
Romina gingaşu Doctora romina gianini
Doctora romina gianini Na y cl
Na y cl Qumica
Qumica