Dijagramikorisne informacije o redoks reakcijama u otopini n










![elektron – ne postoji kao vrsta u otopini [e°]- aktivnost elektrona nema fizički smisao elektron – ne postoji kao vrsta u otopini [e°]- aktivnost elektrona nema fizički smisao](https://slidetodoc.com/presentation_image_h2/cb73d4f8617ab4994ee03cbf11d7711f/image-16.jpg)










- Slides: 37

Dijagrami-korisne informacije o redoks reakcijama u otopini n Latimerov dijagram n Frostov dijagram n Pourbaix-ov dijagram n p. E-p. H dijagram

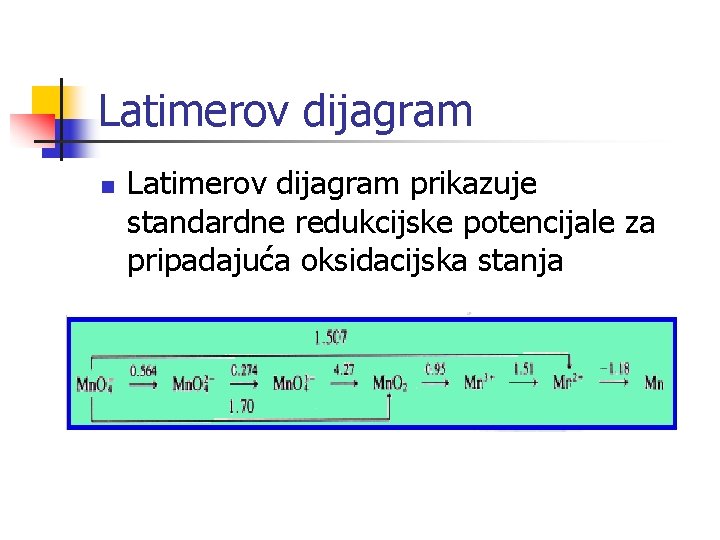
Latimerov dijagram n Latimerov dijagram prikazuje standardne redukcijske potencijale za pripadajuća oksidacijska stanja

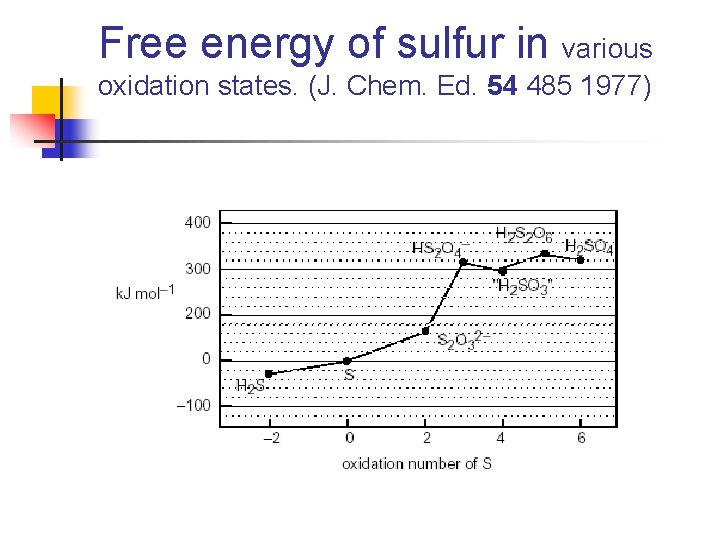
Free energy of sulfur in various oxidation states. (J. Chem. Ed. 54 485 1977)

Latimerovi dijagrami za klor i sumpor u vodenoj otopini

Frostov dijagram n Frostov dijagram pokazuje promjenu Gibsove energije kao funkciju različitih oksidacijskih stanja.

Analiza Frostovog dijagrama n n n n Mn (II) je najstabilnije oksidacijsko stanje mangana. Mn. O 42 - i Mn (III) skloni disproporcioniraju Mn. O 2 ne disproporcionira Mn. O 4 - je jako oksidacijsko sredstvo. Mangan u elementarnom stanju je srednje jako redukcijsko sredstvo Premda je termodinamički pogodna redukcija permanganata do Mn (II) iona, reakcija je spora osim u prisustvu katalizatora. Radi toga su otopine permanganata stabilne U bazičnim uvjetima ne postoji Mn 2+ već netopljivi Mn(OH)2

Pourbaix-ovi dijagrami i redoks reakcije u vodenoj otopini n n Voda može biti oksidacijsko sredstvo: H+ + e H 2 O + e - 1/ 1/ 2 H 2 o p. H = 7 E = -0, 414 - p. H = 14 E =-0, 828 H + OH 2 2 E = -0, 059 V p. H

n Voda može biti redukcijsko sredstvo: REDUCIRAJUĆE DJELOVANJE: o n n 1/ + + 2 e. O + 2 H 2 2 o -II + + 2 e. O + 2 H 2 2 o 2 O 2 + H 2 O + 2 e- -II H 2 O p. H =0 E = 1, 23 V p. H = 7 E = 0, 82 V 2 OH- p. H = 14 E = 0, 41 V

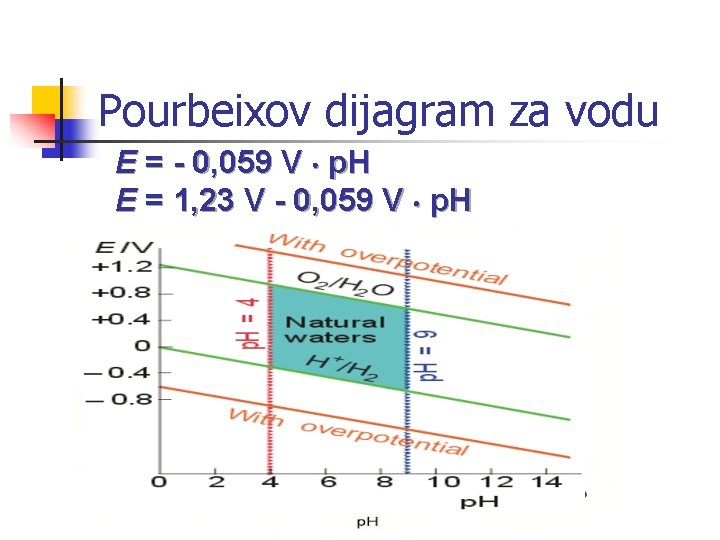
Pourbeixov dijagram za vodu E = - 0, 059 V p. H E = 1, 23 V - 0, 059 V p. H

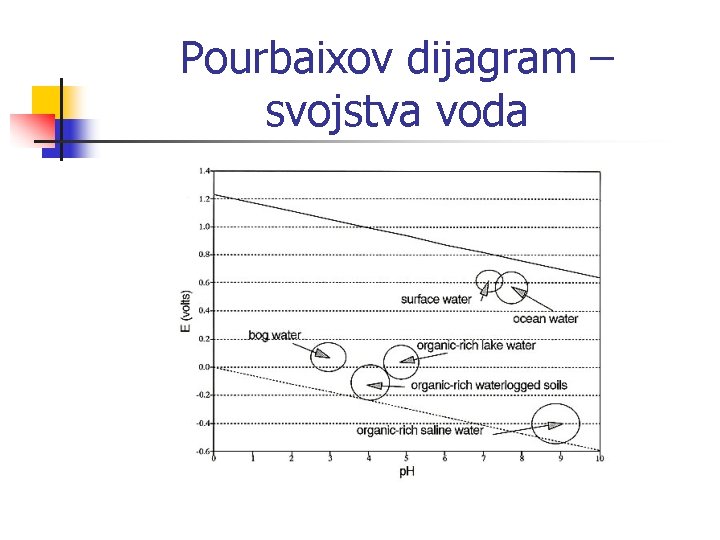
Pourbaixov dijagram – svojstva voda

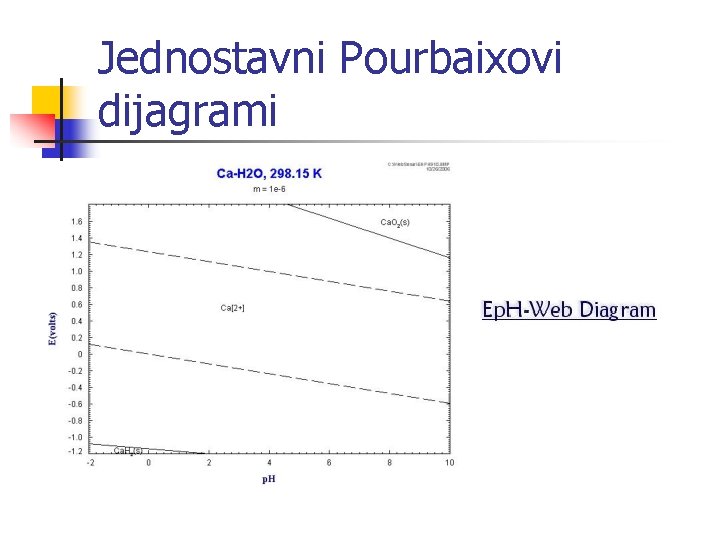
Jednostavni Pourbaixovi dijagrami

Purbeixov dijagram za mangan

Analiza Pourbeixova dijagrama n n Svaka točka na dijagramu odgovara termodinamički najstabilnijoj i najprisutnijoj formi elementa pri odabranom potencijalu i p. H vrijednosti Jaka oksidacijska sredstva nalaze se samo na vrhu Pourbaixova dijagrama. Permanganat je oksidacijsko sredstvu u širokom spektru p. H vrijednosti. Također je jako oksidacijsko sredstvo pri niskim p. H vrijednostima. n Reducirajuća sredstva nalaze se na dnu dijagrama. Mangan u elementarnom stanju je redukcijsko sredstvo pri svim p. H vrijednostima. A posebice je jako redukcijsko sredstvu u bazičnom području.

n n n Kada dominantno područje za odabrano oksidacijsko stanje nestaje potpuno ispod ili iznad odabrane p. H vrijednosti tada element podliježe disproporcioniranju Mn. O 42 - pokazuje tendenciju prema disproporcioniranju. Ionske vrste koje se nalaze u području od vrha prema dnu na odabranoj p. H vrijednosti ne pokazuju ni oksidacijska ni redukcijska svojstva kod te vrijednosti p. H.

Electronska aktivnost i p. E n n n n Kemijske reakcije koje se zbivaju spontano imaju negativnu ΔG (te radi toga pozitivnu vrijednost ΔE) ΔG = -z. FE U ravnoteži nema daljnjih promjena u kemijskom sastavu te je: ΔG = 0 Korištenjem tih informacija koristimo se kako bismo predviđali kemijski sastav u ravnoteži: E je proporcionalan G, odnosno G = -z. FE E je proporcionalan p. E (p. E = -log ae-)
![elektron ne postoji kao vrsta u otopini e aktivnost elektrona nema fizički smisao elektron – ne postoji kao vrsta u otopini [e°]- aktivnost elektrona nema fizički smisao](https://slidetodoc.com/presentation_image_h2/cb73d4f8617ab4994ee03cbf11d7711f/image-16.jpg)
elektron – ne postoji kao vrsta u otopini [e°]- aktivnost elektrona nema fizički smisao e- označava redukcijsku sposobnost otopine

Niska vrijednost p. E -izražena redukcijska svojstva otopine (niska vrijednost p. H – označava kisela svojstva). n n Za izračunavanje p. E pri nestandarnim uvjetima aktiviteta i tlaka rabi se Nernstova jednadžba Niski p. E – redukcijska svojstva Visoki p. E- oksidacijska svojstva

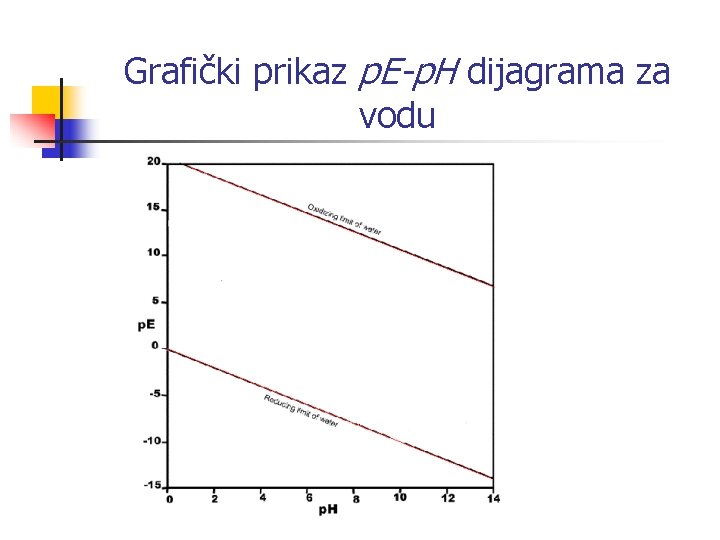
p. E-p. H dijagram vode n Voda se može oksidirati Voda se može reducirati Oksidacijski limit

Oksidacijski limit vode p. E = 20. 75 + log(H+) ili p. E = 20. 75 - p. H

Redukcijski limit vode Granične vrijednosti

Grafički prikaz p. E-p. H dijagrama za vodu

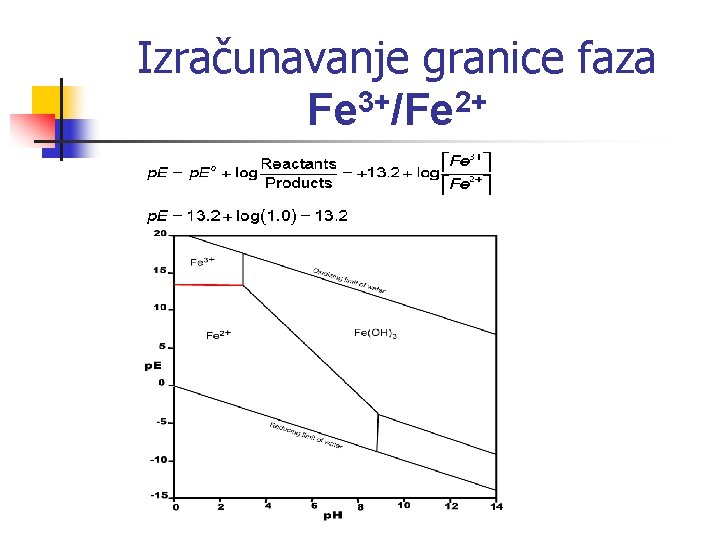
p. E-p. H dijagram za Fe-O 2 -H 2 O n Fe 2+ / Fe 3+ + e- Fe 2+ E 0 = 0. 780 V p. E = ( E 0/ 0. 0591) = 13. 2 V Nernstovom jednadžbom se izražava p. E za vrijednosti aktivnosti i tlaka koji nisu standardni odnosno: Granične koncentracija reaktanata i produkata su jednake Iznad granične vrijednost- stabilniji oksidacijski oblik Ispod granične vrijednosti- stabilniji reducirani oblik

n n n U vodenoj otopini nalaze se ionske vrste: Fe 2+ , Fe 3+ , OH- , H+ Maksimalna konc. (Fe 2+ , Fe 3+ = 10 -5 M) U otopini se nalaze ionske vrste: Fe 2+, Fe 3+ Fe(OH)3 , Fe(OH)2 Kemijske reakcije na granici faza su:

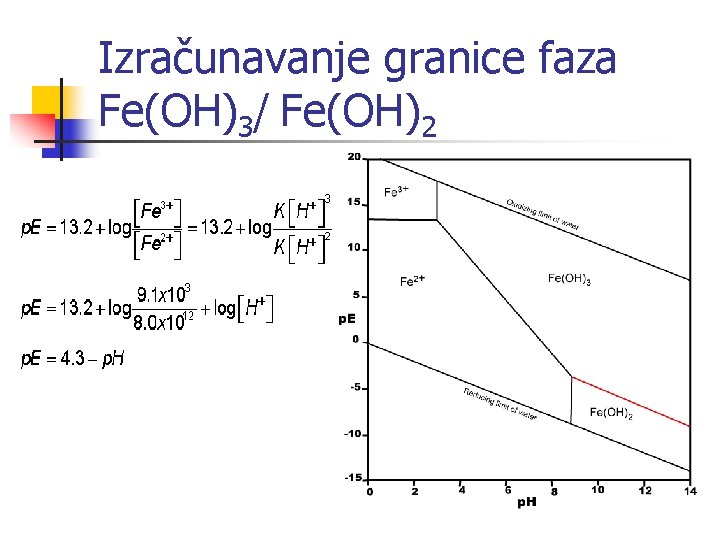
Izračunavanje granice faza 3+ 2+ Fe /Fe

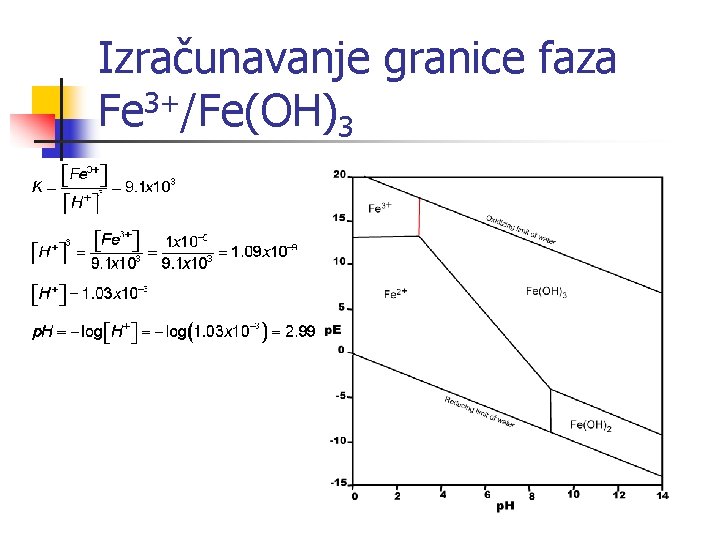
Izračunavanje granice faza Fe 3+/Fe(OH)3

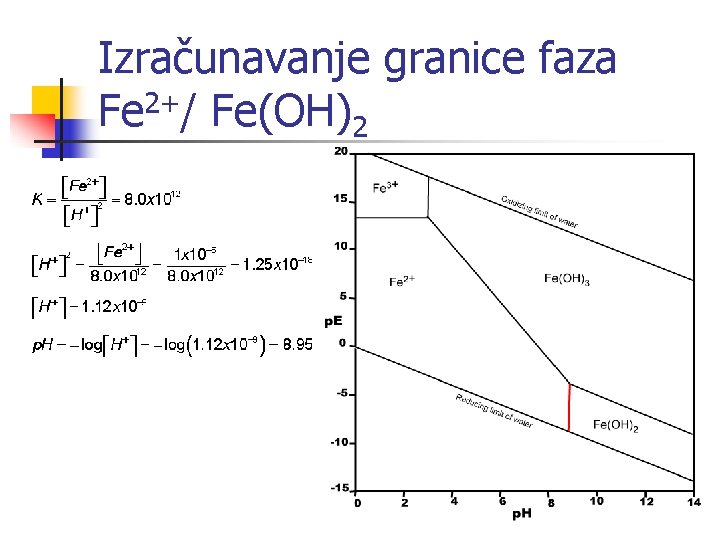
Izračunavanje granice faza Fe 2+/ Fe(OH)2

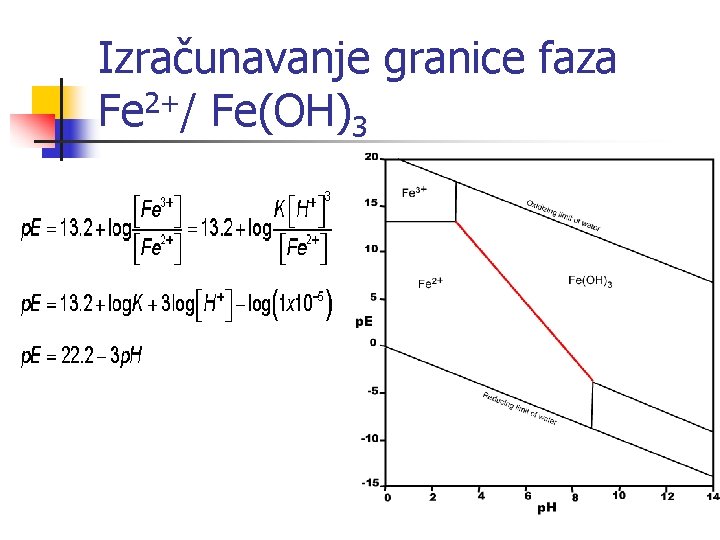
Izračunavanje granice faza Fe 2+/ Fe(OH)3

Izračunavanje granice faza Fe(OH)3/ Fe(OH)2

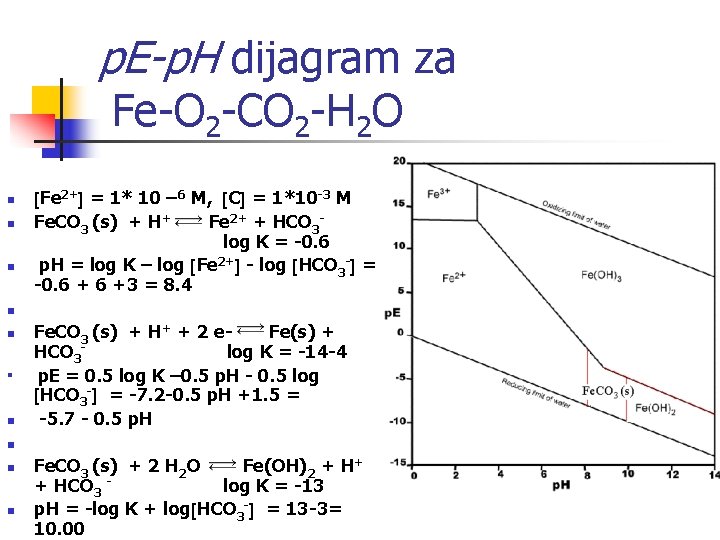
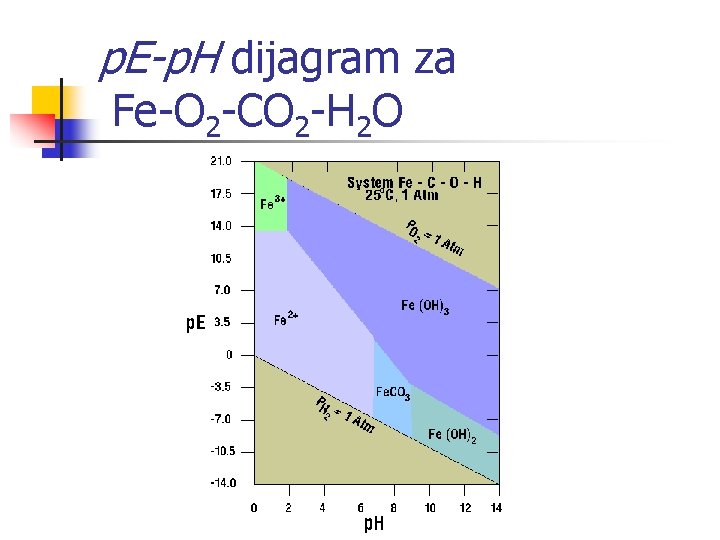
p. E-p. H dijagram za Fe-O 2 -CO 2 -H 2 O n n n Fe 2+ = 1* 10 – 6 M, C = 1*10 -3 M Fe. CO 3 (s) + H+ Fe 2+ + HCO 3 log K = -0. 6 p. H = log K – log Fe 2+ - log HCO 3 - = -0. 6 +3 = 8. 4 n n Fe. CO 3 (s) + H+ + 2 e. Fe(s) + HCO 3 log K = -14 -4 p. E = 0. 5 log K – 0. 5 p. H - 0. 5 log HCO 3 - = -7. 2 -0. 5 p. H +1. 5 = -5. 7 - 0. 5 p. H n n n Fe. CO 3 (s) + 2 H 2 O Fe(OH)2 + H+ + HCO 3 log K = -13 p. H = -log K + log HCO 3 - = 13 -3= 10. 00

p. E-p. H dijagram za Fe-O 2 -CO 2 -H 2 O

Praktična primjena p. E-p. H dijagrama n n n p. E/p. H dijagrami- grafički prikaz termodinamičkih podataka p. E/p. H dijagrami- ne daju informacije o brzini kemijskih reakcija Upućuju – što se može očekivati u prirodnom okolišu Omogučuju- tumačenje mnogih prirodnih fenomena, ali ne mogu odgovoriti na pitanje kako će se brzo te pojave dogoditi Geokemičari koriste p. E/p. H dijagrame za predviđanje vrste nastalih stijena

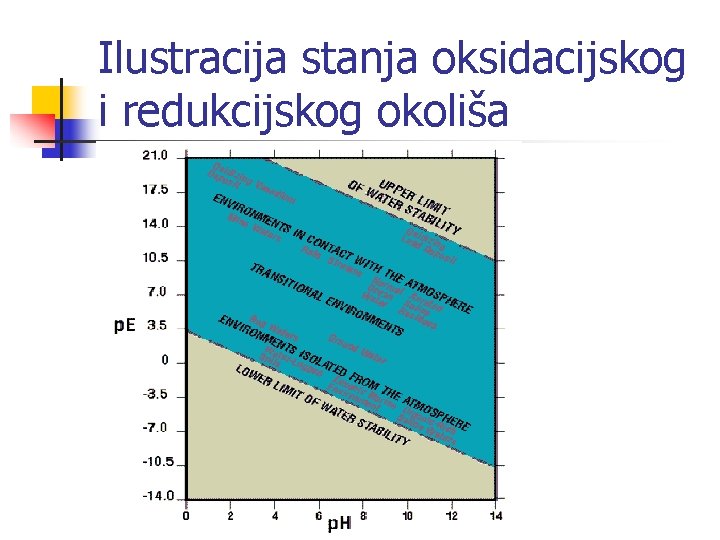
Ilustracija stanja oksidacijskog i redukcijskog okoliša

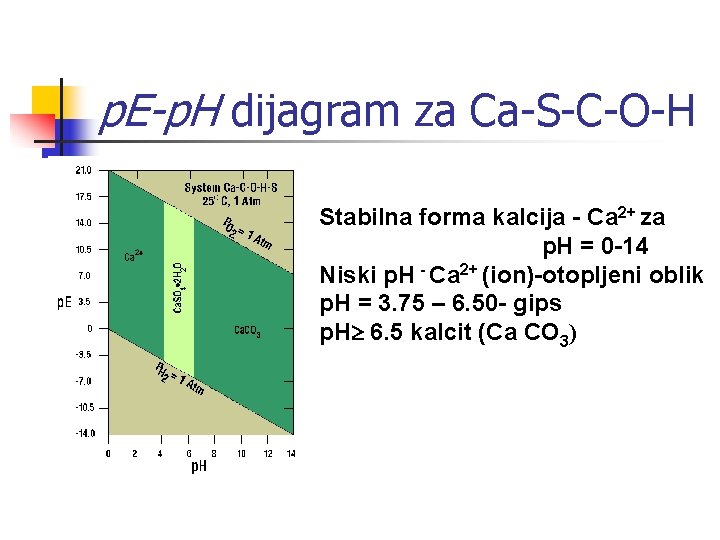
p. E-p. H dijagram za Ca-S-C-O-H Stabilna forma kalcija - Ca 2+ za p. H = 0 -14 Niski p. H - Ca 2+ (ion)-otopljeni oblik p. H = 3. 75 – 6. 50 - gips p. H 6. 5 kalcit (Ca CO 3)

p. E-p. H dijagram za Fe-C-O-H sustav Postoje četiri područja u kojima egzistiraju -Fe 2+, Fe 3+ Fe(OH)3 , Fe(OH)2 -Podzemna voda sadrži veliku količinu Fe(OH)2 -Aeracijom prelazi Fe(OH)2 u Fe(OH)3 –brzo -Precipitacija Fe(OH)3 –neposredno nakon -aeracije -Nastanak Fe. CO 3 (s) smanjuje područje Fe 2+ - iona- važnost karbonata u prirodnim vodama

Standardni redukcijski potencijali i p. E vrijednosti za najčešće rabljene redoks sustave

p. E u vodi i prirodnim vodenim sustavima Primjer: Izračunaj vrijednost p. E jezerske vode pri 10 C ako je p. H = 6. 4 i ako je ta voda u ravnoteži s atmosferskim kisikom pri PO 2 = 0. 21 atm.

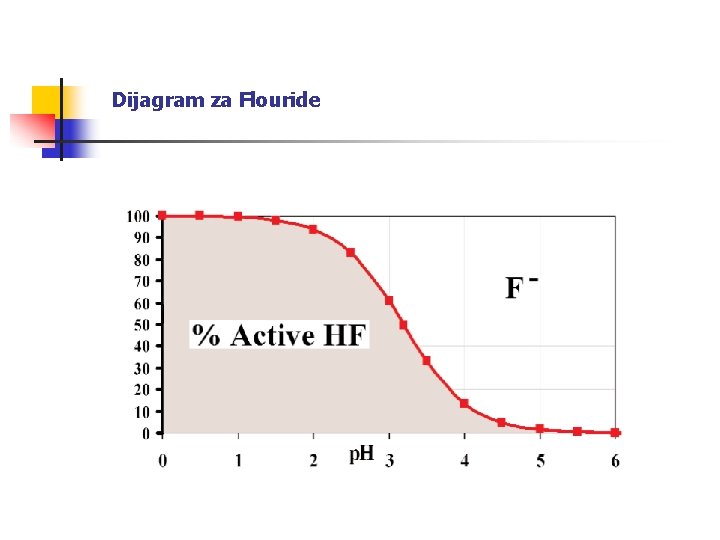
Dijagram za Flouride
 Reaksi redoks
Reaksi redoks Standardne entalpije stvaranja tablica
Standardne entalpije stvaranja tablica Koja su podrucja primene savremenih racunara
Koja su podrucja primene savremenih racunara Rumus titrasi redoks
Rumus titrasi redoks Bikromatometri
Bikromatometri Hso3 yükseltgenme basamağı
Hso3 yükseltgenme basamağı Faktor penyebab korosi besi
Faktor penyebab korosi besi Materi penyetaraan reaksi redoks kelas 12
Materi penyetaraan reaksi redoks kelas 12 Synproporcjonowania
Synproporcjonowania Reaksi oksidasi
Reaksi oksidasi Tepkime denkleştirme programı
Tepkime denkleştirme programı Tepkime kendiliğinden gerçekleşiyorsa
Tepkime kendiliğinden gerçekleşiyorsa Persamaan redoks
Persamaan redoks Malat aspartat mekiği
Malat aspartat mekiği Reaksi redoks pada daur ulang perak
Reaksi redoks pada daur ulang perak Redoks potansiyeli nedir
Redoks potansiyeli nedir Bab 2 reaksi redoks dan elektrokimia
Bab 2 reaksi redoks dan elektrokimia Redoks
Redoks Contoh soal reaksi redoks
Contoh soal reaksi redoks çinko yükseltgenme basamağı
çinko yükseltgenme basamağı