DAI DIAGRAMMI DI LEWIS ALLA GEOMETRIA DELLE MOLECOLE













![ORBITALI DELL’ OSSIGENO ossigeno = [He]2 s 22 p 4 z 2 p y ORBITALI DELL’ OSSIGENO ossigeno = [He]2 s 22 p 4 z 2 p y](https://slidetodoc.com/presentation_image_h2/9a50c5fb0a0fb6fdc652c59fb803afb8/image-29.jpg)
- Slides: 31

DAI DIAGRAMMI DI LEWIS ALLA GEOMETRIA DELLE MOLECOLE Il metodo di Lewis (puntini) si basa solo su una conta di elettroni. Non può predire la geometria delle molecole, né altre proprietà (forze di legame, reattività)

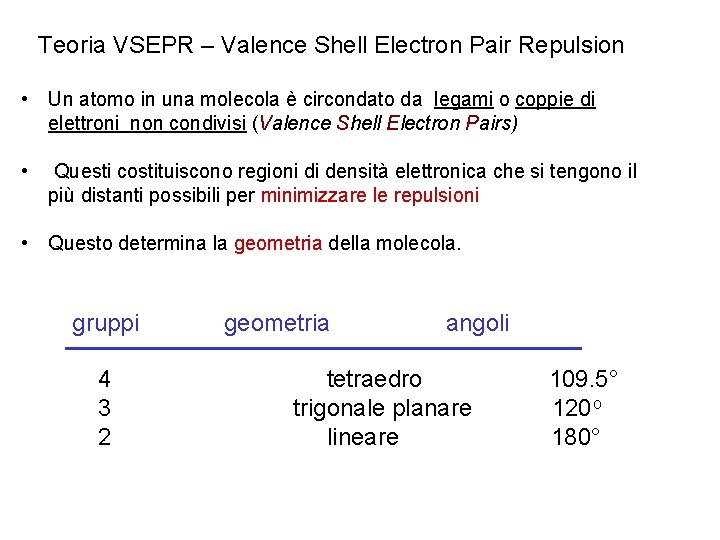
Teoria VSEPR – Valence Shell Electron Pair Repulsion • Un atomo in una molecola è circondato da legami o coppie di elettroni non condivisi (Valence Shell Electron Pairs) • Questi costituiscono regioni di densità elettronica che si tengono il più distanti possibili per minimizzare le repulsioni • Questo determina la geometria della molecola. gruppi 4 3 2 geometria angoli tetraedro trigonale planare lineare 109. 5° 120 o 180°

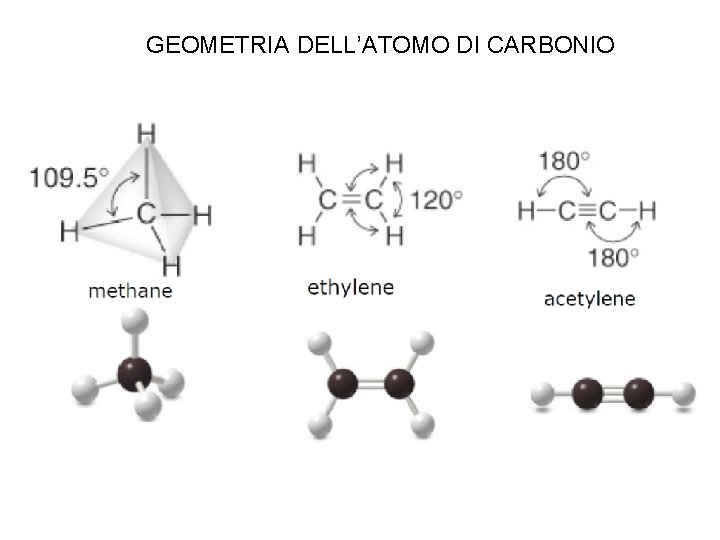
GEOMETRIA DELL’ATOMO DI CARBONIO

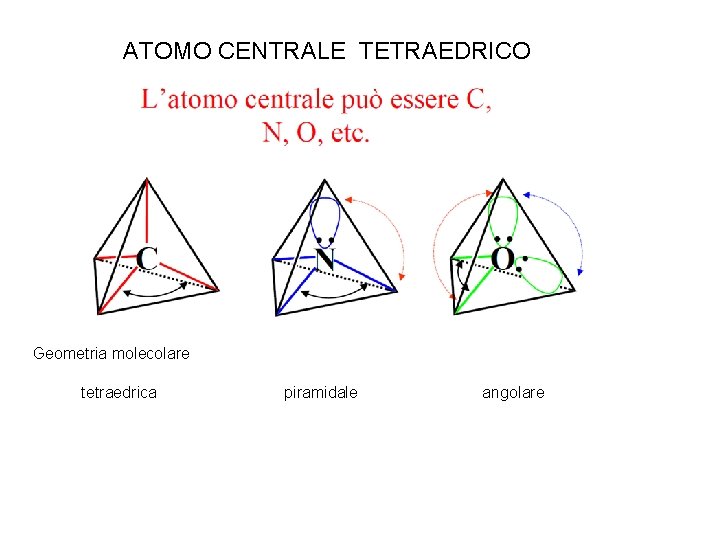
ATOMO CENTRALE TETRAEDRICO Geometria molecolare tetraedrica piramidale angolare

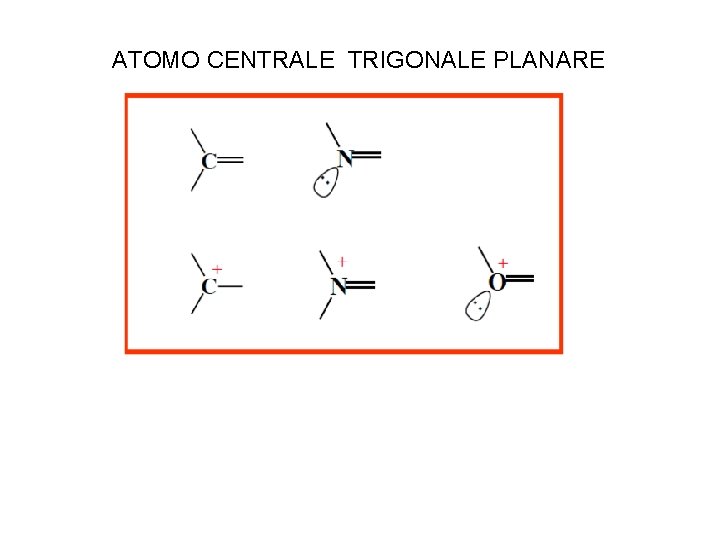
ATOMO CENTRALE TRIGONALE PLANARE

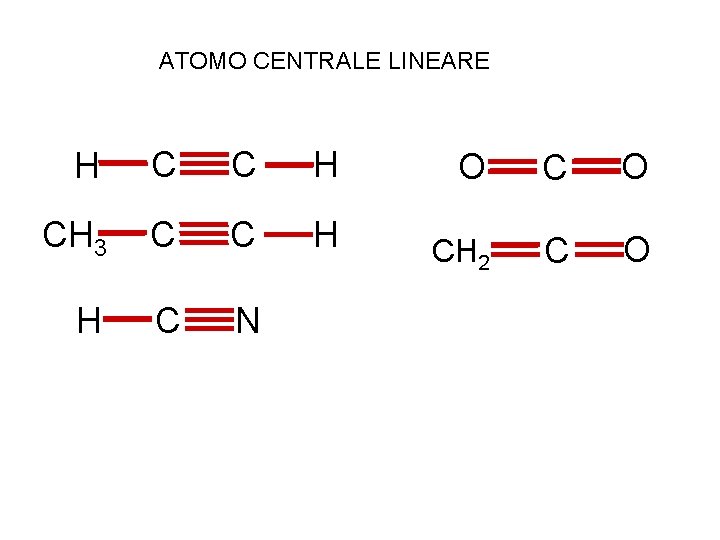
ATOMO CENTRALE LINEARE H C C H CH 3 C C H H C N O CH 2 C O


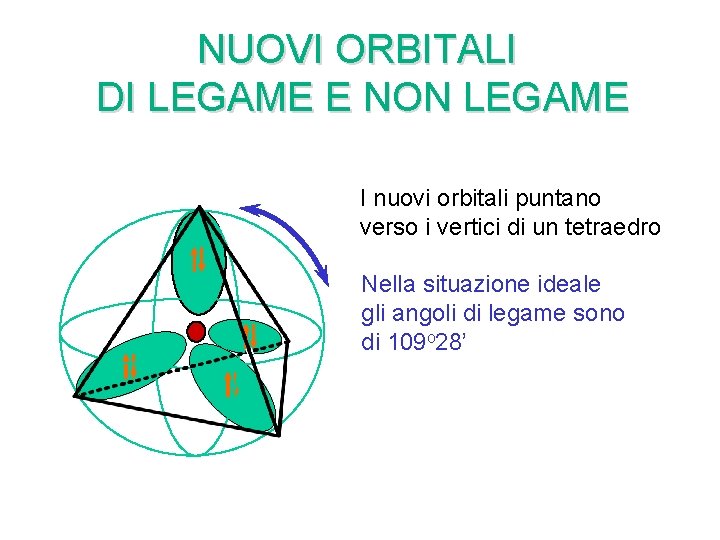
NUOVI ORBITALI DI LEGAME E NON LEGAME I nuovi orbitali puntano verso i vertici di un tetraedro Nella situazione ideale gli angoli di legame sono di 109 o 28’

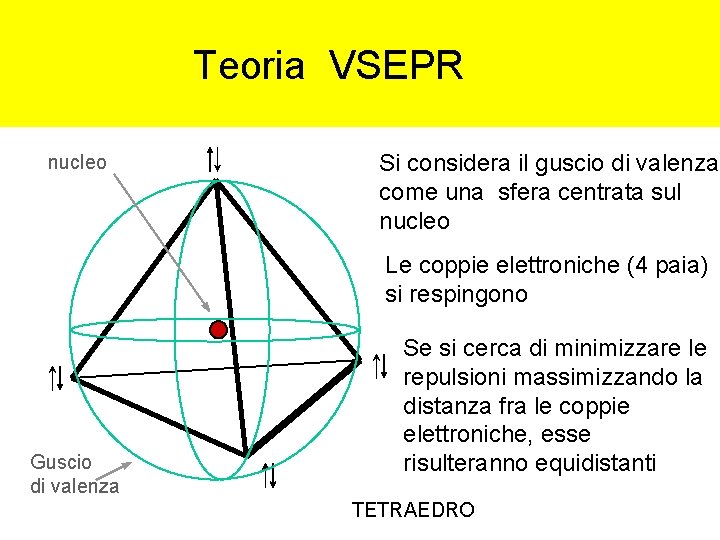
Teoria VSEPR nucleo Si considera il guscio di valenza come una sfera centrata sul nucleo Le coppie elettroniche (4 paia) si respingono Guscio di valenza Se si cerca di minimizzare le repulsioni massimizzando la distanza fra le coppie elettroniche, esse risulteranno equidistanti TETRAEDRO

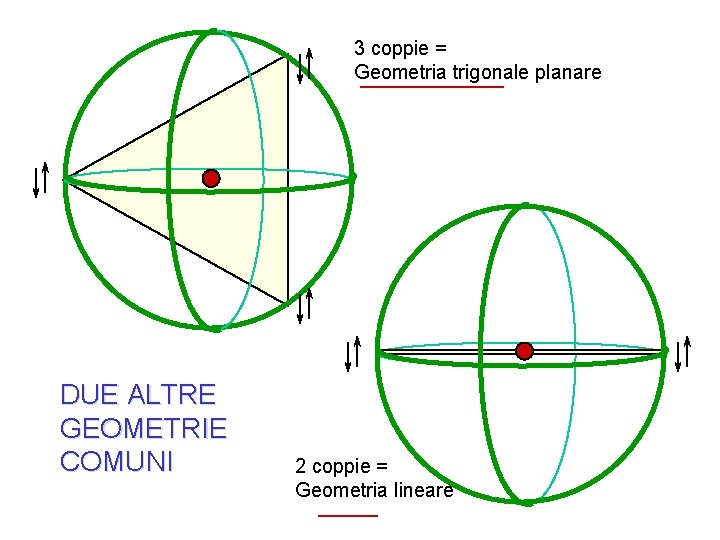
3 coppie = Geometria trigonale planare DUE ALTRE GEOMETRIE COMUNI 2 coppie = Geometria lineare

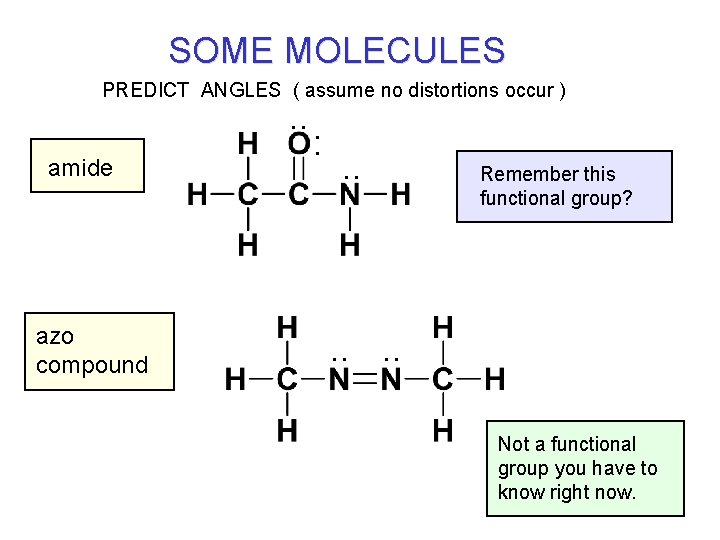
SOME MOLECULES PREDICT ANGLES ( assume no distortions occur ) . . amide azo compound : . . Remember this functional group? . . Not a functional group you have to know right now.

VALENCE SHELL ELECTRON PAIR REPULSION MODELLO VSEPR coppie O R G A N I C I geometria angoli ibridazione 6 coppie ottaedrica 5 coppie bipiramide trigonale 120 o, 90 o tetraedrica (piramidale, angolare) 109 o 28’ 4 coppie 3 coppie trigonale planare 2 coppie lineare 90 o 120 o d 2 sp 3 dsp 3 sp 2 180 o Per la maggior parte delle molecole, queste predizioni sono corrette entro pochi gradi (± 5 o). sp

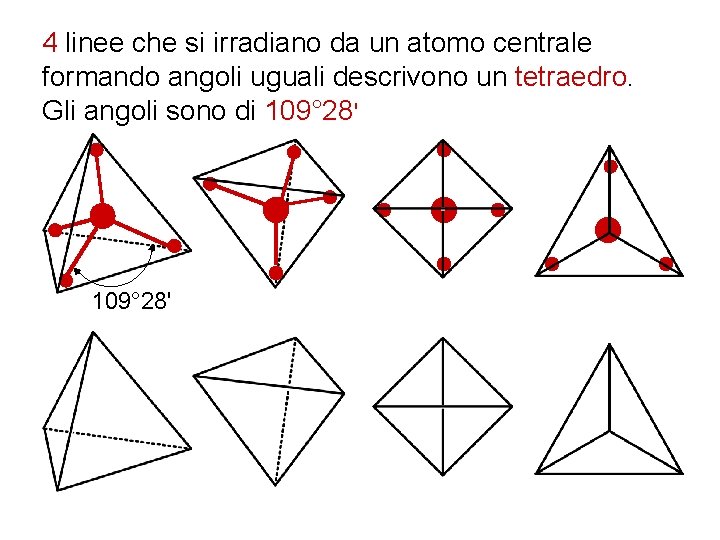
4 linee che si irradiano da un atomo centrale formando angoli uguali descrivono un tetraedro. Gli angoli sono di 109° 28'

DEVIAZIONI DALL’ ANGOLO TETRAEDRICO IDEALE

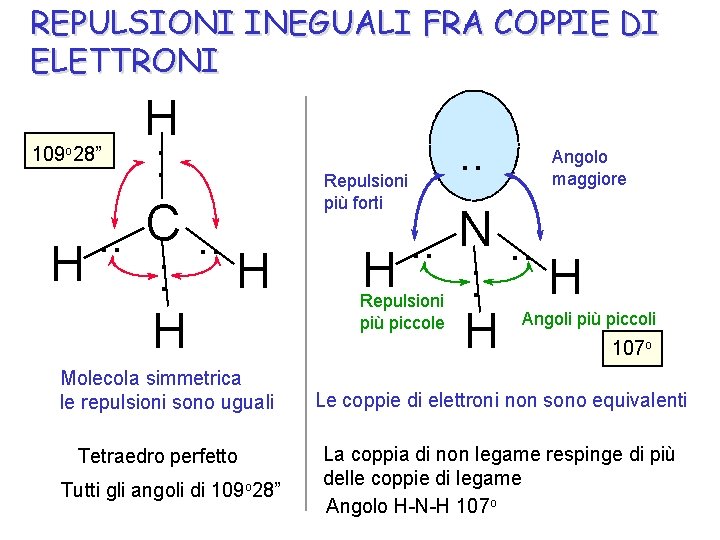
REPULSIONI INEGUALI FRA COPPIE DI ELETTRONI H 109 28” : . . C. . H : H H o Molecola simmetrica le repulsioni sono uguali Tetraedro perfetto Tutti gli angoli di 109 o 28” Repulsioni più forti . . Angolo maggiore . . N. . H : H H Repulsioni più piccole Angoli più piccoli 107 o Le coppie di elettroni non sono equivalenti La coppia di non legame respinge di più delle coppie di legame Angolo H-N-H 107 o

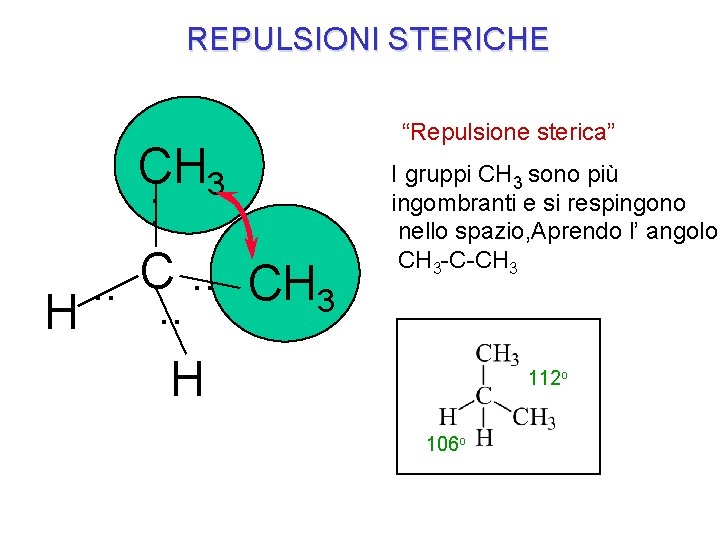
REPULSIONI STERICHE CH 3 : . . CH 3 H H “Repulsione sterica” I gruppi CH 3 sono più ingombranti e si respingono nello spazio, Aprendo l’ angolo CH 3 -C-CH 3 112 o 106 o

L’atomo centrale può essere C, N, O, etc. C tetraedrico

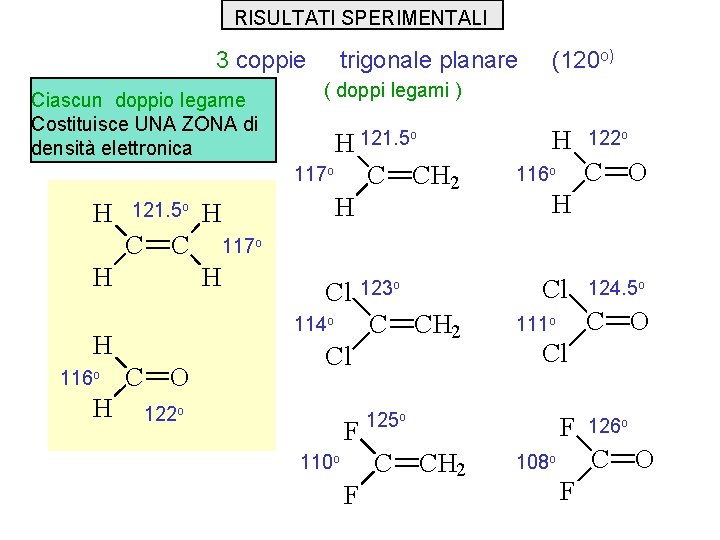
RISULTATI SPERIMENTALI 3 coppie Ciascun doppio legame Costituisce UNA ZONA di densità elettronica trigonale planare ( doppi legami ) 121. 5 o C C H H Cl C O 116 o H Cl 122 o F F CH 2 Cl F CH 2 124. 5 o C O 111 o 125 o C 110 o Cl 123 o C 114 o C O CH 2 122 o 117 o H H 116 o H H C H o 121. 5 H 117 o H (120 o) 126 o C O 108 o F

DEVIAZIONI DAGLI ANGOLI TRIGONALI PLANARI (120°)

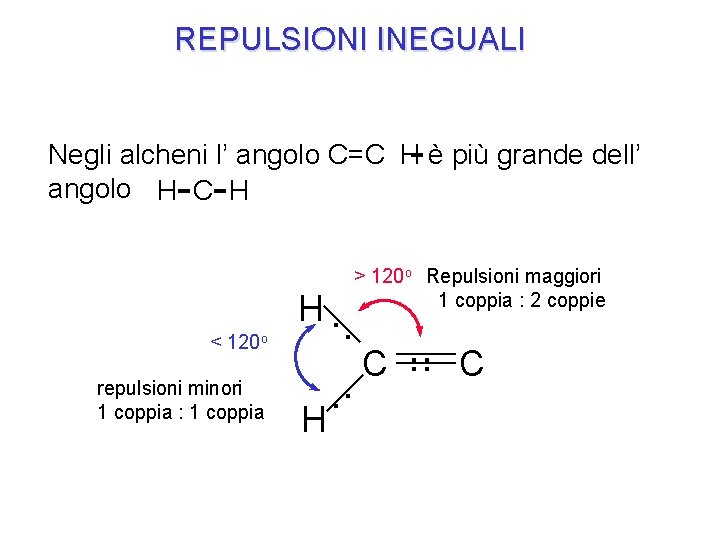
REPULSIONI INEGUALI Negli alcheni l’ angolo C=C H- è più grande dell’ angolo H- C- H < 120 o repulsioni minori 1 coppia : 1 coppia H. > 120 o Repulsioni maggiori 1 coppia : 2 coppie . . . C. . H C

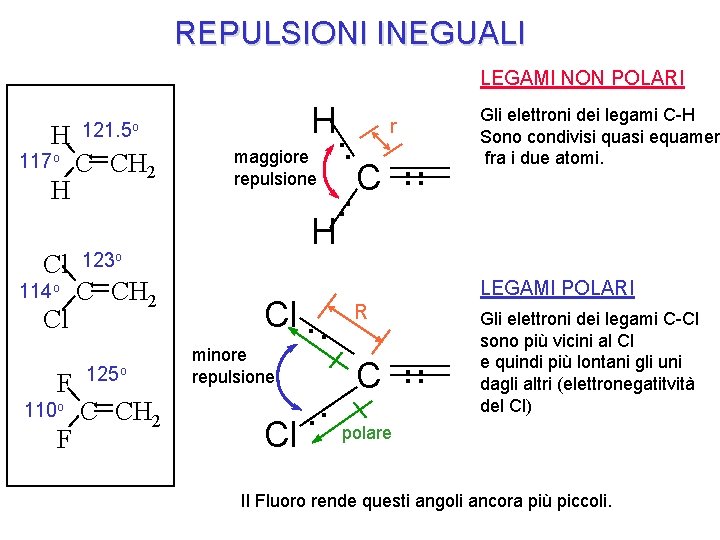
REPULSIONI INEGUALI LEGAMI NON POLARI H 117 o H Cl 114 o Cl F 110 o F H. 121. 5 o C CH 2 maggiore repulsione 125 o C CH 2 . . . C. . Gli elettroni dei legami C-H Sono condivisi quasi equamen fra i due atomi. H 123 o C CH 2 r Cl. . minore repulsione . . Cl LEGAMI POLARI R C . . Gli elettroni dei legami C-Cl sono più vicini al Cl e quindi più lontani gli uni dagli altri (elettronegatitvità del Cl) polare Il Fluoro rende questi angoli ancora più piccoli.







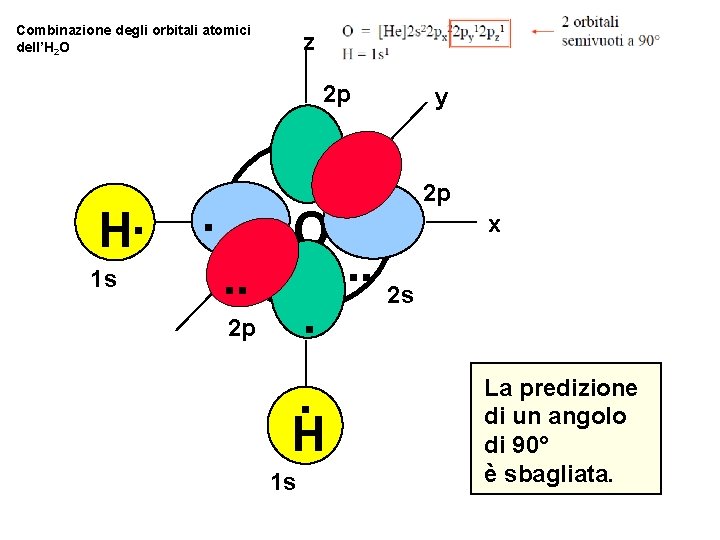
Possiamo predire la forma delle molecole semplicemente combinando gli orbitali atomici disponibili su ciascun atomo? …. . proviamo per l’ H 2 O
![ORBITALI DELL OSSIGENO ossigeno He2 s 22 p 4 z 2 p y ORBITALI DELL’ OSSIGENO ossigeno = [He]2 s 22 p 4 z 2 p y](https://slidetodoc.com/presentation_image_h2/9a50c5fb0a0fb6fdc652c59fb803afb8/image-29.jpg)
ORBITALI DELL’ OSSIGENO ossigeno = [He]2 s 22 p 4 z 2 p y 2 p 22 p 1 2 p . O. . 2 p . x . . 2 s Gli orbitali 2 p sono perpendicolari (90 o)

Combinazione degli orbitali atomici dell’H 2 O z 2 p H. 1 s . . . O. 2 p . H 1 s y 2 p x . . 2 s La predizione di un angolo di 90° è sbagliata.

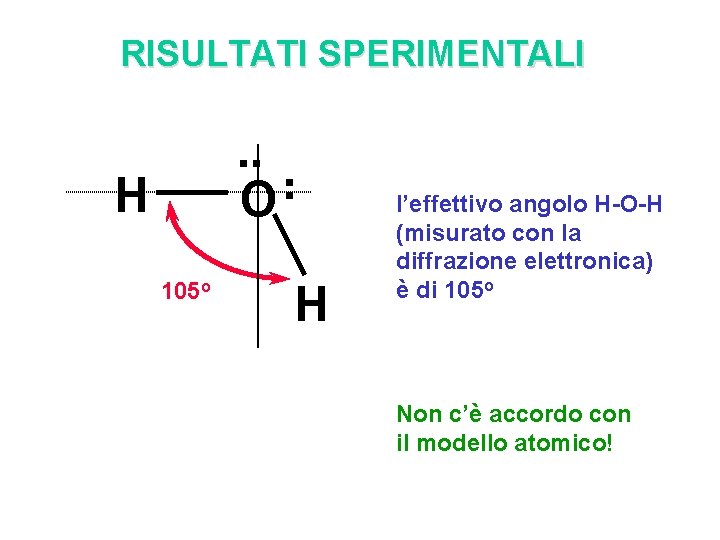
RISULTATI SPERIMENTALI . . O . . H 105 o H l’effettivo angolo H-O-H (misurato con la diffrazione elettronica) è di 105 o Non c’è accordo con il modello atomico!
 Legame covalente
Legame covalente Geometria molecular lineal
Geometria molecular lineal La polarita
La polarita Diagramma delle aree depurato dai paleggi
Diagramma delle aree depurato dai paleggi Geometria euclidea significato
Geometria euclidea significato Cancion banderita española
Cancion banderita española Mas alla de mis miedos mas alla de mi inseguridad
Mas alla de mis miedos mas alla de mi inseguridad Diagrammi di fase binari
Diagrammi di fase binari Esercizi schema er
Esercizi schema er Diagrammi scuola primaria
Diagrammi scuola primaria Diagramma di equilibrio
Diagramma di equilibrio Climogramma italia
Climogramma italia La geometria delle api
La geometria delle api Cose moderne
Cose moderne L'esperienza delle cose moderne e la lezione delle antique
L'esperienza delle cose moderne e la lezione delle antique La nascita delle lingue e delle letterature romanze
La nascita delle lingue e delle letterature romanze Molecole diatomiche
Molecole diatomiche Zanichelli chimica molecole in movimento soluzioni
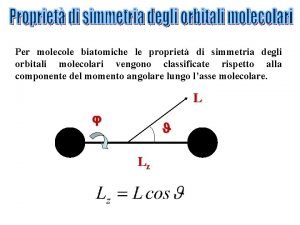
Zanichelli chimica molecole in movimento soluzioni Valitutti soluzioni capitolo 14
Valitutti soluzioni capitolo 14 Le molecole della vita
Le molecole della vita Tensione superficiale zanichelli
Tensione superficiale zanichelli Solu.zone chimica molecole in movimento
Solu.zone chimica molecole in movimento Cl2co geometria molecolare
Cl2co geometria molecolare Soluzioni chimica più capitolo 14
Soluzioni chimica più capitolo 14 Lettere a gesù bambino scritte dai bambini
Lettere a gesù bambino scritte dai bambini Dai gruppi funzionali ai polimeri zanichelli
Dai gruppi funzionali ai polimeri zanichelli Thân dài nhiều áo bọc quanh
Thân dài nhiều áo bọc quanh Madonnina dai riccioli d'oro chi l'ha scritta
Madonnina dai riccioli d'oro chi l'ha scritta Chi phí dài hạn
Chi phí dài hạn Yunxing dai
Yunxing dai Abençoa oh senhor nossa oferta dai nos tua paz
Abençoa oh senhor nossa oferta dai nos tua paz Ammine secondarie
Ammine secondarie