Dalla struttura atomica alla nomenclatura Forma delle molecole


























- Slides: 33

Dalla struttura atomica alla nomenclatura

Forma delle molecole e proprietà delle sostanze Capitolo 4 Unità 12 La forma delle molecole 4. 1 Angolo di legame e forma delle molecole 4. 2 Il modello VSEPR Unità 13 L’ibridazione degli orbitali e la risonanza 4. 3 La teoria degli orbitali ibridi 4. 4 Ibridi di risonanza Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 2

Forma delle molecole e proprietà delle sostanze Capitolo 4 Unità 14 Legami, polarità e solubilità 4. 5 Forma e polarità delle molecole 4. 6 Polarità e miscibilità 4. 7 La formazione delle soluzioni 4. 8 Soluzioni di un solido in un liquido Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016

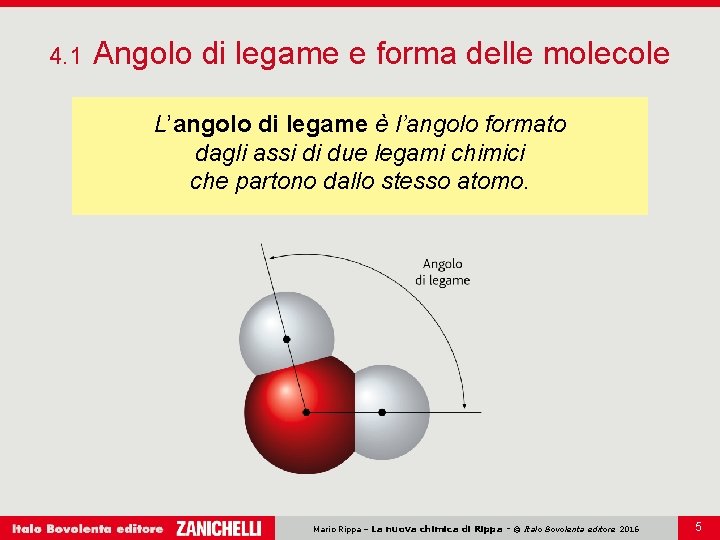
4. 1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione degli atomi nello spazio, la lunghezza e gli angoli di legame definiscono la geometria molecolare. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 4

4. 1 Angolo di legame e forma delle molecole L’angolo di legame è l’angolo formato dagli assi di due legami chimici che partono dallo stesso atomo. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 5

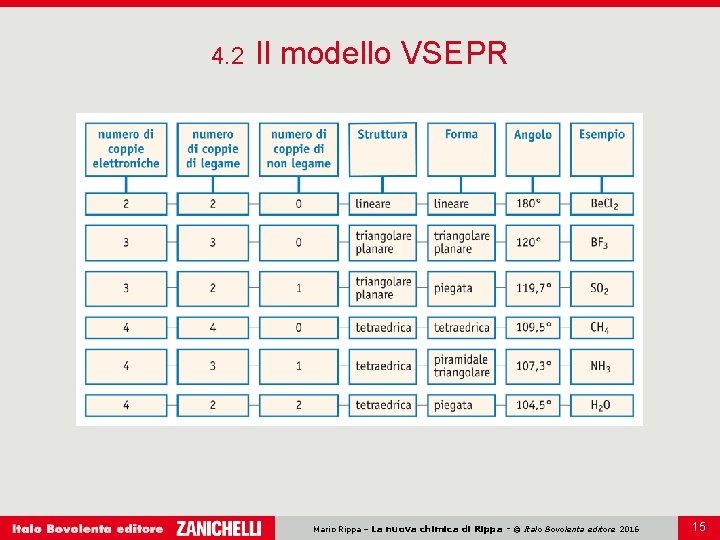
4. 2 Il modello VSEPR La geometria molecolare dei composti può essere ricavata dalla teoria VSEPR. Secondo il modello VSEPR la forma di una molecola viene determinata dalla repulsione tra i doppietti elettronici presenti nel livello più esterno. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 6

4. 2 Il modello VSEPR Gli orbitali esterni occupano posizioni reciproche realizzano la massima distanza possibile e quindi la minima interazione. La geometria di una molecola si ricava dalla struttura di Lewis contando il numero totale di coppie elettroniche presenti attorno all’atomo centrale. I legami multipli si considerano come una coppia elettronica unica. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 7

4. 2 Il modello VSEPR Molecole con due coppie elettroniche attorno all’atomo centrale assumono una geometria lineare con angoli di 180°. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 8

4. 2 Il modello VSEPR Molecole con tre coppie elettroniche attorno all’atomo centrale assumono una geometriangolare planare. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 9

4. 2 Il modello VSEPR Molecole con quattro coppie elettroniche attorno all’atomo centrale assumono una geometria tetraedrica. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 10

4. 2 Il modello VSEPR La forma che la molecola effettivamente assume si ricava invece dal numero di coppie di legame e di non legame. Molecole con lo stesso numero di coppie elettroniche attorno all’atomo centrale, ma con numero diverso di coppie elettroniche di non legame, hanno stessa geometria ma forma diversa. La forma delle molecole è determinata dal numero di atomi legati all’atomo centrale. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 11

4. 2 Il modello VSEPR Molecole con tre coppie di legame attorno all’atomo centrale ma con solo due atomi legati assumono forma piegata. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 12

4. 2 Il modello VSEPR Molecole con quattro coppie di legame attorno all’atomo centrale ma con solo tre atomi legati assumono forma piramidale triangolare. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 13

4. 2 Il modello VSEPR Molecole con quattro coppie di legame attorno all’atomo centrale ma con solo due atomi legati assumono forma piegata. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 14

4. 2 Il modello VSEPR Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 15

4. 2 Il modello VSEPR Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 16

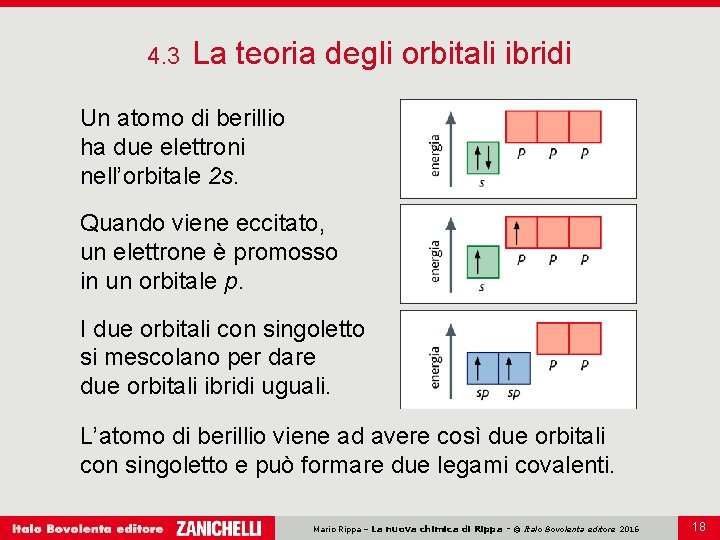
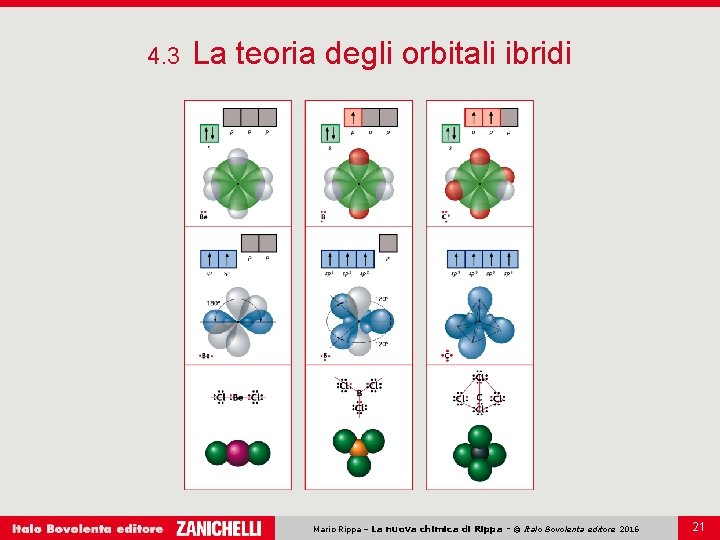
4. 3 La teoria degli orbitali ibridi Secondo la teoria degli orbitali ibridi i legami si possono originare anche da orbitali diversi dagli orbitali s, p, d e f, gli orbitali ibridi. Gli orbitali ibridi sono orbitali nuovi ottenuti dalla combinazione, ricavata matematicamente, di più orbitali atomici di uno stesso atomo. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 17

4. 3 La teoria degli orbitali ibridi Un atomo di berillio ha due elettroni nell’orbitale 2 s. Quando viene eccitato, un elettrone è promosso in un orbitale p. I due orbitali con singoletto si mescolano per dare due orbitali ibridi uguali. L’atomo di berillio viene ad avere così due orbitali con singoletto e può formare due legami covalenti. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 18

4. 3 La teoria degli orbitali ibridi In pratica: più orbitali di tipo diverso si possono mescolare per dare nuovi orbitali, gli orbitali ibridi, isoenergetici tra loro; l’ibridazione degli orbitali permette di aumentare il numero di legami covalenti che un atomo può formare e rende così più stabili le molecole. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 19

4. 3 La teoria degli orbitali ibridi Il numero e il tipo di orbitali ibridi determinano la geometria della molecola formata dall’atomo ibridato. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 20

4. 3 La teoria degli orbitali ibridi Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 21

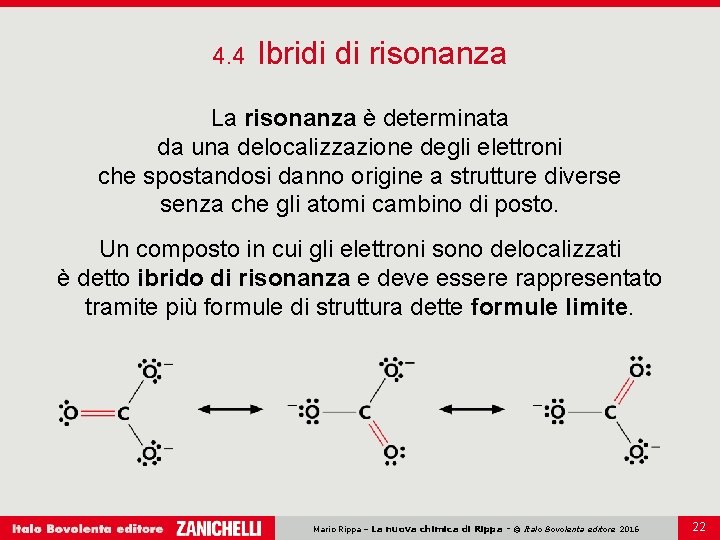
4. 4 Ibridi di risonanza La risonanza è determinata da una delocalizzazione degli elettroni che spostandosi danno origine a strutture diverse senza che gli atomi cambino di posto. Un composto in cui gli elettroni sono delocalizzati è detto ibrido di risonanza e deve essere rappresentato tramite più formule di struttura dette formule limite. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 22

4. 4 Ibridi di risonanza Ciascuna possibile formula limite contribuisce alla stabilità dell’ibrido in relazione al proprio contenuto energetico. L’ibrido assume per più tempo la struttura rappresentata dalla formula limite più stabile Un ibrido di risonanza è tanto più stabile quanto più numerose sono le formule limite equivalenti dal punto di vista energetico che lo rappresentano. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 23

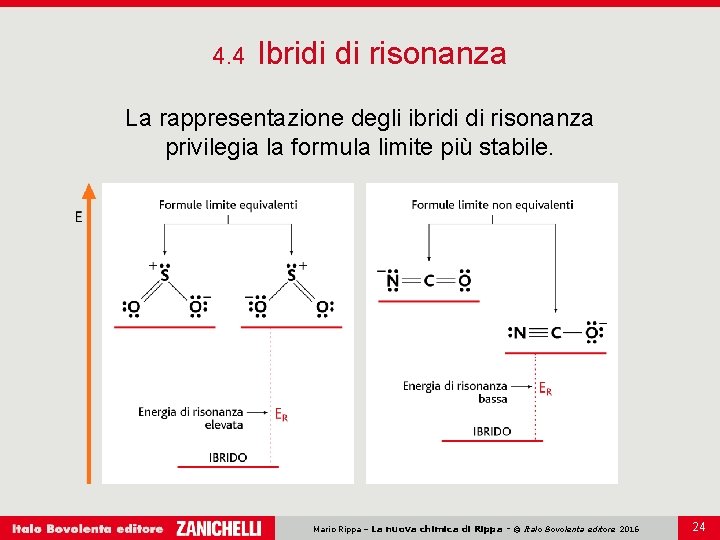
4. 4 Ibridi di risonanza La rappresentazione degli ibridi di risonanza privilegia la formula limite più stabile. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 24

4. 5 Forma e polarità delle molecole La polarità di una molecola dipende, oltre che dalla presenza di legami covalenti eteropolari, anche dalla sua forma. Le molecole polari hanno un dipolo permanente. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 25

4. 5 Forma e polarità delle molecole Le molecole in cui gli elettroni sono equamente condivisi, o nelle quali i dipoli annullano reciprocamente il loro effetto, sono dette molecole apolari. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 26

4. 5 Forma e polarità delle molecole Le molecole apolari interagiscono con difficoltà e con poca forza e si trovano in natura come particelle isolate allo stato gassoso. Le molecole polari interagiscono fortemente tra loro e con altre molecole o ioni attraverso legami ioni-dipolo, legami idrogeno e interazioni di Van der Waals e si trovano in natura in uno stato condensato. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 27

4. 6 Polarità e miscibilità Anche la miscibilità e la solubilità delle sostanze sono influenzate dalla polarità delle loro molecole. Le sostanze polari si sciolgono in quelle polari, le sostanze apolari si sciolgono nelle apolari: il simile scioglie il simile. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 28

4. 7 La formazione delle soluzioni Affinché il processo di solubilizzazione avvenga, occorre che le interazioni tra soluto e solvente riescano a compensare l’energia spesa per allontanare le particelle. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 29

4. 7 La formazione delle soluzioni Solo sostanze con struttura simile possono dar luogo a interazioni con forze uguali o superiori a quelle presenti tra le molecole di soluto e di solvente separati. Tra le sostanze apolari che si miscelano agiscono interazioni dipolo-dipolo indotto o dipolo indotto-dipolo indotto, mentre tra le sostanze polari che si solubilizzano si instaurano interazioni dipolo-dipolo o legami idrogeno. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 30

4. 8 Soluzioni di un solido in un liquido La dissoluzione di un solido ionico in acqua avviene in quanto le forze di attrazione tra gli ioni sono vinte dalle forze ione-dipolo, che si stabiliscono tra gli ioni del cristallo e le molecole d’acqua I singoli ioni sono separati e circondati da molecole d’acqua. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 31

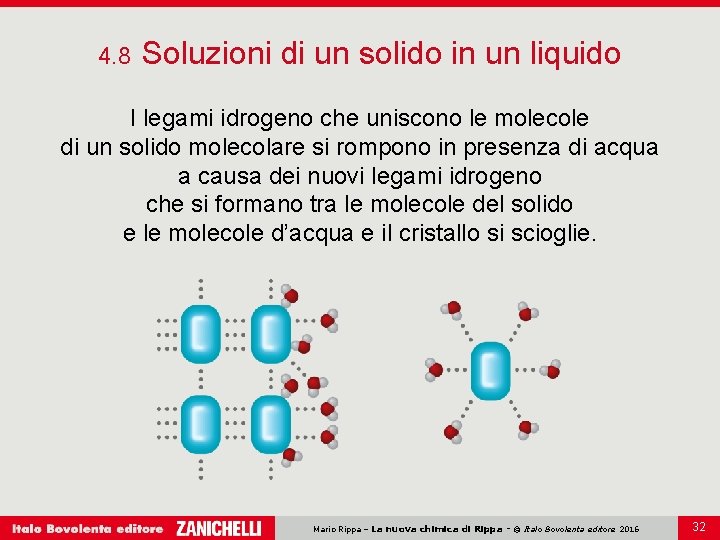
4. 8 Soluzioni di un solido in un liquido I legami idrogeno che uniscono le molecole di un solido molecolare si rompono in presenza di acqua a causa dei nuovi legami idrogeno che si formano tra le molecole del solido e le molecole d’acqua e il cristallo si scioglie. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 32

4. 8 Soluzioni di un solido in un liquido I solidi covalenti e i solidi metallici non sono solubili in acqua. L’acqua è un ottimo solvente per i solidi ionici e per i solidi molecolari. Mario Rippa – La nuova chimica di Rippa - © Italo Bovolenta editore 2016 33
 La forma passiva esercizi
La forma passiva esercizi Elementi di geometria analitica
Elementi di geometria analitica Soluzioni capitolo 14
Soluzioni capitolo 14 Vito posca
Vito posca Chimica più dalla materia alla nomenclatura soluzioni
Chimica più dalla materia alla nomenclatura soluzioni Soluzioni posca
Soluzioni posca Soluzioni capitolo 14
Soluzioni capitolo 14 Legame covalente
Legame covalente Polarità delle molecole
Polarità delle molecole Le particelle che costituiscono i raggi anodici
Le particelle che costituiscono i raggi anodici Passaggio dalla preistoria alla storia
Passaggio dalla preistoria alla storia Dalla monarchia alla repubblica romana
Dalla monarchia alla repubblica romana Dalla monarchia alla repubblica
Dalla monarchia alla repubblica Passaggio dalla preistoria alla storia
Passaggio dalla preistoria alla storia Como el vino de jerez y el vinillo de rioja
Como el vino de jerez y el vinillo de rioja Mas alla de mis miedos mas alla de mi inseguridad
Mas alla de mis miedos mas alla de mi inseguridad Azioni del cane verbi
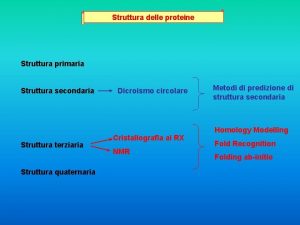
Azioni del cane verbi Struttura delle proteine
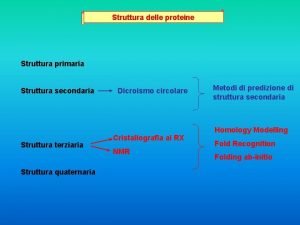
Struttura delle proteine Gli elementi della fiaba
Gli elementi della fiaba Regni rinascimentali mappa
Regni rinascimentali mappa La nascita delle lingue e delle letterature romanze
La nascita delle lingue e delle letterature romanze L'esperienza delle cose moderne e la lezione delle antique
L'esperienza delle cose moderne e la lezione delle antique Esercizi forma interrogativa francese
Esercizi forma interrogativa francese Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Molecole discrete significato
Molecole discrete significato Geometria molecular balancin
Geometria molecular balancin Molecole biatomiche
Molecole biatomiche Le molecole della vita
Le molecole della vita Solu.zone chimica molecole in movimento
Solu.zone chimica molecole in movimento Forma sonata mozart
Forma sonata mozart Forma delle foglie scuola primaria
Forma delle foglie scuola primaria Risoluzione equazioni di secondo grado
Risoluzione equazioni di secondo grado Numero atomico
Numero atomico