Anticorps monoclonaux usage thrapeutique optimisation nouveaux formats et

































- Slides: 51

Anticorps monoclonaux à usage thérapeutique: optimisation, nouveaux formats et défis technico-économiques Jean-Luc Teillaud (Equipe 14 « Biotechnologie des Anticorps » , Centre de Recherche des Cordeliers/INSERM U. 872) jean-luc. teillaud@crc. jussieu. fr AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Les anticorps monoclonaux: 37 ans d’Histoire Publication de la technique d’obtention des anticorps monoclonaux (Ac. M): Köhler & Milstein, Nature, 256: 495, 1975 Premier Ac. M mis sur le marché (1986) : Muromonab (anti-CD 3, souris) Derniers Ac. M mis sur le marché (2011) : ipilimumab (anti-CTLA-4), belimumab (anti-BLy. S/BAFF) * 27 Ac. M ont actuellement une AMM [ USA (FDA) et Europe (EMA)] AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Génération d’un Ac. M recombinant hu. Ig. G, Lymphocyte B Hybridome Ac. M, Hu. Ig. G, ARNt/ARNm Vecteur(s) avec séquences hu. C et hu. C VL VH ADNc Clonage Transfection Lignée cellulaire (CHO, NS 1…) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 3

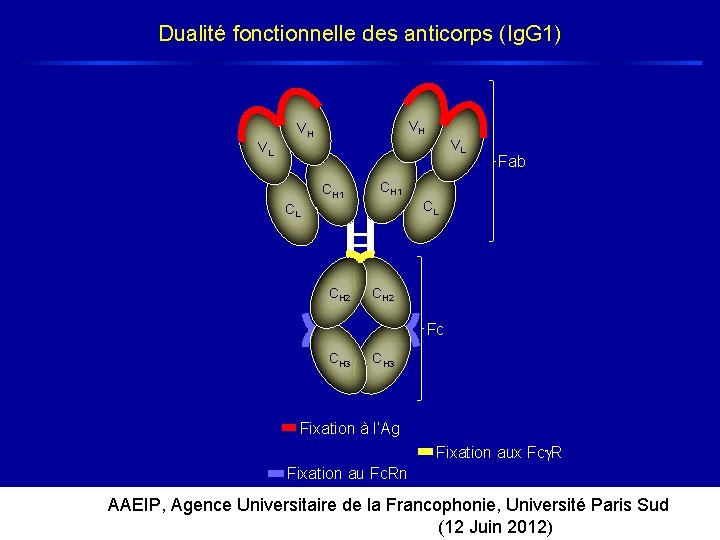
Dualité fonctionnelle des anticorps (Ig. G 1) VH VH VL VL CH 1 CL CL CH 2 Fab CH 2 Fc CH 3 Fixation à l’Ag Fixation aux Fc R Fixation au Fc. Rn AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Modes d’action des Ac. M à usage thérapeutique ligand soluble-récepteur (Ac - Neutralisation de l’interaction anti-ligand, anticorps anti-récepteur): TNF , IL 1 b, VEGF, IL 6 R, EGF-R, CD 25 (IL 2 -R ), Fc RI, toxine (charbon), C 5 - Blocage de l’activation d’un récepteur (HER 2/Neu, EGF-R) - Blocage de l’interaction cellule-cellule (CD 11 a, intégrine 4) - Induction d’apoptose (CD 20) - Ciblage d’une drogue (CD 33 -ozogamicine*) * Retiré du marché AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Modes d’action des Ac. M à usage thérapeutique - Activation de mécanismes effecteurs via la région Fc (ADCC, CDC, phagocytose, production de cytokines ou/et de chimiokines) (CD 20, CD 52) - Induction d’une immunomodulation par blocage de molécules membranaires impliquées dans la co-stimulation ou son contrôle (CD 4, CTLA-4) - Induction d’une réponse immune adaptative cellulaire à longterme AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

«L’anticorps murin qui voulait être humain» - L’infusion d’Ac. M de souris chez l’Homme => anticorps humains anti-Ac de souris (HAMA) => neutralisation et clairance accélérée de l’Ac. M => chute de l’efficacité, effets secondaires dus à la formation de complexes immuns et à leur dépôt. - Les Ac. M de souris ne stimulent pas les fonctions effectrices de l’immunité de façon optimale chez l’Homme : => faible activation du complément, => mauvais recrutement des récepteurs pour la région Fc des Ig (RFc) et du RFcn (=> diminution de la T 1/2). AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Ingénierie cellulaire pour générer des Ac. M humains 1977 : Transformation par l’EBV de lymphocytes B pour produire des Ac. M (Steinmitz et al. , Nature, 269: 420, 1977) Transformation Donneur Immunisé Lignées B (EBV) Lymphocytes B du sang périphérique Ac. M EBV Criblage Ac 1 Ac 2 Ac 3 Clonage des cellules AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Ingénierie moléculaire pour générer des anticorps humains 1984 : Ac. M chimériques souris/homme (Morrison et al. , Proc Natl Acad Sci USA, 81: 6851, 1984) 1988 : Expression de fragments d’anticorps (fragment Fv simple chaîn, e Fv) dans E. coli (Skerra & Plückthun, Science, 240: 1038 ; Huston et al. , Proc Natl Acad Sci USA, 85: 5879, 1988 ; Bird et al. , Science, 242: 423, 1988) 1989 : Ac. M humanisés (Queen et al. , Proc Natl Acad Sci USA, 86: 10029, 1989) 1989 : Banques combinatoires de phages exprimant des fragments d’Ac humains (Fab’, sc. Fv) ( «Phage display» ) (Huse et al. , Science, 246, 1275, 1989) 1994 : Production d’Ac. M humains par des souris transgéniques (Lonberg et al. , Nature, 368: 856, 1994; Green et al. , Nat Genet, 7: 13, 1994) ou transchromosomiques (Tomizuka et al. , Proc Natl Acad Sci USA, 97: 722, 1994) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

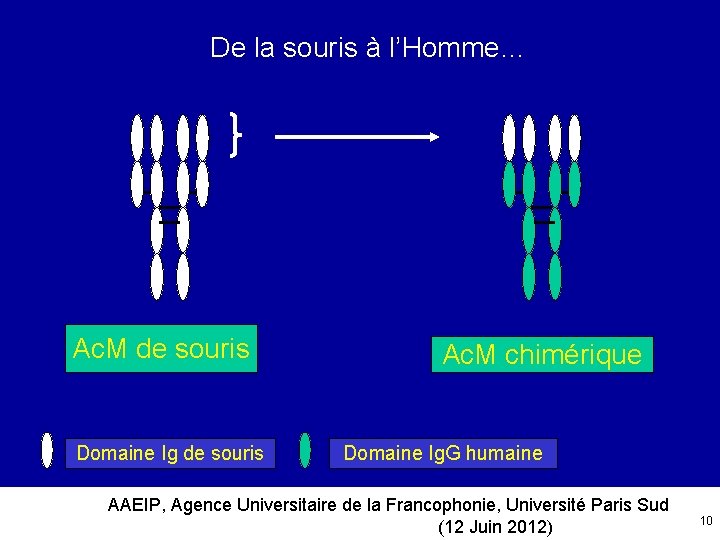
De la souris à l’Homme… Ac. M de souris Domaine Ig de souris Ac. M chimérique Domaine Ig. G humaine AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 10

Ingénierie moléculaire pour générer des anticorps humains 1984 : Ac. M chimériques souris/homme (Morrison et al. , Proc Natl Acad Sci USA, 81: 6851, 1984) 1988 : Expression de fragments d’anticorps (fragment Fv simple chaîn, e Fv) dans E. coli (Skerra & Plückthun, Science, 240: 1038 ; Huston et al. , Proc Natl Acad Sci USA, 85: 5879, 1988 ; Bird et al. , Science, 242: 423, 1988) 1989 : Ac. M humanisés (Queen et al. , Proc Natl Acad Sci USA, 86: 10029, 1989) 1989 : Banques combinatoires de phages exprimant des fragments d’Ac humains (Fab’, sc. Fv) ( «Phage display» ) (Huse et al. , Science, 246, 1275, 1989) 1994 : Production d’Ac. M humains par des souris transgéniques (Lonberg et al. , Nature, 368: 856, 1994; Green et al. , Nat Genet, 7: 13, 1994) ou transchromosomiques (Tomizuka et al. , Proc Natl Acad Sci USA, 97: 722, 1994) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

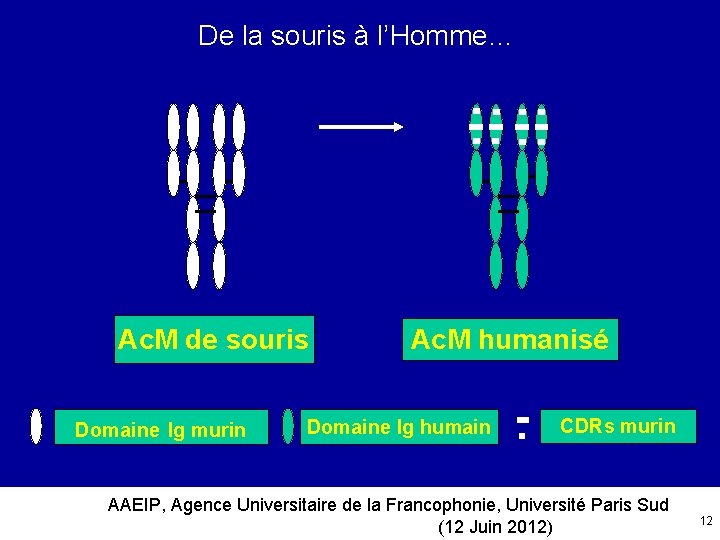
De la souris à l’Homme… Ac. M de souris Domaine Ig murin Ac. M humanisé Domaine Ig humain CDRs murin AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 12

Génération d’un Ac. M recombinant humanisé hu. Ig. G 1, Hybridome B de souris ARNt/ARNm VL VH hu. VL 1. 2. 3. 4. Séquençage Comparaison V humains Modélisation 3 -D/cristal Détermination CDR/FR contact 5. Greffe CDR 6. Mutations ponctuelles FR Ac. M, Hu. Ig. G 1, hu. VH Clonage Transfection Vecteur avec séquences hu. C 1 et hu. C Lignée cellulaire (CHO, NS 1…) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 13

Humanisation d’un Ac. M recombinant Substitutions d’a. a. des FR humains impliqués dans des contacts avec des a. a. des mo. CDRs greffés: remplacement des a. a. «humains» par les a. a. trouvés à la même position sur les VH/VL murins de l’Ac de souris ( «FR back mutations» ) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Ingénierie moléculaire: anticorps humains 1984 : Ac. M chimériques souris/homme (Morrison et al. , Proc Natl Acad Sci USA, 81: 6851, 1984) 1988 : Expression de fragments d’anticorps (fragment Fv simple chaîn, e Fv) dans E. coli (Skerra & Plückthun, Science, 240: 1038 ; Huston et al. , Proc Natl Acad Sci USA, 85: 5879, 1988 ; Bird et al. , Science, 242: 423, 1988) 1989 : Ac. M humanisés (Queen et al. , Proc Natl Acad Sci USA, 86: 10029, 1989) 1989 : Banques combinatoires de phages exprimant des fragments d’Ac humains (Fab’, sc. Fv) ( «Phage display» ) (Huse et al. , Science, 246, 1275, 1989) 1994 : Production d’Ac. M humains par des souris transgéniques (Lonberg et al. , Nature, 368: 856, 1994; Green et al. , Nat Genet, 7: 13, 1994) ou trans-chromosomiques (Tomizuka et al. , Proc Natl Acad Sci USA, 97: 722, 1994) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

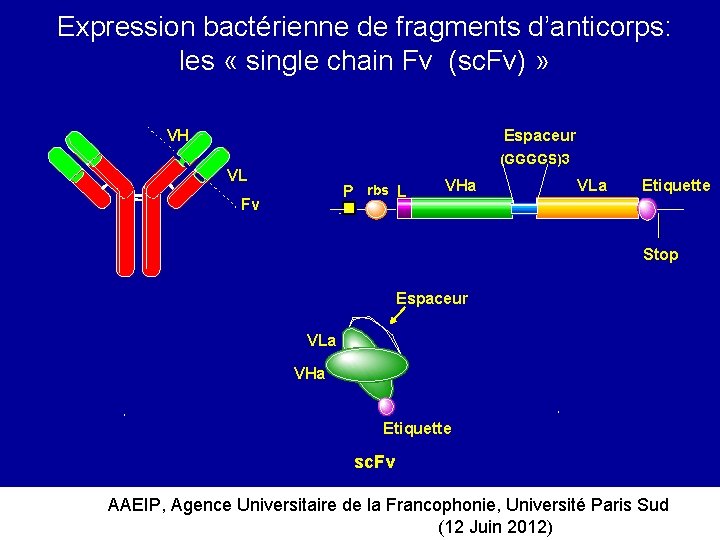
Expression bactérienne de fragments d’anticorps: les « single chain Fv (sc. Fv) » VH Espaceur (GGGGS)3 VL P rbs L Fv VHa VLa Etiquette Stop Espaceur VLa VHa Etiquette sc. Fv AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Ingénierie moléculaire: anticorps humains 1984 : Ac. M chimériques souris/homme (Morrison et al. , Proc Natl Acad Sci USA, 81: 6851, 1984) 1988 : Expression de fragments d’anticorps (fragment Fv simple chaîn, e Fv) dans E. coli (Skerra & Plückthun, Science, 240: 1038 ; Huston et al. , Proc Natl Acad Sci USA, 85: 5879, 1988 ; Bird et al. , Science, 242: 423, 1988) 1989 : Ac. M humanisés (Queen et al. , Proc Natl Acad Sci USA, 86: 10029, 1989) 1989 : Banques combinatoires de phages exprimant des fragments d’Ac humains (Fab’, sc. Fv) ( «Phage display» ) (Huse et al. , Science, 246, 1275, 1989) 1994 : Production d’Ac. M humains par des souris transgéniques (Lonberg et al. , Nature, 368: 856, 1994; Green et al. , Nat Genet, 7: 13, 1994) ou transchromosomiques (Tomizuka et al. , Proc Natl Acad Sci USA, 97: 722, 1994) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

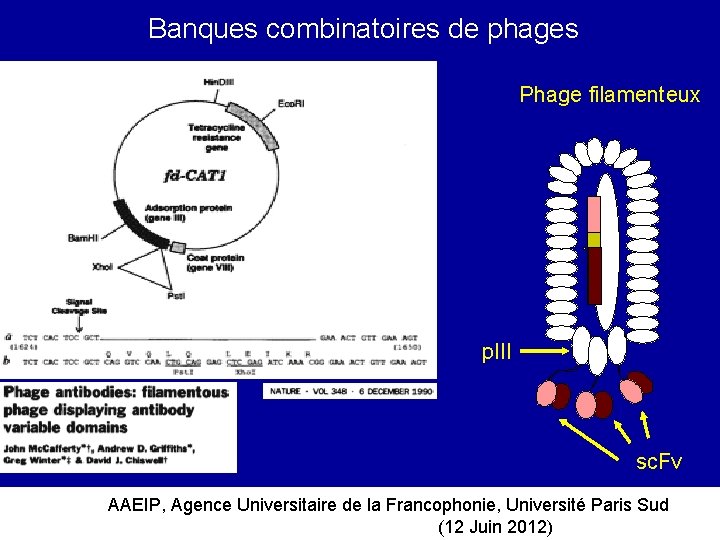
Banques combinatoires de phages Phage filamenteux p. III sc. Fv AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

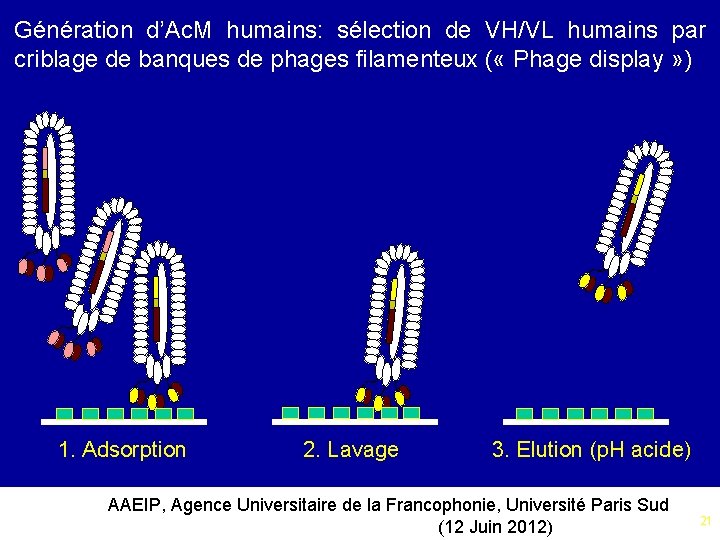
Génération d’Ac. M humains: sélection de VH/VL humains par criblage de banques de phages filamenteux ( « Phage display » ) 1. Clonage et expression de régions Fab ou de sc. Fv humains => production d’une banque de phages 2. Sélection de Fab ou de sc. Fv spécifiques exprimés à la surface des phages 3. Isolement des VH/VL spécifiques et «reformatage» sous forme d’Ig. G entière 4. Transfection et production de l’Ac. M recombinant dans des cellules eucaryotes (CHO, NS 1…) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 19

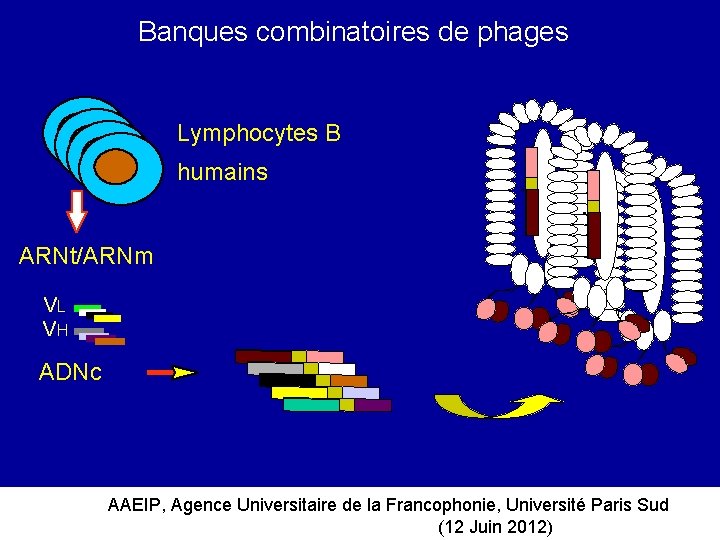
Banques combinatoires de phages Lymphocytes B humains ARNt/ARNm VL VH ADNc AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Génération d’Ac. M humains: sélection de VH/VL humains par criblage de banques de phages filamenteux ( « Phage display » ) 1. Adsorption 2. Lavage 3. Elution (p. H acide) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 21

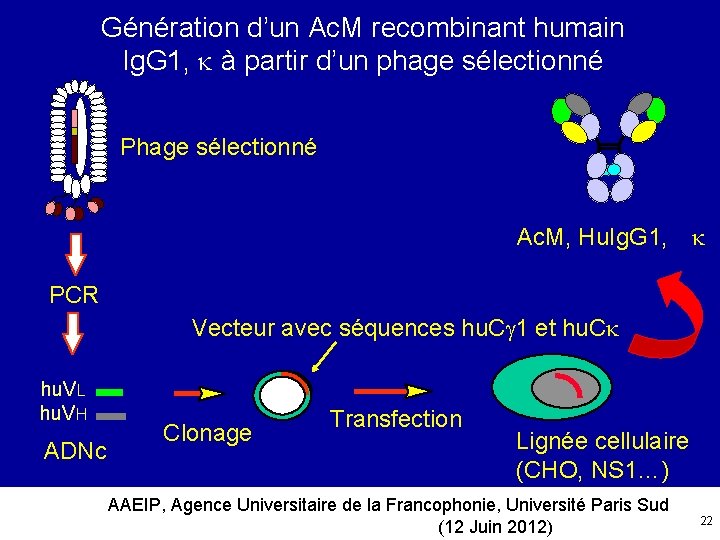
Génération d’un Ac. M recombinant humain Ig. G 1, à partir d’un phage sélectionné Phage sélectionné Ac. M, Hu. Ig. G 1, PCR Vecteur avec séquences hu. C 1 et hu. C hu. VL hu. VH ADNc Clonage Transfection Lignée cellulaire (CHO, NS 1…) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 22

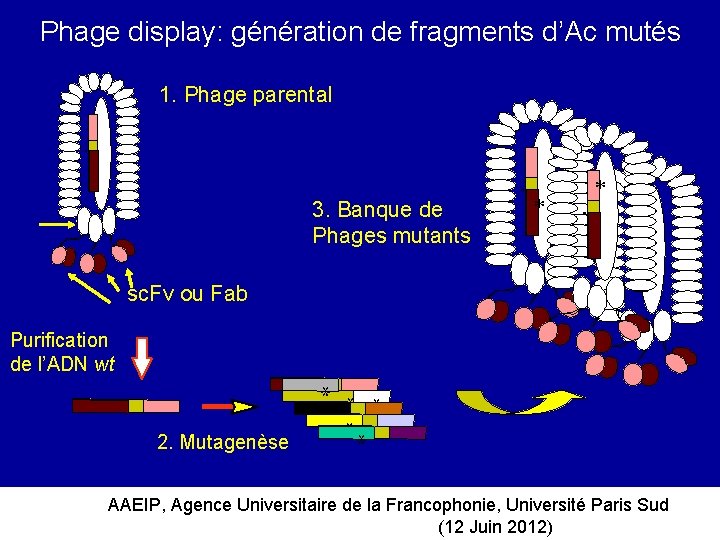
Phage display: génération de fragments d’Ac mutés 1. Phage parental 3. Banque de Phages mutants * * sc. Fv ou Fab Purification de l’ADN wt * ** 2. Mutagenèse AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Phage display: sélection de fragments d’Ac de forte affinité Banque de phages mutés Phage muté sélectionné (forte affinité) * * * 1. Adsorption sur l’Ag (faible densité) 2. Lavage 3. Elution AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 24

Ingénierie moléculaire: anticorps humains 1984 : Ac. M chimériques souris/homme (Morrison et al. , Proc Natl Acad Sci USA, 81: 6851, 1984) 1988 : Expression de fragments d’anticorps (fragment Fv simple chaîn, e Fv) dans E. coli (Skerra & Plückthun, Science, 240: 1038 ; Huston et al. , Proc Natl Acad Sci USA, 85: 5879, 1988 ; Bird et al. , Science, 242: 423, 1988) 1989 : Ac. M humanisés (Queen et al. , Proc Natl Acad Sci USA, 86: 10029, 1989) 1989 : Banques combinatoires de phages exprimant des fragments d’Ac humains (Fab’, sc. Fv) ( «Phage display» ) (Huse et al. , Science, 246, 1275, 1989) 1994 : Production d’Ac. M humains par des souris transgéniques (Lonberg et al. , Nature, 368: 856, 1994; Green et al. , Nat Genet, 7: 13, 1994) ou trans-chromosomiques (Tomizuka et al. , Proc Natl Acad Sci USA, 97: 722, 1994) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Génération d’Ac. M humains: utilisation de souris transgéniques humanisées contenant les gènes d’Ac humains AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 26

1. Invalidation des gènes DJ & J (chaînes H & L) de souris (lignée A) 2. Insertion des gènes codant une partie des chaînes lourdes et légères humaines (YAC) (lignée B). Croisement (Ax. B) => souris « humanisée » 3. Production d’hybridomes après immunisation 4. Clonage de l’Ac. M humain et expression dans des cellules eucaryotes (CHO, NSO …) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Immunogénicité des Ac recombinants 1. Ac chimériques: Dépend de l’Ac chimérique: pas, peu ou fortement immunogène (Homologie plus ou moins forte avec les VH/V humains? ) 2. Ac humanisés: Peu immunogène mais dépend également de l’Ac considéré Pour tous les Ac recombinants: 1. Rôle de la voie d’injection? 2. Rôle des doses injectées et de leur nombre/fréquence? 3. Rôle de l’antigène ciblé? 4. Test de détection des HAMA utilisé! AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Les 27 Ac. M utilisés en clinique en 2012 (FDA+EMEA) - 2 Ac. M sont des Ig. G de souris (une Ig. G 1, une Ig. G 2 a) - 4 Ac. M sont des Ig. G 1 humaines chimériques - 9 Ac. M sont des Ig. G humanisées (dix Ig. G 1 dont deux Fab, deux Ig. G 4, une Ig. G 2/4) - 9 Ac. M sont des Ig. G humaines (sept Ig. G 1, deux Ig. G 2) - 1 Ac bi-spécifique (rat Ig. G 2 b/souris Ig. G 2 a) - 2 Fab (un chimérique PEGylé, un humanisé) * Juin 2012 AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Les Ac. M utilisés en clinique (FDA+EMEA+ Chine) 33 Ac. M sont/ont été sur le marché* et ont généré des revenus de près de quarante milliards d’Euros en 2011: - 8 Ac. M dans les maladies inflammatoires/auto-immunes - 1 Ac. M dans les maladies infectieuses (VRS) - 3 Ac. M dans la transplantation - 1 Ac. M dans les maladies cardio-vasculaires - 1 Ac. M dans une maladie neuro-dégénérative (SEP) - 1 Ac. M dans l’asthme allergique - 15 Ac. M en oncologie - 1 Acm en ophtalmologie (DMLA) - 1 Ac. M dans les maladies osseuses - 1 Ac. M en hématologie (HPN) * Juin 2012 AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Quelques règles de lecture à propos des Ac. M Nom Type xxm. Omab Mouse (souris) xx. XImab Chimeric (chimérique) Ex. d’anticorps muromonab britumomab rituximab cetuximab XXZUmab Humanized trastuzumab (humanisé) alemtuzumab Xxm. Umab Fully Human panitumumab (humain) adalimumab AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Optimiser les anticorps monoclonaux *Optimisation de la fixation des Ac. M et des effets biologiques induits sur la cible : - affinité et avidité - spécificité «fine» : choix de l’épitope (effets pro-apoptotiques, cytostatiques …) *Optimisation des fonctions effectrices : - meilleurs recrutement et activation des cellules effectrices [cellules NK, neutrophiles, monocytes/ macrophages, CTLs (anticorps bispécifiques, «T-bodies» )] - meilleure activation du complément (C 1 q) (voie classique: Ig. G 3> Ig. G 1, Ig. G 2) => formation du Complexe d’Attaque Membranaire AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

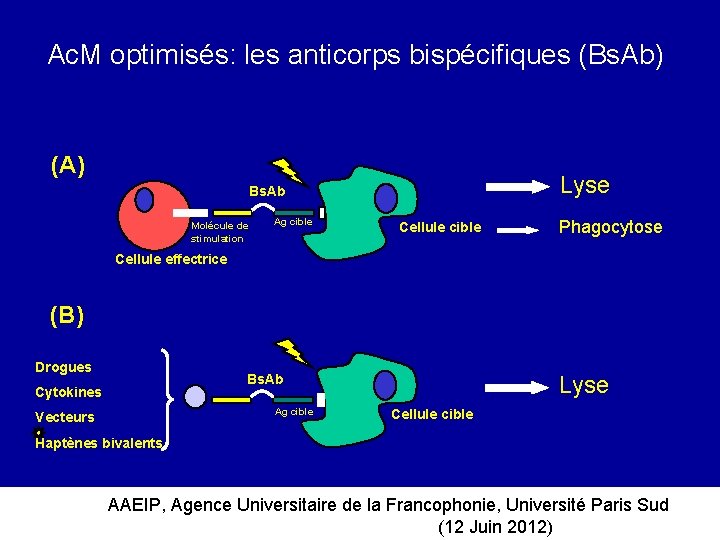
Ac. M optimisés: les anticorps bispécifiques (Bs. Ab) (A) Lyse Bs. Ab Molécule de stimulation Ag cible Cellule cible Phagocytose Cellule effectrice (B) Drogues Bs. Ab Cytokines Ag cible Vecteurs Lyse Cellule cible Haptènes bivalents AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

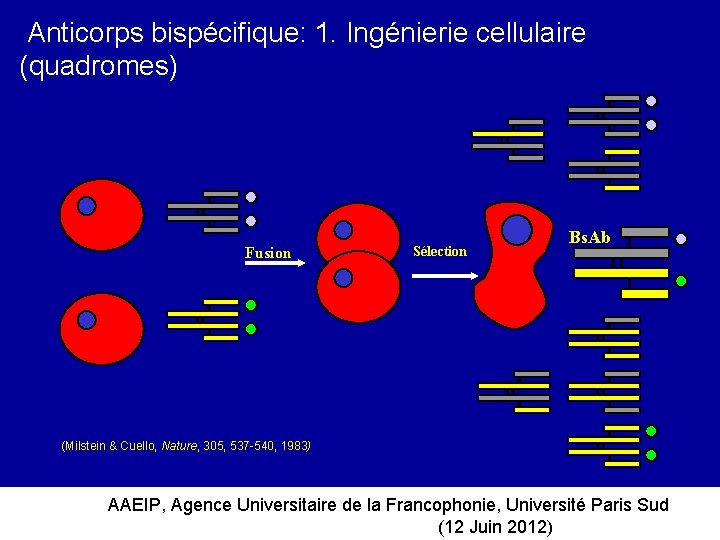
Anticorps bispécifique: 1. Ingénierie cellulaire (quadromes) Fusion Sélection Bs. Ab (Milstein & Cuello, Nature, 305, 537 -540, 1983) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

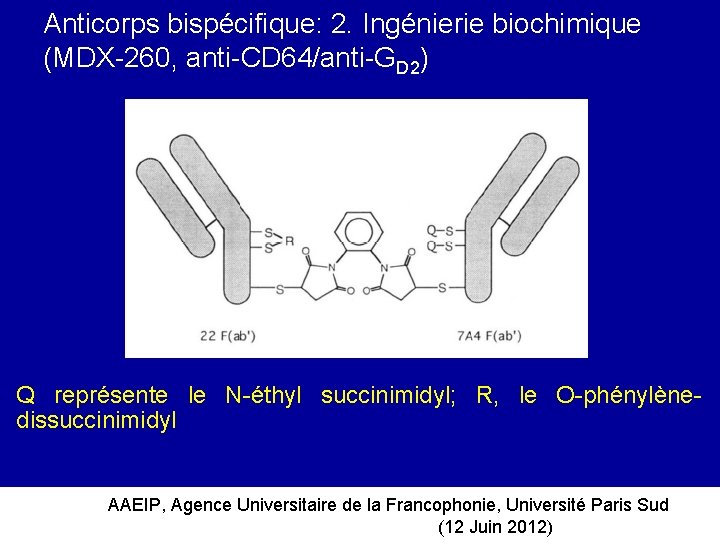
Anticorps bispécifique: 2. Ingénierie biochimique (MDX-260, anti-CD 64/anti-GD 2) Q représente le N-éthyl succinimidyl; R, le O-phénylènedissuccinimidyl AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

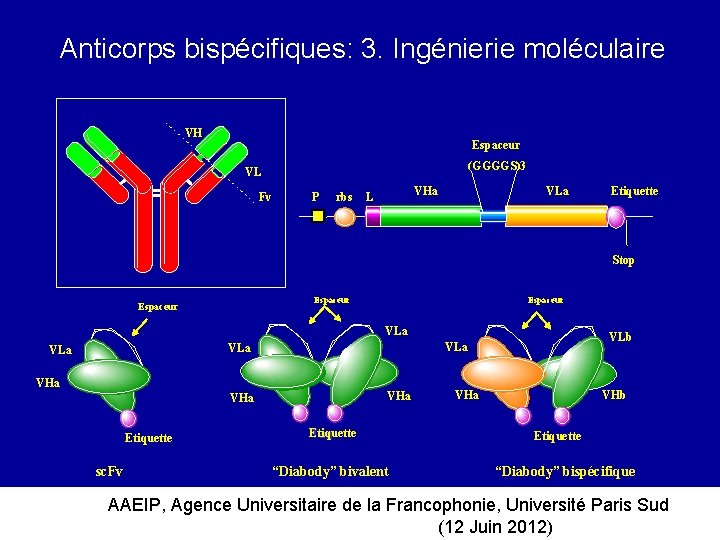
Anticorps bispécifiques: 3. Ingénierie moléculaire VH Espaceur (GGGGS)3 VL Fv P rbs VHa L VLa Etiquette Stop Espaceur VLa VHa VHa Etiquette sc. Fv VLb VLa VLa Etiquette Tag “Diabody” bivalent VHa VHb Etiquette “Diabody” bispécifique AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Génération et ingénierie de fragments d’Ac 1989: Isolement de domaines VH ayant de fortes affinités à partir de banques de domaines VH exprimés dans E. coli (Ward et al, Nature, 341: 544) 1993: Ac intracellulaires (“Intrabodies”) (Marasco et al, PNAS, 90: 7889) et fragments Fc à usage thérapeutique (Debré et al, Lancet, 342: 945) 1993: Ingénierie moléculaire de formats bispécifiques: “diabodies” (Holliger et al, PNAS, 90: 6444), “triabodies”…. 1993: Découverte d’Ac de Camelidæ dépourvus de chaînes légères (Hamers-Casterman et al, Nature, 363: 446) 2008: Régression tumorale chez des patients cancéreux après injection de très faibles doses de fragments d’Ac bispécifiques (Bargou et al, Science, 321: 974) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

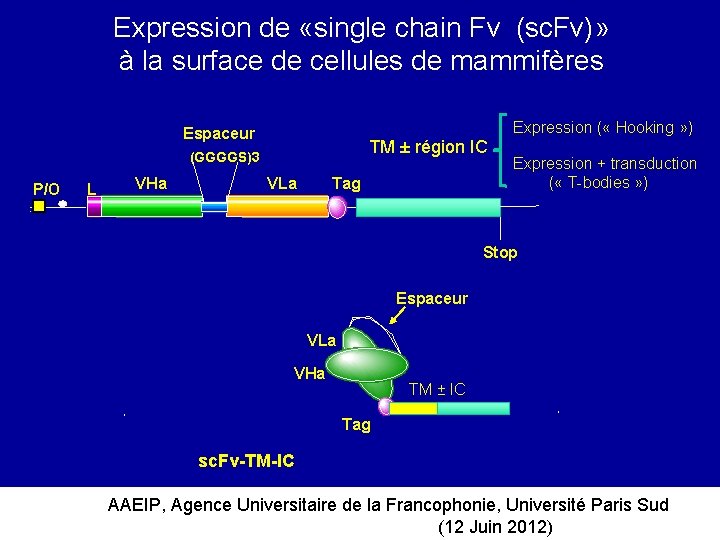
Expression de «single chain Fv (sc. Fv)» à la surface de cellules de mammifères Expression ( « Hooking » ) Espaceur TM ± région IC (GGGGS)3 P/O L VHa Tag VLa Expression + transduction ( « T-bodies » ) Stop Espaceur VLa VHa TM ± IC Tag sc. Fv-TM-IC AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

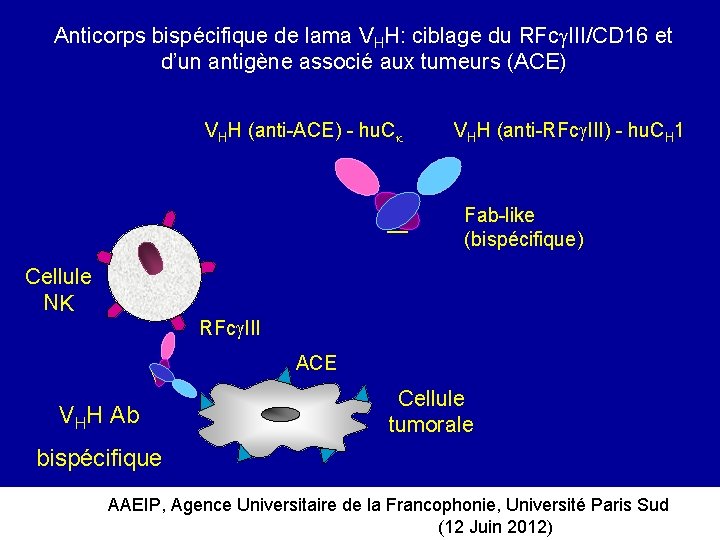
Anticorps bispécifique de lama VHH: ciblage du RFc III/CD 16 et d’un antigène associé aux tumeurs (ACE) VHH (anti-ACE) - hu. C VHH (anti-RFc III) - hu. CH 1 Fab-like (bispécifique) Cellule NK RFc III ACE VHH Ab Cellule tumorale bispécifique AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

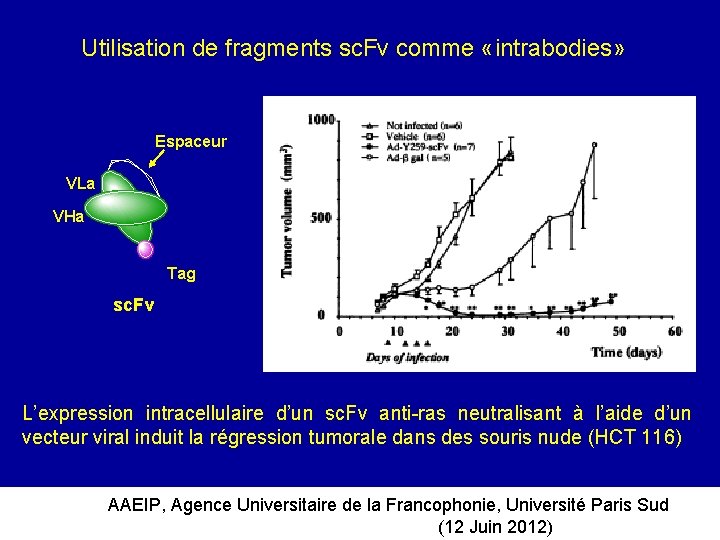
Utilisation de fragments sc. Fv comme «intrabodies» Espaceur VLa VHa Tag sc. Fv L’expression intracellulaire d’un sc. Fv anti-ras neutralisant à l’aide d’un vecteur viral induit la régression tumorale dans des souris nude (HCT 116) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Anticorps monoclonaux optimisés: ingénierie de la région Fc (Ig. G 1) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Fonctions effectrices des Ig. G dépendantes des récepteurs pour la région Fc des Ig. G (RFc ) * Fixation aux RFc activateurs (I, IIA, III): * La cytotoxicité dépendante d’anticorps (ADCC)(cellules NK, monocytes, neutrophiles) * La phagocytose de particules opsonisée (DC, (macrophages) * L’endocytose de complexes immuns (monocytes, DC, macrophages, neutrophiles, lymphocytes B) * La sécrétion de cytokines et chimiokines * Fixation aux RFc inhibiteurs (IIB) : blocage de l’activation cellulaire induite par d’autres récepteurs (BCR, RFc activateurs…) (lymphocytes B, mastocytes, monocytes…) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012) 42

Anticorps monoclonaux optimisés: ingénierie de la région Fc (Ig. G 1) Stratégies d’ingénierie de la région Fc : 1. Criblage et sélection d’anticorps Ig. G 1 ayant une région Fc mutée 2. Modification de la glycosylation de la région Fc des anticorps Ig. G 1 AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

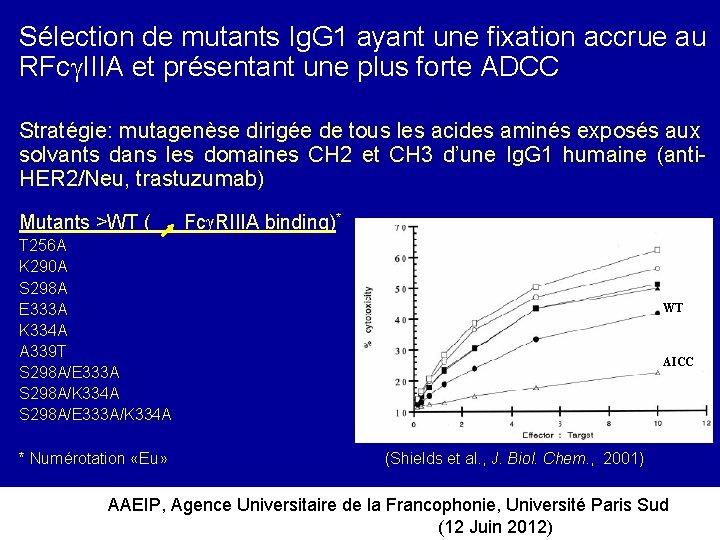
Sélection de mutants Ig. G 1 ayant une fixation accrue au RFc IIIA et présentant une plus forte ADCC Stratégie: mutagenèse dirigée de tous les acides aminés exposés aux solvants dans les domaines CH 2 et CH 3 d’une Ig. G 1 humaine (anti. HER 2/Neu, trastuzumab) Mutants >WT ( Fc RIIIA binding)* T 256 A K 290 A S 298 A E 333 A K 334 A A 339 T S 298 A/E 333 A S 298 A/K 334 A S 298 A/E 333 A/K 334 A * Numérotation «Eu» WT AICC (Shields et al. , J. Biol. Chem. , 2001) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Anticorps monoclonaux optimisés: ingénierie de la région Fc (Ig. G 1) Stratégies d’ingénierie de la région Fc : 1. Criblage et sélection d’anticorps Ig. G 1 ayant une région Fc mutée 2. Modification de la glycosylation de la région Fc des anticorps Ig. G 1 AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

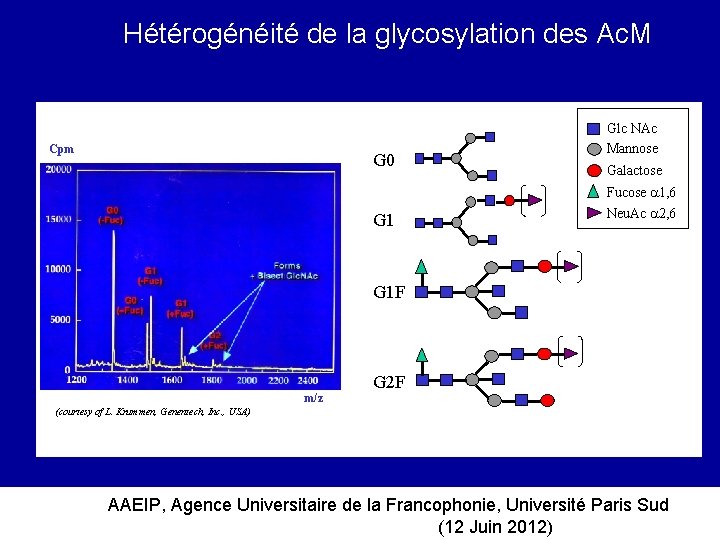
Hétérogénéité de la glycosylation des Ac. M Cpm G 0 G 1 Glc NAc Mannose Galactose Fucose 1, 6 Neu. Ac 2, 6 G 1 F m/z G 2 F (courtesy of L. Krummen, Genentech, Inc. , USA) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Ingénierie de la glycosylation (Ig. G 1 humaines) L’absence de fucose ou un contenu faible en fucose (20 -35%), La présence de galactose et/ou de galactose et d’acide sialique à l’extrémité de/des Glc. NAc terminales, La présence d’une Glc. NAc intercalaire, accroissent la fixation aux RFc et augmente l’ADCC des Ig. G 1 monoclonales humaines AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Les anticorps monoclonaux optimisés * Optimisation des propriétés pharmaco-cinétiques * Meilleure bio-distribution et ciblage (notamment au site de la tumeur) * Meilleure capture de drogues, vecteurs viraux, et haptènes radio-marqués au voisinage de la cellule-cible (dans la plupart des cas, des cellules tumorales) AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

Les nouveaux défis des anticorps monoclonaux - Un, deux, trois Ac. M (bio-terrorisme, oncologie…)? - Les anticorps conjugués aux drogues (immunoconjugués): le grand retour de la “magic bullet”? - Les nouveaux formats (Ac bi- ou tri-spécifiques, simples domaines VH, VHH…? - Nouvelles utilisations: anticorps intra-cellulaires, fragment d’Ac à la surface de cellules effectrices ( « T-bodies » ) ou cibles ( « Hooking » ): Ac. M et thérapie cellulaire? - Qu’est ce qu’un biosimilaire? ! AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)

jean-luc. teillaud@crc. jussieu. fr AAEIP, Agence Universitaire de la Francophonie, Université Paris Sud (12 Juin 2012)