12 janvier 2018 M 2 optimisation thrapeutique PKPD













![Large variabilité interindividuelle [AFA] / dose • Voriconazole 16 patients sous prophylaxie à 200 Large variabilité interindividuelle [AFA] / dose • Voriconazole 16 patients sous prophylaxie à 200](https://slidetodoc.com/presentation_image/174eb4657e773764b30ed23111a2bc38/image-26.jpg)







![Associations contre-indiquées pour V [c] AF : ANSM Antifongique Effet de l’interaction sur les Associations contre-indiquées pour V [c] AF : ANSM Antifongique Effet de l’interaction sur les](https://slidetodoc.com/presentation_image/174eb4657e773764b30ed23111a2bc38/image-44.jpg)
























- Slides: 79

12 janvier 2018 M 2 optimisation thérapeutique PK/PD des antifongiques Dr S. Alfandari Infectiologue et Hygiéniste, CH Tourcoing Infectiologue du Service des Maladies du Sang, CHRU Lille

Menu Généralités ◦ IFI ◦ PK/PD Azolés Candines Polyenes Pyrimidine

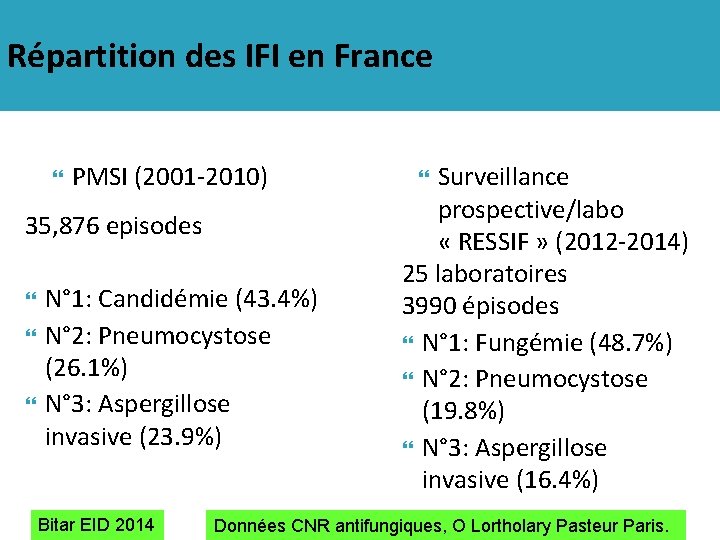
Répartition des IFI en France PMSI (2001 -2010) 35, 876 episodes N° 1: Candidémie (43. 4%) N° 2: Pneumocystose (26. 1%) N° 3: Aspergillose invasive (23. 9%) Bitar EID 2014 Surveillance prospective/labo « RESSIF » (2012 -2014) 25 laboratoires 3990 épisodes N° 1: Fungémie (48. 7%) N° 2: Pneumocystose (19. 8%) N° 3: Aspergillose invasive (16. 4%) Données CNR antifungiques, O Lortholary Pasteur Paris.

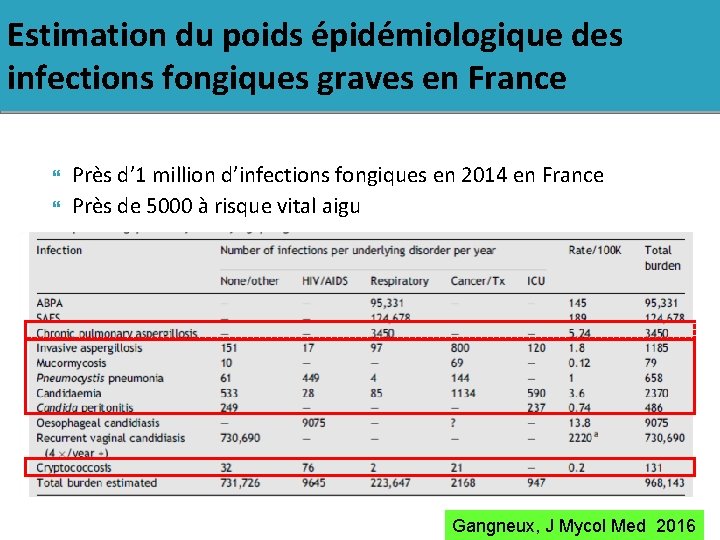
Estimation du poids épidémiologique des infections fongiques graves en France Près d’ 1 million d’infections fongiques en 2014 en France Près de 5000 à risque vital aigu Gangneux, J Mycol Med 2016

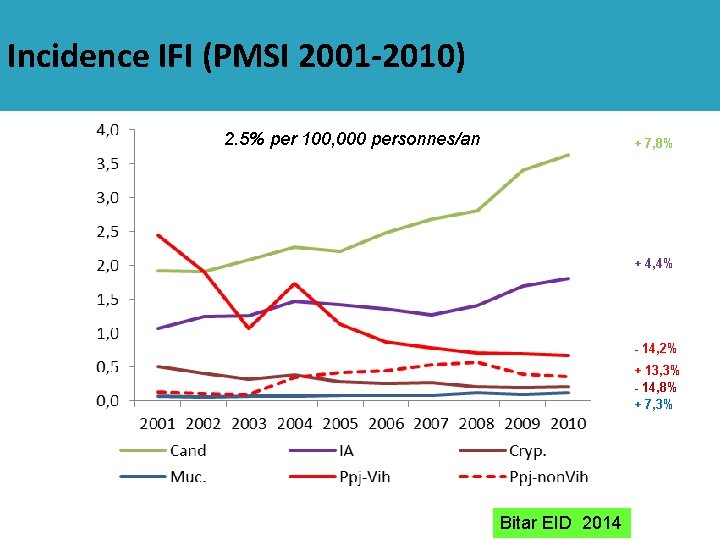
Incidence IFI (PMSI 2001 -2010) 2. 5% per 100, 000 personnes/an + 7, 8% + 4, 4% - 14, 2% + 13, 3% - 14, 8% + 7, 3% Bitar EID 2014

Antifongiques systémiques Azolés ◦ ◦ ◦ Fluconazole Itraconazole Voriconazole Posaconazole Isavuconazole Candines Pyrimidine Polyènes ◦ Anidulafungine ◦ Caspofungine ◦ Micafungine ◦ Fluorocytosine ◦ Amphotéricine B lipid complex (ABLC) ◦ Amphotéricine B liposomale (L-Amb) ◦ Amphotéricine B désoxicholate (Amb-D) 10 molécules / 4 classes

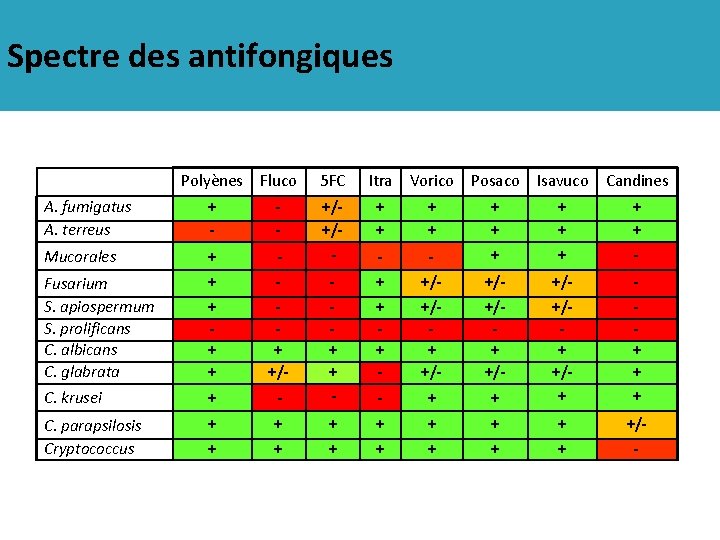
Spectre des antifongiques Polyènes Fluco 5 FC Itra Vorico Posaco Isavuco A. fumigatus A. terreus + - - + + Mucorales + - +/+/ - - Fusarium S. apiospermum S. prolificans C. albicans C. glabrata + + +/- C. krusei + - + + - C. parapsilosis Cryptococcus + + + Candines - + + + + - +/+/+ +/- - + + +/+/+ + + +/-

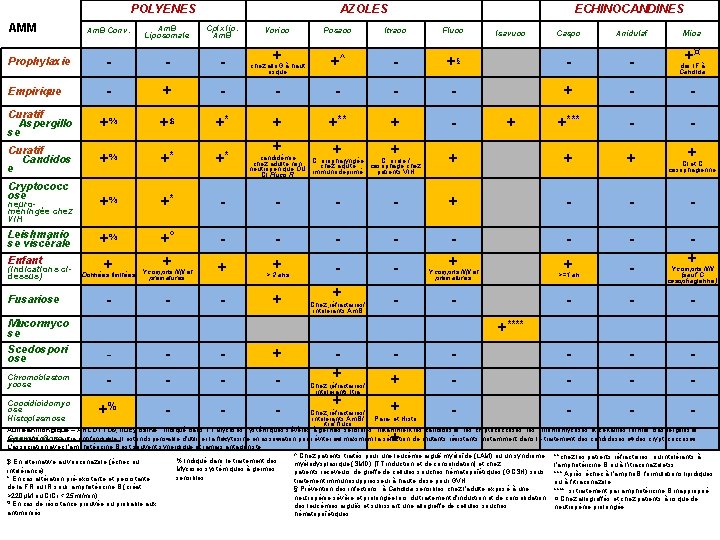
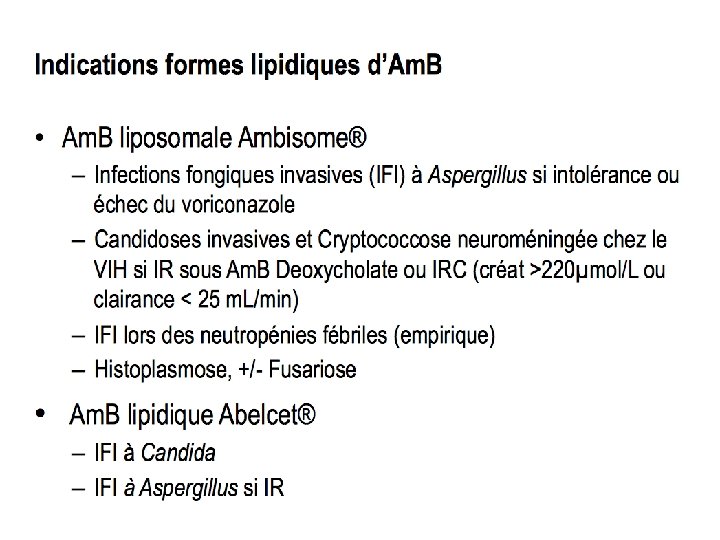
POLYENES AMM AZOLES Am. B Conv. Am. B Liposomale Cplx lip. Am. B Prophylaxie - - - Empirique - + Curatif Aspergillo se +% Curatif Candidos e Cryptococc ose neuroméningée chez VIH Leishmanio se viscérale Enfant (indications cidessus) Fusariose Posaco Itraco Fluco + +^ - - +$ +* + +% +* +* + +% +* - +% Données limitées +° + Y compris NN et - - + prématurés Vorico ECHINOCANDINES Caspo Anidulaf +§ - - +** + - +*** - - + + + - - - - - + > 2 ans + - - + Y compris NN et + prématurés >=1 an - + Y compris NN - + + - - - chez allo. G à haut risque candidémie C. orale / chez adulte non C. oropharyngée chez adulte œsophage chez neutropénique OU immunodéprimé patients VIH CI Fluco R Chez réfractaires/ intolérants Am. B Mucormyco se Isavuco + Mica +¤ des IF à Candida + CI et C. œsophagienne (sauf C œsophagienne) +**** Scedospori ose - - - + Chromoblastom ycose - - Coccidioïdomyc ose Histoplasmose +% - - - - + + - - - + - - Chez réfractaires/ intolérants Itra Chez réfractaires/ intolérants Am. B/ Para- et Histo itra/ fluco Autre antifongique = ANCOTYL®, flucytosine : indiqué dans TT Mycoses systémiques sévères à germes sensibles, notamment les candidoses, les cryptococcoses, les chromomycoses et certaines formes d'aspergilloses. Association à un autre antifongique: Il est indispensable d'utiliser la flucytosine en association pour éviter au maximum la sélection de mutants résistants, notamment dans le traitement des candidoses et des cryptococcoses. Sporotrichose L'association avec l'amphotéricine B est souvent synergique et jamais antagoniste ^ Chez patients traités pour une leucémie aiguë myéloïde (LAM) ou un syndrome **chez les patients réfractaires ou intolérants à % Indiqué dans le traitement des $ En alternative au voriconazole (échec ou myélodysplasique (SMD) [TT induction et de consolidation] et chez l'amphotéricine B ou à l'itraconazoletss Mycoses systémiques à germes intolérance) patients receveurs de greffe de cellules souches hématopoïétiques (GCSH) sous *** Après échec à l'ampho. B, formulations lipidiques sensibles * En cas altération pré-existante et persistante traitement immunosuppresseur à haute-dose pour GVH ou à l'itraconazole de la FR ou IR sous amphotéricine B (créat § Prévention des infections à Candida sensibles chez l'adulte exposé à une ****: si traitement par amphotéricine B inapproprié >220µM ou Cl. Cr < 25 ml/min) neutropénie sévère et prolongée lors du traitement d'induction et de consolidation ¤ Chez allogreffés et chez patients à risque de O En cas de résistance prouvée ou probable aux des leucémies aiguës et subissant une allogreffe de cellules souches neutropénie prolongée antimoniés hématopoïétiques

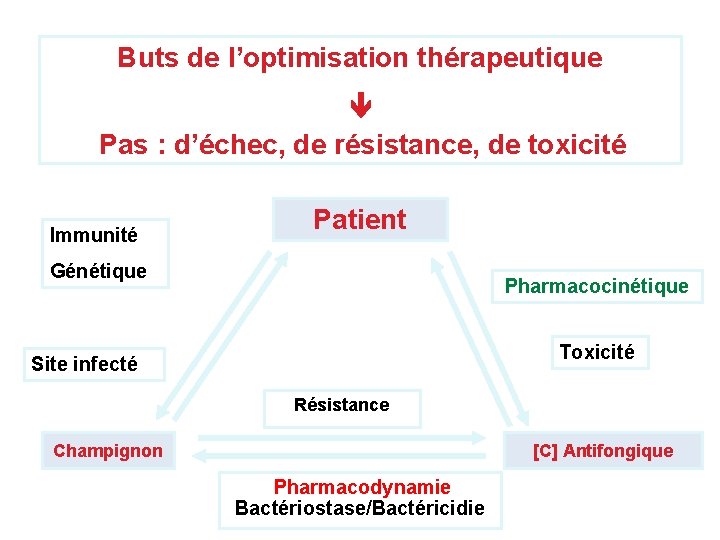
Buts de l’optimisation thérapeutique Pas : d’échec, de résistance, de toxicité Immunité Patient Génétique Pharmacocinétique Toxicité Site infecté Résistance Champignon [C] Antifongique Pharmacodynamie Bactériostase/Bactéricidie


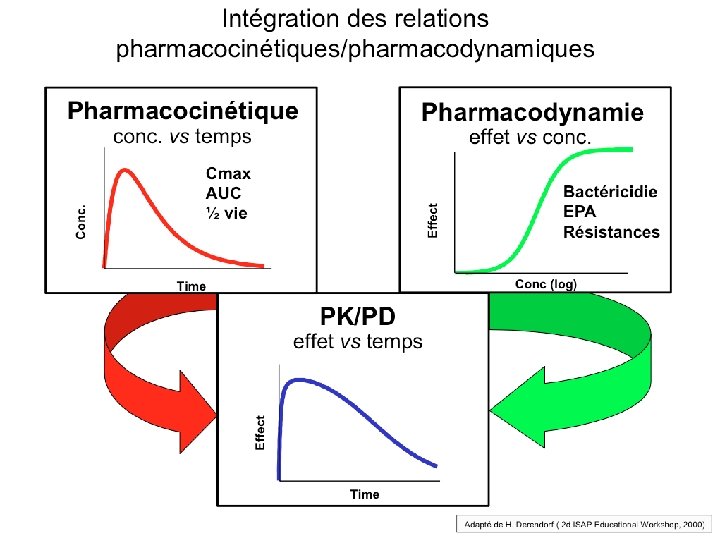
Pharmacodynamie Diapo F. Jehl Paramètres PK/PD, prédictifs de - l’efficacité bactério-clinique - de la prévention de l’émergence de résistance …. par famille d’anti-infectieux. Ces paramètres intègrent - la pharmacocinétique (concentrations et ASC) - la microbiologie (CMI)

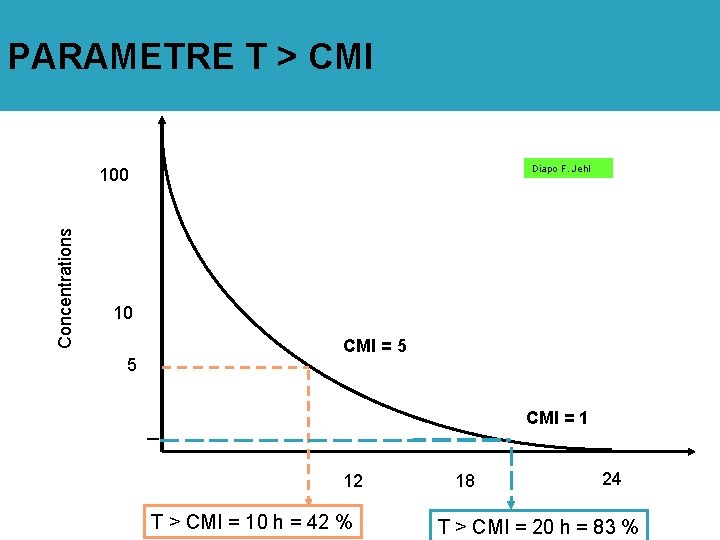
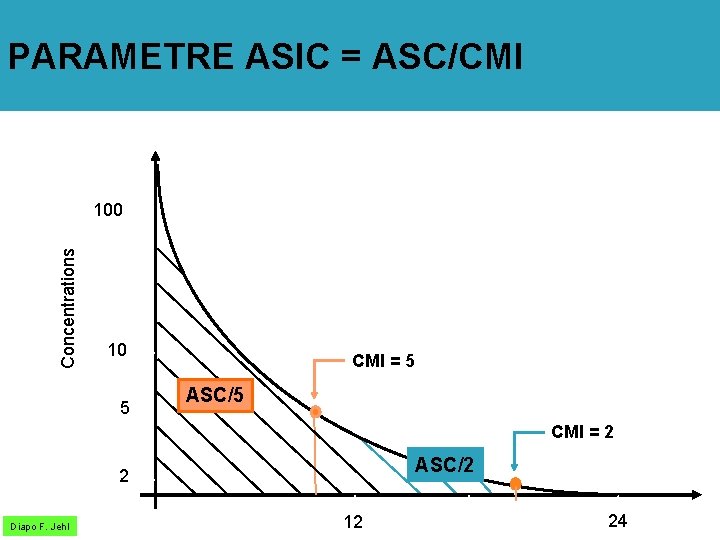
Paramètres pharmacodynamiques prédictifs de l’efficacité/résistance Diapo F. Jehl T > CMI : temps pendant lequel les concentrations sériques sont > CMI ASIC : ASC/CMI (aire sous la courbe des concentrations sériques) QI: Concentrations / CMI: quotients inhibiteurs divers (max, min, sériques, tissulaires) CPM: Concentration de Prévention des Mutations

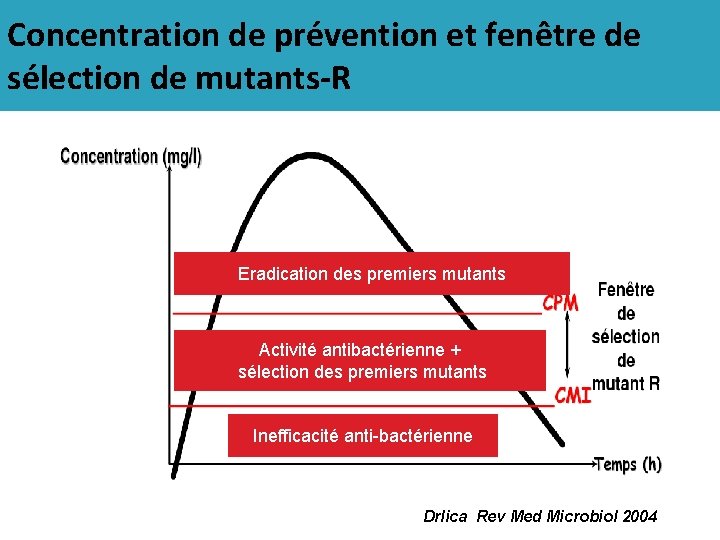
Concentration de prévention et fenêtre de sélection de mutants-R Eradication des premiers mutants Activité antibactérienne + sélection des premiers mutants Inefficacité anti-bactérienne Drlica Rev Med Microbiol 2004

PARAMETRE T > CMI Diapo F. Jehl Concentrations 100 10 5 CMI = 1 12 T > CMI = 10 h = 42 % 18 24 T > CMI = 20 h = 83 %

PARAMETRE ASIC = ASC/CMI Concentrations 100 10 5 CMI = 5 ASC/5 CMI = 2 ASC/2 2 Diapo F. Jehl 12 24

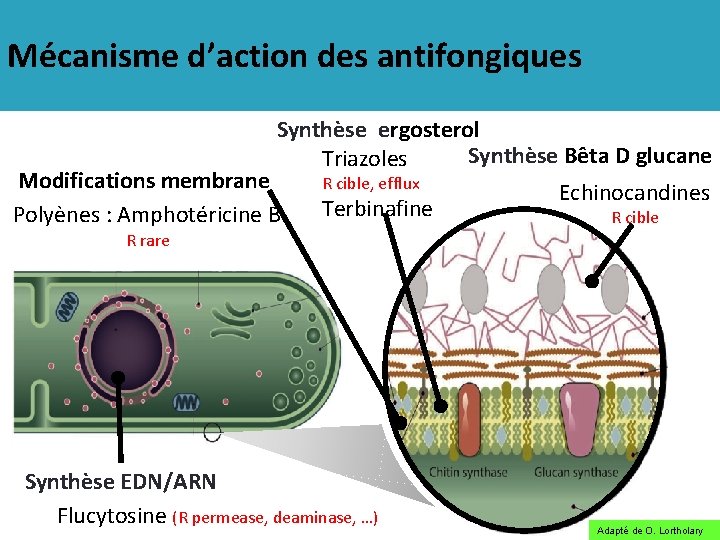
Mécanisme d’action des antifongiques Synthèse ergosterol Synthèse Bêta D glucane Triazoles Modifications membrane R cible, efflux Echinocandines Polyènes : Amphotéricine B Terbinafine R cible R rare Synthèse EDN/ARN Flucytosine (R permease, deaminase, …) Adapté de O. Lortholary

Azolés

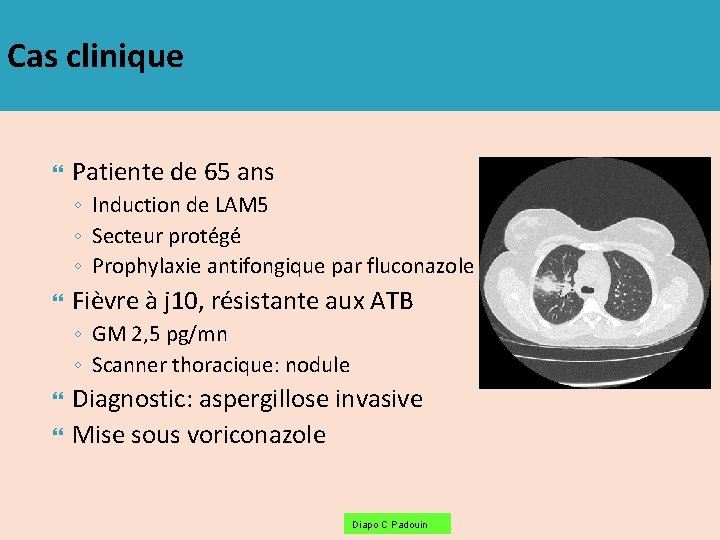
Cas clinique Patiente de 65 ans ◦ Induction de LAM 5 ◦ Secteur protégé ◦ Prophylaxie antifongique par fluconazole Fièvre à j 10, résistante aux ATB ◦ GM 2, 5 pg/mn ◦ Scanner thoracique: nodule Diagnostic: aspergillose invasive Mise sous voriconazole Diapo C Padouin

Comment administrer le voriconazole ? Le patient est stable, n’a pas de mucite sévère, et est capable de prendre un traitement per os. A. Voie IV pendant les 7 premiers jours au moins. On verra ensuite en fonction de la réponse et de son état clinique. B. Voie orale d’emblée. Je ne le passerai IV que si les dosages sont insuffisants C. Voie IV pour la dose de charge pendant les 24 premières heures, puis voie orale D. Je ne sais pas Diapo C Padouin

En pratique : Si pas de contre-indication, la voie orale peut être envisagée précocement En dehors de la dose de charge, la voie IV ne garantit pas des concentrations supérieures à la voie orale La toxicité rénale de l’excipient de la forme IV doit être prise en compte La dose de charge et la demi-vie du voriconazole permettent un contrôle de la concentration résiduelle dès J 2. Diapo C Padouin 20

Traitement initial de l’Aspergillose par VORICONAZOLE Mentions AMM: Le traitement doit être débuté avec la dose d’attaque spécifiée, différente pour la forme intraveineuse de la forme orale, afin d’obtenir le premier jour des concentrations plasmatiques proches de l’état d’équilibre. Compte tenu de la biodisponibilité orale élevée du médicament (96%), le relais par la forme orale peut se faire quand le tableau clinique le permettra. Voie intraveineuse Voie orale (Patients ≥ 40 kg) Dose de charge (pendant les premières 24 h) 6 mg/kg toutes les 12 heures 400 mg toutes les 12 heures Dose d’entretien (après les premières 24 h) 4 mg/kg deux fois par jour 200 mg deux fois par jour Recos ECIL (Herbrecht R 2007): “There are insufficient data for recommendations of when to initiate oral treatment. In addition, oral dosing not adapted to weight may lead to suboptimal therapy. Intravenous voriconazole administration is contraindicated in renal Insufficiency » Diapo C Padouin

Biodisponibilité du voriconazole Le switch d’une dose normalisée au poids (IV) à une dose fixe (orale) peut être problématique Dose de charge IV = 360 mg toutes les 12 h (6 mg/kg patients de 60 kg) Dose de charge per os = 400 mg toutes les 12 h (patients de 60 kg) Dose d’entretien IV = 240 mg toutes les 12 h (4 mg/kg patients de 60 kg) Dose d’entretien per os = 200 mg toutes les 12 h (patients de 60 kg) 126 patients, 203 résiduelles, 137 pics, age 1 – 85 ans poso IV 40 – 400 mg bid, VO 50 – 500 mg bid Médiane, [interquartile] Voie IV (mg / L) Voie orale (mg / L) Pic Résiduelle 3. 2 2. 6 2. 2 1. 3 [2. 0 – 5. 9] [1. 0 – 4. 2] [1. 2 – 3. 3] [0. 7 – 2. 6] Diapo C Padouin Padoin, RICAI, 2004

Cas clinique, suite Poids : 72 kgs Bilan hépatique : normal DFG: 70 ml/mn. => Le voriconazole est débuté avec dose de charge IV puis PO. La lésion se stabilise, le patient a 38°C. Un premier dosage sérique résiduel de voriconazole est demandé au à J 4, alors que le patient prend 200 mg x 2 / j. Ce dosage est à 0, 6 mg/L Que faites-vous ? Diapo C Padouin

Résiduel à 0, 6 mg/L sous 200 mg x 2 Que faites-vous ? A. Je ne change rien B. J’augmente la posologie car la concentration est inférieure à 1 mg/L C. J’augmente la posologie (250 mg x 2) et prévoit un contrôle de la concentration résiduelle 7 jours après la modification posologique D. J’augmente la posologie (250 mg x 2) et prévoit un contrôle de la concentration résiduelle 2 jours après la modification posologique Diapo C Padouin

Résiduel à 0, 6 mg/L sous 200 mg x 2 Que faites-vous ? A. Je ne change rien B. J’augmente la posologie car la concentration est inférieure à 1 mg/L C. J’augmente la posologie (250 mg x 2) et prévoit un contrôle de la concentration résiduelle 7 jours après la modification posologique D. J’augmente la posologie (250 mg x 2) et prévoit un contrôle de la concentration résiduelle 2 jours après la modification posologique Diapo C Padouin
![Large variabilité interindividuelle AFA dose Voriconazole 16 patients sous prophylaxie à 200 Large variabilité interindividuelle [AFA] / dose • Voriconazole 16 patients sous prophylaxie à 200](https://slidetodoc.com/presentation_image/174eb4657e773764b30ed23111a2bc38/image-26.jpg)
Large variabilité interindividuelle [AFA] / dose • Voriconazole 16 patients sous prophylaxie à 200 mg bid p. o. Crés Johnson H, Antimicrob Agents Chemother 2010 Large variabilité • C résiduelle ( « trough » ) • Cinétique (AUC) 87 patients hémato (prophylaxie ou curatif) R = 0. 14 P = 0. 051 Trifilio S, Cancer 2007 Absence corrélation dose/[vori] Diapo: D. Allorge, Lille

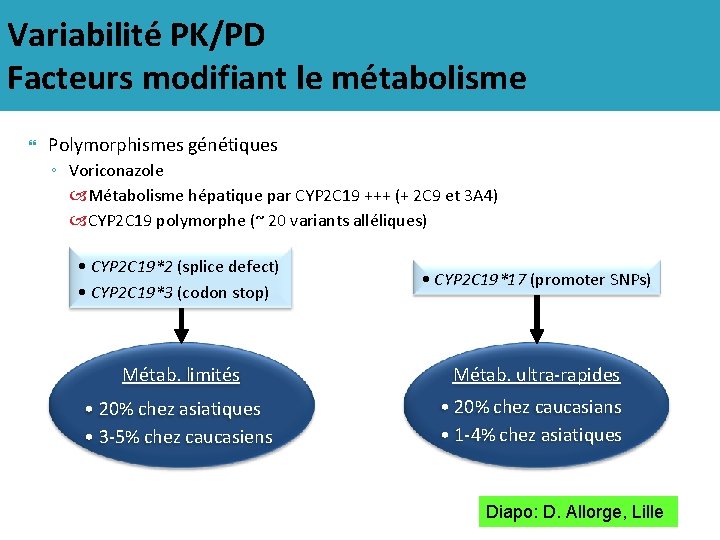
Variabilité PK/PD Facteurs modifiant le métabolisme Polymorphismes génétiques ◦ Voriconazole Métabolisme hépatique par CYP 2 C 19 +++ (+ 2 C 9 et 3 A 4) CYP 2 C 19 polymorphe (~ 20 variants alléliques) • CYP 2 C 19*2 (splice defect) • CYP 2 C 19*3 (codon stop) • CYP 2 C 19*17 (promoter SNPs) Métab. limités Métab. ultra-rapides • 20% chez asiatiques • 3 -5% chez caucasiens • 20% chez caucasians • 1 -4% chez asiatiques Diapo: D. Allorge, Lille

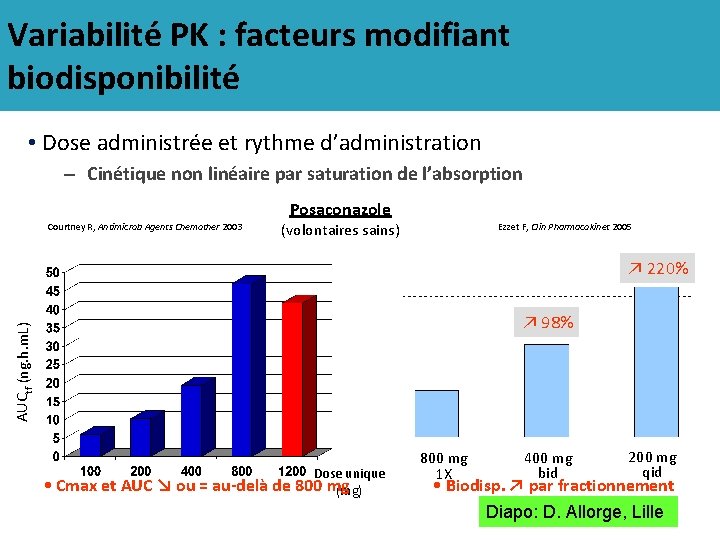
Variabilité PK : facteurs modifiant biodisponibilité • Dose administrée et rythme d’administration – Cinétique non linéaire par saturation de l’absorption Posaconazole Courtney R, Antimicrob Agents Chemother 2003 (volontaires sains) Ezzet F, Clin Pharmacokinet 2005 ↗ 220% AUCtf (ng. h. m. L) ↗ 98% Dose unique • Cmax et AUC ↘ ou = au-delà de 800 mg (mg) 800 mg 1 X 400 mg bid 200 mg qid • Biodisp. ↗ par fractionnement Diapo: D. Allorge, Lille

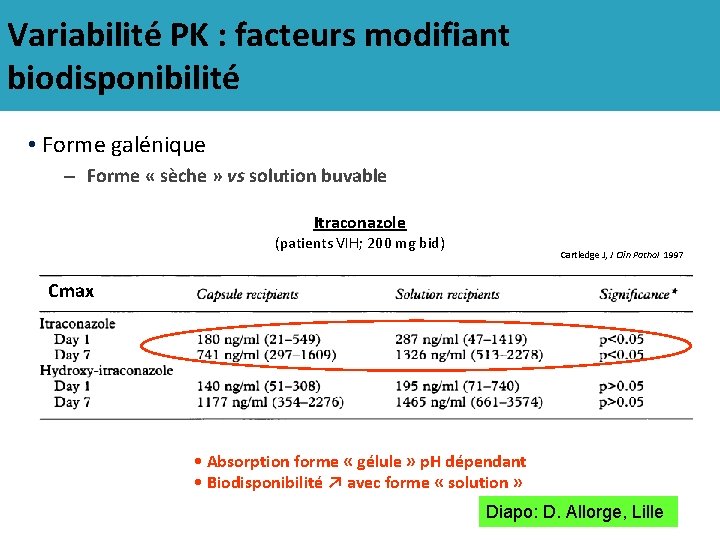
Variabilité PK : facteurs modifiant biodisponibilité • Forme galénique – Forme « sèche » vs solution buvable Itraconazole (patients VIH; 200 mg bid) Cartledge J, J Clin Pathol 1997 Cmax • Absorption forme « gélule » p. H dépendant • Biodisponibilité ↗ avec forme « solution » Diapo: D. Allorge, Lille

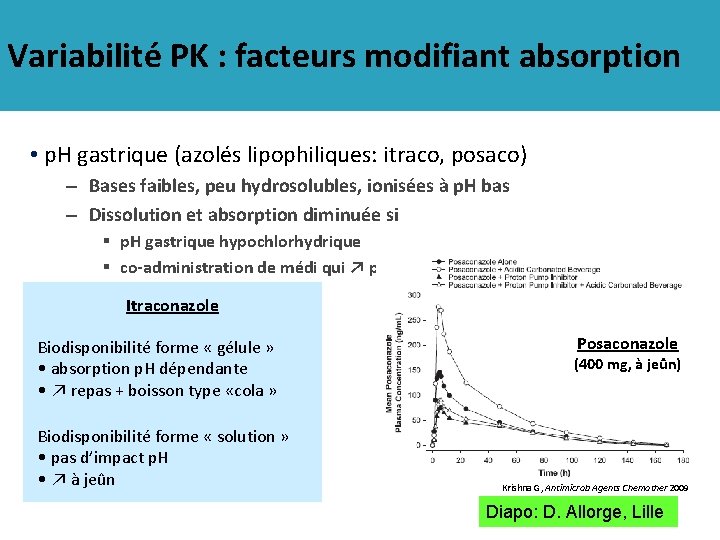
Variabilité PK : facteurs modifiant absorption • p. H gastrique (azolés lipophiliques: itraco, posaco) – Bases faibles, peu hydrosolubles, ionisées à p. H bas – Dissolution et absorption diminuée si § p. H gastrique hypochlorhydrique § co-administration de médi qui ↗ p. H (IPP, anti-H 2…) Itraconazole Biodisponibilité forme « gélule » • absorption p. H dépendante • ↗ repas + boisson type «cola » Biodisponibilité forme « solution » • pas d’impact p. H • ↗ à jeûn Posaconazole (400 mg, à jeûn) Krishna G, Antimicrob Agents Chemother 2009 Diapo: D. Allorge, Lille

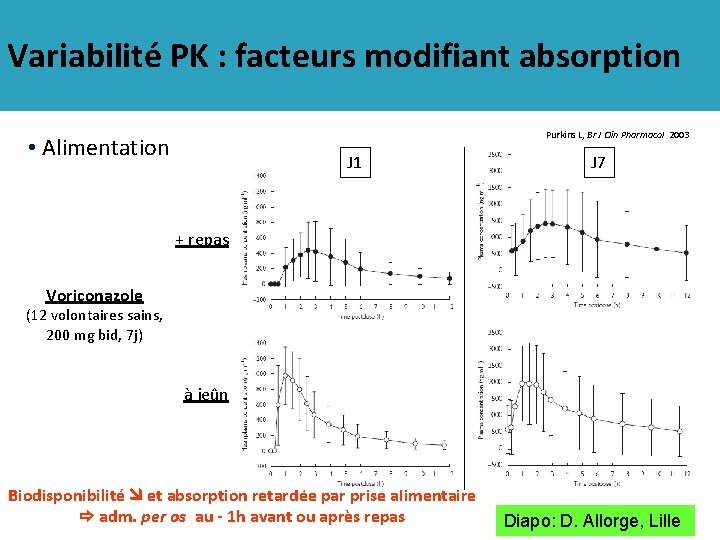
Variabilité PK : facteurs modifiant absorption Purkins L, Br J Clin Pharmacol 2003 • Alimentation J 1 J 7 + repas Voriconazole (12 volontaires sains, 200 mg bid, 7 j) à jeûn Biodisponibilité et absorption retardée par prise alimentaire adm. per os au - 1 h avant ou après repas Diapo: D. Allorge, Lille

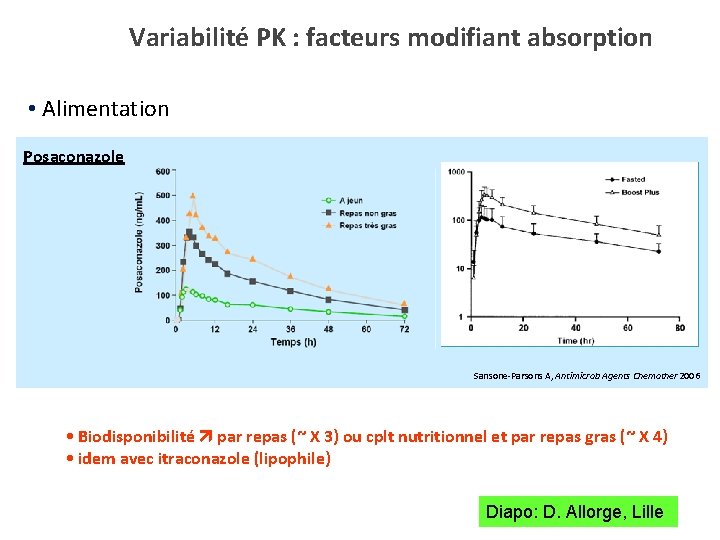
Variabilité PK : facteurs modifiant absorption • Alimentation Posaconazole Sansone-Parsons A, Antimicrob Agents Chemother 2006 • Biodisponibilité par repas (~ X 3) ou cplt nutritionnel et par repas gras (~ X 4) • idem avec itraconazole (lipophile) Diapo: D. Allorge, Lille

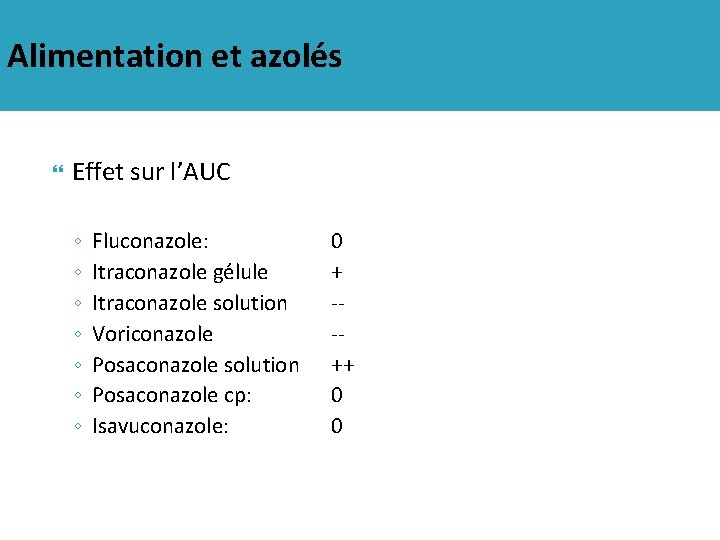
Alimentation et azolés Effet sur l’AUC ◦ ◦ ◦ ◦ Fluconazole: Itraconazole gélule Itraconazole solution Voriconazole Posaconazole solution Posaconazole cp: Isavuconazole: 0 + --++ 0 0

Cas clinique, suite Avant même que l’on ne reçoive le résultat du premier dosage, la patiente se plaint d’hallucinations visuelles et parait confuse. ◦ L’IRM cérébrale est normale. ◦ Le bilan hépatique montre des transaminases à 3 N Le dosage revient : il est à 5, 8 ng/m. L. ◦ Les troubles neurologiques sont imputés à une toxicité neurologique du voriconazole qui est arrêté Diapo C Padouin

Vous avez arrêté le voriconazole pour troubles neurologiques liés à un surdosage. Que faites-vous ? A. B. C. D. E. Je débute de l’amphotericine B liposomale Je débute de la caspofongine Je reprend le voriconazole dans 48 h Je redose dans 48 h et je reprendrai, à posologie réduite, si le taux est < 4 mg/L, Je redose dans 7 j et je reprendrai, à posologie réduite, si le taux est < 4 mg/L, Diapo C Padouin

Vous avez arrêté le voriconazole pour troubles neurologiques liés à un surdosage. Que faites-vous ? A. B. C. D. E. Je débute de l’amphotericine B liposomale Je débute de la caspofungine Je reprend le voriconazole dans 48 h Je redose dans 48 h et je reprendrai, à posologie réduite, si le taux est < 4 mg/L, Je redose dans 7 j et je reprendrai, à posologie réduite, si le taux est < 4 mg/L, Diapo C Padouin

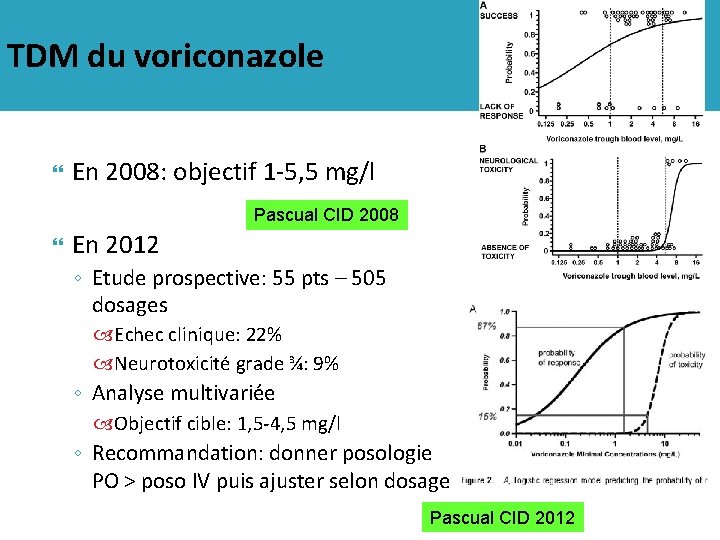
TDM du voriconazole En 2008: objectif 1 -5, 5 mg/l Pascual CID 2008 En 2012 ◦ Etude prospective: 55 pts – 505 dosages Echec clinique: 22% Neurotoxicité grade ¾: 9% ◦ Analyse multivariée Objectif cible: 1, 5 -4, 5 mg/l ◦ Recommandation: donner posologie PO > poso IV puis ajuster selon dosage Pascual CID 2012

TDM du VRC: un essai randomisé Etude monocentrique, à évaluation aveugle (n=110) ◦ ◦ Pas de TDM vs TDM (objectif 1 -5, 5 mg/l) à j 4 Génotype CYP 2 C 19 identique dans les 2 groupes Indication: IFI ou empirique Poso : charge 6 mg/kg/12 h J 1, puis 4 mg/kg/12 h (IV ou PO) Moins d’arret pour toxicité si TDM ◦ 4 vs 17%; p=0, 02 Plus de réponses complètes ou partielles ◦ 81 vs 57%; p=0, 04 Park CID 2012

Voriconazole : relation concentration – efficacité / toxicité Relation concentration – efficacité établie ◦ Cible 2 mg/L (1 à 5, 5 mg/L, Pascual, CID, 2008) Relation concentration – toxicité neurologique établie ◦ Cible 2 mg/L (1 à 5 mg/L, Pascual, CID, 2008) Relation concentration – toxicité hépatique incertaine ◦ Cible 2 mg/L (1 à 4 -5 mg/L) Relation concentration – toxicité cutanée non ◦ Photosensibilité (10%), carcinogénèse (Williams, CID, 2014) Diapo C Padouin

Le LBA retrouve M. tuberculosis Le patient est de nouveau sous voriconazole. Il a fait une insuffisance rénale sous ambisome Que faites-vous ? A. Vous débutez une quadrithérapie classique B. Vous remplacez la rifampicine par de la rifabutine C. Vous arrêtez le voriconazole le temps de traiter la tuberculose D. Vous ne traitez la tuberculose qu’après avoir traité l’aspergillose E. Vous remplacez le voriconazole par du posaconazole

Le LBA retrouve M. tuberculosis Le patient est de nouveau sous voriconazole. Il a fait une insuffisance rénale sous ambisome Que faites-vous ? A. Vous débutez une quadrithérapie classique B. Vous remplacez la rifampicine par de la rifabutine C. Vous arrêtez le voriconazole le temps de traiter la tuberculose D. Vous ne traitez la tuberculose qu’après avoir traité l’aspergillose E. Vous remplacez le voriconazole par du posaconazole

Variabilité PK : interactions médicamenteuses • Nombreuses et complexes (≠ mécanismes) – AF azolés sont +/§ Substrats / inhibiteurs de transporteurs (P-gp) § Substrats / inhibiteurs d’enzymes (CYP 450 +++) Interactions PK au niveau : • absorption intestinale • métabolisme (intest. , hépat. ) • élimination rénale, biliaire Diapo: D. Allorge, Lille

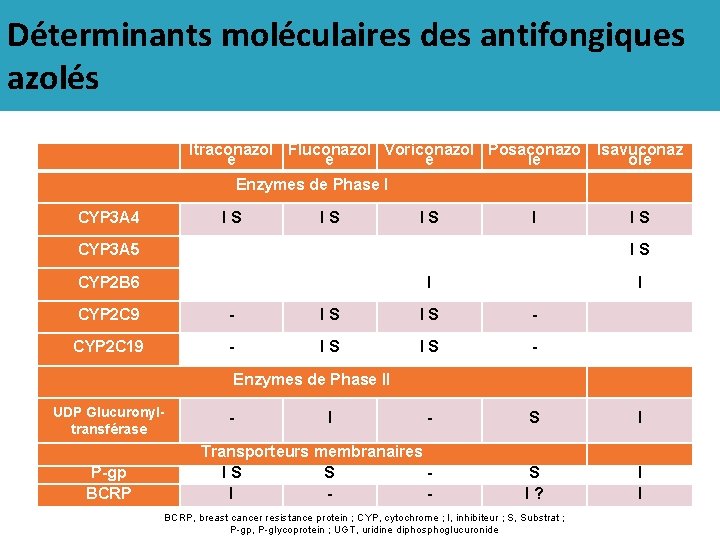
Déterminants moléculaires des antifongiques azolés Itraconazol Fluconazol Voriconazol Posaconazo Isavuconaz e e e le ole Enzymes de Phase I CYP 3 A 4 I S I S I CYP 3 A 5 I S CYP 2 B 6 I I CYP 2 C 9 - I S - CYP 2 C 19 - I S - - S I Transporteurs membranaires I S S I - S I ? I I Enzymes de Phase II UDP Glucuronyltransférase P-gp BCRP - I BCRP, breast cancer resistance protein ; CYP, cytochrome ; I, inhibiteur ; S, Substrat ; 30/12/2016 P-gp, P-glycoprotein ; UGT, uridine diphosphoglucuronide 43
![Associations contreindiquées pour V c AF ANSM Antifongique Effet de linteraction sur les Associations contre-indiquées pour V [c] AF : ANSM Antifongique Effet de l’interaction sur les](https://slidetodoc.com/presentation_image/174eb4657e773764b30ed23111a2bc38/image-44.jpg)
Associations contre-indiquées pour V [c] AF : ANSM Antifongique Effet de l’interaction sur les concentrations Conséquences cliniques plasmatiques Carbamazépine, phénobarbital, primidone Voriconazole du voriconazole Millepertuis Isavuconazole, voriconazole Efavirenz Isavuconazole, voriconazole de isavuconazole voriconazole de l’efavirenz Etranavir Isavuconazole De l’isavuconazole Perte d’efficacité de l’azolé Ketoconazole Isavuconazole De l’isavuconazole Perte d’efficacité de l’azolé Nafcilline Isavuconazole De l’isavuconazole Perte d’efficacité de l’azolé Rifabutine Isavuconazole De l’isavuconazole Perte d’efficacité de l’azolé Rifampicine Isavuconazole, voriconazole du voriconazole Perte d’efficacité de l’azolé Ritonavir > 200 mgx 2/j Isavuconazole De l’isavuconazole Perte d’efficacité de l’azolé et majoration toxicité de l’efavirenz du voriconazole Perte d’efficacité de l’azolé et majoration toxicité de l’efavirenz : augmentation des concentrations plasmatiques, : diminution des concentrations plasmatiques Ritonavir > 400 mgx 2/j Voriconazole * Lorsque l’interaction a été démontrée pour un antifongique azolé, la contre-indication a été étendue à l’ensemble des antifongiques azolés 30/12/2016 44

Caractéristiques PK/PD communes Effet de classe : toxicité he patique Temps-de pendance = dose de charge Isavuconazole : 3 x dose d’entretien à J 1 -J 2 L’optimisation des concentrations sériques efficaces passent par: -La connaissance des voies de métabolisation = voies du cytochrome P 450 -La connaissance de l’influence de l’alimentation et des antiacides sur l’absorption et la BD -L’utilisation des dosages+++ des concentrations sériques pour monitorage

Voriconazole Lipophile 58% liaison protéines plasmatiques T 1/2 ~6– 9 heures Métabolisme hépatique Solubilisé dans cyclodextrine ◦ Accumulation si IR 220 mol/L Objectif AUC/CMI >= 100 Non dialysable Sinnollareddy M, et al. IJAA 2012; 39: 1 -10.


Fluconazole Hydrophile 12% liaison protéines plasmatiques demi-vie: 25 heures T max: 1, 5 heure Volume distribution : 0, 7 L/kg Objectif AUC/CMI >= 100 Patient de réanimation Dialysable ◦ Vd augmenté: 50/60 => 88/99 l ◦ T 1/2 augmentée de 50 -100% ◦ Pas de conseil de modification de posologie Sinnollareddy M, et al. IJAA 2012; 39: 1 -10.


Itraconazole Lipophile 99. 8% liaison proteines plasmatiques Demi-vie: 17 -24 h T max: 2 -4 h Métabolisme hépatique : métabolite actif = OH-itra Objectif AUC/CMI >= 30 Non dialysable Sinnollareddy M, et al. IJAA 2012; 39: 1 -10.

Posaconazole solution 98% liaison aux protéines plasmatiques Forme orale (iv en développement) pharmacocinétique linéaire, absence d’augmentation de l’absorption au-delà de 800 mg/j T 1/2: 25 -30 h Elimination biliaire Non dialysable Sinnollareddy M, et al. IJAA 2012; 39: 1 -10.

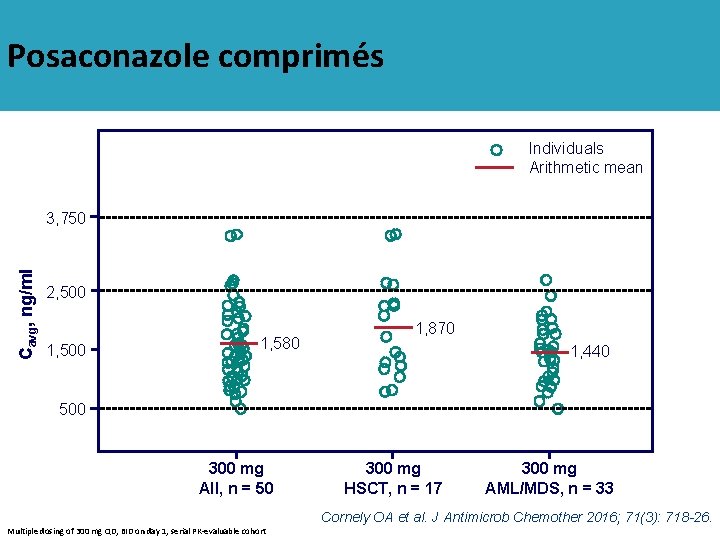
Posaconazole comprimés Individuals Arithmetic mean Cavg, ng/ml 3, 750 2, 500 1, 580 1, 870 1, 440 500 300 mg All, n = 50 300 mg HSCT, n = 17 300 mg AML/MDS, n = 33 Cornely OA et al. J Antimicrob Chemother 2016; 71(3): 718 -26. Multiple dosing of 300 mg QD, BID on day 1, serial PK-evaluable cohort

Isavuconazole Biodisponibilité 98 % Pas d’impact du repas et du p. H Pharmacocinétique proportionnelle jusqu’à 600 mg/j Large volume de distribution (450 L) >99% liaison aux protéines plasmatiques Principale voie d'élimination par le métabolisme du CYP 3 A 4 /5 Excrétion rénale sous forme inchangée <1 % de la dose administrée. Demi-vie longue (~ 130 heures) nécessite un régime de dose de charge pour atteindre rapidement l'état d'équilibre

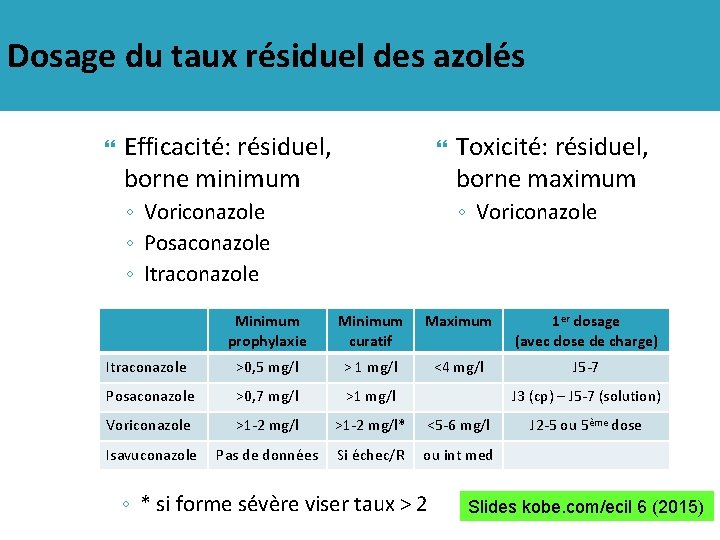
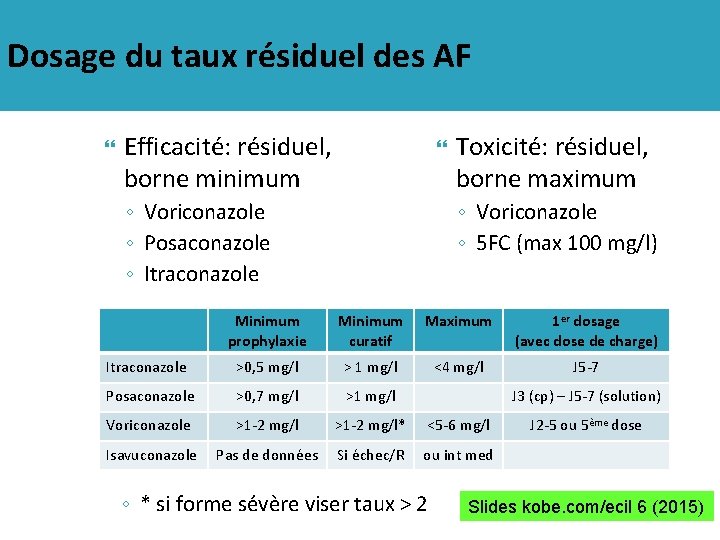
Dosage du taux résiduel des azolés Efficacité: résiduel, borne minimum ◦ Voriconazole ◦ Posaconazole ◦ Itraconazole Toxicité: résiduel, borne maximum ◦ Voriconazole Minimum prophylaxie Minimum curatif Maximum 1 er dosage (avec dose de charge) Itraconazole >0, 5 mg/l > 1 mg/l <4 mg/l J 5 -7 Posaconazole >0, 7 mg/l >1 mg/l Voriconazole >1 -2 mg/l* <5 -6 mg/l Isavuconazole Pas de données Si échec/R ou int med J 3 (cp) – J 5 -7 (solution) ◦ * si forme sévère viser taux > 2 J 2 -5 ou 5ème dose Slides kobe. com/ecil 6 (2015)

Echinocandines



Candines Produit Anidulafungine * Caspofungine * Micafungine ** A. U. C. CL Vd T ½ (mg. h/L) (L/h/Kg) (L/kg) (h) 104 0. 96 30 -40 52 93. 5 0. 9 8 -10 9 -11 107 -214 1. 4 16. 2 8 * Données chez volontaires sains ** Données sur patients de réanimation Médiocre diffusion LCR/urines Forte liaison aux protéines plasmatiques Stone AAC 2002 Hirata Yakugaku Zasshi 2007 Sinnollareddy M, et al. IJAA 2012; 39: 1 -10.

Polyenes




Effets secondaires polyènes Immédiats liés à la perfusion La perfusion induit la production de cytokines pyrogènes par les monocytes/macrophages d’où: → Fièvre → Tremblements → Céphalées → Troubles digestifs → Irritation veineuse → Courbatures → Collapsus cardiovasculaire → Bronchospasme STOP Si reprise = ralentir+++ le débit Différés liés à la toxicité viscérale Insuffisance rénale mixte, réversible: • Néphropathie glomérulaire: ↓DFG (VC° rénale) • Néphropathie tubulaire: cytotoxicité par pores mbn dans C épithéliales Troubles électrolytiques : ↓ K+, ↓ Mg+ Anémie (↓érythropoïétine rénale) Rares: Hépatite toxique Cardiaque (torsade de pointe hypo. K+)



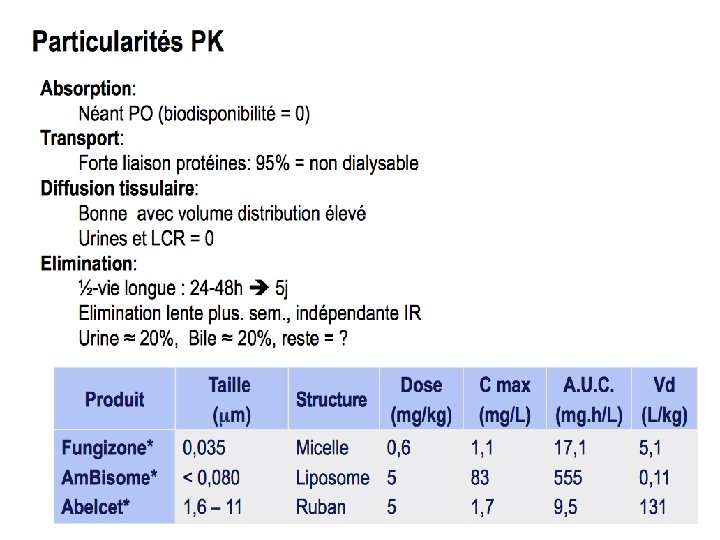
Pharmacocinétique, posologies et effets indés amphotéricine B désoxycholate (Am. B) amphotéricine B liposomale lipid complex (ABLp) (ABLC) flucytosine* Voie d’administration IV IV / PO Biodisponibilité (%) < 5 < 5 80 - 90 1 -3 mg/kg 3 -5 mg/kg 25 mg/kg/6 h Hypokaliémie Hypomagnésémie Insuffisance rénale Mêmes complications que l’amphotéricine B désoxycholate mais fréquence moindre Troubles digestifs Fièvre Frissons lors de l’injection Tolérance supérieure pour ABLp : données contradictoires Dose journalière habituelle Effets indésirables fréquents Cytopénie *Ajustement posologique en cas d’insuffisance rénale, ne pas utiliser en monothérapie Cytopénie jusqu’à aplasie médullaire lors de surdosage Cytolyse hépatique

IV ou PO ◦ ◦ Biodisponibilité orale 90% Bonne diffusion dans le LCS et l’urine 10% liaison aux protéines plasmatiques Demi-vie 3 -6 h Toujours en association Dosages sériques ◦ Sélection rapide de résistance si monothérapie ◦ Pic 2 h après administration pour toxicité Objectif > 100 mg/l ◦ Creux Objectif > 25 mg/l Vermes et al. JAC 2000; 46: 171 -9

Flucytosine: effets secondaires Toxicité hépatique et médullaire Toxicité gastro-intestinale Toxicité hépatique* : cytolyse Toxicité hématologique* : moelle osseuse ◦ Conversion du 5 FC en 5 FU (intracellulaire ou si T flacons > 25 °C) ◦ - douleurs gastriques ◦ - entéro-(colite) ulcéro-membraneuse ◦ - (perforation) ◦ - leucopénie, agranulocytose ◦ - pancytopénie *Si concentration > 100 mg/l (53 patients en USI) Vermes et al, Chemotherapy 2000

Flucytosine en pratique Posologie ◦ 100 mg/kg/24 h En 3 -4 prises/j 25 mg/kg/6 h ◦ Avec ampho B ou azolé IR ◦ DFG 20 à 39: 25 mg/kg/12 h ◦ DFG 9 à 20: 25 mg/kg/24 h

Récapitulons

Posologies initiales « standard » adulte Amphotéricine B liposomale: 3 à 10 mg/kg/j selon l’indication 5 fluorocytosine: 100 mg/kg/j Candines ◦ Caspo: 70 mg J 1 puis 50 à 70 mg/j selon le poids ◦ Mica: 50 à 150 mg/j selon l’indication ◦ Anidula: 200 mg J 1 puis 100 mg/j Azolé ◦ ◦ ◦ Fluco: 100 à 800 mg J 1 puis 100 à 400 mg selon l’indication Itra: 100 à 400 mg/j selon l’indication Vori: 6 mg/kg/12 h J 1 puis 4 mg/kg/12 h Posaco cp: 300 mg/12 h J 1 puis 300 mg/j Isavuco: 200 mg/8 h J 1 -J 2 puis 200 mg/24 h

Dosage du taux résiduel des AF Efficacité: résiduel, borne minimum ◦ Voriconazole ◦ Posaconazole ◦ Itraconazole Toxicité: résiduel, borne maximum ◦ Voriconazole ◦ 5 FC (max 100 mg/l) Minimum prophylaxie Minimum curatif Maximum 1 er dosage (avec dose de charge) Itraconazole >0, 5 mg/l > 1 mg/l <4 mg/l J 5 -7 Posaconazole >0, 7 mg/l >1 mg/l Voriconazole >1 -2 mg/l* <5 -6 mg/l Isavuconazole Pas de données Si échec/R ou int med J 3 (cp) – J 5 -7 (solution) ◦ * si forme sévère viser taux > 2 J 2 -5 ou 5ème dose Slides kobe. com/ecil 6 (2015)

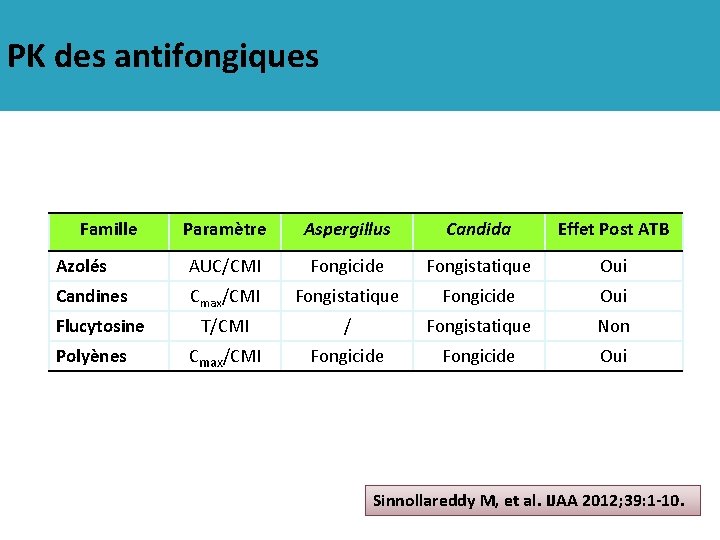
PK des antifongiques Famille Paramètre Aspergillus Candida Effet Post ATB Azolés AUC/CMI Fongicide Fongistatique Oui Candines Cmax/CMI Fongistatique Fongicide Oui T/CMI / Fongistatique Non Cmax/CMI Fongicide Oui Flucytosine Polyènes Sinnollareddy M, et al. IJAA 2012; 39: 1 -10.

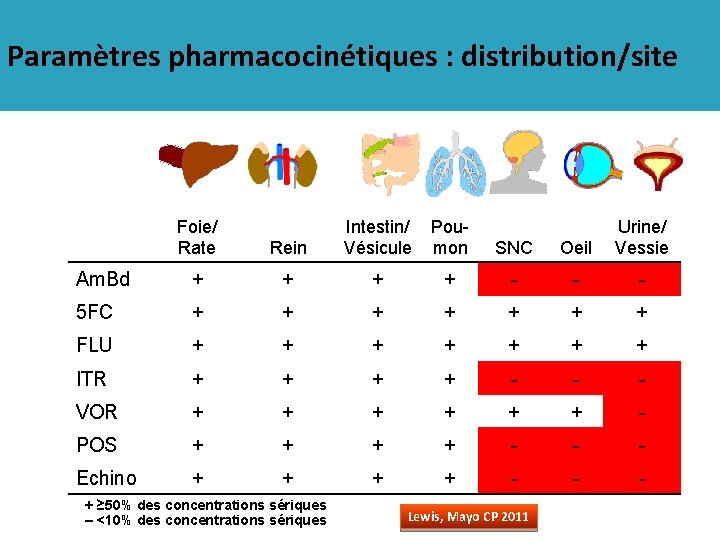
Paramètres pharmacocinétiques : distribution/site Foie/ Rate SNC Oeil Urine/ Vessie Rein Am. Bd + + - - - 5 FC + + + + FLU + + + + ITR + + - - - VOR + + + - POS + + - - - Echino + + - - - + ≥ 50% des concentrations sériques – <10% des concentrations sériques Intestin/ Pou. Vésicule mon Lewis, Mayo CP 2011

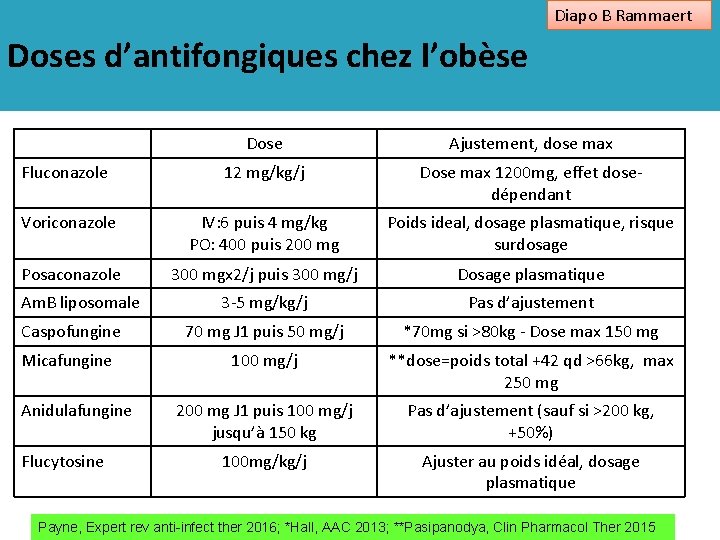
Diapo B Rammaert Doses d’antifongiques chez l’obèse Dose Ajustement, dose max Fluconazole 12 mg/kg/j Dose max 1200 mg, effet dosedépendant Voriconazole IV: 6 puis 4 mg/kg PO: 400 puis 200 mg Poids ideal, dosage plasmatique, risque surdosage Posaconazole 300 mgx 2/j puis 300 mg/j Dosage plasmatique 3 -5 mg/kg/j Pas d’ajustement Caspofungine 70 mg J 1 puis 50 mg/j *70 mg si >80 kg - Dose max 150 mg Micafungine 100 mg/j **dose=poids total +42 qd >66 kg, max 250 mg 200 mg J 1 puis 100 mg/j jusqu’à 150 kg Pas d’ajustement (sauf si >200 kg, +50%) 100 mg/kg/j Ajuster au poids idéal, dosage plasmatique Am. B liposomale Anidulafungine Flucytosine Payne, Expert rev anti-infect ther 2016; *Hall, AAC 2013; **Pasipanodya, Clin Pharmacol Ther 2015

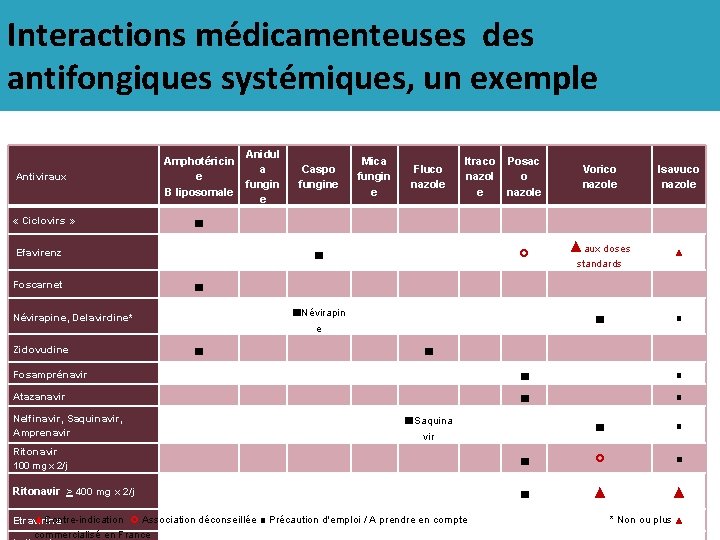
Interactions médicamenteuses des antifongiques systémiques, un exemple Antiviraux Anidul Amphotéricin a e fungin B liposomale e Caspo fungine ■ Efavirenz Foscarnet ■ ■Névirapin Zidovudine ■ Fosamprénavir Nelfinavir, Saquinavir, Amprenavir « Ciclovirs » Fluco nazole Itraco nazol e Vorico nazole ▲aux doses Isavuco nazole ■ ■ ■Saquina ■ ■ Ritonavir 100 mg x 2/j ■ ■ Ritonavir > 400 mg x 2/j ■ ▲ ▲ Atazanavir ■ e vir Posac o nazole Névirapine, Delavirdine* Mica fungin e ▲Contre-indication Association déconseillée ■ Précaution d'emploi / A prendre en compte Etravirine commercialisé en France standards ▲ ■ ■ ■ * Non ou plus ▲

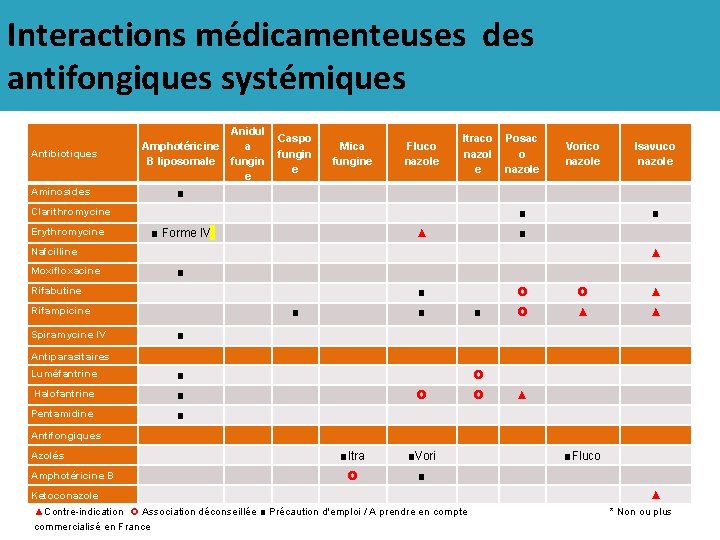
Interactions médicamenteuses des antifongiques systémiques Antibiotiques Anidul Amphotéricine a B liposomale fungin e Aminosides ■ Clarithromycine Erythromycine ■ Forme IV Caspo fungin e Mica fungine Fluco nazole Itraco nazol e Posac o nazole Vorico nazole ■ ▲ ■ Isavuco nazole ■ Nafcilline ▲ Moxifloxacine ■ Rifabutine Rifampicine ■ Spiramycine IV ■ Luméfantrine ■ Halofantrine ■ Pentamidine ■ ▲ ■ ■ ▲ ▲ Antiparasitaires Antifongiques Azolés Amphotéricine B ■Itra ■Vori ■ Ketoconazole ▲Contre-indication Association déconseillée ■ Précaution d'emploi / A prendre en compte commercialisé en France ■Fluco ▲ * Non ou plus


Conclusion Polyènes Azolés Candines Flucytosine ◦ +: large spectre ◦ -: toxicité (et prix) ◦ +: IV et PO; diffusion tissulaire, ajustement sur dosage sérique ◦ -: interactions, variabilité métabolisme, sélection R, coût (pour certains) ◦ +: tolérance ◦ -: spectre, coût ◦ +: diffusion coût, synergie sur candida/crypto ◦ -: spectre, résistance si monothérapie, toxicité