2 3 Persamaan Keadaan Gas Nyata n Pada




















- Slides: 25

2. 3 Persamaan Keadaan Gas Nyata n Pada tahun 1873 Van der Waals, seorang fisikawan bangsa Belanda menjabarkan persamaan gas nyata sebagai berikut Untuk 1 mol Untuk n mol a dan b 2. 5 a disebut tetapan Van der Waals 2. 5 b

Tabel 2. 1 Tabel Tetapan Gas zat He H 2 a, (J. m 3. kmol-2) (x 103 ) 3, 44 24, 80 b, (m 3. kmol-1) 0, 0234 0, 0266 O 2 138, 00 0, 0318 CO 2 366, 00 0, 0429 H 2 O 580, 00 0, 0319 Hg 292, 00 0, 0055

Persamaan Beattie-Bridgeman n Merupakan modifikasi dari persamaan Virial 2. 7 dengan A = Ao(1 - a/v) B = Bo(1 -b/v) = C/v. T 3 n 2. 8 2. 9 2. 10 Ao, a, Bo, b dan C adalah tetapan yang berbeda untuk setiap gas

2. 4 n Bidang p-v-T Gas Sempurna Jika Variabel p, v, dan T pada persamaan keadaan gas sempurna digambarkan pada tiga sumbu saling tegak lurus diperoleh bidang keadaan gas sempurna p isometrik isobarik T v

p p v 3 v 2 T 3 T 2 v 1 T v Proses Isotermal Proses isokorik pv = RT = C p = R/v T = CT

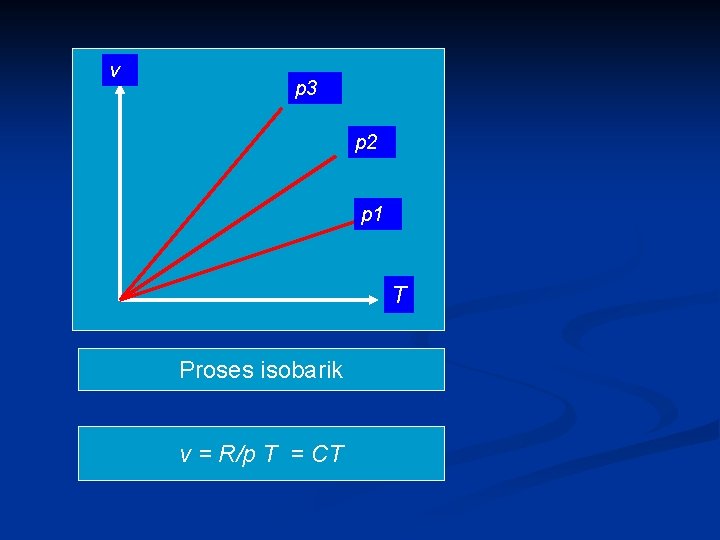
v p 3 p 2 p 1 T Proses isobarik v = R/p T = CT

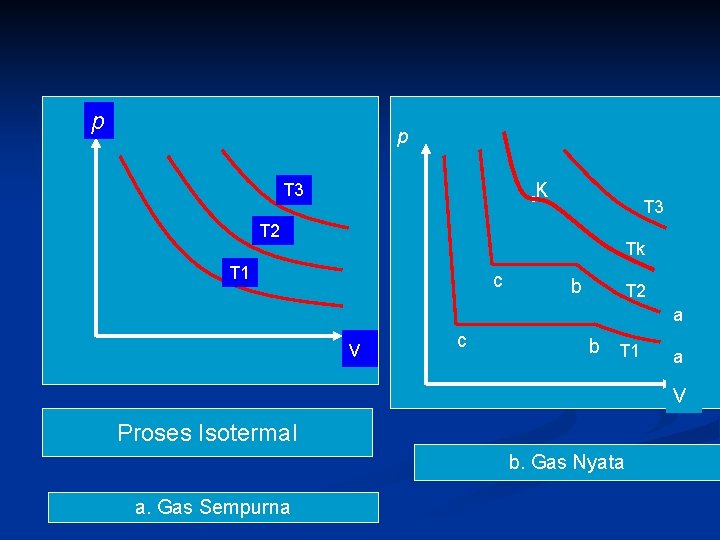
2. 5 Bidang p-v-T Gas Nyata n n Gas nyata memiliki sifat: Molekul molekul tarik menarik dan mempunyai volume Dapat menjadi cair dan padat Hukum-hukum Boyle dan Gay-Lussac hanya diikuti oleh gas nyata secara pendekatan, yaitu pada tekanan rendah jauh dari keadaan cairnya Perbedaan sifat gas sempurna dengan gas nyata tampak jelas pada diagram p-v-T atau prpses Isotermal

p p ◦K T 3 T 2 Tk T 1 c b T 2 a v c b T 1 a v Proses Isotermal b. Gas Nyata a. Gas Sempurna

Gas nyata ketika tekanan masih rendah, (volume besar), pemampatan juga diikuti oleh kenaikan tekanan seperti pada gas sempurna ( garis a-b) n Setelah itu walaupun volume diperkecil tekanan tidak berubah, garis b-c disebut garis koeksistensi cair-gas, yaitu fase cair dan gas (uap) dapat berada bersama. n Di titik b mulai terbentuk cairan di titik c semua uap telah menjadi cair n Pemampatan selanjutnya akan diikuti kenaikan tekanan yang besar n

Jika proses ini diulangi pada suhu T 2> T 1 maka garis b-c menjadi lebih pendek, dan pada suhu tertetu (suhu kritis (Tk) garis koeksistensi menjadi nol. Tekanannya diberi simbol pk dan volumenya vk. n Di atas suhu kritis gas nyata tak dapat dicairkan dengan cara dimampatkan. Dan gas nyata mengikuti dengan baik Hukum Boyle. n

Tabel 2. 2 Data titik tripel Zat Helim Suhu (K) Tekanan (Torr) 2, 186 38, 300 Hidrogen 13, 840 52, 800 Deutrium 18, 480 128, 800 Neon 24, 630 324, 000 Nitrogen 63, 180 94, 000 Oksigen 54, 360 1, 140 Amonia 195, 400 45, 570 Karbon dioksida 216, 550 388, 000 Sulfur dioksida 197, 680 1, 256 Air 273, 160 4, 580

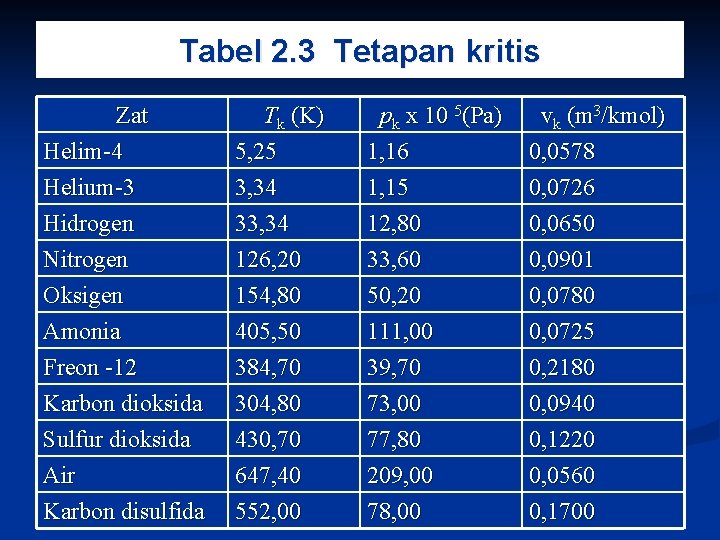
Tabel 2. 3 Tetapan kritis Zat Helim-4 Helium-3 Hidrogen Tk (K) 5, 25 3, 34 33, 34 pk x 10 5(Pa) 1, 16 1, 15 12, 80 vk (m 3/kmol) 0, 0578 0, 0726 0, 0650 Nitrogen Oksigen Amonia Freon -12 Karbon dioksida Sulfur dioksida Air Karbon disulfida 126, 20 154, 80 405, 50 384, 70 304, 80 430, 70 647, 40 552, 00 33, 60 50, 20 111, 00 39, 70 73, 00 77, 80 209, 00 78, 00 0, 0901 0, 0780 0, 0725 0, 2180 0, 0940 0, 1220 0, 0560 0, 1700

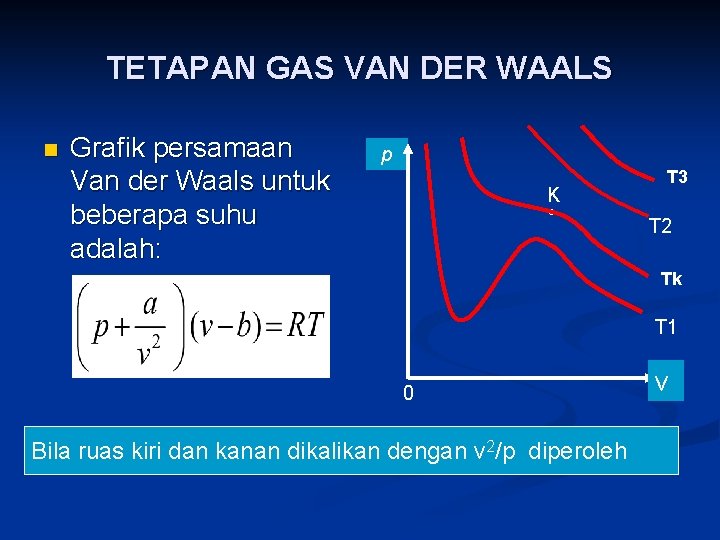
TETAPAN GAS VAN DER WAALS n Grafik persamaan Van der Waals untuk beberapa suhu adalah: p K ◦ T 3 T 2 Tk T 1 0 Bila ruas kiri dan kanan dikalikan dengan v 2/p diperoleh v

a b Persamaan ini mempunyai tiga akar v 1, v 2, dan v 3 Pada suhu kritis Tk ketiga akar berimpit dan tekanan yang bersangkutan adalah tekanan kritis pk, sehingga persamaannya menjadi c

Mempunyai tiga akar nyata yang sama yaitu vk n Persamaan derajat tiga dalam v yang ketiga akarnya sama dengan vk adalah n (v- vk) 3 = v 3 – 3 vkv 2 + 3 vk 2 v – vk 3 = 0 … d n Kedua persamaan c dan d adalah identik sehingga koefisien yang bersangkutan dapat disamakan n

I. 3 vk =b + RTk/pk n II. 3 vk 2 = a/pk n III. vk 3 = ab/pk n Dari ketiga persamaan ini dapat diperoleh: vk = 3 b e Tk = 8 a/ (27 b. R) f pk = a/(27 b 2) g (pkvk)/Tk = (3/8) R h Menurut persamaan (h) RTk/(pkvk) = 8/3 =2, 67

Hasil eksperimen beberapa gas diperoleh ; n n He = 3, 13 H 2 = 3, 03 CO 2 = 3, 49 C 6 H 6 = 3, 76 Dari persmaan Vk = 3 b atau vk/b = 3 n Sedangkan dari hasil eksperimen diperoleh n A = 1, 41 CO 2 = 1, 86 n H 2 = 2, 8 O 2 = 1, 89 n

Contoh soal 2. 1 Berapakah tekanan yang ditimbulkan oleh 3 gram gas nitrogen di dalam bejana yang voluenya 5 liter pada suhu 17 o. C. Diketahui bobot molekul nitrogen 28 dan diangap sebagai gas sempurna. Nyatakan satuannya dalam atmosfer dan pascal. n Jawab Diketahui m = 3 gram, T = (17 + 273, 15 ) K = 290, 15 K V = 5 ltr, M = 28 gram/mol = 28 kg/kmol P = ……. atm p = …………. Pa Penyelesaian p. V = (m/M) RT …………. . p = (m/M) RT /V = (3 gram/ 28 gram mol-1)( 0, 082 ltr atm mol-1 K 1)(290, 15)/5 ltr = 0, 51 atm n

p. V = (m/M) RT …………. . p = (m/M) RT /V = (3 gram/ 28 gram mol-1)( 8, 314 J mol-1 K-1) (290, 15)/5 x 10 -3 m 3 = 51692. 3 Pa

Contoh Soal 2. 2 n n Sebuah bejana volumenya 2 liter dilengkapi dengan kran, berisi gas oksigen pada suhu 300 K dan tekanan 1 atm. Sistem dipanasi hingga menjadi 400 K dengan kran terbuka. Kran lalu ditutup dan bejana dibiarkan mendingin kembali sampai suhu semula. Hitunglah: a. tekanan akhir? Berapa gram oksigen yang masih tertinggal dalam bejama? Penyelesaian O 2 O 2

Diketahui: n Keadaan (1) Keadaan (2) Keadaan (3) n P 1 = 1 atm p 2 = 1 atm p 3 =? n V 1 = 2 liter V 2 =2 liter V 3 = 2 liter n T 1 = 300 K T 2 = 400 K T 3 = 300 K Proses (1) ke keadaan (2) Proses pemanasan dengan kran terbuka (tekanan tetap). Perubahan volume bejana dapat diabaikan. a. Keadaan (2) dan (3) mempunyai massa yang sama, karena waktu mendigin kran ditutup. Pada keadaan (2) dan (3) berlaku persamaan p 2 V 2 = (m/M)RT 2 dan p 3 V 3 = (m/M)RT 3 n

Persamaan pertama dibagi persamaan kedua menghasilkan : p 2/p 3 = T 2/T 3, ingat V 2 = V 3 = 2 liter atau p 3 = (T 2/T 3) p 2 = (300 K/400 K)x 1 atm = 0, 75 atm b. Untuk mencari massa yang masih tertingal dalam bejana dapat menghitung dari keadaan (2) atau (3). Misalnya kita pilih keadaan (3) p 3 V 3 = (m/M) RT 3 atau m = p 3 V 3 M/(RT 3) = (0, 75 atm)(2 liter)(32 gram mol-1)/(0, 082 liter. atm mol -1 K-1 x 300 K) m = 1, 95 gram n

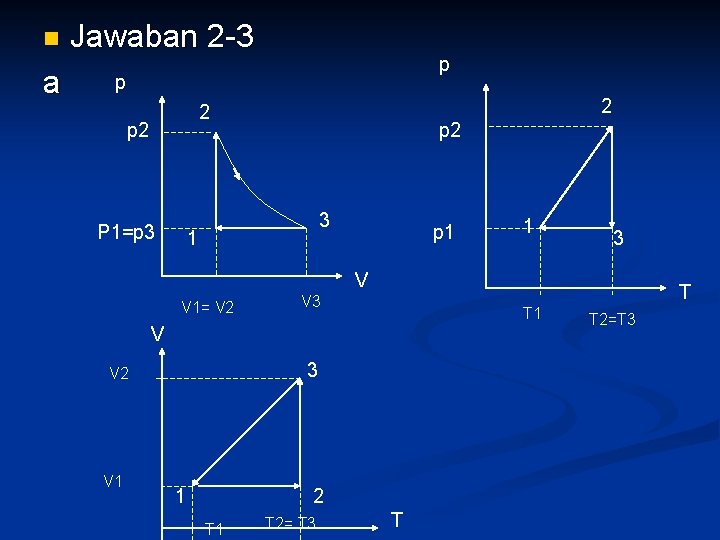
n n 2 -3 Suatu gas ideal terdiri dari 4 mole, mula tekanannya 2 atm. Dan volumenya 0, 1 m 3. Gas dipanaskan pada volume konstan (isometrik) sehingga tekanannya menjadi 2 kali tekanan semula. Kemudian gas diekspansikan pada temperatur konstan (isotermal) hingga tekanannya kembali ke tekanan mula-mula, kemudian gas dikompresikan pada tekanan konstan hingga volumenya kembali ke volume mula-mula. (a) Gambarkan proses tersebut pada diagram p-V, p-T, dan V-T (b) Tentukan temperatur akhir proses isometrik

n a Jawaban 2 -3 p p 2 2 p 2 P 1=p 3 p 2 3 1 p 1 1 3 V V 1= V 2 T V 3 T 1 V 3 V 2 V 1 1 2 T 1 T 2= T 3 T T 2=T 3

b) n = 4 mol, V 1 = V 2 = 0, 1 m 3 = 100 ltr p 1 = 2 atm R = 0, 082 ltr atm mol-1 K-1 p 2 = 4 atm Keadaan 1 p 1 V 1 = n. RT 1 atau T 1 = p 1 V 1/n. R T 1 = (2 atm x 100 lte)/(4 mol x 0, 082 ltr. atm mol-1 K-1 ) = 609 , 76 K Proses 1 ke 2 (isometrik) p 1/T 1 = p 2/T 2 …… T 2 = p 2 T 1/p 1 = 2 p 1. T 1/p 1 T 2 = 2 T 1 = 2 x 609, 76= 1219, 5 K
 Contoh soal persamaan van der waals untuk gas nyata
Contoh soal persamaan van der waals untuk gas nyata Volume molar
Volume molar Menimba air sumur memanfaatkan katrol
Menimba air sumur memanfaatkan katrol Isoterm
Isoterm Gas nyata
Gas nyata Pengertian gas nyata
Pengertian gas nyata Koefisien virial
Koefisien virial Persamaan keadaan
Persamaan keadaan Irama berselang seli
Irama berselang seli Penggunaan klinik gaya pada tubuh manusia adalah
Penggunaan klinik gaya pada tubuh manusia adalah Polar chart
Polar chart Bagaimana bentuk umum persamaan kuadrat
Bagaimana bentuk umum persamaan kuadrat Tetapan r
Tetapan r Pvnrt
Pvnrt Syarat suatu gas dikatakan ideal
Syarat suatu gas dikatakan ideal Ideal gas vs perfect gas
Ideal gas vs perfect gas Imaginary gas
Imaginary gas Gas law
Gas law Ideal gas vs perfect gas
Ideal gas vs perfect gas Reason of bhopal gas tragedy
Reason of bhopal gas tragedy Gas leaked in bhopal gas tragedy
Gas leaked in bhopal gas tragedy Volume molare
Volume molare Flue gas desulfurisation gas filter
Flue gas desulfurisation gas filter Poisonous gas leaked in bhopal gas tragedy
Poisonous gas leaked in bhopal gas tragedy Difference between ideal gas and real gas
Difference between ideal gas and real gas Kinetika kimia
Kinetika kimia














































