Todo gs exerce uma PRESSO ocupando um certo

















































- Slides: 61


Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V = 5 L T = 300 K P = 1 atm erto Rob n o n ame g A f. Pro

Os valores da pressão, do volume e da temperatura não são constantes, então, dizemos que PRESSÃO (P), VOLUME (V) e TEMPERATURA (T) são VARIÁVEIS DE ESTADO DE UM GÁS P 1 = 1 atm P 2 = 2 atm P 3 = 6 atm V 1 = 6 L V 2 = 3 L V 3 = 3 L T 1 = 300 K T 2 = 300 K T 3 = 900 K Robe n o n e gam A. f o Pr rto

Denominamos de pressão de um gás a colisão de suas moléculas com as paredes do recipiente em que ele se encontra to f. A Pro non e gam er b o R

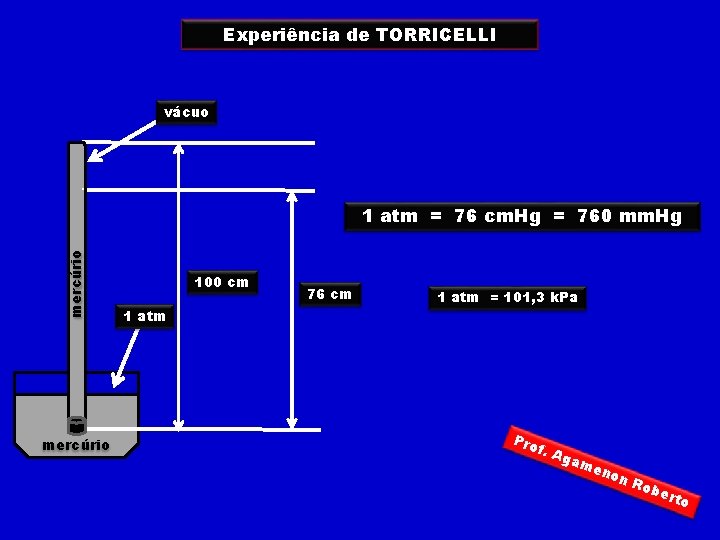
Experiência de TORRICELLI vácuo mercúrio 1 atm = 76 cm. Hg = 760 mm. Hg mercúrio 100 cm 1 atm 76 cm 1 atm = 101, 3 k. Pa Pro f. A gam eno n. R obe rto

É o espaço ocupado pelo gás 1 L = 1000 m. L = 1000 cm 3 Nos trabalhos científicos a unidade usada é a escala absoluta ou Kelvin (K) T = t + 273 rto Robe n o n e Agam. f o r P

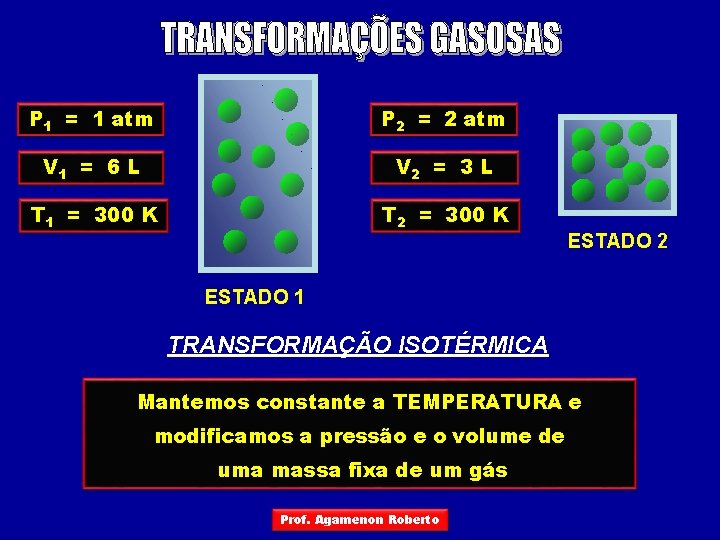
P 1 = 1 atm P 2 = 2 atm V 1 = 6 L V 2 = 3 L T 1 = 300 K T 2 = 300 K ESTADO 2 ESTADO 1 TRANSFORMAÇÃO ISOTÉRMICA Mantemos constante a TEMPERATURA e modificamos a pressão e o volume de uma massa fixa de um gás Prof. Agamenon Roberto

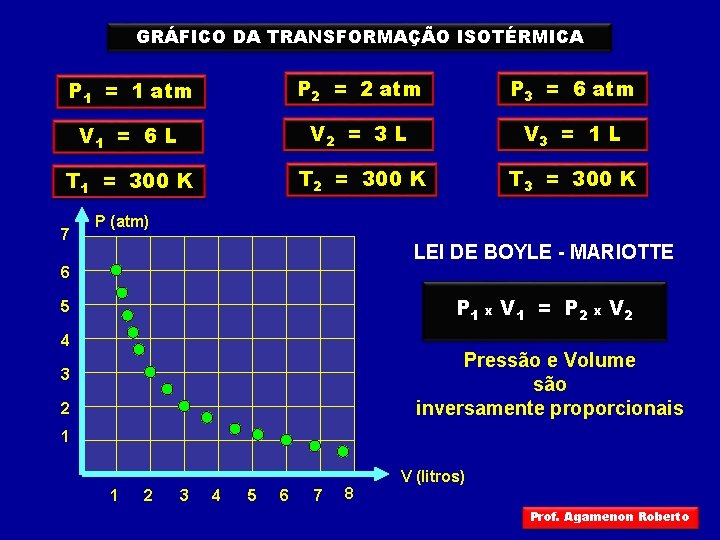
GRÁFICO DA TRANSFORMAÇÃO ISOTÉRMICA P 1 = 1 atm P 2 = 2 atm P 3 = 6 atm V 1 = 6 L V 2 = 3 L V 3 = 1 L T 1 = 300 K T 2 = 300 K T 3 = 300 K 7 P (atm) LEI DE BOYLE - MARIOTTE 6 PP 1 xx V V 1= constante = P 2 x V 2 5 4 Pressão e Volume são inversamente proporcionais 3 2 1 1 2 3 4 5 6 7 8 V (litros) Prof. Agamenon Roberto

TRANSFORMAÇÃO ISOTÉRMICA

P 1 = 1 atm P 2 = 1 atm V 1 = 6 L V 2 = 3 L T 1 = 300 K T 2 = 150 K ESTADO 2 ESTADO 1 TRANSFORMAÇÃO ISOBÁRICA Mantemos constante a PRESSÃO e modificamos a temperatura absoluta e o volume de uma massa fixa de um gás Prof. Agam enon Robe rto

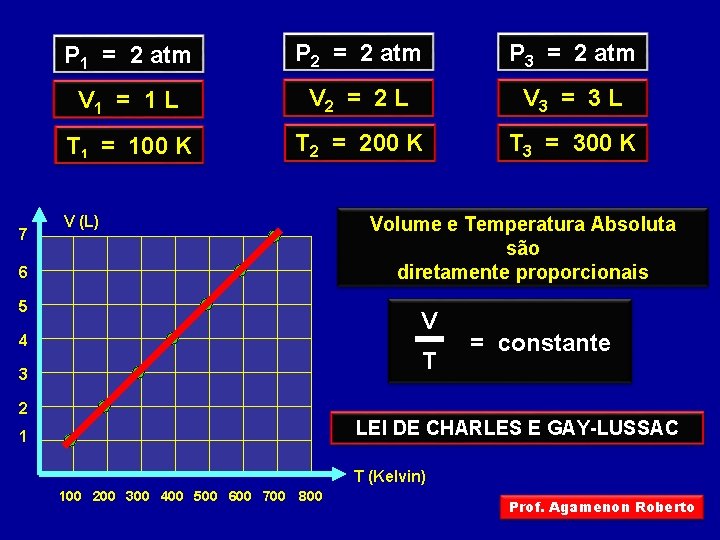
7 P 1 = 2 atm P 2 = 2 atm P 3 = 2 atm V 1 = 1 L V 2 = 2 L V 3 = 3 L T 1 = 100 K T 2 = 200 K T 3 = 300 K V (L) 6 5 Volume e Temperatura Absoluta são diretamente proporcionais V 4 T 3 2 = constante LEI DE CHARLES E GAY-LUSSAC 1 T (Kelvin) 100 200 300 400 500 600 700 800 Prof. Agamenon Roberto

P 1 = 4 atm P 2 = 2 atm V 1 = 6 L V 2 = 6 L T 1 = 300 K T 2 = 150 K ESTADO 1 ESTADO 2 TRANSFORMAÇÃO ISOCÓRICA Mantemos constante o VOLUME e modificamos a temperatura absoluta e a pressão de uma massa fixa de um gás o rt n Robe o gamen Prof. A

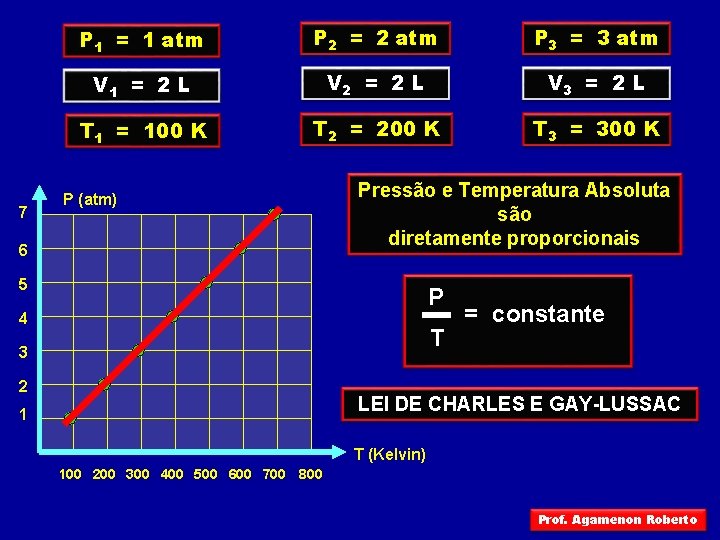
7 P 1 = 1 atm P 2 = 2 atm P 3 = 3 atm V 1 = 2 L V 2 = 2 L V 3 = 2 L T 1 = 100 K T 2 = 200 K T 3 = 300 K P (atm) 6 Pressão e Temperatura Absoluta são diretamente proporcionais 5 P 4 T 3 2 = constante LEI DE CHARLES E GAY-LUSSAC 1 T (Kelvin) 100 200 300 400 500 600 700 800 Prof. Agamenon Roberto


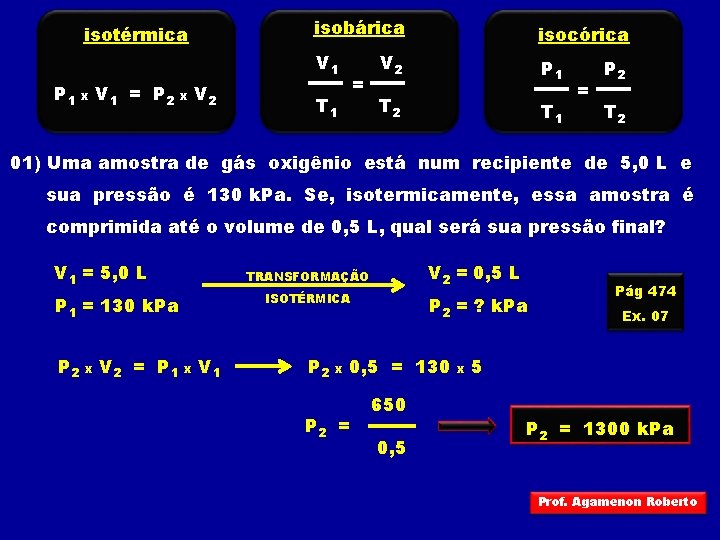
isotérmica P 1 x V 1 = P 2 x V 2 isobárica isocórica V 1 V 2 P 1 T 2 T 1 = P 2 T 2 01) Uma amostra de gás oxigênio está num recipiente de 5, 0 L e sua pressão é 130 k. Pa. Se, isotermicamente, essa amostra é comprimida até o volume de 0, 5 L, qual será sua pressão final? V 1 = 5, 0 L ISOTÉRMICA P 1 = 130 k. Pa P 2 x V 2 = P 1 V 2 = 0, 5 L TRANSFORMAÇÃO x V 1 P 2 x P 2 = ? k. Pa 0, 5 = 130 P 2 = 650 0, 5 x Pág 474 Ex. 07 5 P 2 = 1300 k. Pa Prof. Agamenon Roberto

isotérmica P 1 x V 1 = P 2 x V 2 isobárica isocórica V 1 V 2 P 1 T 2 T 1 = = P 2 T 2 02) Uma amostra de nitrogênio gasoso encontra-se a 27ºC e 1 atm. Se essa amostra sofrer uma transformação isocórica até chegar a 177ºC, qual será a pressão final? T 1 = 27ºC TRANSFORMAÇÃO ISOCÓRICA P 1 = 1 atm T 2 = 177ºC Pág 480 P 2 = ? atm Ex. 24 T 1 = 27ºC + 273 = 300 K T 2 = 177ºC + 273 = 450 K P 1 T 1 = P 2 1 T 2 300 = P 2 450 P 2 = 1, 5 atm Prof. Agamenon Roberto

03) Considere uma determinada quantidade de gás carbônico em um recipiente de 15 m 3, a 1 atm e 57ºC. Se esse gás for transferido para outro recipiente de 20 m 3, qual deverá a temperatura final (em ºC), a fim de que a pressão não se altere? V 1 = 15 m 3 TRANSFORMAÇÃO P 1 = 1 atm ISOBÁRICA T 1 = 57ºC V 2 = 20 m 3 P 2 = 1 atm T 2 = ? ºC Pág 480 Ex. 27 T 1 = 57ºC + 273 = 330 K V 1 T 1 = on gamen Prof. A V 2 15 T 2 330 o Robert = 20 T 2 = 440 K – 273 = 167ºC

04) Um recipiente cúbico de aresta 20 cm contém um gás à pressão de 0, 8 atm. Transfere-se esse gás para um cubo de 40 cm de aresta, mantendo-se constante a temperatura. A nova pressão do gás é de: a) 0, 1 atm. DESAFIO 20 cm b) 0, 2 atm. c) 0, 4 atm. 40 cm T = constante d) 1, 0 atm e) 4, 0 atm. 20 cm 40 cm P = 0, 8 atm V = 8000 20 8 a 3 L 3 P’ = ? atm 3 3 L cm 3 40 64000 64 V’ = a cm 3 P’ x V’ = P x V P’ x 64 = 0, 8 x 8 P’ = 6, 4 P’ = 0, 1 atm 64 Prof. Agamenon Roberto

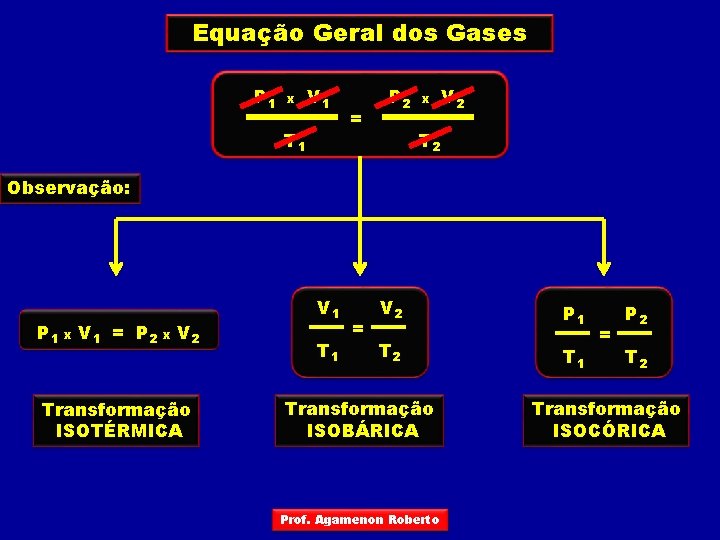
Equação Geral dos Gases P 1 x V 1 T 1 = P 2 x V 2 T 2 Observação: P 1 x V 1 = P 2 x V 2 Transformação ISOTÉRMICA V 1 T 1 = V 2 P 1 T 2 T 1 Transformação ISOBÁRICA Prof. Agamenon Roberto = P 2 Transformação ISOCÓRICA

P 1 x V 1 T 1 P 2 = x V 2 T 2 01) Uma amostra de 1 mol de gás oxigênio ocupa 22, 4 L a 0ºC e 1 atm. Empregue a equação geral dos gases para prever qual será o volume dessa mesma amostra de gás se estivesse submetida a uma temperatura de 273ºC e a uma pressão de 0, 5 atm V 1 = 22, 4 L P 1 = 1 atm P 2 = 0, 5 atm T 1 = 0ºC 1 x = 273 V 2 = T 2 = 273ºC + 273 = 546 K T 2 = 273ºC 22, 4 2 T 1 = 0ºC + 273 = 273 K V 2 = ? L x 0, 5 22, 4 0, 5 x 546 V 2 1 x 22, 4 1 = 0, 5 x V 2 2 V 2 = 89, 6 L Prof. Agamenon Roberto

02) A partir de dados enviados de Vênus por sondas espaciais norte – americanas e soviéticas, pode-se considerar que, em certos pontos da superfície desse planeta, a temperatura é de 327ºC e a pressão atmosférica é de 100 atm. Sabendo-se que na superfície da Terra o volume molar de um gás ideal é 24, 6 L a 27ºC e 1, 00 atm, qual seria o valor desse volume nesses pontos de Vênus? V 1 = ? L P 1 = 100 atm P 2 = 1, 00 atm T 1 = 327ºC 100 x 600 V 1 = 49, 2 100 T 1 = 327ºC + 273 = 600 K V 2 = 24, 6 L T 2 = 27ºC + 273 = 300 K T 2 = 27ºC 1 x 24, 6 300 100 x 2 V 1 = 0, 492 L = 492 m. L 1 x 24, 6 1 Pág. 486 Ex. 11 Prof. Agamenon Roberto

03) Certa massa de gás hidrogênio ocupa um volume de 100 litros a 5 atm e – 73°C. A que temperatura essa massa de hidrogênio irá ocupar um volume de 1000 litros na pressão de 1 atm? a) 400°C. V 1 = 100 L b) 273°C. P 1 = 5 atm c) 100°C. T 1 = – 73°C + 273 = 200 K d) 127°C. V 2 = 1000 L e) 157°C. P 2 = 1 atm P 1 x T 1 V 1 = P 2 x V 2 T 2 = ? 5 x 100 200 T 2 = = 2000 5 1 x 1000 T 2 5 x 2 1 = 1 x 1000 T 2 = 400 K – 273 = 127°C Prof. Agamenon Roberto

Dizemos que um gás se encontra nas CNTP quando: P = 1 atm ou 760 mm. Hg e T = 0 °C ou 273 K É o volume ocupado por um mol de um gás Nas CNTP o volume molar de qualquer gás é de 22, 4 L Pro f. A gam eno n. R obe rto

HIPÓTESE DE AVOGADRO Gás METANO V=2 L P = 1 atm T = 300 K Gás CARBÔNICO Volumes IGUAIS de gases quaisquer, nas mesmas condições de TEMPERATURA e PRESSÃO contêm a mesma quantidade de MOLÉCULAS Prof. Agamenon Roberto

01) Faça uma previsão do volume ocupado por uma amostra de 3, 5 mol de gás nitrogênio nas CNTP? 3, 5 mol 3, 5 Ex. 03 22, 4 L 1 mol 1 Pág. 486 V = 22, 4 V 1 x V = 3, 5 x 22, 4 V = 78, 4 L Prof. Agamenon Roberto

02) A 25ºC e 1 atm o volume molar dos gases é 24, 5 L. Nessas condições de pressão e temperatura, qual será o volume ocupado por 64 g de gás ozônio, O 3? Dado: massa molar do ozônio = 48 g/mol 1 mol 48 64 = 48 g 24, 5 L 64 g V 24, 5 V 48 x V = Pág. 486 Ex. 07 V = 64 x 24, 5 1568 48 V = 32, 67 L Prof. Agamenon Roberto

03) Um balão contém 1, 20 g de nitrogênio gasoso, N 2; outro balão, de mesmo volume, contém 0, 68 g de um gás X. Ambos os balões estão à mesma temperatura e pressão. A massa molecular do gás X será aproximadamente igual a: Dado: N = 14 u. m. a. Pág. 487 a) 16. 1, 20 g de N 2 b) 10. c) 18. d) 30. e) 32. n. N = n X x T, V, P Ex. 15 T, V, P 2 m. N 2 MX 0, 68 g de X 1, 2 = 28 x = 0, 68 m. X 1, 20 MX 28 MX = 28 = x 0, 68 1, 2 0, 68 MX MX = 16 u. m. a. Prof. Agamenon Roberto

Lei do Gás Ideal (Equação de Clapeyron) P x T V = constante P Para 1 mol de gás nas CNTP x V = T P Para 2 mol de gás nas CNTP x Para n mol de gás nas CNTP Generalizando teremos: P x V V = n x = = T x x x R 22, 4 = 0, 082 273 1 V T P 1 22, 4 x 2 273 1 x 22, 4 273 x x n = 2 x 0, 082 = n x 0, 082 T Prof. Agamenon Roberto

P R = 0, 082 atm x L mol x K x V = n R = 62, 3 x R T x mm. Hg mol x x L K R = 8, 315 k. Pa x L mol x K 01) Ao realizar a reação de ferro metálico com uma solução aquosa de ácido clorídrico, um químico recolheu 83, 15 L de gás hidrogênio a 100 k. Pa de pressão e a 27ºC. Qual a quantidade em mols de gás hidrogênio na amostra recolhida? P x 100 n= V = n x x R x T 83, 15 = n 100 x 8, 315 83, 15 x 300 x 8, 315 x 300 n = 3, 33 mols Pág. 491 Ex. 31 Prof. Agamenon Roberto

P R = 0, 082 atm x L mol x K x V = n R = 62, 3 x R T x mm. Hg mol x x L K R = 8, 315 k. Pa x L mol x K 02) Há dúvida se certa amostra de gás é de oxigênio (O 2), nitrogênio (N 2) ou dióxido de carbono (CO 2). Medidas revelaram que a massa da amostra é 0, 70 g, seu volume é 750 m. L, sua pressão é 0, 82 atm e sua temperatura é 27ºC. Com base nessas informações, é possível decidir entre um dos três gases, como sendo o que existe na amostra? Explique. P x V = n 0, 82 n= x x T 0, 75 = n x 0, 82 x 0, 082 x R 0, 082 x 300 n= 0, 75 x 300 n = 0, 025 mol M= m M 0, 70 0, 025 O gás é o N 2 Prof. Agamenon Roberto 0, 025 = 0, 70 M M = 28 u Pág. 491 Ex. 33

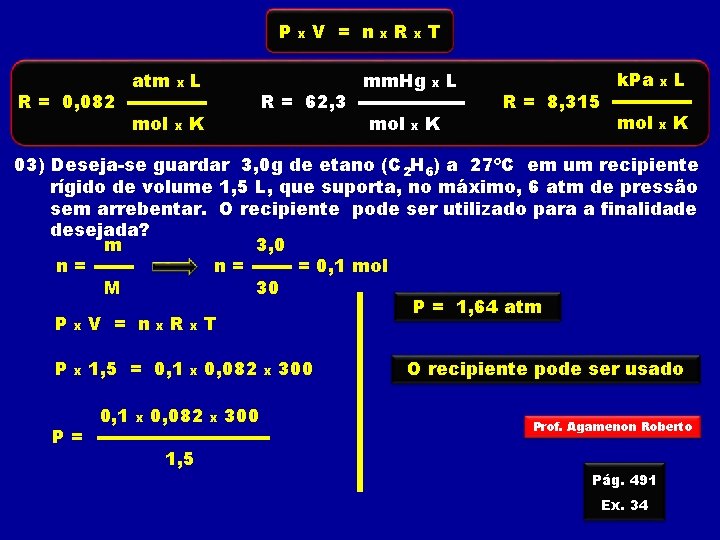
P R = 0, 082 atm x L mol x K x V = n R = 62, 3 x R T x mm. Hg mol x x K L R = 8, 315 k. Pa x L mol x K 03) Deseja-se guardar 3, 0 g de etano (C 2 H 6) a 27ºC em um recipiente rígido de volume 1, 5 L, que suporta, no máximo, 6 atm de pressão sem arrebentar. O recipiente pode ser utilizado para a finalidade desejada? m 3, 0 n= n= = 0, 1 mol M 30 P = 1, 64 atm Px. V = nx. Rx. T P x P= 1, 5 = 0, 1 x x 0, 082 1, 5 0, 082 x 300 O recipiente pode ser usado Prof. Agamenon Roberto Pág. 491 Ex. 34

04) 2, 2 g de um gás estão contidos num recipiente de volume igual a 1, 75 litros, a uma temperatura de 77 o. C e pressão e 623 mm. Hg. Este gás deve ser: Dados: H = 1 u; C = 12 u; O = 16 u; N = 14 u; S = 32 u a) NO. m = 2, 2 g b) H 2 S. V = 1, 75 L c) SO 2. T = 77ºC = 350 K d) CO 2. P = 623 mm. Hg e) NH 3. P 623 x 1, 75 = x V = 2, 2 M M = 44 g/mol x Prof. Agamenon Roberto m M 62, 3 x x R 350 x T M = 2, 2 x 62, 3 x 350 623 x 1, 75 CO 2 = 12 + 32 = 44 g/mol

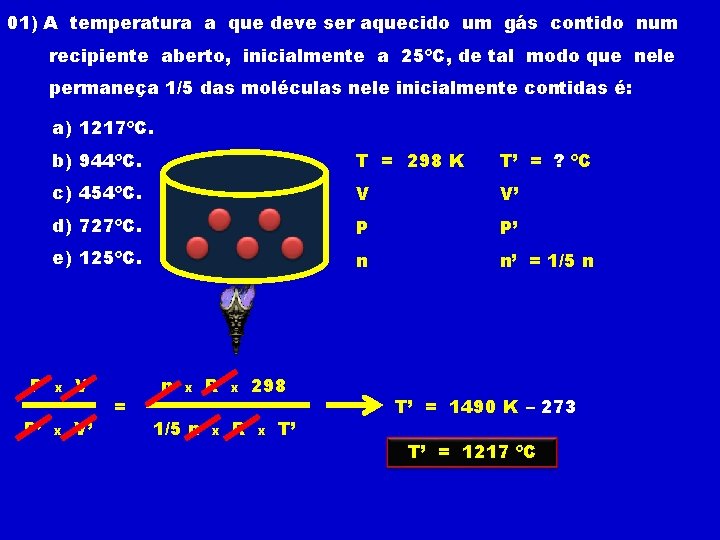
05) A temperatura a que deve ser aquecido um gás contido num recipiente aberto, inicialmente a 25ºC, de tal modo que nele permaneça 1/5 das moléculas nele inicialmente contidas é: a) 1217ºC. b) 944ºC. T = 25ºC 298 K T’ = ? ºC c) 454ºC. V V’ d) 727ºC. P P’ e) 125ºC. n n’ = 1/5 n Prof. Agamenon Roberto P x V P’ x V’ = n x 1/5 n R x x R 298 x T’ T’ = 1490 K – 273 T’ = 1217 ºC

P R = 0, 082 atm x L mol x K x V = n R = 62, 3 x R T x mm. Hg mol x x K L R = 8, 315 k. Pa x L mol x K 06) Um recipiente de 1 L contém gás nitrogênio a 5 atm e um outro recipiente, de 3 L, contém gás oxigênio a 2 atm. Ambos estão na mesma temperatura. a) Em qual deles há mais moléculas? 5 N 2 5 2 x x 1 3 = n n’ x x x 1 = n R R x x x R x T O 2 T 5 T’ 6 = n n’ 2 x n’ = 3 = n’ 6 5 x R n b) Determine a relação entre o número de moléculas de gás? n’ n = 6 5 Prof. Agamenon Roberto Pág. 491 Ex. 38 x T’

Mistura de Gases Estas misturas funcionam como se fosse um único gás PA V A TA n A PB VB TB n. B P V T Podemos estudar a mistura gasosa ou relacionar a mistura gasosa com os gases nas condições iniciais pelas expressões P. V = n. T. R. T gamen Prof. A o ert on Rob P x V T = P A x VA TA + P B x VB TB

01) Considere a mistura de 0, 5 mol de CH 4 e 1, 5 mol de C 2 H 6, contidos num recipiente de 30 L a 300 K. A pressão total, em atm, é igual a: a) 1, 64 atm. b) 0, 82 atm. c) 0, 50 atm. d) 0, 41 atm. e) 0, 10 atm. P. V = n. T. R. T P. 30 = 2. 0, 082. 300 P = 2. 0, 82. 30 30 P = 1, 64 atm Prof. Agamenon Roberto

02) Dois gases perfeitos estão em recipientes diferentes. Um dos gases ocupa volume de 2, 0 L sob pressão de 4, 0 atm e 127°C. O outro ocupa volume de 6, 0 L sob pressão de 8, 0 atm a 27°C. Que volume deverá ter um recipiente para que a mistura dos gases a 227°C exerça pressão de 10 atm? gás A gás B P. V = T g 10. V 500 10. V VA = 2, 0 L PA = 4, 0 atm TAA = 400 127 K ºC 5 VB = 6, 0 L V = ? PB = 8, 0 atm P = 10 atm TBB = 300 27 ºC K T = 500 227 K ºC PA. V A TA 4. 2 = 400 4. 2 = 4 + + + PB. V B TB 8. 6 300 8. 6 3 2. V = 2 + 16 V = 18 V = 9 L 2 Prof. Agamenon Roberto

Pressão Parcial de um Gás A P P x T V x = Gás B V = n. T PA x x VA TA R x + T PB VB x TB Mantendo o VOLUME e a TEMPERATURA P’A é a pressão parcial do gás A P’A x V = n. A P’A x V T = x R PA x T VA P’B é a pressão parcial do gás B P’B x V = n. B P’B x V T = Lei de DALTON: P = PA + PB Prof. Agamenon Roberto x R PB x T VB

01) Uma mistura gasosa é formada por 4 mol de hélio e 1 mol de monóxido de carbono. Sabendo que a pressão total da mistura é 100 k. Pa e o volume é 125 L, determine para cada gás: a) A fração em mols x. He = n. He ntotal = 4 5 = 0, 80 x. CO = n. CO ntotal = 1 = 0, 20 5 b) A pressão parcial P’He = x. He P’CO = x. CO x x Ptotal = 0, 8 x 100 = 80 k. Pa Ptotal = 0, 2 x 100 = 20 k. Pa Pág. 498 Ex. 02 Prof. Agamenon Roberto

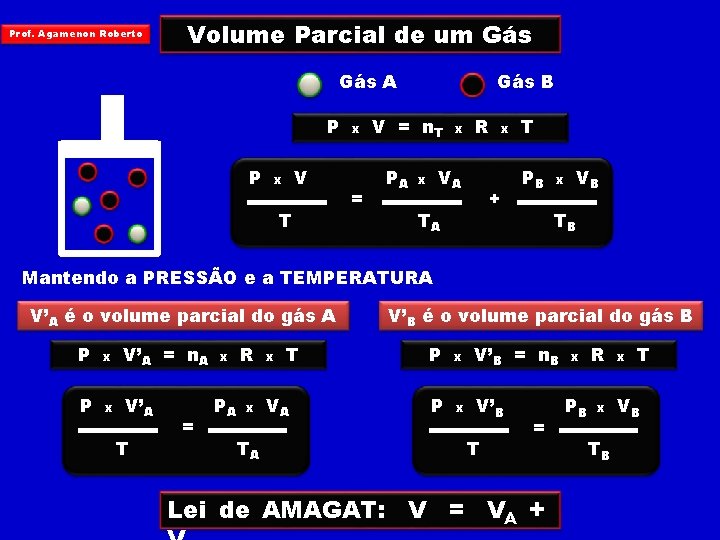
Prof. Agamenon Roberto Volume Parcial de um Gás A P P V x T x = Gás B V = n. T PA x R VA x x + TA T PB x VB TB Mantendo a PRESSÃO e a TEMPERATURA V’A é o volume parcial do gás A P x V’A = n. A P x V’A T = x R PA x T VA V’B é o volume parcial do gás B P x V’B = n. B P x V’B T = Lei de AMAGAT: V = VA + x R PB x T VB

01) Uma mistura gasosa é formada por 4 mol de hélio e 1 mol de monóxido de carbono. Sabendo que a pressão total da mistura é 100 k. Pa e o volume é 125 L, determine para cada gás: a) A fração em mols x. He = n. He ntotal = 4 5 = 0, 80 x. CO = n. CO ntotal = 1 = 0, 20 5 b) A pressão parcial RESPONDIDA ANTES c) O volume parcial V’CO = x. CO x Vtotal = 0, 2 x 125 = 25 L V’He = x. He x Vtotal = 0, 8 x 125 = 100 L Pág. 498 Ex. 02 Prof. Agamenon Roberto

Densidade dos Gases Gás hidrogênio (H 2) Gás carbônico (CO 2) O gás H 2 é menos denso que o ar atmosférico O gás CO 2 é mais denso que o ar atmosférico Prof. Agamenon Roberto

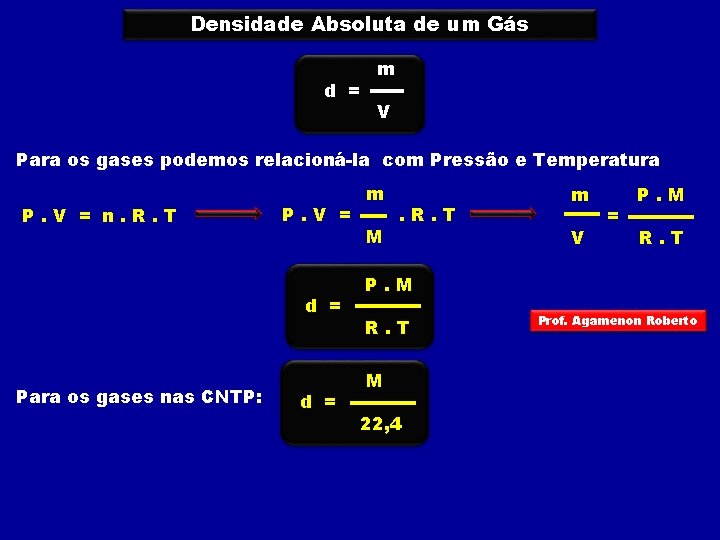
Densidade Absoluta de um Gás d = m V Para os gases podemos relacioná-la com Pressão e Temperatura P. V = n. R. T P. V = d = Para os gases nas CNTP: d = m M . R. T m V = P. M R. T M 22, 4 Prof. Agamenon Roberto

01) A densidade absoluta do gás oxigênio (O 2) a 27ºC e 3 atm de pressão é: Dado: O = 16 u d = x g/L a) 16 g/L. T = 27°C + 273 = 300 K b) 32 g/L. P = 3 atm c) 3, 9 g/L. MO 2 = 32 u d) 4, 5 g/L. R = 0, 082 atm. L / mol. K e) 1, 0 g/L. d = P x M R x T = 3 x 0, 082 32 x 300 = 96 24, 6 d = 3, 9 g/L Prof. Agamenon Roberto

02) A densidade de um gás é 1, 96 g/L medida nas CNTP. A massa molar desse gás é: a) 43, 90 g / mol. b) 47, 89 g / mol. c) 49, 92 g / mol. d) 51, 32 g / mol. e) 53, 22 g / mol. d = 1, 96 M 22, 4 M = 1, 96 x 22, 4 M = 43, 90 g/mol Prof. Agamenon Roberto

DENSIDADE RELATIVA É obtida quando comparamos as densidades de dois gases, isto é, quando dividimos as densidades dos gases, nas mesmas condições de temperatura e pressão Gás A P d. A = d. A d. B = P R x x R MA x x MA T Gás B d. B = T R x P x x T MB d A, B P R = d A , Ar = x x MB T MA MB MA 28, 96

01) A densidade do gás carbônico em relação ao gás metano é igual a: Dados: H = 1 u; C = 12 u; O = 16 u a) 44. b) 16. d CO , CH = 2 4 c) 2, 75. d) 0, 25 e) 5, 46 M CO 2 = 12 + 2 M CH 4 = 12 + 4 M 44 CO 2 M 16 CH 4 x = 2, 75 16 = 44 u. m. a. x 1 = 16 u. m. a. Prof. Agamenon Roberto

02) A densidade relativa do gás oxigênio (O 2) em relação ao ar atmosférico é: Dado: O = 16 u a) 16. b) 2. d. O 2 , Ar = M 32 O 2 28, 96 = 1, 1 c) 0, 5. d) 1, 1. e) 1, 43 Pro non f. A e gam rto e Rob

DIFUSÃO E EFUSÃO Quando abrimos um recipiente contendo um perfume, após certo tempo sentimos o odor do perfume Isso ocorre porque algumas moléculas do perfume passam para a fase gasosa e se dispersam no ar chegando até nossas narinas Esta dispersão recebe o nome de DIFUSÃO Prof. Agamenon Roberto

DIFUSÃO E EFUSÃO Uma bola de festas com um certo tempo murcha, isto ocorre porque a bola tem poros e o gás que se encontrava dentro da bola sai por estes poros Prof. Agamenon Roberto Este fenômeno denomina-se de EFUSÃO


A velocidade de difusão e de efusão é dada pela LEI DE GRAHAM que diz: A velocidade de difusão e de efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade Nas mesmas condições de temperatura e pressão a relação entre as densidades é igual à relação entre suas massas molares, então: v. A v. B = d. B v. A d. A v. B = MB MA Prof. Agamenon Roberto

01) ( Mackenzie – SP ) Um recipiente com orifício circular contém os gases y e z. O peso molecular do gás y é 4, 0 e o peso molecular do gás z é 36, 0. A velocidade de escoamento do gás y será maior em relação à do gás z: a) 3 vezes b) 8 vezes c) 9 vezes My = 4 u Mz = 36 u d) 10 vezes vy e) 12 vezes vz = vy = 3 x Mz vy My vz = 3 36 9 4 vz Prof. Agamenon Roberto

01) A velocidade de difusão do gás hidrogênio é igual a 27 km/min, em determinadas condições de pressão e temperatura. Nas mesmas condições, a velocidade de difusão do gás oxigênio em km/h é de: Prof. Agamenon Roberto Dados: H = 1 g/mol; O = 16 g/mol. a) 4 km/h. v. H b) 108 km/h. v. O c) 405 km/h. d) 240 km/h. v. H 2 e) 960 km/h. v. O 2 27 x v. O 60 2 = 4 = 27 km/min = 27 km / (1/60) h 2 = x km/h 2 MO 2 = v. O 27 = 60 v. O MH 2 2 x 1620 4 2 = 405 km/h = 32 16 2

REVISÃO

01) A temperatura a que deve ser aquecido um gás contido num recipiente aberto, inicialmente a 25ºC, de tal modo que nele permaneça 1/5 das moléculas nele inicialmente contidas é: a) 1217ºC. b) 944ºC. T = 25ºC 298 K T’ = ? ºC c) 454ºC. V V’ d) 727ºC. P P’ e) 125ºC. n n’ = 1/5 n P x V P’ x V’ = n x 1/5 n R x x R 298 x T’ T’ = 1490 K – 273 T’ = 1217 ºC

02. (IFET) Dois balões de igual capacidade, A e B, mantidos na mesma temperatura, apresentam massas iguais de H 2(g) e O 2(g). A pressão do H 2(g) no balão A é igual a 1, 6 atm. Assinale a alternativa abaixo que corresponde a pressão que o O 2 (g) exerce no balão B. Dados: M(H 2) = 2 g/mol e M(O 2) = 32 g/mol. a) 0, 1 atm. b) 0, 5 atm. c) 1, 0 atm. d) 1, 6 atm. e) 2, 0 atm. PO 2 x VA = VB A PH 2 = 1, 6 atm 1, 6 x V PO 2 x V m. H 2 n. H 2 = 1, 6 H 2 M 2 H 2 x = m. O 2 n n. OO 2 2 M 32 O 2 m H 2 TA = T B =m B Po 2 = ? atm O 2 n. H 2 x R x T n. O 2 x R x T PO 2 = 3, 2 32 PO 2 = 0, 1 atm

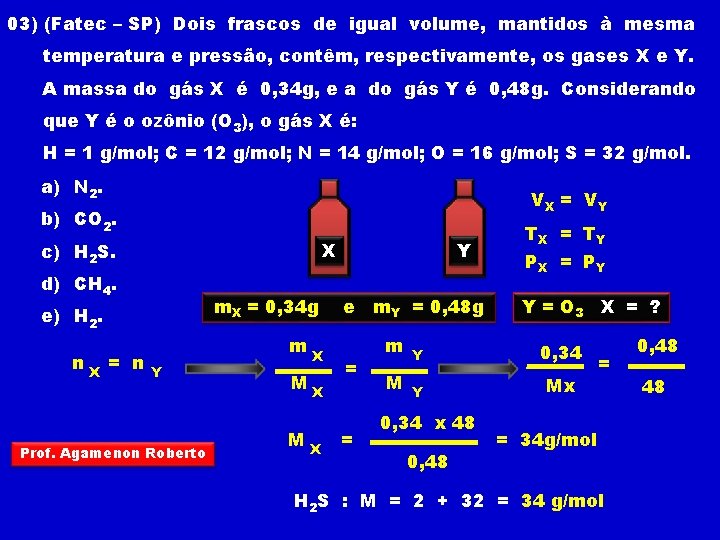
03) (Fatec – SP) Dois frascos de igual volume, mantidos à mesma temperatura e pressão, contêm, respectivamente, os gases X e Y. A massa do gás X é 0, 34 g, e a do gás Y é 0, 48 g. Considerando que Y é o ozônio (O 3), o gás X é: H = 1 g/mol; C = 12 g/mol; N = 14 g/mol; O = 16 g/mol; S = 32 g/mol. a) N 2. VX = V Y b) CO 2. X c) H 2 S. d) CH 4. m. X = 0, 34 g e) H 2. n. X = n m Y Prof. Agamenon Roberto X MX MX Y e m. Y = 0, 48 g = = TX = T Y PX = P Y Y = O 3 X = ? m Y 0, 34 M Y Mx 0, 34 x 48 0, 48 = = 34 g/mol H 2 S : M = 2 + 32 = 34 g/mol 0, 48 48

04) Um estudante de química armazenou em um cilindro de 10 L, 6 g de hidrogênio e 28 g de hélio. Sabendo-se que a temperatura é de 27°C no interior do cilindro. Calcule: Dados: H 2 = 2 g/mol; He = 4 g/mol I. O número de mol do H 2 e do He. 6 n. H 2 = 3 mol n. He = 28 4 = 7 mol II. A pressão total da mistura P x V = n. T x R x T P x 10 = 10 x 0, 082 x 300 P = 24, 6 atm III. A pressão parcial de cada componente da mistura P’H 2 x V = n. H 2 x P’H 2 x 10 = 3 0, 082 x P’H 2 = 7, 38 atm R x T x 300 P’He x V = n. He x P’He x 10 = 7 0, 082 x R x T x 300 P’He = 17, 22 atm Prof. Agamenon Roberto

05) Uma mistura gasosa contém 4 mols de gás hidrogênio, 2 mols de gás metano exercem uma pressão de 4, 1 atm, submetidos a uma temperatura de 27°C. Calcule os volumes parciais destes dois gases. n. H 2 = 4 mols n. CH 4 = 2 mols P = 4, 1 atm T = 300 27° C K P X V H 2 = n H 2 4, 1 X V’H 2 4 Rx. T = 4 x 0, 082 x 300 4, 1 X V’CH 4 = 2 x 0, 082 x 300 x 0, 082 V’H 2 = 24 L V’ H 2 = ? V’ CH 4 = ? x 4, 1 x 300 2 x V’CH 4 = 12 L 0, 082 x 300 4, 1 Prof. Agamenon Roberto

06) Uma mistura gasosa contém 6 mols de gás hidrogênio, 2 mols de gás metano e ocupa um recipiente de 82 L. Calcule os volumes parciais destes dois gases. n H 2 = 6 mols n CH 4 Podemos relacionar, também, o volume parcial com o volume total da mistura pela = 2 mols expressão abaixo V = 82 L V’ A = x A x H 2 = x CH 4 = 6 8 2 8 = 0, 75 = 0, 25 V’H 2 = 0, 75 V’CH 4 = 0, 25 x x x V 82 = 61, 5 L 82 = 20, 5 L Prof. Agamenon Roberto
 La senna al ponte di iena gauguin
La senna al ponte di iena gauguin Um certo dia uma mulher
Um certo dia uma mulher Wgrav
Wgrav Todo tiene su tiempo
Todo tiene su tiempo Si todo es relativo ¿acaso todo vale?
Si todo es relativo ¿acaso todo vale? Todo tiene su tiempo y todo lo que se quiere
Todo tiene su tiempo y todo lo que se quiere Site:slidetodoc.com
Site:slidetodoc.com Forte forte pra da certo
Forte forte pra da certo Idh
Idh Queda livre
Queda livre Qual foi o marco inicial do trovadorismo
Qual foi o marco inicial do trovadorismo Um certo dia à beira mar
Um certo dia à beira mar A vendedora de roupas esta arrumando os cabides da vitrine
A vendedora de roupas esta arrumando os cabides da vitrine Oscar arremessa uma bola de basquete
Oscar arremessa uma bola de basquete Capitanias hereditárias que deram certo
Capitanias hereditárias que deram certo Certo capital aplicado gerou um montante de 1000
Certo capital aplicado gerou um montante de 1000 Certo pai disse a seu filho
Certo pai disse a seu filho Certo dia o professor paulo
Certo dia o professor paulo Certo e errado bom e mau
Certo e errado bom e mau Antes crescei na graça e no conhecimento
Antes crescei na graça e no conhecimento Probabilità totale di eventi incompatibili
Probabilità totale di eventi incompatibili Sou eu o grande eu sou harpa
Sou eu o grande eu sou harpa Uncisal num certo dia do mes de novembro
Uncisal num certo dia do mes de novembro Quando tudo não der mais certo
Quando tudo não der mais certo Quando tudo não der mais certo
Quando tudo não der mais certo In un certo mese dell'anno per 3 volte il martedi
In un certo mese dell'anno per 3 volte il martedi Deus está aqui aleluia
Deus está aqui aleluia Relato de um certo oriente
Relato de um certo oriente Uma empresa de transporte precisa efetuar uma entrega
Uma empresa de transporte precisa efetuar uma entrega Fuvest um estudante quer utilizar uma lâmpada
Fuvest um estudante quer utilizar uma lâmpada Uma vela acesa foi colocada
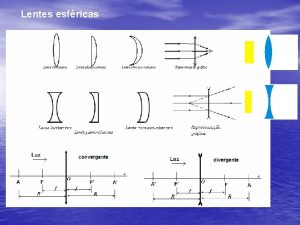
Uma vela acesa foi colocada Uma elipse é uma seção plana de um cilindro circular
Uma elipse é uma seção plana de um cilindro circular Era uma estrela tão alta era uma estrela tão fria
Era uma estrela tão alta era uma estrela tão fria Uma uma
Uma uma Um escoteiro usa uma lupa
Um escoteiro usa uma lupa Atitude é uma pequena coisa que faz uma grande diferença
Atitude é uma pequena coisa que faz uma grande diferença Era uma vez uma ilha onde moravam todos os sentimentos
Era uma vez uma ilha onde moravam todos os sentimentos Era uma vez uma sementinha
Era uma vez uma sementinha Uma equipe de cientistas lançará
Uma equipe de cientistas lançará Uma onda possui uma frequencia angular de 110 rad/s
Uma onda possui uma frequencia angular de 110 rad/s Uma bola sera retirada de uma sacola contendo 5
Uma bola sera retirada de uma sacola contendo 5 Densa
Densa Era uma vez uma menina chamada
Era uma vez uma menina chamada Abo
Abo Sorteando uma das n pessoas de uma sala
Sorteando uma das n pessoas de uma sala Um estudante deseja queimar uma folha de papel
Um estudante deseja queimar uma folha de papel Só sei que maria de nazaré resolveu se casar com josé
Só sei que maria de nazaré resolveu se casar com josé Uma flecha lançada uma palavra dita
Uma flecha lançada uma palavra dita Exemplo de raiz fasciculada tuberculosa
Exemplo de raiz fasciculada tuberculosa Era uma vez uma ilha onde moravam todos os sentimentos
Era uma vez uma ilha onde moravam todos os sentimentos Era uma vez uma galinha
Era uma vez uma galinha Me merezco todo lo bueno
Me merezco todo lo bueno Te deseo de todo corazón
Te deseo de todo corazón Presentandote tu en todo como ejemplo de buenas obras
Presentandote tu en todo como ejemplo de buenas obras Todo aquel que es nacido de dios no practica el pecado
Todo aquel que es nacido de dios no practica el pecado Que es la microlocalización de un proyecto
Que es la microlocalización de un proyecto Nos vemos atribulados en todo pero no abatidos
Nos vemos atribulados en todo pero no abatidos Relativo a la amistad
Relativo a la amistad Dios es mi todo
Dios es mi todo Cuando das todo por una persona y no lo valora
Cuando das todo por una persona y no lo valora Julian le paso el balon a valentin y metio gol
Julian le paso el balon a valentin y metio gol Familia nutricia
Familia nutricia