S GIO DC V O TO AN GIANG
























- Slides: 29

SỞ GIÁO DỤC VÀ ĐÀO TẠO AN GIANG ----- ĐÀI PHÁT THANH -TRUYỀN HÌNH AN GIANG ---------- GIẢNG DẠY KIẾN THỨC HỌC KỲ 2 MÔN HÓA HỌC LỚP 12

Bài 27: NHÔM VÀ HỢP CHẤT CỦA NHÔM Giáo viên: PHẠM VÕ DUYÊN MINH


A. NHÔM I- VỊ TRÍ TRONG BẢNG TUẦN HOÀN, CẤU HÌNH ELECTRON NGUYÊN TỬ Nhôm (Al) ở ô số 13 thuộc chu kỳ 3 nhóm IIIA của bảng tuần hoàn Cấu hình electron nguyên tử: 1 s 22 p 63 s 23 p 1 Viết gọn là [Ne] 3 s 23 p 1 Nhôm dễ nhường cả 3 electron hóa trị nên có số oxi hóa +3 trong các hợp chất.

II- TÍNH CHẤT VẬT LÍ - Nhôm là kim loại màu trắng bạc, khối lượng riêng D = 2, 7 gam/cm 3, nhiệt độ nóng chảy 6600 C, khá mềm, rất dẻo dễ dát mỏng. - Nhôm là kim loại nhẹ, dẫn điện, dẫn nhiệt rất tốt

III- TÍNH CHẤT HÓA HỌC Nhôm là kim loại có tính khử mạnh, chỉ sau kim loại kiềm và kiềm thổ, nên dễ bị oxi hóa thành ion dương Al 3+ +3 e

1. Tác dụng với phi kim: Nhôm khử dễ dàng các nguyên tử phi kim thành ion âm a) Tác dụng với halogen: Bột nhôm tự bốc cháy khi tiếp xúc với khí clo 0 0 +3 -1 2 Al + 3 Cl 2 2 Al. Cl 3 (Nhôm clorua) b) Tác dụng với oxi: Khi đốt, bột nhôm cháy trong không khí với ngọn lửa sáng chói, tỏa nhiều nhiệt 0 0 +3 -2 4 Al + 3 O 2 2 Al 2 O 3 (Nhôm oxit) Nhôm bền trong không khí ở nhiệt độ thường do có màng Al 2 O 3 rất mỏng và bền bảo vệ

2. Tác dụng với axit a) Với HCl, H 2 SO 4 loãng Nhôm khử dễ dàng ion H+ trong dung dịch HCl và H 2 SO 4 loãng thành khí H 2 0 +1 +3 0 2 Al + 6 HCl 2 Al. Cl 3 + 3 H 2↑ 0 +1 +3 0 2 Al + 3 H 2 SO 4 loãng Al 2(SO 4)3 + 3 H 2↑ Tổng quát: 2 Al + 6 H+ 2 Al 3+ + 3 H 2↑

b) Với H 2 SO 4 đặc, HNO 3 +5 +6 Nhôm khử N hoặc S xuống số oxi hóa thấp hơn. 0 +6 +3 +4 2 Al + 6 H 2 SO 4đặc, nóng Al 2(SO 4)3+3 SO 2↑+ 6 H 2 O 0 +5 +3 +2 Al + 4 HNO 3 loãng Al(NO 3)3 + NO↑ + 2 H 2 O 0 +5 +3 +4 Al + 6 HNO 3 đặc, nóng Al(NO 3)3 + 3 NO 2↑ + 3 H 2 O *Chú ý: Al bị thụ động bởi dung dịch HNO 3 đặc nguội, H 2 SO 4 đặc nguội.

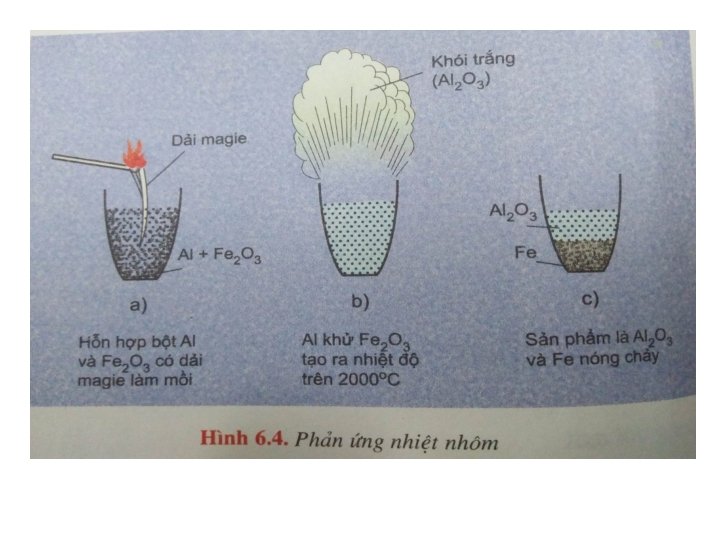
3. Tác dụng với oxit kim loại: Ở nhiệt độ cao Al khử được nhiều ion kim loại trong oxit (Fe 2 O 3, Cr 2 O 3. . . ) thành kim loại tự do 0 t 0 +3 +3 0 2 Al + Fe 2 O 3 Al 2 O 3 + 2 Fe 0 t 0 +3 +3 0 2 Al + Cr 2 O 3 Al 2 O 3 + 2 Cr Phản ứng này gọi là phản ứng nhiệt nhôm


4. Tác dụng với nước: - Nếu phá bỏ lớp oxit trên bề mặt nhôm, thì Al tác dụng với nước ở nhiệt độ thường 2 Al + 6 H 2 O 2 Al(OH)3 + 3 H 2↑ - Phản ứng nhanh chóng dừng lại vì Al(OH)3 là lớp vỏ bảo vệ không cho Al tiếp xúc với nước. Thực tế Al không tác dụng với nước.

5. Tác dụng với dung dịch kiềm: Giải phóng khí H 2 - Al 2 O 3 là oxit lưỡng tính nên tác dụng với dd kiềm Al 2 O 3 + 2 Na. OH 2 Na. Al. O 2 + H 2 O (1) Natri aluminat - Sau đó Al tác dụng với nước: 2 Al + 6 H 2 O 2 Al(OH)3 + 3 H 2↑ (2) - Al(OH)3 là hidroxit lưỡng tính nên tác dụng tiếp với dd kiềm Al(OH)3 + Na. OH Na. Al. O 2 + 2 H 2 O (3) - Cộng (2) và (3) ta được: 2 Al + 2 Na. OH + 2 H 2 O 2 Na. Al. O 2 + 3 H 2↑

IV- ỨNG DỤNG VÀ TRẠNG THÁI TỰ NHIÊN 1. Ứng dụng - Vật liệu chế tạo máy bay, ô tô. . . - Dùng trong xây dựng nhà cửa, trang trí nội thất. - Làm dây cáp dẫn điện, dụng cụ nhà bếp. - Dùng hàn đường ray.

2. Trạng thái tự nhiên Nhôm là kim loại hoạt động mạnh nên trong tự nhiên chỉ tồn tại ở dạng hợp chất. Là nguyên tố đứng hàng thứ ba sau oxi và silic về độ phổ biến trong vỏ Trái Đất sét (Al 2 O 3. 2 Si. O 2. 2 H 2 O) Boxit (Al 2 O 3. 2 H 2 O) Mica(K 2 O. Al 2 O 3. 2 H 2 O)

V- SẢN XUẤT NHÔM Phương pháp sản xuất: điện phân nhôm oxit nóng chảy 1. Nguyên liệu: Quặng boxit Al 2 O 3. 2 H 2 O 2. Điện phân nhôm oxit nóng chảy:

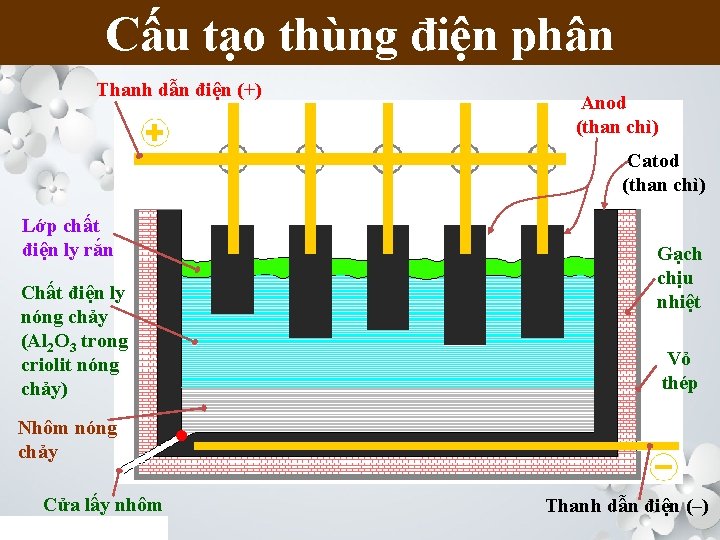
Cấu tạo A. thùng NHÔM điện phân Thanh dẫn điện (+) Anod (than chì) Catod (than chì) Lớp chất điện ly rắn Chất điện ly nóng chảy (Al 2 O 3 trong criolit nóng chảy) Gạch chịu nhiệt Vỏ thép Nhôm nóng chảy Cửa lấy nhôm Thanh dẫn điện (–)

2. Điện phân nhôm oxit nóng chảy Chuẩn bị chất điện li nóng chảy: Hòa tan Al 2 O 3 trong criolit (3 Na. F. Al. F 3) nóng chảy nhằm hạ nhiệt độ nóng chảy của hỗn hợp xuống 9000 C, có tính dẫn điện tốt, khối lượng riêng nhỏ nổi lên trên và bảo vệ nhôm không bị oxi hóa. Quá trình điện phân: • Ở catot (-): Al 3+ + 3 e Al • Ở anot (+): 2 O 2 - O 2 + 4 e • Phương trình điện phân

B. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA NHÔM I. NHÔM OXIT Al 2 O 3 1. Tính chất vật lí: Chất rắn, màu trắng, không tan trong nước, nóng chảy trên 20500 C

2. Tính chất hóa học: Nhôm oxit là oxit lưỡng tính Al 2 O 3 tác dụng với dung dịch axit Al 2 O 3 + 6 HCl 2 Al. Cl 3 + 3 H 2 O Al 2 O 3 + 6 H+ 2 Al 3+ + 3 H 2 O Al 2 O 3 tác dụng với dung dịch kiềm Al 2 O 3 + 2 Na. OH 2 Na. Al. O 2 + H 2 O Al 2 O 3 + 2 OH- 2 Al. O 2 - + H 2 O

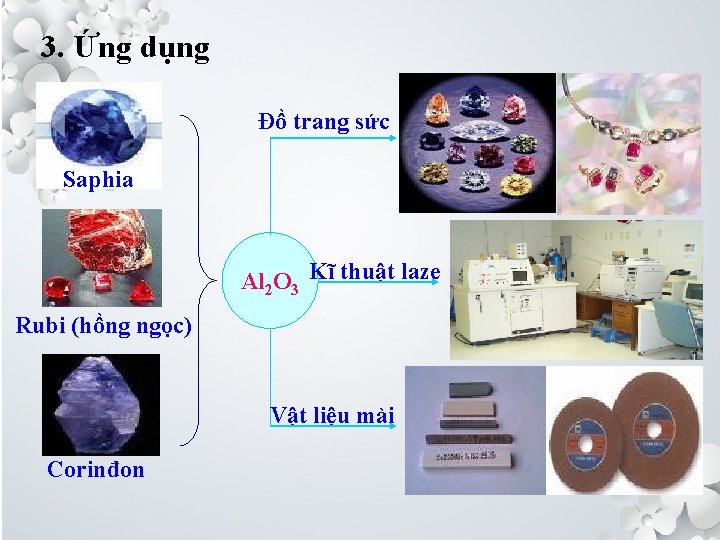
3. Ứng dụng Đồ trang sức Saphia Al 2 O 3 Kĩ thuật laze Rubi (hồng ngọc) Vật liệu mài Corinđon

II. NHÔM HIDROXIT Al(OH)3 1. Tính chất vật lí: Chất rắn, màu trắng, kết tủa ở dạng keo

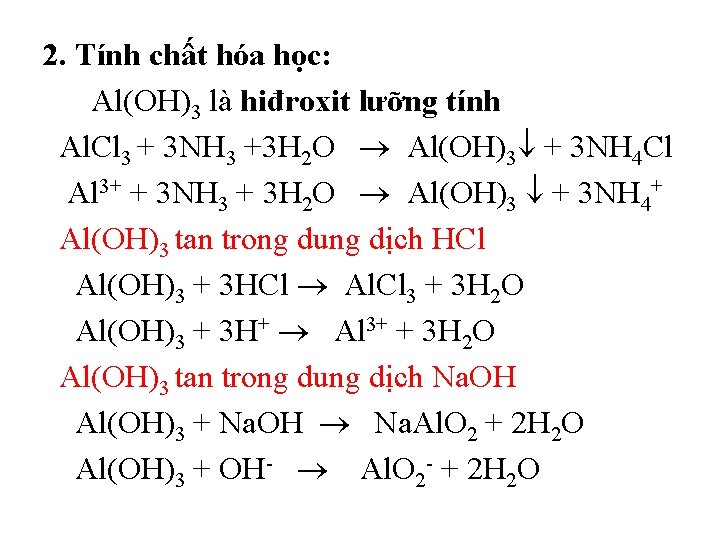
2. Tính chất hóa học: Al(OH)3 là hiđroxit lưỡng tính Al. Cl 3 + 3 NH 3 +3 H 2 O Al(OH)3 + 3 NH 4 Cl Al 3+ + 3 NH 3 + 3 H 2 O Al(OH)3 + 3 NH 4+ Al(OH)3 tan trong dung dịch HCl Al(OH)3 + 3 HCl Al. Cl 3 + 3 H 2 O Al(OH)3 + 3 H+ Al 3+ + 3 H 2 O Al(OH)3 tan trong dung dịch Na. OH Al(OH)3 + Na. OH Na. Al. O 2 + 2 H 2 O Al(OH)3 + OH- Al. O 2 - + 2 H 2 O

III. NHÔM SUNFAT Al 2(SO 4)3 Ngành thuộc da Công nghiệp giấy Công nghiệp nhuộm vải Phèn chua K 2 SO 4. Al 2(SO 4)3. 24 H 2 O Hoặc KAl(SO 4)2. 12 H 2 O Chất làm trong nước đục

IV. CÁCH NHẬN BIẾT ION Al 3+ TRONG DUNG DỊCH Thuốc thử: dung dịch kiềm dư (Na. OH, Ca(OH)2. . . ) Hiện tượng: Có kết tủa trắng keo, sau đó tan trong kiềm dư. Al 3+ + 3 OH- Al(OH)3 + OH- dư Al. O 2 - + 2 H 2 O

Cảm ơn các em đã chú ý theo dõi

Bài tập củng cố Câu 1: Phát biểu nào dưới đây là đúng? A. Nhôm là một kim loại lưỡng tính. B. Al(OH)3 là một bazơ lưỡng tính. C. Al 2 O 3 là oxit trung tính. D. Al(OH)3 là một hidroxit lưỡng tính. Đáp án D

Câu 2: Trong những chất sau, chất nào không có tính lưỡng tính? A. Al(OH)3 B. Al 2 O 3 C. Zn. SO 4 D. Na. HCO 3 Đáp án C

Câu 3: Nhôm bền trong không khí và nước là do: A. nhôm là kim loại kém hoạt động. B. có màng oxit Al 2 O 3 bền vững bảo vệ. C. có màng hidroxit Al(OH)3 bền vững bảo vệ. D. nhôm có tính thụ động với không khí và nước. Đáp án B