Regulatory System of Health Canada Kyung Won Seo













































































- Slides: 83

Regulatory System of Health Canada Kyung Won Seo Korea Food & Drug Administration


국외장기훈련 개요 v 훈련개요 § 훈련국: 캐나다 § 훈련기관명: 캐나다보건성 (Health Canada) • Health Products and Food Branch / Therapeutic Product Directorate / Bureau of Metabolism, Oncology, Reproductive Science / Oncology Division § 훈련과제: 캐나다의 의약품 허가 및 심사체계 연구 § 훈련기간: 2009. 8. 24 - 2011. 8. 23 (24개월) • 어학연수 : 4개월 • Health Canada 의약품국 항암제신약심사과 : 14개월 • Health Canada 생물의약품국 임상심사과 : 6개월






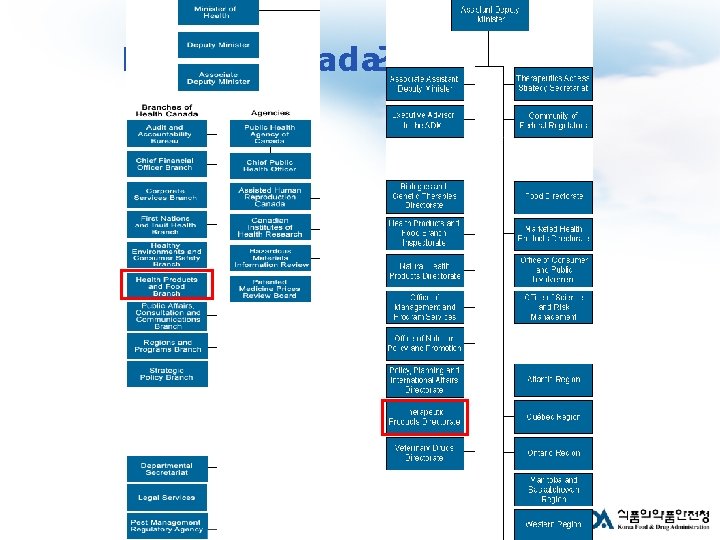
Health Canada조직



TPD의 조직 v v v Director General's Office Submission and Information Policy Division (SIPD) Office of Business Transformation (OBT) Office of Patented Medicines and Liaison (OPML) Office of Risk Management Bureau of Policy, Science and International Programs Office of Clinical Trials (OCT) Bureau of Pharmaceutical Sciences (BPS) Bureau of Cardiology, Allergy and Neurological Sciences Bureau of Gastroenterology, Infection and Viral Diseases Bureau of Metabolism, Oncology and Reproductive Sciences Bureau of Medical Devices (BMD)


TPD 세부 조직과 역할 (1) v Submission and Information Policy Division (SIPD) § Submission processing & Performance reports § Information dissemination & Publication § DIN issuance & Notification v Office of Business Transformation (OBT) § Business Transformation strategy & Planning & Administration § Regulatory Project Management v Office of Patented Medicines and Liaison (OPML) § Administration of Patent Medicine Regulation & Patent Register v Office of Risk Management § Risk management & Special Access Programme v Bureau of Policy, Science and International Programs § Policy and Regulatory Development § International Cooperation & Harmonization § Science Advisory Committees (Biostatistics)

TPD 세부 조직과 역할 (2) v Bureau of Cardiology, Allergy and Neurological Sciences (BCANS) § Clinical and Preclinical Reviews (prescription drugs) v Bureau of Gastroenterology, Infection and Viral Diseases (BGIVD) § Clinical and Preclinical Reviews (prescription drugs) § Nonprescription Drug Evaluation and Labelling v Bureau of Metabolism, Oncology and Reproductive Sciences (BMORS) § Clinical and Preclinical Reviews (prescription drugs) v Bureau of Pharmaceutical Sciences (BPS) § Clinical Comparative Bioavailability Data Evaluations § Quality Review

BGTD 의 조직 v Director General's Office v Office of Policy and International Collaboration (OPIC) v Office of Regulatory Affairs (ORA) v Office of Quality and Information Management (OQIM) v Office of Business Integration and Risk Management (OBIRM) v Administrative Services Unit (ASU) v The Centre for Vaccine Evaluation (CVE) v Centre for Evaluation of Radiopharmaceuticals and Biotherapeutics (CERB) v The Centre for Blood and Tissues Evaluation (CBTE)


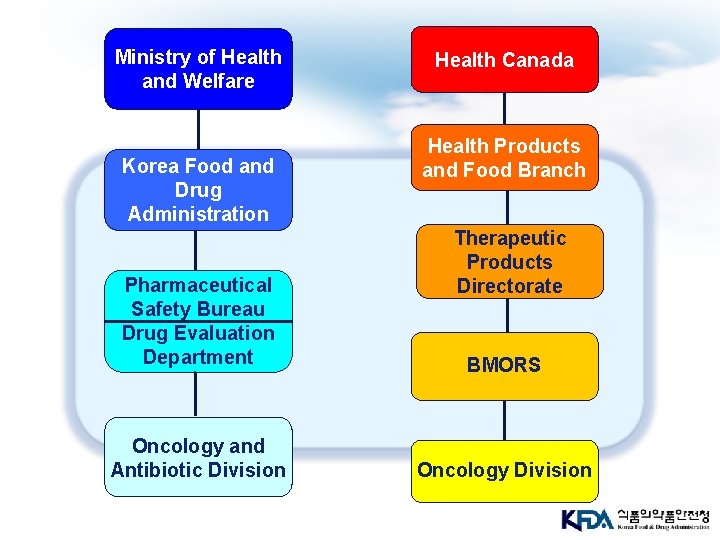
Ministry of Health and Welfare Korea Food and Drug Administration Pharmaceutical Safety Bureau Drug Evaluation Department Oncology and Antibiotic Division Health Canada Health Products and Food Branch Therapeutic Products Directorate BMORS Oncology Division

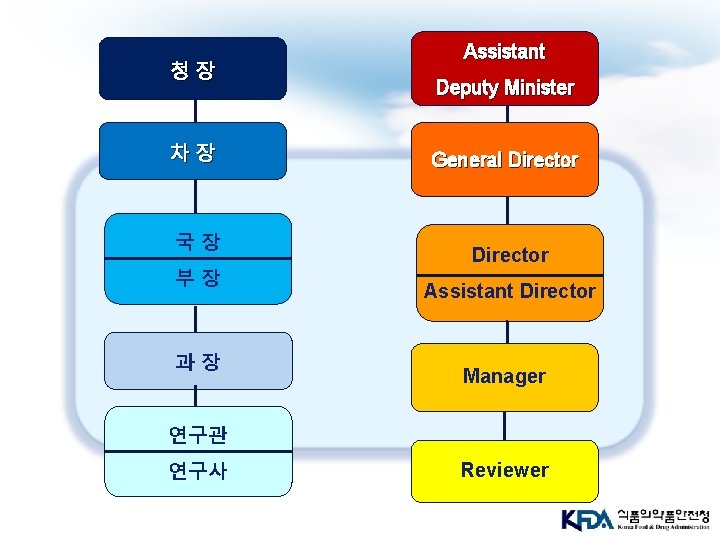
청장 차장 국 장 부 장 과 장 Assistant Deputy Minister General Director Assistant Director Manager 연구관 연구사 Reviewer






심사의 종류 v New Drug Submission (NDS) - 신약신청 v Supplement to a New Drug Submission (SNDS) – 자료제출 의약품 신청 v Supplement to a New Drug Submission - Confirmatory (SNDS-C) - 조건부 삭제 신청 v Abbreviated New Drug Submission (ANDS) – 복제의약품 신 청 v Supplement to a Abbreviated New Drug Submission (SANDS) - 자료제출 복제의약품 신청 v Notifiable Change (NC) - PM 변경 신청 v Clinical Trial Applications (CTA) and Amendments (CTA-A) 임상승인 및 변경 신청 v Periodic Safety Update Report - Confirmatory (PSUR-C) v Applications for Drug Identification Number (DINA) - 의약품 고유번호 신청

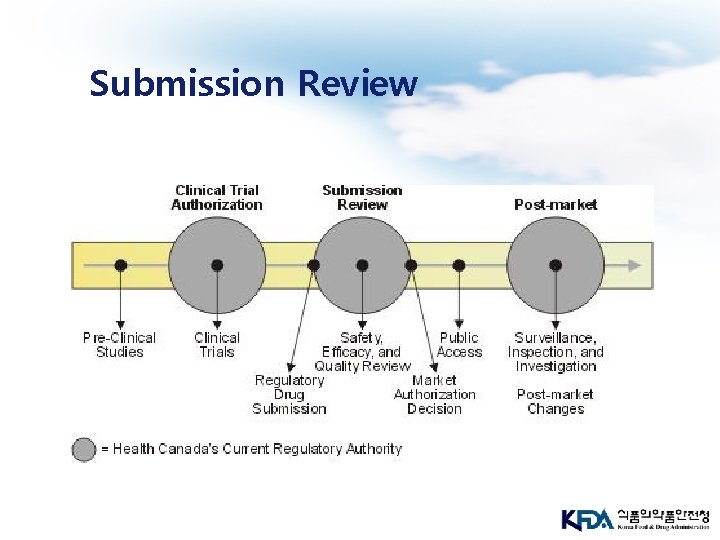
Submission Review

New Drug Submission

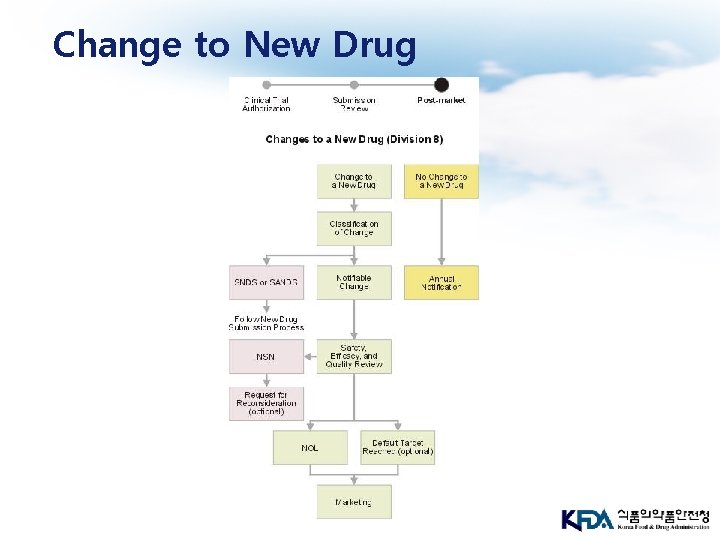
Change to New Drug

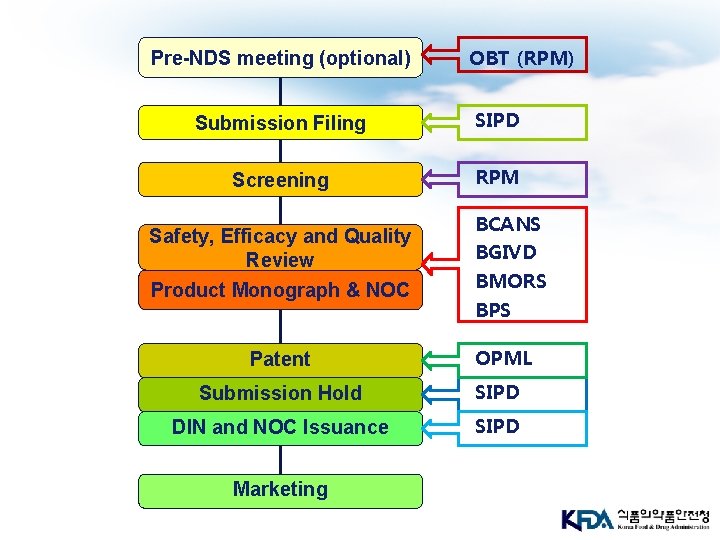
Pre-NDS meeting (optional) OBT (RPM) Submission Filing SIPD Screening RPM Safety, Efficacy and Quality Review Product Monograph & NOC Patent BCANS BGIVD BMORS BPS OPML Submission Hold SIPD DIN and NOC Issuance SIPD Marketing



Pre-Submission Meeting (3) v 회사는 회의 개최 2주전에 다음의 자료를 제출함 (바인 더 1개 이내) § § § § § a cover letter an agenda for the meeting a list of specific issues (grouped by discipline) a brief summary of the drug product proposed strengths and dosages an overview of the market history of the product including the foreign regulatory status of the drug a summary of the development of the product, including any changes in production process, dosage form, testing methods etc. leading up to a description of the manufacturing process for the product to be marketed a summary of the clinical development plan for the drug, including identification of clinical trials completed in Canada (if any) and confirmation of which trials are still ongoing (if any) identification of the indication(s) for which approval is sought brief summaries of the safety and efficacy data relating to the drug (e. g. draft of the product monograph)

자료 접수 (Filing) v 최초 제출 자료에는 control number (식약청의 접수번 호에 해당)가 부여됨 v 모든 문서는 ‘Submission and Information Policy Division (SIPD)’ 부서에 우편으로 접수됨 v CTA, CTA-A 그리고 Clarifax (식약청의 보완요구 유 사)는 BGTD의 Regulatory Affairs Division 또는 TPD 의 Submission Management Unit에서 우편으로 접수 함 v SIPD는 문서 접수 후 10 calendar days 내에 해당 심 사부로 보냄




Reconsideration (재고려) 요청 v 다음과 같은 결과를 받은 경우, 회사는 ‘Request for Reconsideration’을 제출할 수 있음 § Rejection of Priority Review Request § Rejection of Request for Advance Consideration under the Notice of Compliance with Conditions Policy § Screening Rejection Letter (SRL) § Notice of Deficiency - Withdrawal Letter (NOD/W) § Notice of Non-compliance - Withdrawal Letter (NON/W) § Not Satisfactory Notice (NSN)



Screening v 목적 : 심사의 적합성 여부 확인 § NDSs, SNDS-Cs, ANDSs, SANDSs 및 DINAs에 대한 정보는 심사 Bureau/Centre에 접수된 시점으로부터 45 calendar days 이내 § NOC/c policy에 따라 이미 Priority Review submissions 및 advance consideration에 적합하다 고 판단된 submission의 경우, 해당 Bureau/Centre 에 접수된 시점으로부터 25 calendar days 이내 § NCs와 관련된 정보와 자료는 해당 Bureau/Centre에 접수된 시점으로부터 7 calendar days 이내 v Submission이 적합하다고 판단된 날짜로부터 workload로서 계산됨























Clinical Trial Application 대상 v 개발 중에 있는 의약품의 Phase I ~ Phase III v Comparative bioavailability 시험 (우리나라의 생동 성시험 포함) v NOC/c로 승인된 (조건부 승인) 의약품의 조건내의 임상 v Phase IV 임상은 승인 대상 아님 v Comparative bioavailability 시험과 건강한 지원자 에 대한 Phase I 시험의 경우, 심사 기간은 7일임. 다음의 경우에는 적용되지 않음 § somatic cell therapy, xenografts, gene therapy, prophylactic vaccines 또는 reproductive 및 genetic technology



CTA Requirements v CTD 형식에 따라 작성 제출되어야 함 v 각 module은 별도의 binder로 제출되어야 함 v Module은 다음과 같이 구성됨 § Module 1: Administrative / Clinical Information § Module 2: Common Technical Document Summaries (Quality 자료만으로 구성) § Module 3: Quality (Module의 2 세부정보)

CTA 요구사항 - Module 1 (1) v 목차 v Module 1, Module 2및 Module 3의 리스트 v Application Information § Drug Submission Application Form (HC/SC 3011): 캐나다 내 Senior Medical또는 Scientific Officer와 Senior Executive Officer 의 서명 필요 § 캐나다에서 완료된 또는 진행 중인 임상시험 리스 트 § Investigator’s Brochure: 이미 캐나다에 허가된 의약품이라면 대신 Product Monograph 를 제출 함


CTA 요구사항 - Module 1(3) v Protocol Synopsis v Study Protocol(s): 최종 프로토콜의 복사본 v Informed Consent Documents: 환자들이 임상시험에 참여함으로써 초래되는 기대되는 유익성과 위험성과 관련한 기술이 포함되어야 함 v Clinical Trial Site Information: 신청 시점에서의 각 임상시험 사이트에 대한 Clinical Trial Site Information Form 제출 v Canadian Research Ethics Board(s) Refusals: 해당 임상시험 승인을 거절 한 적이 있는 캐나다 내 Research Ethics Board의 name, address, telephone number, the fax number 및 electronic mail address. 승인이 거 절된 이유와 일자 v Foreign Refusals: 외국 규제기관에 의해 거절된 적이 있는지에 대한 정보 v Letters of Access: Health Canada에게 관련 Master Files (예; Drug Master Files, Site Reference Files)에 접근 할 수 있는 권한을 부여하는 letter § § 의약품의 경우 CTA filing 이전에 DMF가 승인되었음이 확인되어야 함 생물학적제제의 경우 Master File information은 CTA와 동시에 제출 가능 v 기타 Application-related Information: pre-CTA consultation meeting minutes등



CTA 요구사항 –Module 2 (3) v 임상시험 단계에 따른 “Quality Overall Summary - Chemical Entities (QOSCE)” § Clinical Trial Applications - Phase I: QOS-CE (CTA - Phase I); § Clinical Trial Applications - Phase II: QOS-CE (CTA - Phase II); § Clinical Trial Applications - Phase III: QOS-CE (CTA - Phase III) v For Placebo-controlled studies: Placebo의 성분 분량에 대한 정보 제출

CTA 요구사항 – Module 3 v Quality Module § Module 3 (Quality) content 의 list § Body of Data • Module 2에서 제출된 Quality information 에 대한 세부정보 • 생물학적제제 및 방사성의약품의 경우 다음을 제출 – Production Documentation – Executed Batch Records: 개발 단계에 따라 (예; Phase I III), Executed Batch Records 를 제출해야 함 § Literature References





CTA-Amendments대상 v 생물학적 제제 및 방사성의약품의 경우, 의약품의 생산과 관련된 변경이 승인된 CTA의 범주 밖으로 판단되면 새로운 CTA로 신청해야 함: § use of a new or alternate facility for any stage of production except those used for packaging § changes in biological source material § changes to genetic expression systems § changes to the purification process § changes in drug substance and/or final product dosage form (e. g. , liquid to lyophilized formulation) § significant changes to product release specifications § changes in drug substance and/or final product strength

CTA 심사 Process v CTA 및 CTA-Am는 Health Canada에 접수된 후 30 day default review period 부여 v 심사기간의 시작을 통보하는 acknowledgement letter 가 발송됨 v Screening § 스크리닝 deficiency가 발견되면 다음과 같이 통보됨 • Request for Clarification (Clarifax) 또는 • Screening Rejection Letter v Clarification 요청 § 2 calendar days 내에 답변 제출 v CTA 또는 CTA-A 심사 중에 심각한 deficiency가 확인되 거나 Clarifax에 대한 답변이 시간 내에 이루어지지 않으 면, Not Satisfactory Notice (NSN)가 발급됨


CTA – Notification (2) v Notification대상 § 의약품의 quality나 safety에 영향을 미치지 않는 Quality (Chemistry and Manufacturing) information의 변경 • • • production scale-ups with no changes in the process tightening of existing test specifications changes in contract testing laboratories changes in packaging material extension of shelf life v CTA 또는 CTA-A 승인 이후 다른 규제 기관이나 Research Ethics Board 에서 거절된 경우 notification 으로 제출. 심사결과에는 영향을 미치 지 않음


 Kyung hee university mba
Kyung hee university mba Captain kyung
Captain kyung Address cont'd
Address cont'd Kyung hee university hospital at gangdong
Kyung hee university hospital at gangdong Html q
Html q Regulatory institutions in indian financial system
Regulatory institutions in indian financial system Missile launcher closed-loop system
Missile launcher closed-loop system Regulatory system strengthening
Regulatory system strengthening Regulatory system strengthening
Regulatory system strengthening Nhps licensing
Nhps licensing Sonia johnson health canada
Sonia johnson health canada Might for predictions
Might for predictions Thoughts for easter
Thoughts for easter If + past simple
If + past simple What was the importance of the battle of kettle creek
What was the importance of the battle of kettle creek There won't be any schools in the future
There won't be any schools in the future Wwe edge royal rumble 2010
Wwe edge royal rumble 2010 Remains annotations
Remains annotations Youjip
Youjip Youjup
Youjup Modal verb indicates certainty
Modal verb indicates certainty I'm building a rocket poem
I'm building a rocket poem Cranes hwang sunwon summary
Cranes hwang sunwon summary Battle of coleto creek
Battle of coleto creek Three of a kind all letting fly
Three of a kind all letting fly A baseball pitcher won 80 percent
A baseball pitcher won 80 percent Ram divided 15 pennies among four small bags
Ram divided 15 pennies among four small bags Oxymoron in macbeth
Oxymoron in macbeth If i won the lottery, i would grammar
If i won the lottery, i would grammar If clause first conditional examples
If clause first conditional examples Fill in the gaps with 'll/will or won't
Fill in the gaps with 'll/will or won't Explain why william won the battle of hastings
Explain why william won the battle of hastings What you dont know wont hurt
What you dont know wont hurt To an athlete dying young
To an athlete dying young Revision unit 6
Revision unit 6 Who won the battle of qubec
Who won the battle of qubec Youjip won
Youjip won Jim said to me please lend me your pen
Jim said to me please lend me your pen Past or present
Past or present Who won the chinese civil war
Who won the chinese civil war When was the battle of rice boats
When was the battle of rice boats Seung-won hwang
Seung-won hwang Regrettably these days lots of people don’t have jobs.
Regrettably these days lots of people don’t have jobs. Our class won the competition
Our class won the competition Nobel peace prize winners wiki
Nobel peace prize winners wiki Olypmpic sports
Olypmpic sports Who won the nobel prize in chemistry
Who won the nobel prize in chemistry Common factors psychotherapy
Common factors psychotherapy Abstrct nouns
Abstrct nouns As a warm-up here's a question that won't affect your score
As a warm-up here's a question that won't affect your score Question tag
Question tag Present unreal
Present unreal Przepisz zdania, używając must lub mustn’t.
Przepisz zdania, używając must lub mustn’t. She has won
She has won Jin won lee
Jin won lee Would is past tense of will
Would is past tense of will I won't remember anything else
I won't remember anything else In your notebook write about things you will or won't
In your notebook write about things you will or won't Chapter 23 the hunger games
Chapter 23 the hunger games Hard to seem won
Hard to seem won Youjip won
Youjip won Lexington and concord outcome
Lexington and concord outcome Circle the correct alternative to complete the rules
Circle the correct alternative to complete the rules Btec sport unit 3
Btec sport unit 3 Dispositional framework vs regulatory framework
Dispositional framework vs regulatory framework Signs have three purposes, identify the three.
Signs have three purposes, identify the three. Regulatory framework for financial services in india
Regulatory framework for financial services in india Chapter 22 regulatory and advisory agencies
Chapter 22 regulatory and advisory agencies Dea number verification
Dea number verification Nonpathogenic bacteria are milady
Nonpathogenic bacteria are milady Functions of sebi
Functions of sebi Regulatory change management process
Regulatory change management process Regulatory functions of sebi
Regulatory functions of sebi Diversity and regulatory challenges
Diversity and regulatory challenges Signs signals and roadway markings
Signs signals and roadway markings Regulatory capital vs economic capital
Regulatory capital vs economic capital Regulatory capital vs economic capital
Regulatory capital vs economic capital Regulatory w automatyce
Regulatory w automatyce Gene regulatory network
Gene regulatory network State nuclear regulatory inspectorate
State nuclear regulatory inspectorate Broken yellow center line
Broken yellow center line Gene regulatory network
Gene regulatory network Regulatory reform fire safety order 2005
Regulatory reform fire safety order 2005 Bbfc media aspects covered
Bbfc media aspects covered