QUMICA ORGNICA Juan Carlos Salazar Snchez Ude G


















- Slides: 30

QUÍMICA ORGÁNICA Juan Carlos Salazar Sánchez Ude. G CUCBA QUIMICA

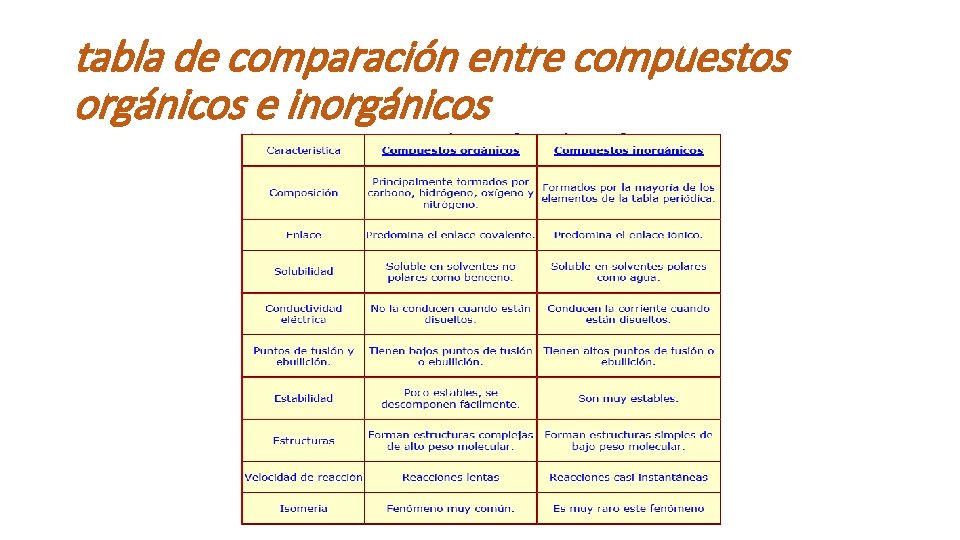
Compuestos orgánicos e inorgánicos • Los compuestos orgánicos están formados por átomos de carbono combinados de forma covalente entre si y con átomos de hidrogeno. • Los compuestos inorgánicos son todos los demás. • Antes de 1828 todos los intentos por sintetizar un compuesto orgánico desde compuestos inorgánicos no dieron resultados, pero Wholer en ese mismo año logro sintetizar urea (un compuesto orgánico) desde a partir del cianato de amonio (un compuesto inorgánico).

La química orgánica • La importancia de la química orgánica se infiere al reflexionar sobre como seria la vida moderna sin: alimentos, ropa, gas, fármacos, detergentes, combustibles, nailon, jabones, aspirina, acrilán, papel, gasolinas, aceites, colorantes sintéticos, explosivos, lacas, barnices, insecticidas, velcro, vitaminas, grasas, carbohidratos, proteínas, etc. La característica de estos compuestos es que poseen carbono.

Compuestos orgánicos e inorgánicos • En la química orgánica los enlaces covalentes y no los iónicos son los que más abundan. Debido a la prevalencia tan grande de los átomos no metálicos en los compuestos orgánicos, en sus estructuras moleculares predominan los enlaces covalentes. Por otro lado, en los compuestos inorgánicos, predominan los enlaces iónicos. • Otra característica importante de los compuestos orgánicos es que en su gran mayoría son moléculas no polares, ya que, tienen muchos enlaces, C-C y C-H que son no polares (la excepción se da cuando estos están unidos a elementos electronegativos como el O y N).

¿Que explica las Características de los compuestos orgánicos? • El carbono posee unas características especiales, que juntas lo hacen único dentro del sistema periódico, por lo que es el elemento base de todos los compuestos orgánicos. • Electronegatividad intermedia por lo que puede formar enlace covalente tanto con metales como con no metales. • Tetravalencia: lo que ofrece la posibilidad de unirse a sí mismo formando cadenas. • Además, tiene un tamaño pequeño lo que posibilita la formación de enlaces dobles y triples, ya que es posible que los átomos se aproximen lo suficiente para formar enlaces.

tabla de comparación entre compuestos orgánicos e inorgánicos

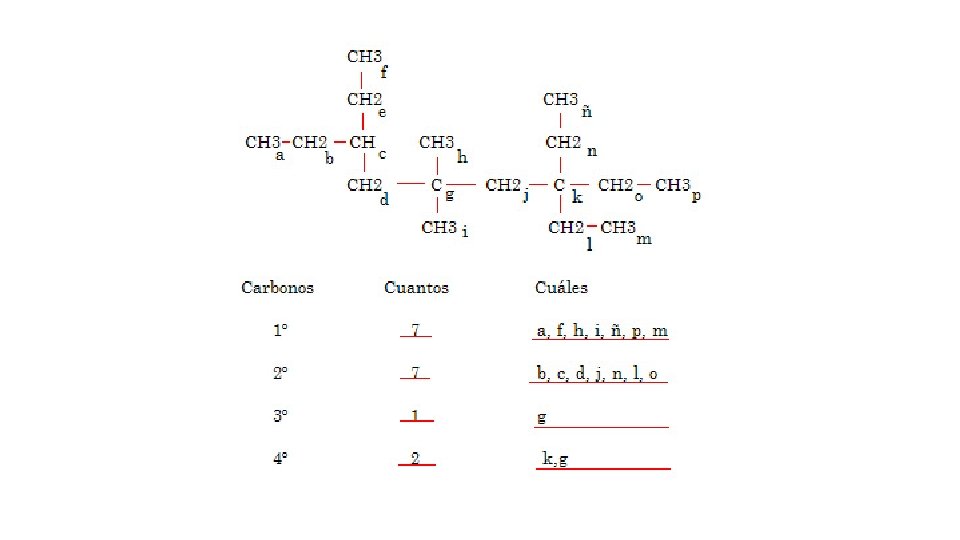
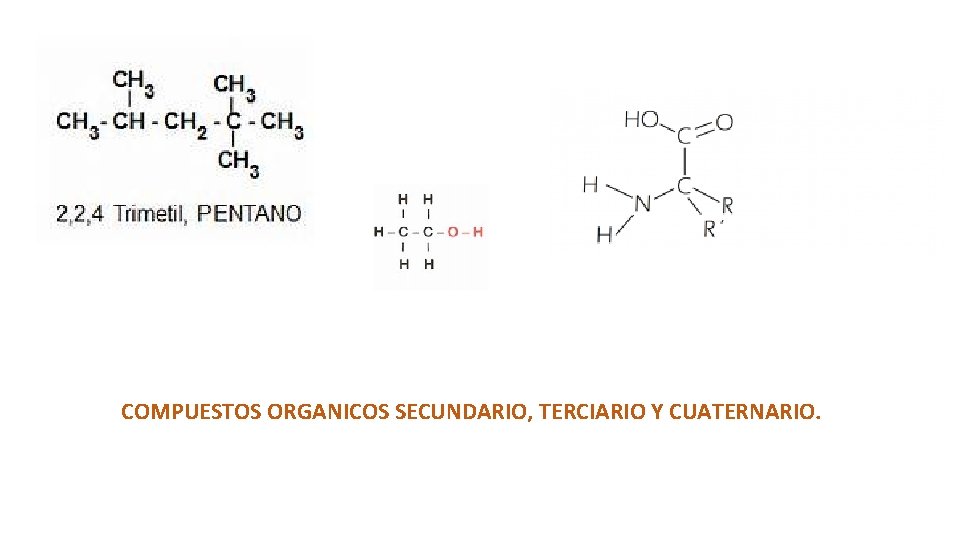
Tipos de átomos de carbono • En las formulas estructurales los átomos de carbono tiene un acomodo muy específico que les otorga una denominación como carbonos primario, secundario, terciario y cuaternario. El primario es aquel que solo une a otro carbono, el secundario une a dos carbonos y así sucesivamente hasta el carbono cuaternario.


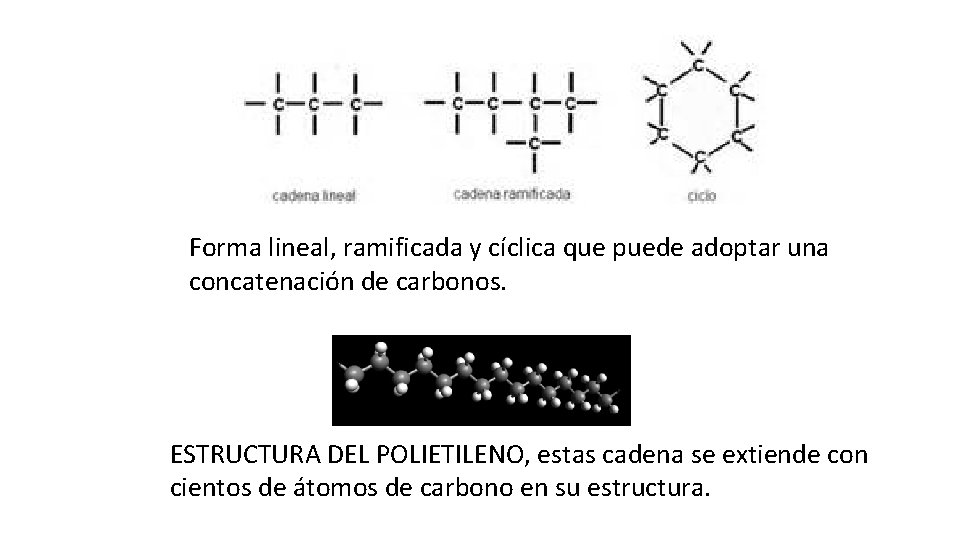
CARACTERISTICAS ESTRUCTURALES DE LOS COMPUESTOS ORGANICOS • Las moléculas orgánicas pueden tener cadenas lineales o ramificadas, ser cadenas abiertas o cíclicas, saturadas o insaturadas y ser carbocíclicos o heterocíclicos (en los que al menos uno de los componentes del ciclo es de un elemento diferente al carbono). Carbocíclico heterocíclico • Debido a que el carbono tiene la característica de unirse a otros átomos de carbono con facilidad, y a su vez a otros átomos de elementos no metales, se convierte en un elemento único para formar compuestos muy complejos, con cadenas que pueden ser muy grandes. Por ejemplo, el polietileno.

Forma lineal, ramificada y cíclica que puede adoptar una concatenación de carbonos. ESTRUCTURA DEL POLIETILENO, estas cadena se extiende con cientos de átomos de carbono en su estructura.

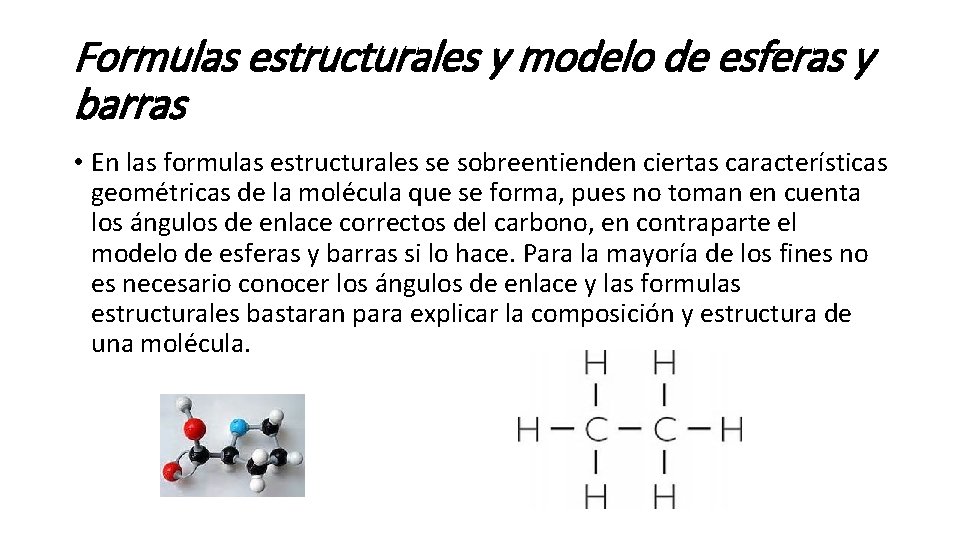
Formulas estructurales y modelo de esferas y barras • En las formulas estructurales se sobreentienden ciertas características geométricas de la molécula que se forma, pues no toman en cuenta los ángulos de enlace correctos del carbono, en contraparte el modelo de esferas y barras si lo hace. Para la mayoría de los fines no es necesario conocer los ángulos de enlace y las formulas estructurales bastaran para explicar la composición y estructura de una molécula.

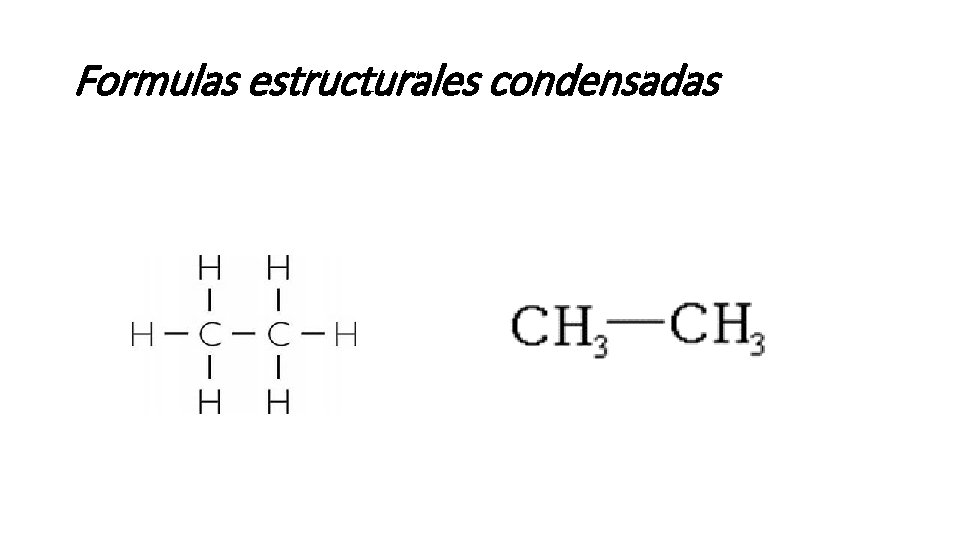
Formulas estructurales condensadas

Compuestos saturados e insaturados • La palabra saturado, describe a toda molécula cuyos átomos están unidos directamente a todos los átomos que les es posible. Insaturado implica que se le puede añadir algo. • Los compuestos insaturados tienen enlaces dobles o triples. Si las moléculas de una sustancia poseen únicamente enlaces sencillos, se le llama compuesto saturado, y cuando existen uno o más enlaces dobles o triples se llama compuesto insaturado.


Compuestos cíclicos • Muchas moléculas orgánicas contienen anillos de átomos de carbono. Un anillo de carbono es una estructura de tres o más átomos de carbono que forman un ciclo cerrado. Las moléculas con estas características se llaman anillos o compuestos cíclicos. No todos los átomos del anillo tienen que ser de carbono, algunos pueden ser de oxígeno, nitrógeno o azufre, en estos casos se les llama compuestos heterocíclicos.

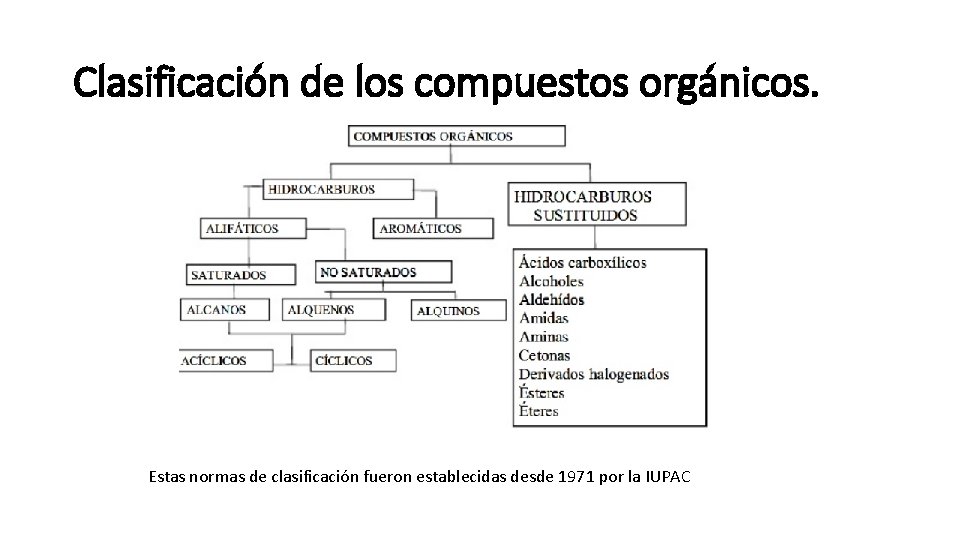
Clasificación de los compuestos orgánicos. Estas normas de clasificación fueron establecidas desde 1971 por la IUPAC

Compuestos oxigenados

Compuestos nitrogenados

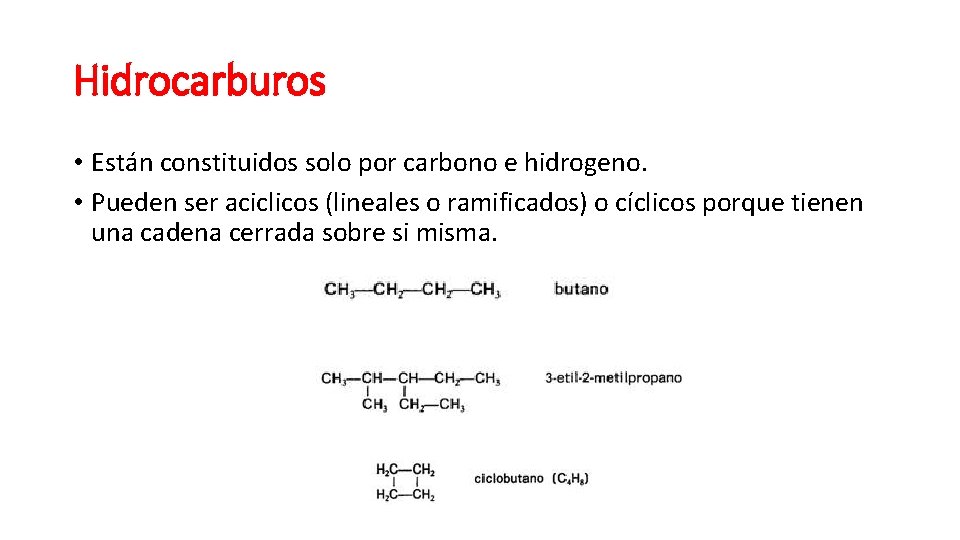
Hidrocarburos • Están constituidos solo por carbono e hidrogeno. • Pueden ser aciclicos (lineales o ramificados) o cíclicos porque tienen una cadena cerrada sobre si misma.

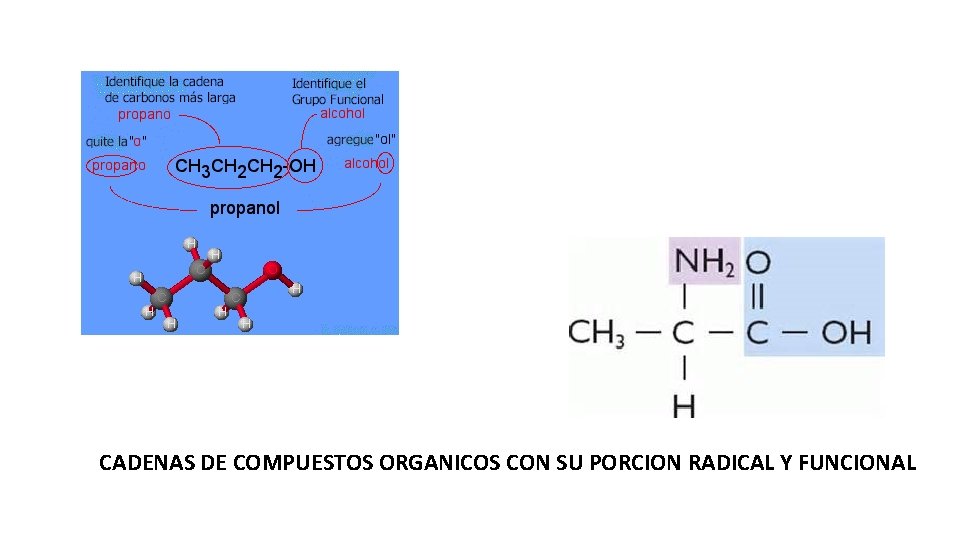
Clasificación de los compuestos orgánicos • Poseen dos partes: una llamada radical (parte inactiva) y otra conocida como grupo funcional (parte activa). • NOTA: no se debe confundir la parte llamada radical en un compuesto orgánico con un radical (antes llamado “radical libre”) que se caracteriza por tener uno o mas electrones desapareados, lo que lo hace inestable muy reactivo y de vida corta. • Antes a los grupos sustituyentes se les llamaba radical, pero después se descubrieron “radicales libres” y la IUPAC ahora recomienda, decir, a un grupo sustituyente; grupo amino, grupo metilo, grupo carboxilo, etc. Y aun radical libre simplemente radical.

Clasificación de los compuestos orgánicos • Estos compuestos se clasifican en binarios, terciarios y cuaternarios • Binarios: un compuesto es binario cuando en su cadena solo tiene átomos de carbono e hidrogeno. • Terciarios: son aquellos que poseen además de carbono e hidrogeno, también tiene un átomo de O, N o algún halógenos. • Cuaternarios: son los que tienen además de carbono e hidrogeno, existen dos átomos de N, O o algún halógeno. • Otra manera de clasificar a los compuestos orgánicos es de acuerdo a su origen; natural o sintético. A su estructura, a su funcionalidad, a su peso molecular.

COMPUESTOS ORGANICOS SECUNDARIO, TERCIARIO Y CUATERNARIO.

CADENAS DE COMPUESTOS ORGANICOS CON SU PORCION RADICAL Y FUNCIONAL

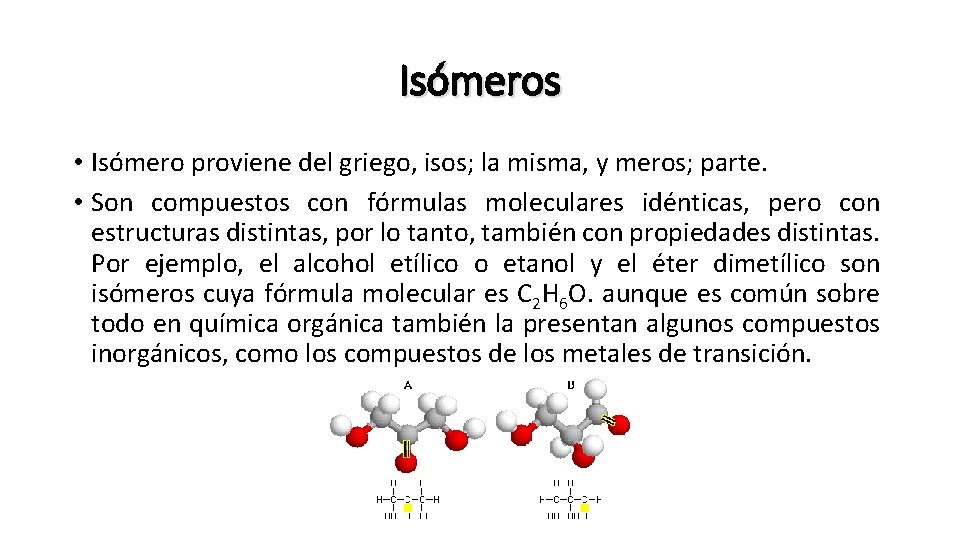
Isómeros • Isómero proviene del griego, isos; la misma, y meros; parte. • Son compuestos con fórmulas moleculares idénticas, pero con estructuras distintas, por lo tanto, también con propiedades distintas. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C 2 H 6 O. aunque es común sobre todo en química orgánica también la presentan algunos compuestos inorgánicos, como los compuestos de los metales de transición.

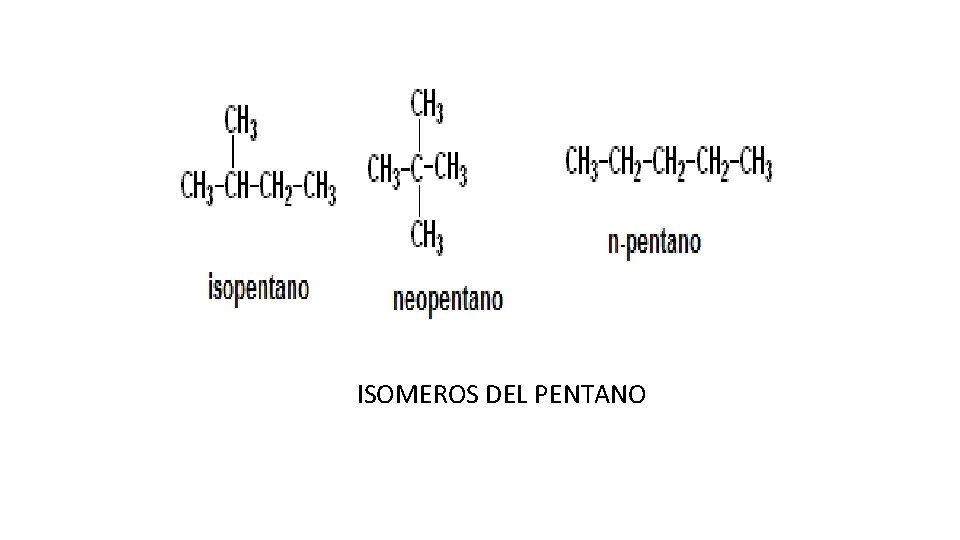
Isómeros introducción • En un principio no era tan fácil de aceptar el isomerismo, ya que, como hemos visto en clase, la química establece que los compuestos químicos solo pueden ser diferentes unos de otros cuando tienen composiciones elementales diferentes, pero lo que ahora resulta claro es que también importa la forma espacial que se adquiere aun con los mismos elementos estructurales. • El cianato de amonio y la urea, los dos compuestos del experimento de Wholer, poseen la formula molecular CH 4 N 2 O, pero sus átomos están organizados de manera distinta. Ejemplo: los tres isómeros del pentano comparte la formula C 5 H 12.

ISOMEROS DEL PENTANO

Isómeros • Entre más átomos de carbono haya en cada molécula, mayor es su número de isómeros. Por ejemplo, alguien calculo que existen cerca de 6. 25 X 1013 isómeros posibles para el C 40 H 82. Es común que los isómeros tengan propiedades muy diferentes. Como es común que difieran tanto, en química orgánica donde hay tantos carbonos por molécula y por ende, tantos isómeros, es que se usa más la formula estructural que la molecular.

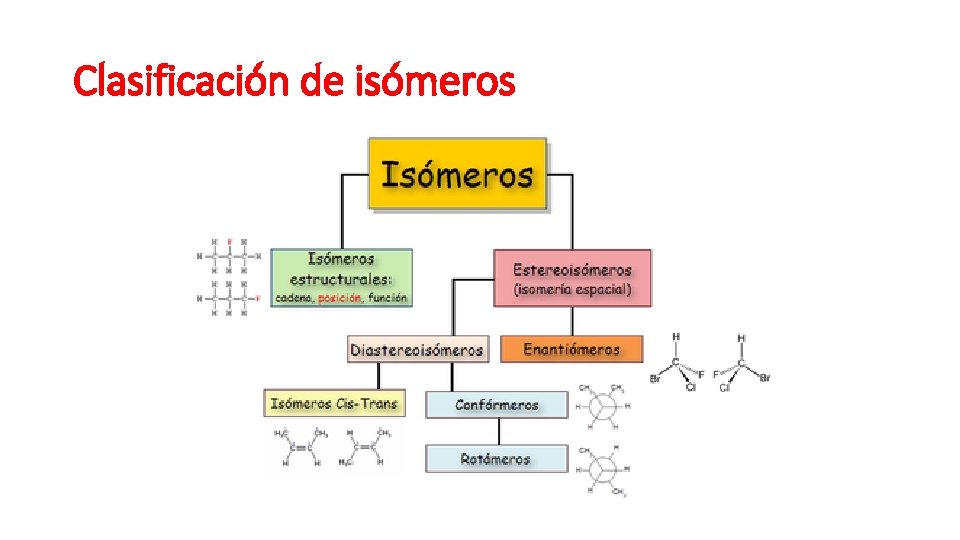
Isomería espacial y estructural • Estructural; Es una forma de isomería, donde las moléculas con la misma fórmula molecular tienen una diferente distribución de los enlaces entre sus átomos, al contrario de lo que ocurre en la estereoisomería. • Espacial; Presentan estereoisomería aquellos compuestos que tienen fórmulas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de la cadena; los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta, o sea, difieren en la orientación espacial de sus átomos.

Isomería en compuestos inorgánicos • En química inorgánica también se presenta isomería, aunque este fenómeno no es tan trascendente como la química orgánica. Las principales formas de isomerismo que se dan en química inorgánica son las siguientes: • Isomería estructural o topológica • Isomería conformacional • Isomería cis-trans (geométrica) • Isomería de posición • Isomería óptica • Isomería de ionización • Isomería de coordinación • Isomería de enlace en un complejo de cobalto • Isomería de enlace • Isomería de polimerización

Clasificación de isómeros
 Air castles by juan f. salazar analysis
Air castles by juan f. salazar analysis Yudy snchez
Yudy snchez Ccplans
Ccplans Diego snchez
Diego snchez Elisa snchez
Elisa snchez Ude
Ude Tsia tsia searching for connection
Tsia tsia searching for connection Ude uke
Ude uke Abz ude
Abz ude Ing
Ing Hisinone uni due
Hisinone uni due Ude
Ude Juan carlos quispe
Juan carlos quispe Biografia de carlos onetti
Biografia de carlos onetti Juan carlos marmolejo
Juan carlos marmolejo Ranjay krishna
Ranjay krishna Carlos juan finlay accomplishments
Carlos juan finlay accomplishments Juan carlos aldave
Juan carlos aldave Lisis terminologia medica
Lisis terminologia medica Em que ano surgiu o futsal
Em que ano surgiu o futsal Juan carlos gualdron alba
Juan carlos gualdron alba Juan carlos rossetti
Juan carlos rossetti Juan carlos olivares rojas
Juan carlos olivares rojas Juan carlos urizar
Juan carlos urizar El cerdito juan carlos onetti
El cerdito juan carlos onetti Futsal 1930
Futsal 1930 Irene santolaya torrego
Irene santolaya torrego Juan carlos garcia salas
Juan carlos garcia salas Juan carlos niebles
Juan carlos niebles Rafael arturo cepeda peña
Rafael arturo cepeda peña Juan carlos passano
Juan carlos passano






















































