Introduccin a la Qumica Orgnica Prof Jos Snchez






- Slides: 31

Introducción a la Química Orgánica Prof. José Sánchez A.

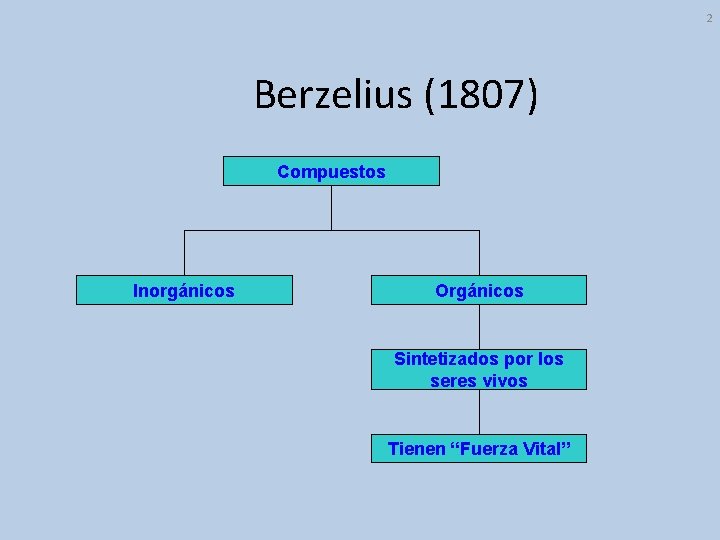
2 Berzelius (1807) Compuestos Inorgánicos Orgánicos Sintetizados por los seres vivos Tienen “Fuerza Vital”

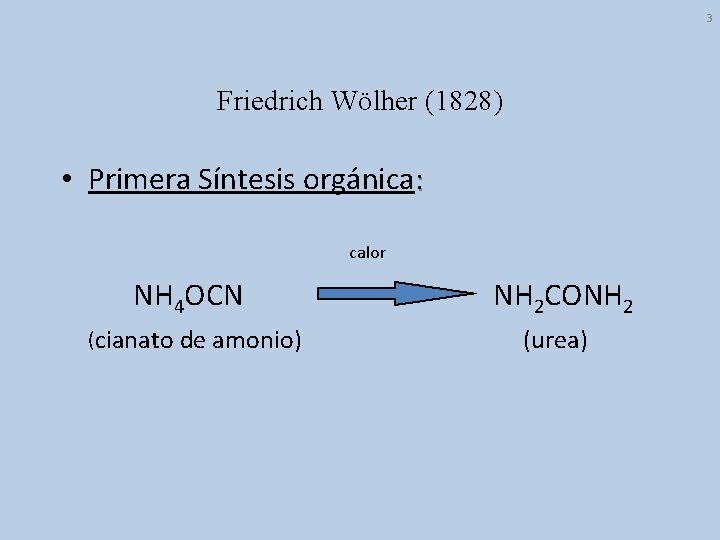
3 Friedrich Wölher (1828) • Primera Síntesis orgánica: calor NH 4 OCN (cianato de amonio) NH 2 CONH 2 (urea)

4 August Kekulé (1861) • QUÍMICA ORGÁNICA: – La Química de los “Compuestos del Carbono”.

5 Química orgánica en la actualidad: • La Química de los “Compuestos del Carbono”. • También tienen hidrógeno. • Se exceptúan CO, CO 2, carbonatos, bicarbonatos, cianuros. . . • Pueden tener otros elementos: O, N, S, P, halógenos. . .

6 Actualidad: • Número de compuestos: – Inorgánicos: – Orgánicos: unos 100. 000 7. 000 (plásticos, insecticidas, jabones, medicamentos, gasolinas, fibras textiles. . . )

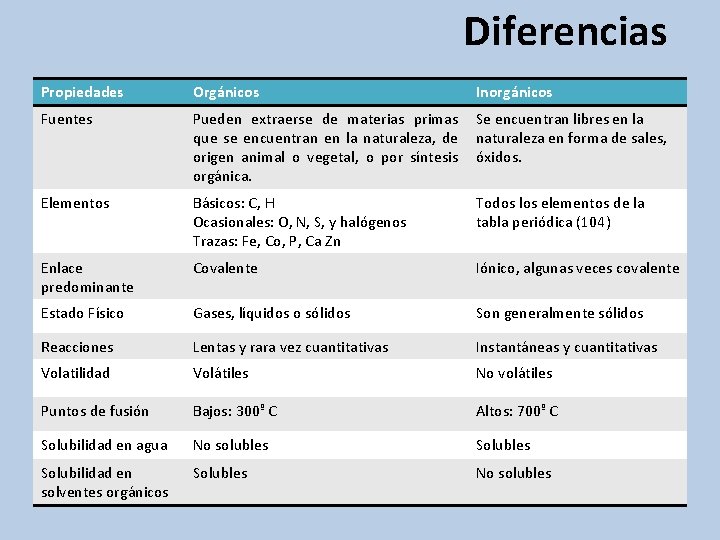
Diferencias Propiedades Orgánicos Inorgánicos Fuentes Pueden extraerse de materias primas que se encuentran en la naturaleza, de origen animal o vegetal, o por síntesis orgánica. Se encuentran libres en la naturaleza en forma de sales, óxidos. Elementos Básicos: C, H Ocasionales: O, N, S, y halógenos Trazas: Fe, Co, P, Ca Zn Todos los elementos de la tabla periódica (104) Enlace predominante Covalente Iónico, algunas veces covalente Estado Físico Gases, líquidos o sólidos Son generalmente sólidos Reacciones Lentas y rara vez cuantitativas Instantáneas y cuantitativas Volatilidad Volátiles No volátiles Puntos de fusión Bajos: 300º C Altos: 700º C Solubilidad en agua No solubles Solubilidad en solventes orgánicos Solubles No solubles

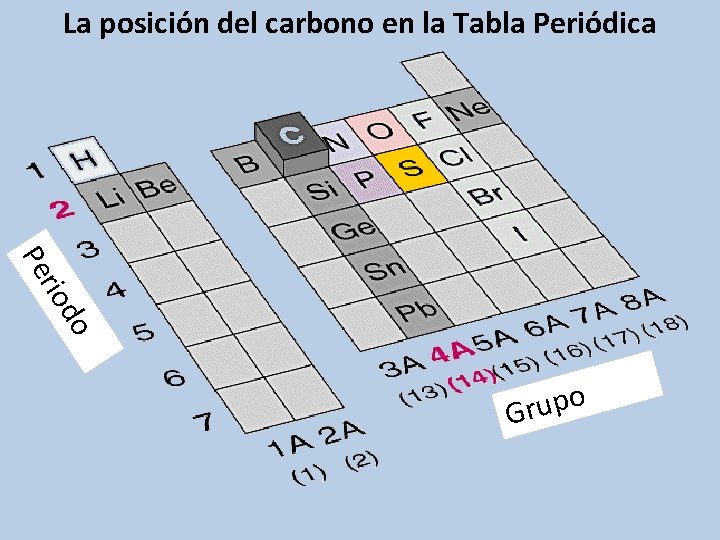
La posición del carbono en la Tabla Periódica do rio Pe o p u r G

Características del Carbono • Electronegatividad intermedia – Enlaza fácilmente tanto con metales como con no metales • Posibilidad de unirse a sí mismo formando cadenas. • Enlaces muy fuertes, se desprenden 830 k. J/mol al formar 2 enlaces C–H • Tamaño pequeño, por lo que es posible que los átomos se aproximen lo suficiente para formar enlaces dobles y triples (esto no es posible en el Silicio). 9

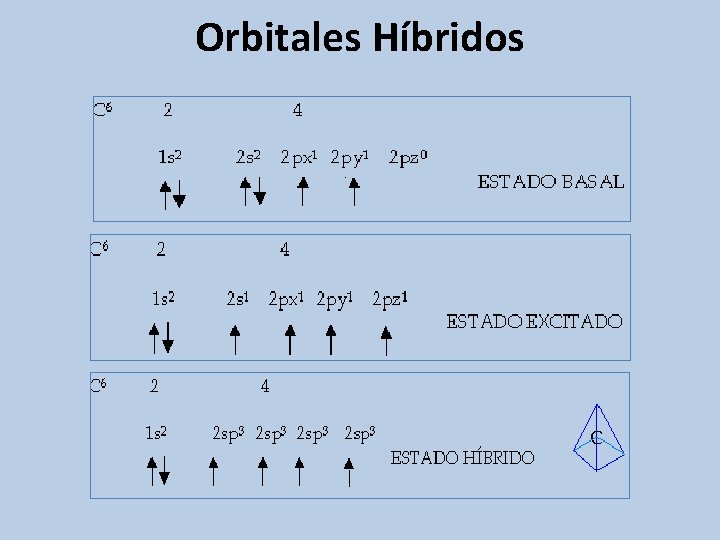
Orbitales Híbridos

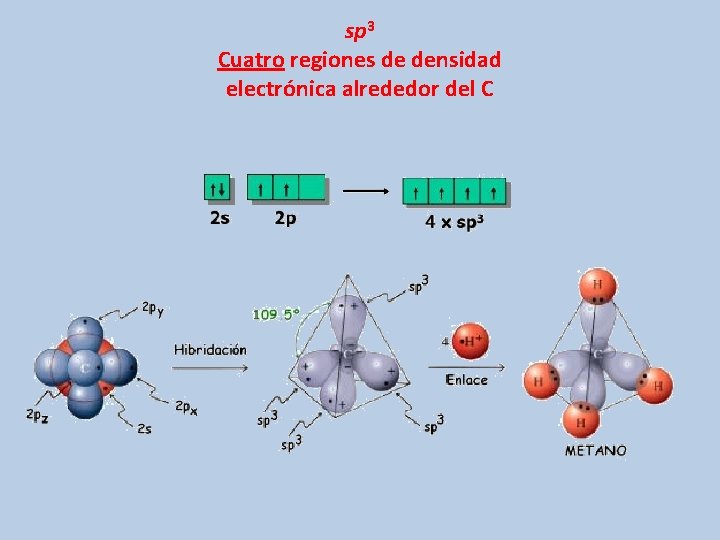
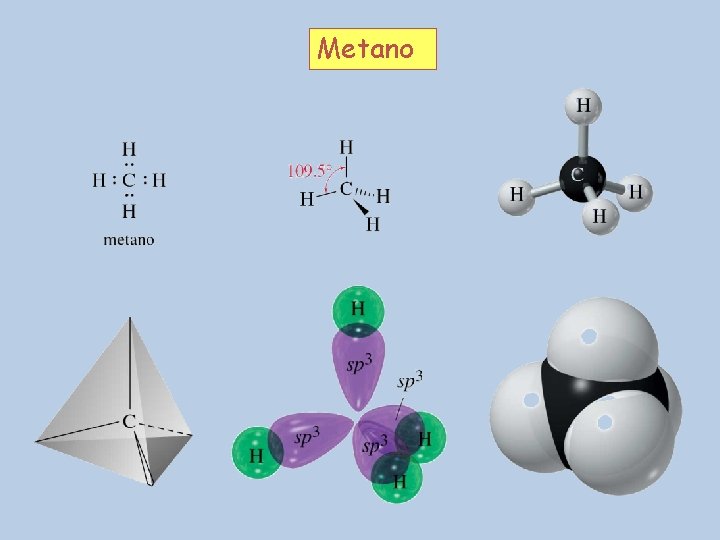
sp 3 Cuatro regiones de densidad electrónica alrededor del C

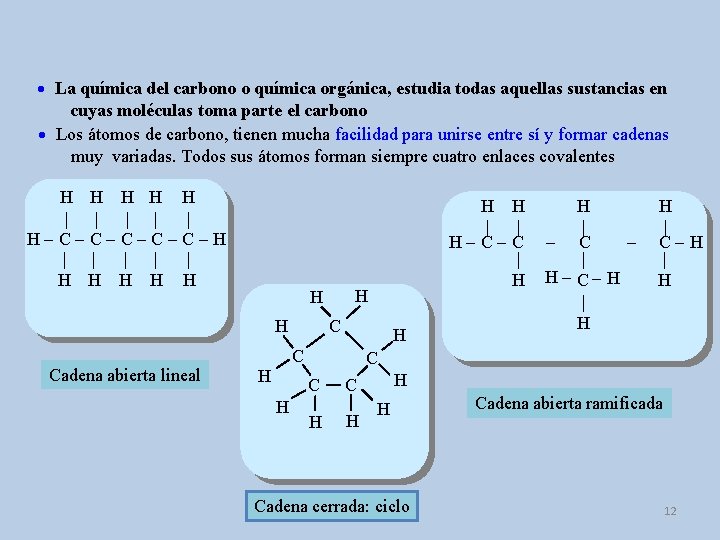
La química del carbono o química orgánica, estudia todas aquellas sustancias en cuyas moléculas toma parte el carbono Los átomos de carbono, tienen mucha facilidad para unirse entre sí y formar cadenas muy variadas. Todos sus átomos forman siempre cuatro enlaces covalentes H H H | | | H-C-C-C-H | | | H H H H Cadena abierta lineal H C H H | - C | H - C- H | H H | C-H | H C C H H H | | H-C-C | H H H Cadena cerrada: ciclo Cadena abierta ramificada 12

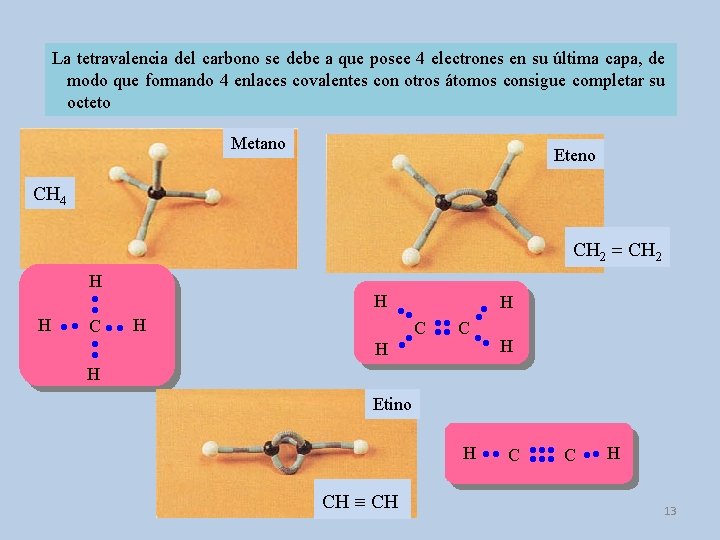
La tetravalencia del carbono se debe a que posee 4 electrones en su última capa, de modo que formando 4 enlaces covalentes con otros átomos consigue completar su octeto Metano Eteno CH 4 CH 2 = CH 2 H H H C C H H C H Etino H C C H CH 13

Metano

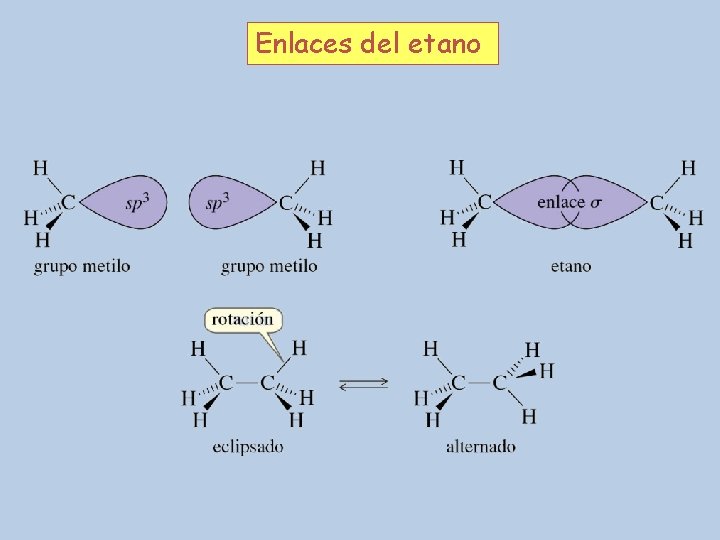
Enlaces del etano

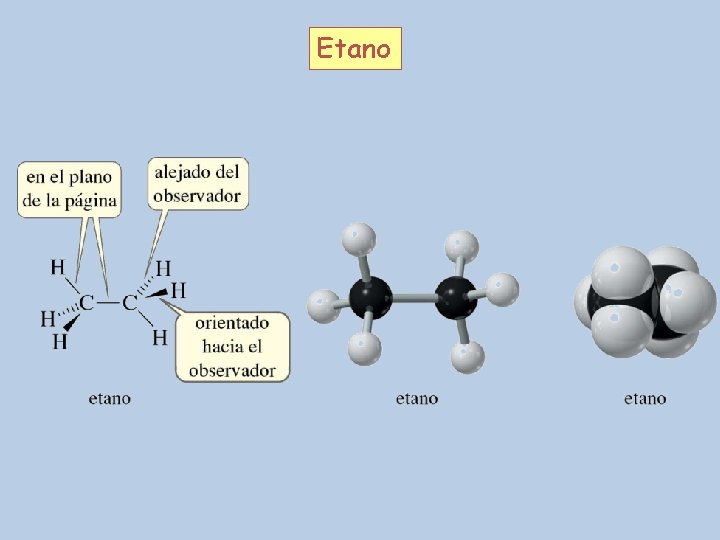
Etano

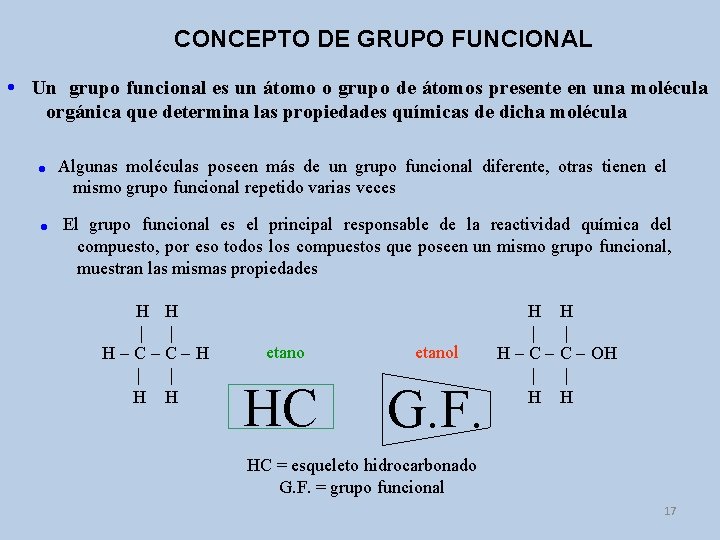
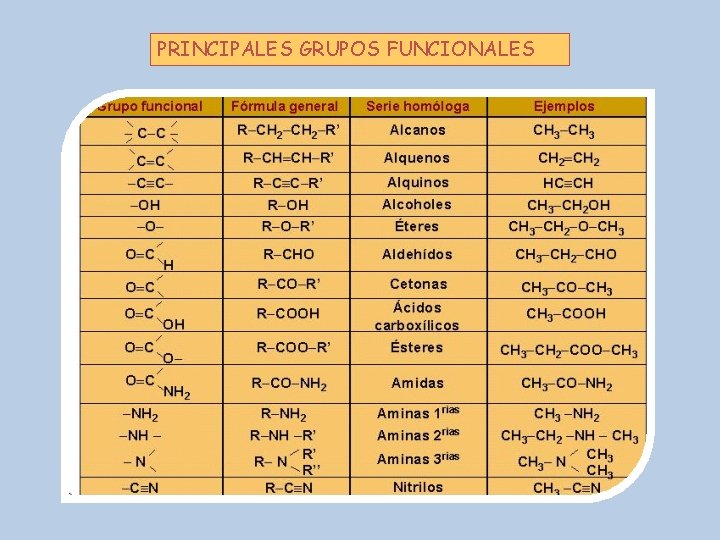
CONCEPTO DE GRUPO FUNCIONAL Un grupo funcional es un átomo o grupo de átomos presente en una molécula orgánica que determina las propiedades químicas de dicha molécula Algunas moléculas poseen más de un grupo funcional diferente, otras tienen el mismo grupo funcional repetido varias veces El grupo funcional es el principal responsable de la reactividad química del compuesto, por eso todos los compuestos que poseen un mismo grupo funcional, muestran las mismas propiedades H H | | H-C-C-H | | H H etanol HC G. F. H H | | H - C - OH | | H H HC = esqueleto hidrocarbonado G. F. = grupo funcional 17

PRINCIPALES GRUPOS FUNCIONALES

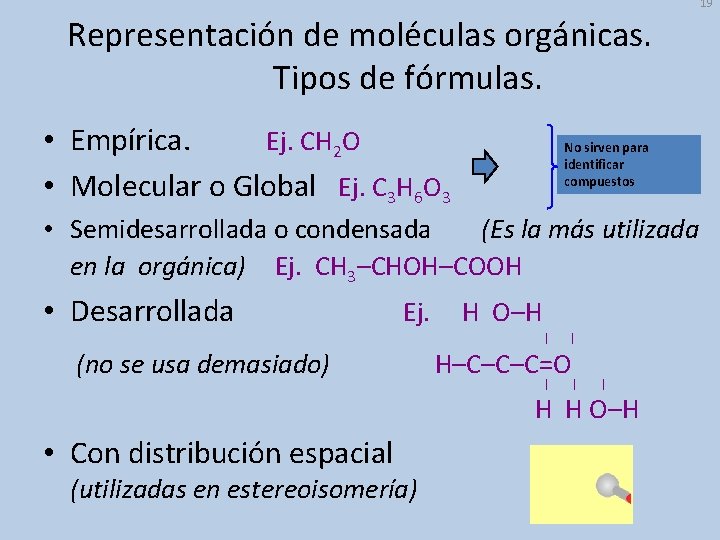
19 Representación de moléculas orgánicas. Tipos de fórmulas. • Empírica. Ej. CH 2 O • Molecular o Global Ej. C 3 H 6 O 3 No sirven para identificar compuestos • Semidesarrollada o condensada (Es la más utilizada en la orgánica) Ej. CH 3–CHOH–COOH • Desarrollada Ej. H O–H (no se usa demasiado) H–C–C–C=O H H O–H • Con distribución espacial (utilizadas en estereoisomería)

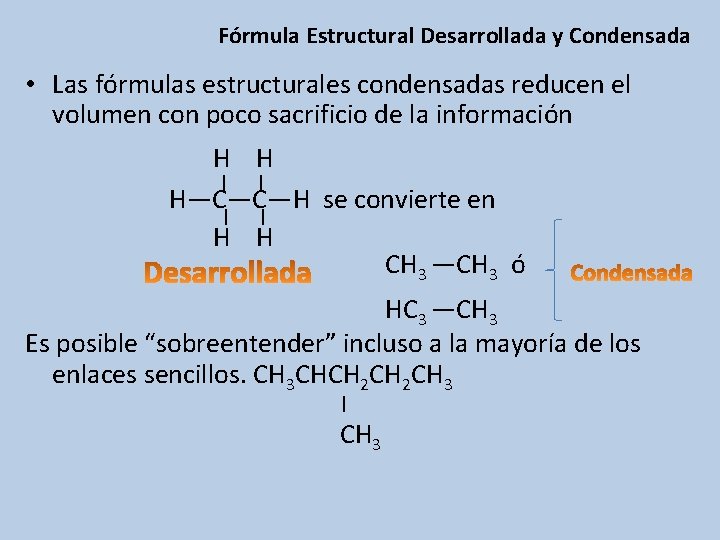
Fórmula Estructural Desarrollada y Condensada • Las fórmulas estructurales condensadas reducen el volumen con poco sacrificio de la información H H | | H—C—C—H se convierte en | | H H CH 3 —CH 3 ó HC 3 —CH 3 Es posible “sobreentender” incluso a la mayoría de los enlaces sencillos. CH 3 CHCH 2 CH 3 | CH 3

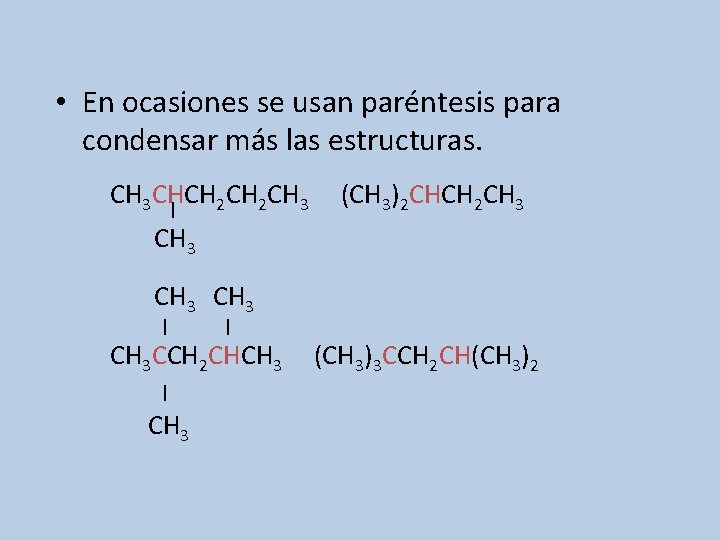
• En ocasiones se usan paréntesis para condensar más las estructuras. CH 3 CHCH 2 CH 3 | (CH 3)2 CHCH 2 CH 3 | | CH 3 CCH 2 CHCH 3 | CH 3 (CH 3)3 CCH 2 CH(CH 3)2

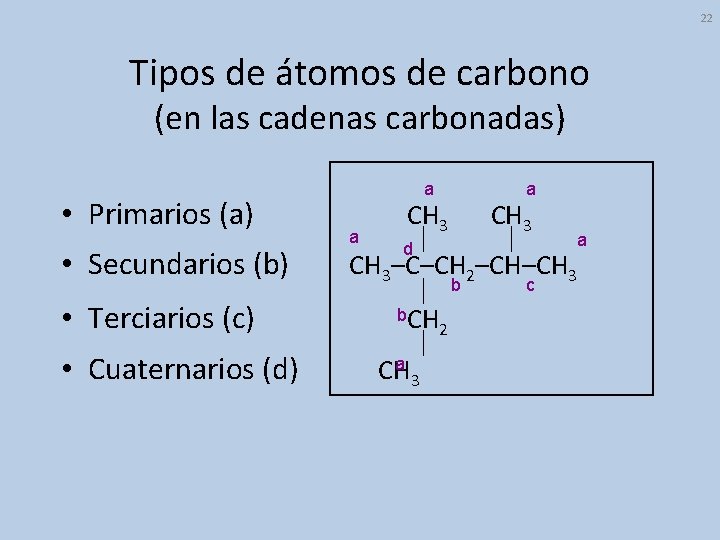
22 Tipos de átomos de carbono (en las cadenas carbonadas) • Primarios (a) • Secundarios (b) • Terciarios (c) • Cuaternarios (d) a a CH 3 a a d CH 3–C–CH 2–CH–CH 3 c b b. CH 2 a CH 3

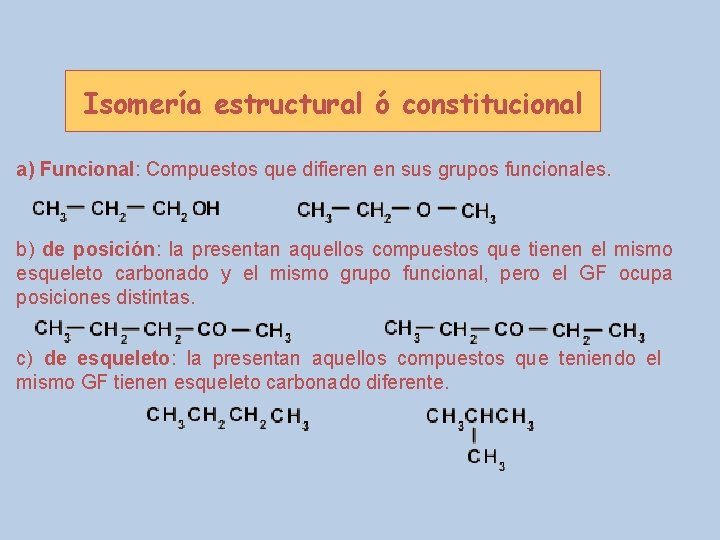
Isomería estructural ó constitucional a) Funcional: Compuestos que difieren en sus grupos funcionales. b) de posición: la presentan aquellos compuestos que tienen el mismo esqueleto carbonado y el mismo grupo funcional, pero el GF ocupa posiciones distintas. c) de esqueleto: la presentan aquellos compuestos que teniendo el mismo GF tienen esqueleto carbonado diferente.

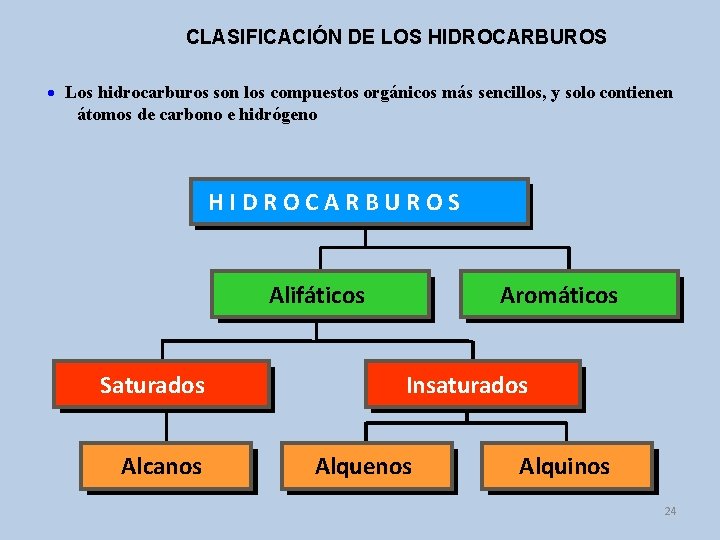
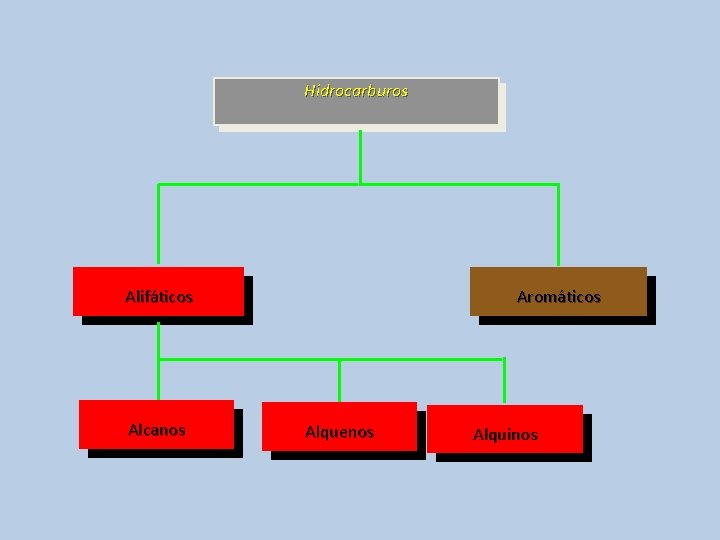
CLASIFICACIÓN DE LOS HIDROCARBUROS Los hidrocarburos son los compuestos orgánicos más sencillos, y solo contienen átomos de carbono e hidrógeno HIDROCARBUROS Alifáticos Saturados Alcanos Aromáticos Insaturados Alquenos Alquinos 24

Hidrocarburos Alifáticos Aromáticos

Hidrocarburos Alifáticos Alcanos Aromáticos Alquenos Alquinos

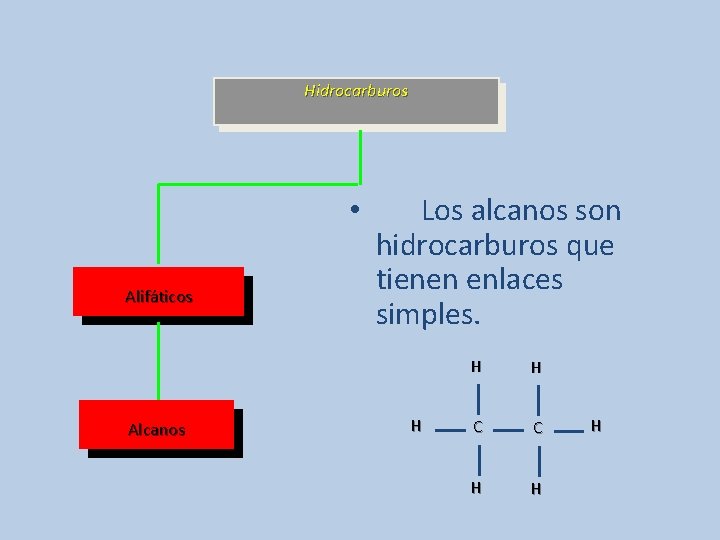
Hidrocarburos • Alifáticos Alcanos Los alcanos son hidrocarburos que tienen enlaces simples. H H H C C H H H

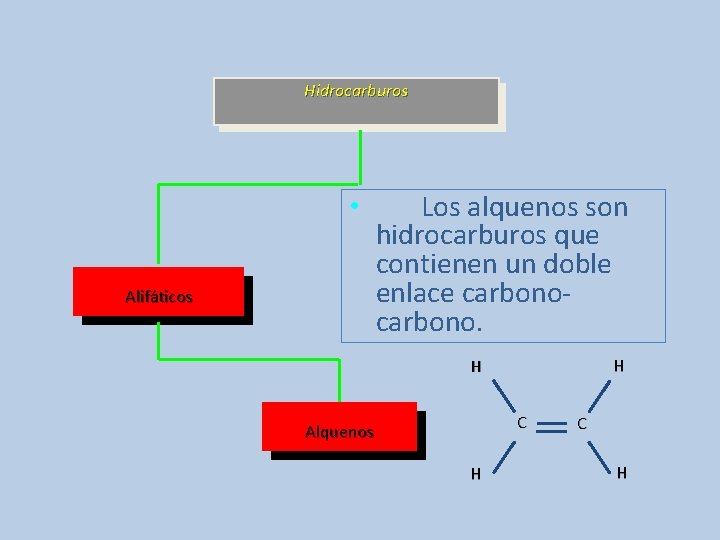
Hidrocarburos • Alifáticos Los alquenos son hidrocarburos que contienen un doble enlace carbono. H H C Alquenos H C H

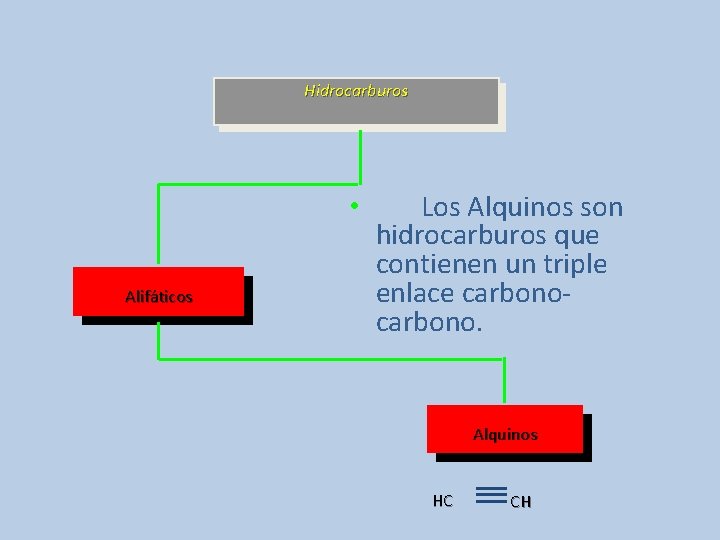
Hidrocarburos • Alifáticos Los Alquinos son hidrocarburos que contienen un triple enlace carbono. Alquinos HC CH

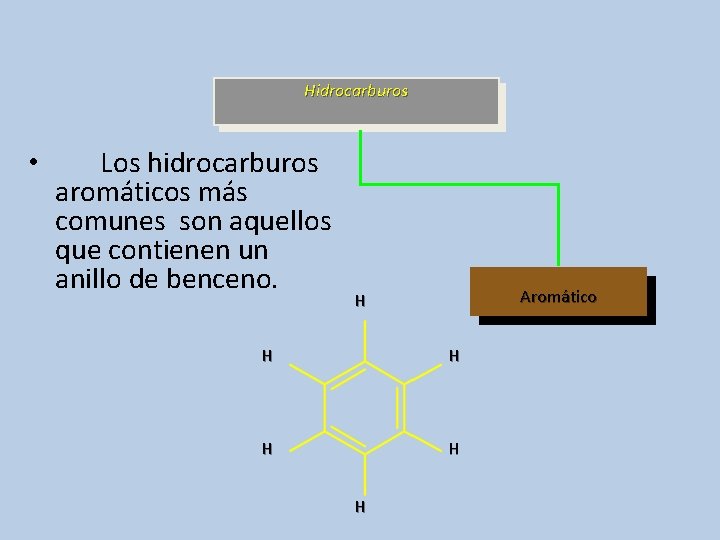
Hidrocarburos • Los hidrocarburos aromáticos más comunes son aquellos que contienen un anillo de benceno. Aromático H H H

ASIGNACIONES • • PRESENTAR UN RESUMEN EJECUTIVO CONFECCIONAR GLOSARIO AUTOCOLLAGE QUIZ 1 – TALLER EN CLASE.
 Yudy snchez
Yudy snchez Elisa snchez
Elisa snchez Mezkalitos
Mezkalitos Elisa snchez
Elisa snchez Introduccin
Introduccin Que diferencia hay entre filosofia y ciencia
Que diferencia hay entre filosofia y ciencia Introducción de las enzimas
Introducción de las enzimas Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Qumica
Qumica Qumica
Qumica Celdas
Celdas Carbono hibridacion
Carbono hibridacion Poluição das águas
Poluição das águas Qumica
Qumica Qumica
Qumica Qumica
Qumica As interações entre os íons produzem aglomerados
As interações entre os íons produzem aglomerados Qumica
Qumica Aplicaciones del cloro
Aplicaciones del cloro Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Qumica
Qumica Qumica
Qumica Reacciones de orden cero
Reacciones de orden cero Como sacar entalpia de reaccion
Como sacar entalpia de reaccion Qumica
Qumica





















































