Qumica dos NoMetais Profa GRAA PORTO Introduo Veremos



















- Slides: 22

Química dos Não-Metais Profa. GRAÇA PORTO

Introdução • • Veremos as propriedades químicas de não metais selecionados e de alguns dos oxiácidos e oxiânions deles derivados. Muitos não metais apresentam diversos números de oxidação diferentes. Alguns comuns estão listados abaixo: N : +5, +4, +3, +2, +1, -3. O : -1, -2. F : -1. P : +5, +3, +1, -3. S : +6, +4, +2, -2. Cl : +7, +5, +3, +1, -1. Br : +5, +1, -1. I : +7, +5, +1, -1.

1. • • 2. • • Dois pontos importantes devem ser observados: Em um composto no qual o não metal apresenta número de oxidação negativo, ele estará presente como Um ânion monoatômico (por exemplo, N 3 - , O 2 -, F-). Uma espécie na qual o não-metal está ligado covalentemente a um elemento menos eletronegativo como hidrogênio (por exemplo, NH 3, H 2 O, HF) Em um composto no qual o não-metal apresenta número de oxidação positivo, ele estará ligado a um elemento mais eletronegativo, como oxigênio. Assim, Nitrogênio possui número de oxidação +5 na molécula HNO 3 e no íon NO 3 -; em ambas as espécies, o átomo de nitrogênio está ligado a três átomos de oxigênio. Enxofre possui número de oxidação +6 na molécula H 2 SO 4 e no íon SO 42 -; em ambos os casos, o átomo de enxofre está ligado a quatro átomos de oxigênio.

Oxigênio e Flúor • • • A química redox do oxigênio é relativamente simples. Ele apresenta apenas três números de oxidação comuns: -2, 1 e 0. Na maioria dos seus compostos estáveis, o oxigênio apresenta número de oxidação – 2. Este é o caso, por exemplo, de Molécula de água (H 2 O) Íon óxido (O 2 -) e íon hidróxido (OH-) Moléculas de oxiácidos (HCl. O 4, HNO 3, H 2 SO 4 etc. ) Oxiânions (Cl. O 4 -, NO 3 -, HSO 4 -, SO 42 - etc. ) Flúor apresenta apenas um número de oxidação em seus compostos: -1. É o caso de Moléculas de fluoretos não-metálicos, como HF, CF 4 e SF 6. Íon F-, encontrado em compostos como Na. F e Sn. F 2.

Os íons fluoreto são comumente usados em programas de prevenção de cárie dentária. O esmalte externo dos dentes é, principalmente, hidroxiapatita, Ca 5(PO 4)3(OH). O íon OHtorna este composto mais suscetível aos ácidos orgânicos formados na boca pela fermentação do açúcar. A exposição a íons F- converte parte da hidroxiapatita a fluoroapatita, Ca 5(PO 4)3 F. Ela é mais resistente a ácido. A fonte de íons fluoreto pode ser Sn. F 2 (fluoreto estanoso) no creme dental ou Na. F, adicionado a água potável o nível de i ppm. Os elementos: F 2, O 2 e O 3 Flúor (E 0 red = +2, 87 V) é um agente oxidante tão poderoso que não pode ser preparado ou usado em solução aquosa: F 2(g) + H 2 O(l) 2 F-(aq) + ½ O 2(g) + 2 H+(aq) E 0 tot = E 0 red F 2 + E 0 ox H 2 O = +2, 87 V – 1, 23 V = +1, 64 V Oxigênio diatômico, O 2, é um forte agente oxidante em solução ácida: ½ O 2(g) + 2 H+(aq) + 2 e. H 2 O; E 0 red = +1, 23 V Como aparecem íons H+ como agentes nesta meia-equação, o poder oxidante do O 2 decresce com o aumento do p. H. Em solução básica, a voltagem de redução padrão é bem menor:

½ O 2(g) + H 2 O + 2 e- • • 2 OH-(aq); E 0 red= +0, 40 V Entre todos os agentes oxidantes, o oxigênio elementar é o mais abundante e o mais importante. Sua presença no ar faz com que todas as apresentações da água estejam normalmente saturadas com oxigênio atmosférico. Freqüentemente esquecemos este fato e ficamos surpreendidos com fenômenos como A formação de precipitados brancos ou amarelos quando sulfeto de hidrogênio é usado em análise qualitativa ½ O 2(g) + H 2 S S(s) + H 2 O A cor amarela que soluções de Na. I ou KI adquirem após algum tempo de estocagem: ½ O 2(g) + 2 I-(aq) + 2 H+(aq) I 2(aq) + H 20 Ao lado do flúor, o ozônio, é talvez o mais forte de todos os agentes oxidantes: O 3(g) + 2 H+(aq) + 2 e. O 2(g) + H 2 O; E 0 red= +2, 07 V

O ozônio é freqüentemente usado como substituto para o cloro no tratamento de águas para a população. Uma mistura de 2% de O 3 na água é mais efetiva do que Cl 2 na oxidação de bactérias e outros poluentes. Mais importante ainda, os produtos resultantes da oxidação por ozônio são menos perigosos; o cloro pode reagir compostos orgânicos na água, formando substâncias supostamente cancerígenas, como CHCl 3. Por outro lado, o ozônio é mais caro do que o cloro. Ele também é decomposto mais rapidamente, de modo que oferece pouca ou nenhuma proteção contra bactérias que entrem no suprimento de água após tratamento. Peróxido de hidrogênio O peróxido de hidrogênio, H 2 O 2 tem a seguinte estrutura de Lewis: H. . O O. . H Há uma ligação O - O na molécula.

Peróxido de hidrogênio pode atuar como forte agente oxidante. Neste caso ele é reduzido a H 2 O. Por outro lado, H 2 O 2 pode atuar como um fraco agente redutor, sendo oxidado a O 2. Peróxido de hidrogênio tende a se decompor em água, o que explica por que suas soluções rapidamente perdem o poder oxidante. A reação envolvida é desproporcionamento: H 2 O 2(aq) + 2 H+(aq) + 2 e. E 0 red= +1, 77 V H 2 O 2(aq) O 2(g) + 2 H+(aq) + 2 e. E 0 ox = -0, 68 V 2 H 2 O 2(aq) O 2(g) + 2 H 2 O

Oxiácidos e oxiânions dos não-metais 1. Estaremos tratando com espécies nas quais o não-metal apresenta um número de oxidação positiva. Muitas dessas espécies são oxiânions, ânions poliatômicos nos quais o átomo não metálico está ligado a um ou mais átomos de oxigênio. Outras são os oxiácidos, nos quais os átomos de hidrogênio estão ligados a um ou mais átomos de oxigênio de oxiânion. Nomenclatura: Quando o não-metal forma dois oxiânions, o sufixo-ato é usado para o ânion no qual o não-metal está no maior estado de oxidação. O sufixo-ito é usado para o ânion no qual o não-metal está no menor estado de oxidação: SO 42 sulfato nº. oxid. S = +6 SO 32 sulfito nº. oxid. S = +4

2. 3. Quando o não-metal forma mais de dois oxiânions, são usados os prefixos per- (mais alto estado de oxidação) e hipo- (mais baixo estado de oxidação): Cl. O 4 perclorato nº oxid. Cl = +7 Cl. O 3 clorato nº oxid. Cl = +5 Cl. O 2 clorito nº oxid. Cl = +3 Cl. Ohipoclorito nº oxid. Cl = +1 O nome de um oxiácido está diretamente relacionado com o ânion correspondente. O sufixo –ato é substituído por ico; -ito é substituído por –oso: HCl. O 4 ácido perclórico H 2 SO 4 ácido sulfúrico HCl. O 3 ácido clórico H 2 SO 3 ácido sulfuroso HCl. O 2 ácido cloroso HCl. O ácido hipocloroso

1. 2. 1. 2. Acidez Generalizando, podemos dizer que: A acidez aumenta com o aumento da eletronegatividade do átomo não -metálico central. A acidez aumenta com o aumento do número de oxidação do átomo não -metálico central. Este comportamento quanto à acidez pode ser relacionado com a estrutura molecular. Numa molécula dé oxiácido, o átomo de hidrogênio que dissocia está ligado ao oxigênio, e está ligado a um átomo não-metálico X. Poderíamos representar a estrutura de um oxiácido como H-O-X, e sua dissociação em água como: H – O – X (aq) H+ + XO- (aq) Para que um próton, com sua carga +1, seja separado da molécula, a densidade eletrônica em torna do oxigênio deve ser menor possível, esta decresce quando: X é um átomo fortemente eletronegativo, como Cl. Estes átomos atraem elétrons do oxigênio e tornam o ácido hipocloroso mais forte do que o hipoiodoso. Átomos adicionais de oxigênio, fortemente eletronegativos, são ligados a X. Eles tendem a atrair elétrons do átomo de oxigênio que está ligado ao H. Assim, é de se esperar que a facilidade de dissociação de um próton e portanto, Ka aumentem na seuinte ordem; da esquerda para a direita:

O X – O – H O – X – O - H O +1 1. 2. +3 O – X – O – H O +5 +7 Propriedades oxidantes e redutoras Alguns princípios gerais: Uma espécie na qual o não-metal está em seu mais alto estado de oxidação pode apenas atuar como agente oxidante, e nunca como agente redutor. Do mesmo modo, espécies nas quais o não-metal está em seu mais baixo estado de oxidação podem apenas atuar como agentes de redução. Uma espécie na qual o não-metal está em um estado intermediário de oxidação pode atuar como agente oxidante ou como agente redutor. Em geral, uma espécie em um estado intermediário de oxidação tende a desproporcionar se o somatório E 0 ox + E 0 red é um número positivo (E 0 tot > 0)

3. 4. O poder oxidante de um oxiânion está diretamente relacionado com a concentração de íons H+ (inversamente relacionado com o p. H). Cl. O 3 -(aq) + 6 H+(aq) + 6 e. Cl-(aq) + 3 H 2 O Como H+ é um reagente, uma diminuição em sua concentração deve tornar a meia-reação menos espontânea. O poder redutor de um oxiânion está inversamente relacionado com a concentração de íon H+ (diretamente relacionado com o p. H). Cl. O 3 -(aq) + H 2 O Cl. O 4 -(aq) + 2 H+(aq) + 6 e. Neste caso, H+ é um produto. A diminuição da sua concentração deve tornar a reação mais espontânea a aumentar a voltagem.

Cloro (bromo, iodo) Os elementos cloro, bromo e iodo podem atuar como agentes oxidantes em solução aquosa, sendo reduzidos a íons halogeneto: Cl 2(g 0 + 2 e 2 Cl-(aq) E 0 red= +1, 36 V Br 2(l) + 2 e 2 Br-(aq) E 0 red= +1, 07 V I 2(S) + 2 e 2 I-(aq) E 0 red= +0, 53 V A capacidade do cloro para oxidar bactérias é utilizada sob forma de cloração no tratamento de águas. Iodo, em solução alcoólica, é utilizada como antisséptico oxidante suave. Como o cloro é um agente oxidante mais forte do que bromo ou iodo, pode ser usado para preparar estes elementos por oxidação dos seus ânions, Br- e I-: A adição de cloro a uma solução que contenha qualquer um desses íons dá o halogênio livre, Br 2 ou I 2. Após a adição de cloro, a solução é extraída por um solvente orgânico.

Oxiânions e oxiácidos halogênios Em todos os oxiácidos do cloro o átomo de hidrogênio está ligado ao oxigênio, em vez de cloro. Isto é, de um modo geral; apenas os átomos de hidrogênio ligados ao oxigênio dissociam-se formando íons H+ em água. Os halogênios e todos seus oxiácidos e oxiãnions são agentes oxidantes relativamente fortes. Para oxiácidos e oxiânions, isto é verdade em solução ácida. Ácido hipocloroso e íon hipoclorito Quando coro é adicionado a água, ele sofre a seguite reação reversível: Cl 2(g) + H 2 O HCl. O(aq) + H+(aq)+ Cl- (aq) A solução resultante é denominada “água de cloro”. Ela contém quantidades eqüimolares do ácido fraco HCl. O e do ácido forte HCl. O cloro é muito mais solúvel em solução básica do que em água pura. A reação que ocorre quando o cloro é borbulhado em uma solução de hidróxido de sódio a temperatura ambiente, é: Cl 2(g) + 2 OH-(aq) Cl. O-(aq) + Cl- (aq) + H 2 O A solução formada é comercializada como água sanitária para uso doméstico e como desinfetante.

Cloratos e percloratos Clorato de potássio é um poderoso agente oxidante em solução ácida. Ele reage violentamente com materiais facilmente oxidados, incluindo muitos compostos orgânicos, e pode ser usado como fonte de oxigênio em laboratório, se for aquecido de modo brando com Mn. O 2 como catalisador.

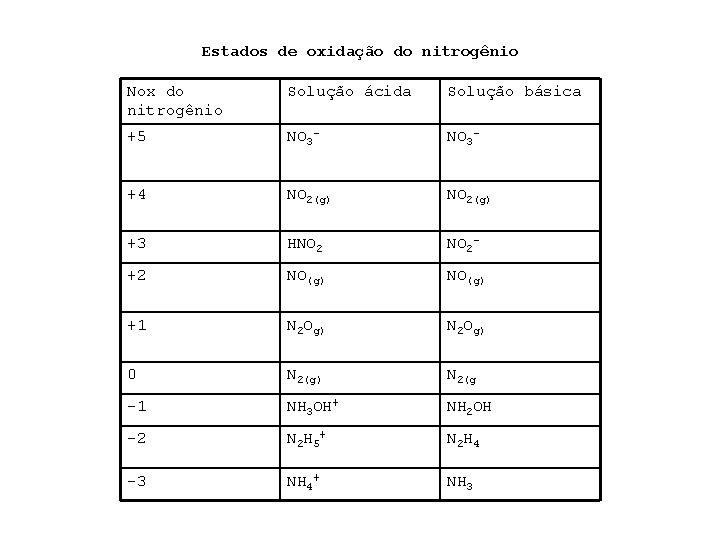
nitrogênio • • O nitrogênio pode assumir todos os números de oxidação possíveis entre +5 e – 3. Analisando o diagrama de potencial padrão para espécies nitrogenadas e comparando com o análogo para o cloro, temos: 1)Em vários estados de oxidação, a espécie nitrogenada estável é um óxido, como NO ou NO 2, em vez do oxiânion ou oxiácido. Há apenas dois oxiânions comuns de nitrogênio, NO 3 - e NO 2 -. 2) os valores de Ered 0 para espécies nitrogenadas são um pouco menores o que os do cloro. Por exemplo, o íon NO 3 possui um valor de Ered 0 um pouco menor o que o do íon Cl. O 3 -, o quer dizer que ele é um agente oxidante um tanto mais fraco. Na prática, isso é uma vantagem e não uma desvantagem. Nitratos são bem mais seguros para serem manuseados do que os cloratos(ou percloratos ou hipocloritos).

Estados de oxidação do nitrogênio Nox do nitrogênio Solução ácida Solução básica +5 NO 3 - +4 NO 2(g) +3 HNO 2 - +2 NO(g) +1 N 2 Og) 0 N 2(g) N 2(g -1 NH 3 OH+ NH 2 OH -2 N 2 H 5 + N 2 H 4 -3 NH 4+ NH 3

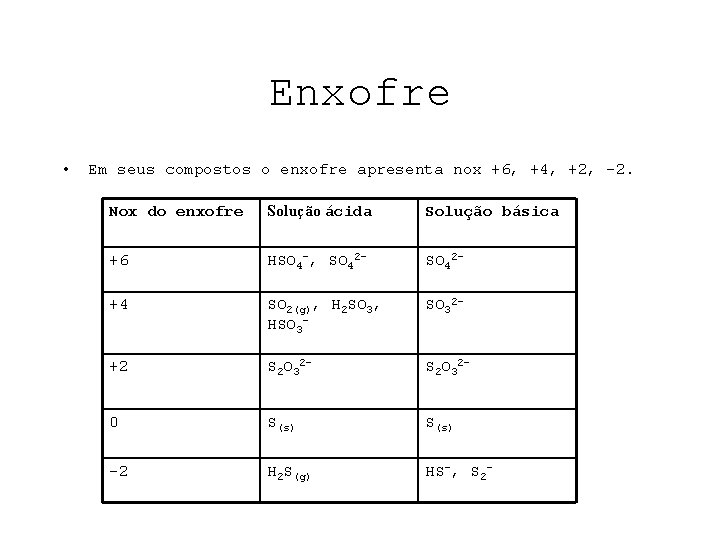
Enxofre • Em seus compostos o enxofre apresenta nox +6, +4, +2, -2. Nox do enxofre Solução ácida Solução básica +6 HSO 4 -, SO 42 - +4 SO 2(g), H 2 SO 3, HSO 3 - SO 32 - +2 S 2 O 32 - 0 S(s) -2 H 2 S(g) HS-, S 2 -

• Note também que, para o enxofre: 1) espécies do estado +6 ( HSO 4 -, SO 42 -) podem atuar apenas como agentes oxidantes, e nunca como agentes redutores, em reações redox. 2)espécies no estado +4 ( SO 2(g, H 2 SO 3, HSO 32 - ), no estado +2 ( S 2 O 32 -, S 2 O 32 - )ou no estado 0 podem atuar como agentes oxidantes ou como agentes redutores. HS-, S 2 - )podem atuar apenas como agentes redutores, e nunca como agentes oxidantes, em reações redox. 3)espécies no estado – 2 ( H 2 S(g)

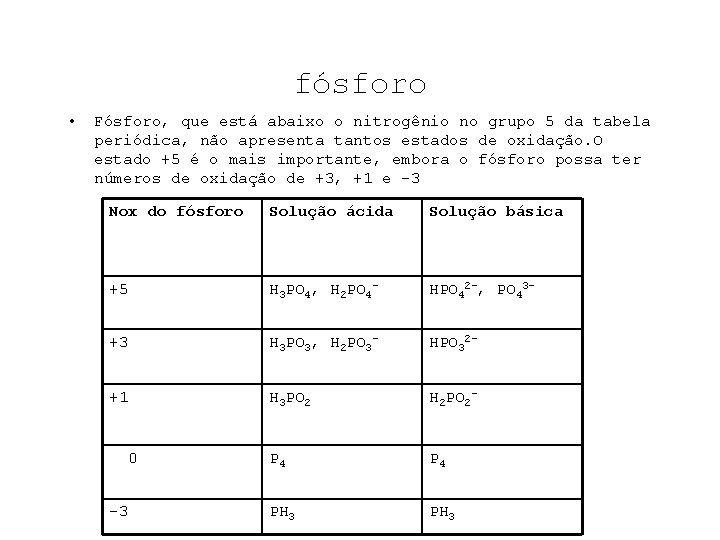
fósforo • Fósforo, que está abaixo o nitrogênio no grupo 5 da tabela periódica, não apresenta tantos estados de oxidação. O estado +5 é o mais importante, embora o fósforo possa ter números de oxidação de +3, +1 e -3 Nox do fósforo Solução ácida Solução básica +5 H 3 PO 4, H 2 PO 4 - HPO 42 -, PO 43 - +3 H 3 PO 3, H 2 PO 3 - HPO 32 - +1 H 3 PO 2 H 2 PO 2 - P 4 PH 3 0 -3

Aplicações do ácido fosfórico e seus sais no cotidiano • • • Sais de ácido fosfórico apresentam diversos usos. Diirogenofosato de cálcio, Ca(H 2 PO 4)2 é o principal componente da maioria dos fertilizantes. Ele é solúvel em água e fornece o fósforo necessário para o crescimento das plantas. Fosfato de sódio, Na 3 PO 4, é utilizado em limpadores multiuso porque sua solução aquosa é fortemente básica. Em épocas passadas os os fosfatos eram encontrados na maioria os detergentes. Esta aplicação tem sido restringia porque os fosfatos promovem o crescimento das algas que podem poluir rios e lagos. O principal uso do ácido fosfórico é na fabricação de fertilizantes como o Ca(H 2 PO 4)2 Menores quantidades de H 3 PO 4 são usadas como flavorizantes em refrigerantes à base de cola.
 Slidetodoc.com
Slidetodoc.com Foi graa
Foi graa No céu veremos a trindade
No céu veremos a trindade Transforma a nossa oferta no dom do filho teu
Transforma a nossa oferta no dom do filho teu Internet profa
Internet profa 7 saberes de edgar morin
7 saberes de edgar morin Internet profa
Internet profa Basta de multiplicaciones
Basta de multiplicaciones Www.profa
Www.profa Profa campis
Profa campis Moléculas polares e apolares exemplos
Moléculas polares e apolares exemplos Qumica
Qumica Qumica
Qumica Qumica
Qumica Atomos de carbono
Atomos de carbono Qumica
Qumica Celdas
Celdas Escriba la formula de los siguientes compuestos
Escriba la formula de los siguientes compuestos Epimeros
Epimeros Como se nombran los eteres
Como se nombran los eteres Qumica
Qumica Qumica
Qumica Qumica
Qumica









































