Profa Graa Porto Entre vrios tipos de reaes






























![H I H 3 C – OH I H [O] OH I H 3 H I H 3 C – OH I H [O] OH I H 3](https://slidetodoc.com/presentation_image_h/b2567adb39ef3d5d54b16dada09badd2/image-44.jpg)




- Slides: 52

Profa. Graça Porto

Entre vários tipos de reações É quando um átomo ou grupo de átomos é podemos destacar as de substituído por um radical do outro reagente SUBSTITUIÇÃO, ADIÇÃO H H e LUZ H C H H + Cl ELIMINAÇÃO H C Cl H Cl + H Cl

É quando duas ou mais moléculas reagentes formam uma única como produto H H C C Cl Cl CCl 4 H C C H + Cl Cl H H

É quando de uma molécula são retirados dois átomos ou dois grupos de átomos sem que sejam substituídos por outros H H OH C C H H H+ H H C C H + H 2 O

Entre os compostos orgânicos que sofrem reações de substituição destacam-se os alcanos, o benzeno e seus derivados, os haletos de alquila, álcoois e ácidos carboxílicos

É quando substituímos um ou mais átomos de hidrogênio de um alcano por átomos dos halogênios H H LUZ H C H H + Cl Cl H Cl + H Cl

Podemos realizar a substituição dos demais átomos de hidrogênio sucessivamente, resultando nos compostos CH 4 + 2 Cl 2 H 2 CCl 2 + 2 HCl CH 4 + 3 Cl 2 HCCl 3 + 3 HCl CH 4 + 4 Cl 2 CCl 4 + 4 HCl

A reatividade depende do carbono onde ele se encontra; a Nos alcanos de cadeias maiores, teremos vários átomos preferência de substituição segue a de hidrogênios possíveis de serem substituídos seguinte ordem: C terciário > C secundário > C primário H I CH 3 – CH 3 + Cl 2 I CH 3 LUZ Cl I CH 3 – CH 3 + H – Cl I CH 3 produto principal

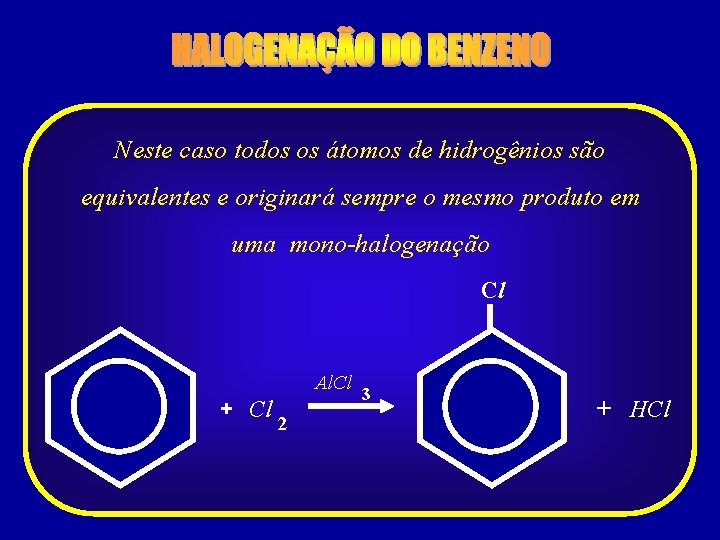
Neste caso todos os átomos de hidrogênios são equivalentes e originará sempre o mesmo produto em uma mono-halogenação Cl Al. Cl + Cl 2 3 + HCl

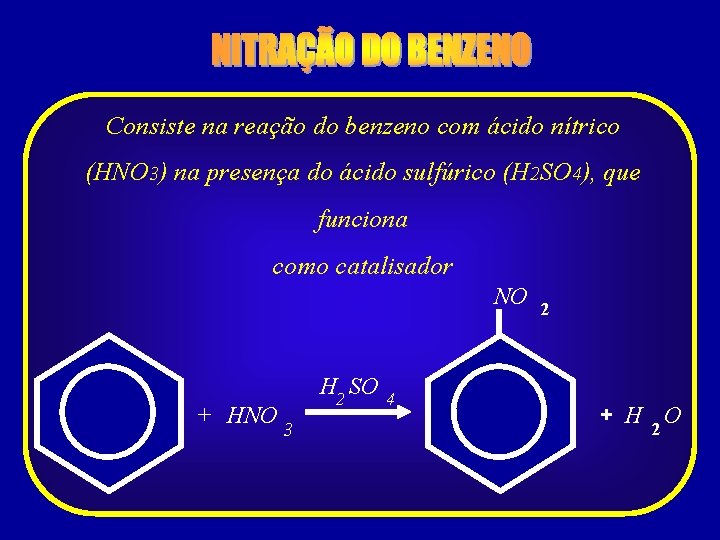
Consiste na reação do benzeno com ácido nítrico (HNO 3) na presença do ácido sulfúrico (H 2 SO 4), que funciona como catalisador NO + HNO H 2 SO 3 4 2 + H O 2

Consiste na reação do benzeno com o ácido sulfúrico concentrado e a quente SO 3 H + H 2 SO 4 4 + H O 2

Consiste na reação do benzeno com haletos de alquila na presença de ácidos de Lewis CH 3 Al. Cl + CH Cl 3 3 + HCl

01) No 3 – metil pentano, cuja estrutura está representada a seguir: 1 H 3 C 2 CH 3 4 CH 2 6 CH CH 5 2 CH 3 O hidrogênio mais facilmente substituível por halogênio está situado no carbono de número: a) 1. b) 2. c) 3. d) 4. e) 6. 3

02) Fenol (C 6 H 5 OH) é encontrado na urina de pessoas expostas a ambientes poluídos por benzeno (C 6 H 6). Na transformação do benzeno em fenol ocorre a) b) c) d) e) substituição no anel aromático. quebra na cadeia carbônica. rearranjo no anel aromático. formação de ciclano. polimerização. OH FENOL BENZENO +. . .

03) Considere a reação de substituição do butano: BUTANO + Cl LUZ 2 X + ORG NICO Y INORG NICO O nome do composto X é: a) b) c) d) e) cloreto de hidrogênio. 1 -cloro butano. 2 -cloro butano. 1, 1 -cloro butano. 2, 2 -dicloro butano. CH 3 – CH 2 – CH 3 + Cl 2 carbono secundário é mais reativo que carbono primário 2 – cloro butano LUZ 1 2 3 CH 3 – CH 2 – CH 3 Cl + HCl 4

Assim teremos: ORIENTADORES ORTO META – PARA DESATIVANTES ( ATIVANTES ) ) observadas reações( de substituição Todas as A velocidade da reação e o produto obtido – OH com ocorrem seus – COOH – NO 2 benzeno – SOtambém 3 H – CN com dependem do radical presente no benzeno – NH 2 derivados, porém diferem na velocidade de Os orientadores META possuem um átomo que orientam a entrada dos substituintes – CH 3 ocorrência e nos produtos obtidos com ligação dupla ou tripla ligado ao – Cl – Br –I benzeno ( desativantes )

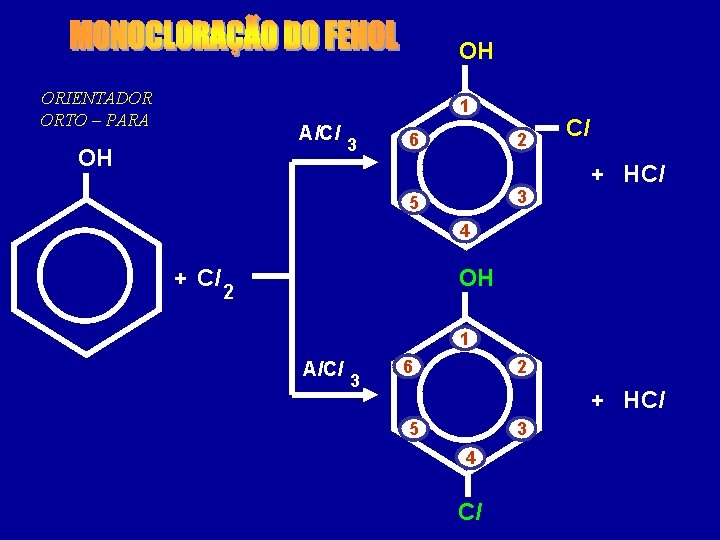
OH ORIENTADOR ORTO – PARA 1 Al. Cl OH 3 6 2 Cl + HCl 3 5 4 + Cl OH 2 1 Al. Cl 3 6 2 + HCl 5 3 4 Cl

o grupo “nitro” é orientador meta NO 2 1 Al. Cl 2 6 + Cl 5 3 4 2 3 + Cl HCl

01) (UNICAP-98) O clorobenzeno, ao reagir por substituição eletrofílica com: V 0 0 HNO 3, em presença de H 2 SO 4, produz 2 -nitroclorobenzeno. F 1 1 Cl 2, em presença de Fe. Cl 3, produz preferencialmente metadiclorobenzeno V 2 2 CH 3 Cl, em presença de Al. Cl 3, produz 4 -metilclorobenzeno. V 3 3 H 2 SO 4, em presença de SO 3, produz 2 -hidrogenosulfato de clorobenzeno. F 4 4 Br 2, produz preferencialmente, em presença de Fe. Cl 3 3 -bromo, cloro benzeno. Cl 1 6 2 3 5 4 o “cloro” é orientador orto-para e desativante

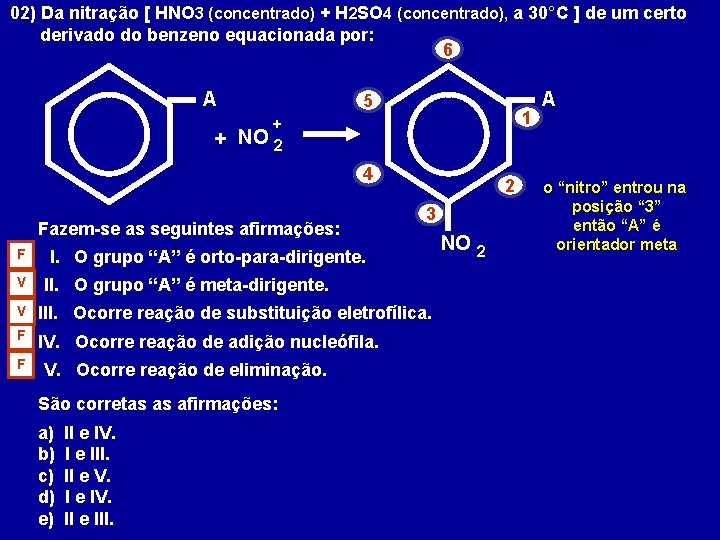
02) Da nitração [ HNO 3 (concentrado) + H 2 SO 4 (concentrado), a 30°C ] de um certo derivado do benzeno equacionada por: 6 A + NO 5 1 + 2 4 Fazem-se as seguintes afirmações: F V 2 3 I. O grupo “A” é orto-para-dirigente. II. O grupo “A” é meta-dirigente. V III. Ocorre reação de substituição eletrofílica. F IV. Ocorre reação de adição nucleófila. F V. Ocorre reação de eliminação. São corretas as afirmações: a) b) c) d) e) II e IV. I e III. II e V. I e IV. II e III. NO 2 A o “nitro” entrou na posição “ 3” então “A” é orientador meta

Os haletos de hidrogênio As reações adição mais importantes reagemde com os alcenos produzindo haletos de alquil ocorrem nos alcenos, nos alcinos, H Hem aldeídos e I I H – C = C – H + H – Cl H nas cetonas I CCl 4 H I H–C – H I I H Cl

Neste caso, Paradevemos alcenoslevar em consideração com três ou mais átomosade carbono REGRA DE MARKOVNIKOV que diz: a adição do haleto de alquil produzirá dois compostos, + “O hidrogênio (H ) é adicionado sendo um deles em maior proporção ao carbono da dupla ligação (produto principal) mais hidrogenado”

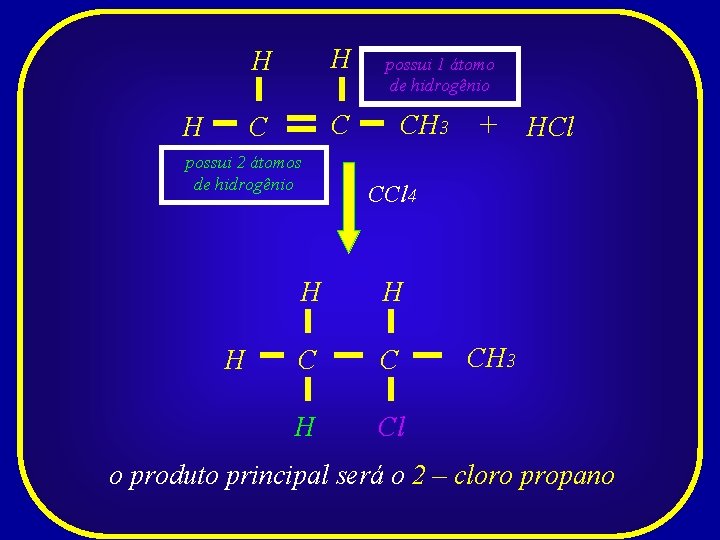
H H H C C possui 2 átomos de hidrogênio H possui 1 átomo de hidrogênio CH 3 + HCl CCl 4 H H C C H Cl CH 3 o produto principal será o 2 – cloro propano

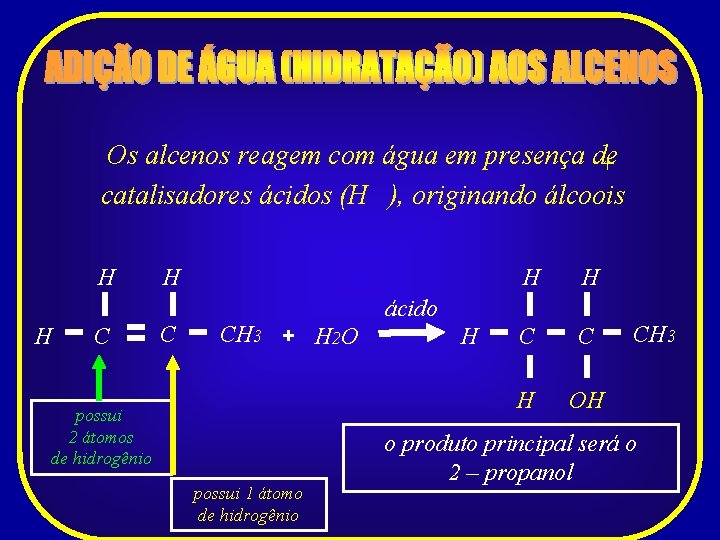
Os alcenos reagem com água em presença de + catalisadores ácidos (H ), originando álcoois H H C CH 3 + H 2 O possui 2 átomos de hidrogênio possui 1 átomo de hidrogênio H H C C H OH ácido H CH 3 o produto principal será o 2 – propanol

Os halogênios reagem com os alcenos, na presença do CCl 4, formando di-haletos de alquil. H H C CH 3 + Cl – Cl H H C C Cl Cl CCl 4 H CH 3

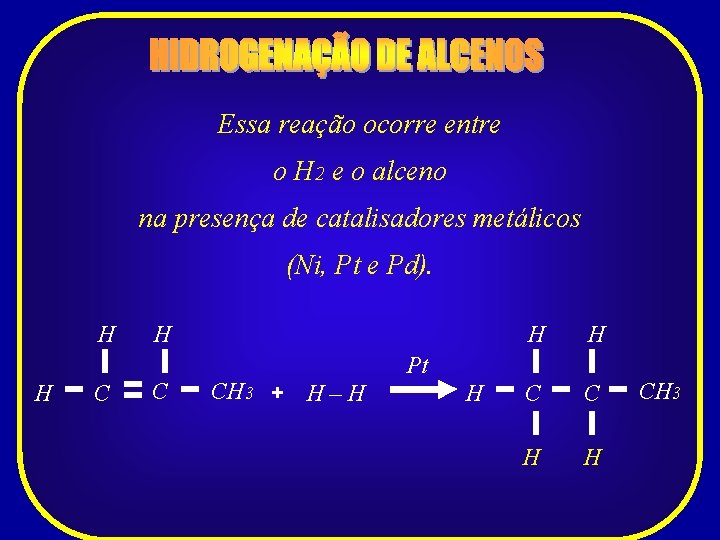
Essa reação ocorre entre o H 2 e o alceno na presença de catalisadores metálicos (Ni, Pt e Pd). H H C CH 3 + H – H H H C C H H Pt H CH 3

01) Com respeito à equação: X + HBr C 6 H 13 Br Pode-se afirmar que X é um: a) b) c) d) e) alcano e a reação é de adição. alceno e a reação de substituição. alceno e a reação é de adição eletrofílica. alcano e a reação é de substituição eletrofílica. alceno e a reação é de substituição.

H–C C – CH 3 + H – Cl H – C = C – CH 3 Ocorre a adição de H Cl 1 mol do haleto de hidrogênio para, em seguida, H Cl ocorrer a adição de H – C = C – CH 3 + H – Cl H – C – CH 3 outro mol do haleto de hidrogênio H Cl

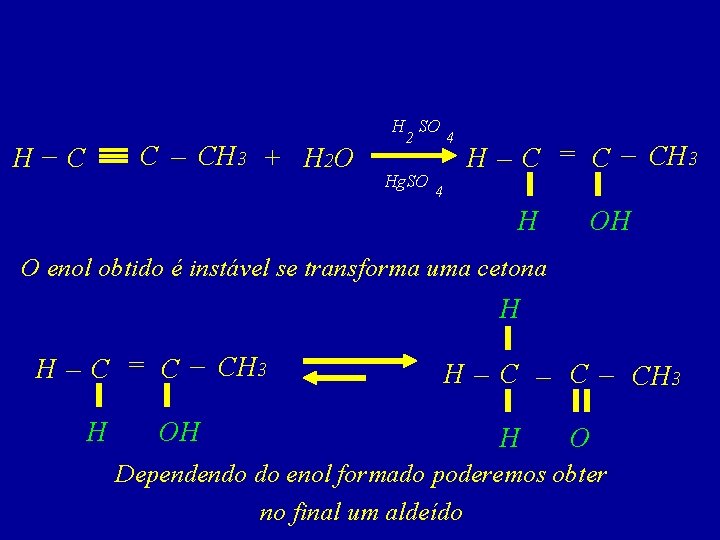
H SO H–C C – CH 3 + H 2 O 2 Hg. SO 4 H – C = C – CH 3 4 A hidratação dos alcinos, H OH O enol obtido é instável se transforma em cetona que é catalisada com H 2 SO 4 e Hg. SO 4, H possui uma seqüência parecida H – C = C – CH 3 H – C – CH 3 com a dos alcenos. H OH H O Dependendo do enol formado poderemos obter no final um aldeído

H SO H–C C – CH 3 + H 2 O 2 Hg. SO 4 H – C = C – CH 3 4 H OH O enol obtido é instável se transforma uma cetona H H – C = C – CH 3 H OH H – C – CH 3 H O Dependendo do enol formado poderemos obter no final um aldeído

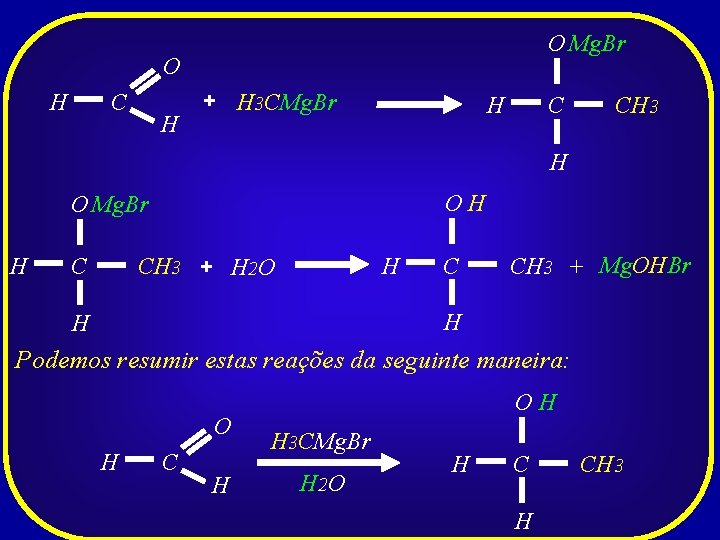
O esquema geral do processo é: A adição de reagentes de Grignard (RMg. X), seguida de metanal + RMg. X H 2 O hidrólise, álcool primário a aldeídos ou cetonas é um dos melhores processos aldeído + RMg. X H 2 O para álcool secundário a preparação H 2 Ode álcoois cetona + RMg. X álcool terciário

O Mg. Br O H C H + H 3 CMg. Br H C CH 3 H OH O Mg. Br H H CH 3 + H 2 O C C CH 3 + Mg. OHBr H H Podemos resumir estas reações da seguinte maneira: O H C H OH H 3 CMg. Br H 2 O H CH 3

O H 3 C C H OH H 3 CMg. Br H 2 O H 3 C C CH 3 H ETANAL 2 - PROPANOL OH O H 3 C C PROPANONA CH 3 H 3 CMg. Br H 2 O H 3 C C CH 3 2 – METIL – 2 – PROPANOL

01) Dada à reação abaixo, podemos afirmar que o composto orgânico obtido é o: O H 3 C C H H 2 O + H 3 CCH 2 Mg. Br a) ácido butanóico. b) 1 – butanol. OH c) 2 – butanol. d) etanol. e) 2 – propanol. H 3 C C CH 2 – BUTANOL ou BUTAN – 2 – OL CH 3

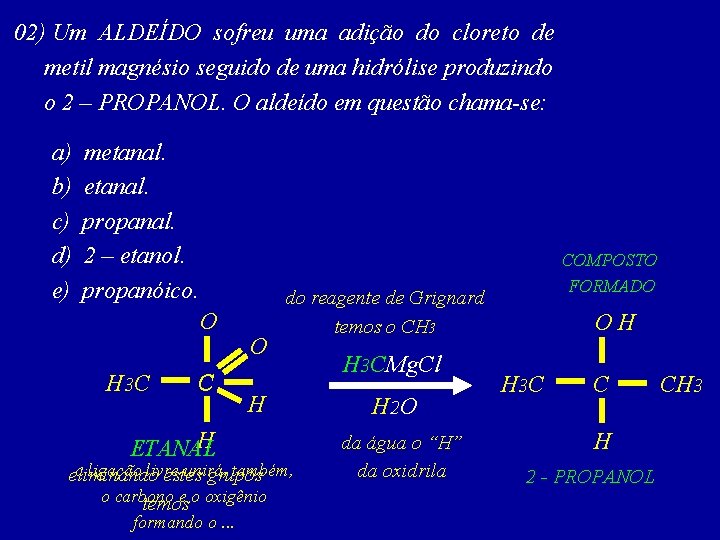
02) Um ALDEÍDO sofreu uma adição do cloreto de metil magnésio seguido de uma hidrólise produzindo o 2 – PROPANOL. O aldeído em questão chama-se: a) b) c) d) e) metanal. propanal. 2 – etanol. propanóico. O H 3 C C H ETANAL O do reagente de Grignard temos o CH 3 H a ligação livre unirá, também, eliminando estes grupos o carbono e o oxigênio temos formando o. . . COMPOSTO FORMADO H 3 CMg. Cl H 2 O da água o “H” da oxidrila OH H 3 C C H 2 - PROPANOL CH 3

As reações de eliminação são processos, em geral, inversos aos descritos para as reações de adição e, constituem métodos de obtenção de alcenos e alcinos

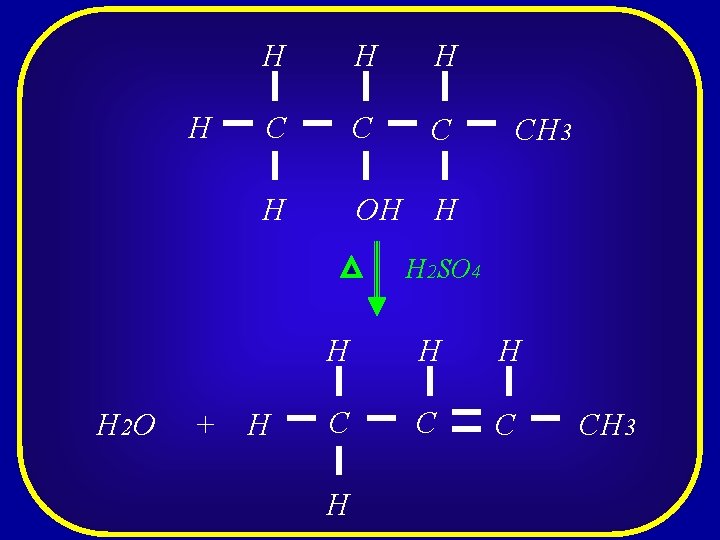
A desidratação dos álcoois segue A desidratação (eliminação de água) a regra de SAYTZEFF, isto é, de um álcool elimina-se oxidrila e deste o hidrogênio carbono ocorre com a aquecimento álcool em do presença de vizinho ao carbono da oxidrila MENOS ácido sulfúrico HIDROGENADO

H H C C C H OH H CH 3 H 2 SO 4 H 2 O + H H C C C H CH 3

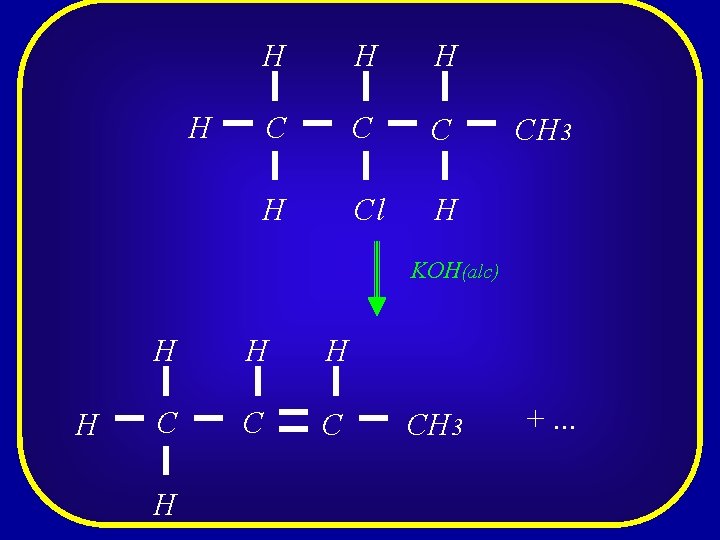
Esta reação, normalmente, ocorre em solução concentrada de KOH em álcool O haleto eliminado reage com o KOH produzindo sal e água

H H H C C C H Cl H H CH 3 KOH(alc) H H C C C H CH 3 +. . .

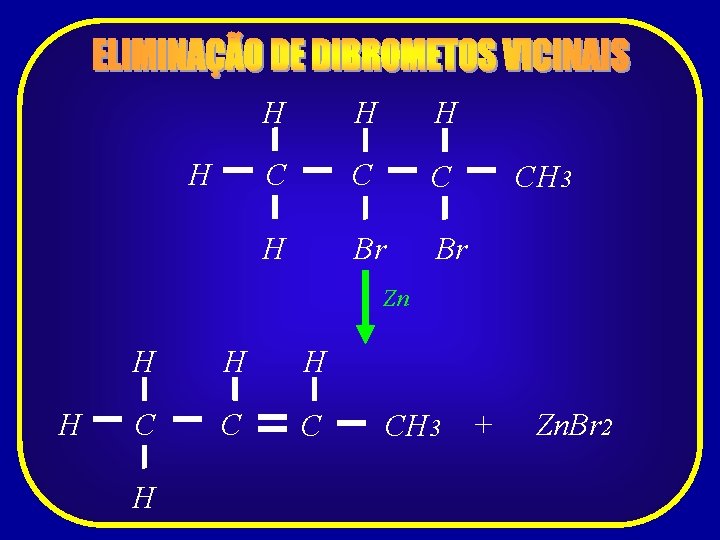
H H C C C H Br Br CH 3 Zn H H C C C H CH 3 + Zn. Br 2

H H H C C C H Br Br H CH 3 KOH (alc) As duas moléculas de HBr eliminadas reagem com o KOH formando sal e água H H C C CH 3 +. . .

Os álcoois primários, ao sofrerem, As principais reações de O comportamento oxidação, em aldeídos e estes, oxidação redução compostos dos álcooisetransformam-se primários, secundários e orgânicos terciários, se deixados em contato com oxidante, ocorrem com os oxidantes, sãoaldeídos oxidados a álcoois, e alcenos são semelhantes ácidos carboxílicos
![H I H 3 C OH I H O OH I H 3 H I H 3 C – OH I H [O] OH I H 3](https://slidetodoc.com/presentation_image_h/b2567adb39ef3d5d54b16dada09badd2/image-44.jpg)
H I H 3 C – OH I H [O] OH I H 3 C – OH I H – H 2 O O H 3 C – C H ETANAL sofre desidratação ETANOL O H 3 C – C O [O] H 3 C – C ÁCIDO ETANÓICO H OH ETANAL RESUMINDO H I H 3 C – OH I H ETANOL O [O] H 3 C – C ETANAL O [O] H OH ÁCIDO ETANÓICO

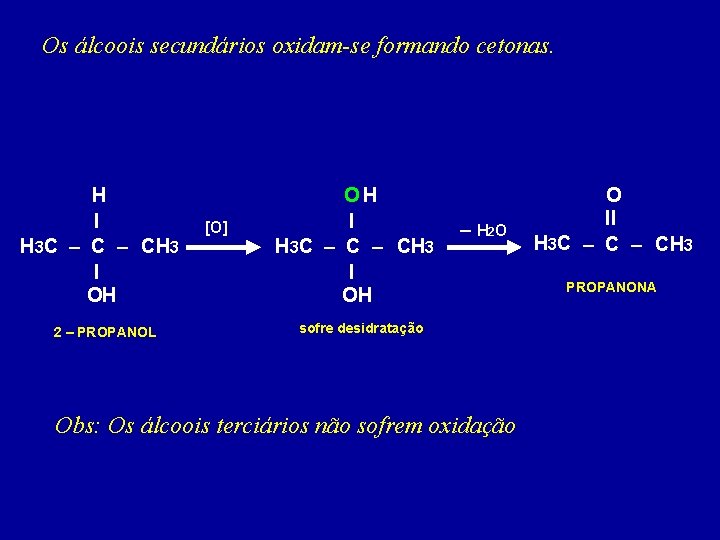
Os álcoois secundários oxidam-se formando cetonas. H I H 3 C – CH 3 I OH 2 – PROPANOL [O] OH I H 3 C – CH 3 I OH – H 2 O sofre desidratação Obs: Os álcoois terciários não sofrem oxidação O II H 3 C – CH 3 PROPANONA

01) Quando um álcool primário sofre oxidação, o produto principal é: a) ácido carboxílico. b) álcool secundário. c) éter. d) álcool terciário. e) cetona.

OXIDAÇÃO DE ALCENOS Os alcenos sofrem oxidação branda originando diálcoois vicinais H H I I H 3 C – C = C – CH 3 H H [O] I I H 3 C – C – CH 3 branda I I OH OH

A oxidação a fundo, com quebra da ligação dupla, produz ácido carboxílico e /ou cetona H I H 3 C – C = H I C – CH 3 [O] a fundo O 2 H 3 C – C H [O] H O I H 3 C 2 H – 3 C = –O C + O H = O 2 H 3 C – C OH H I C – CH 3

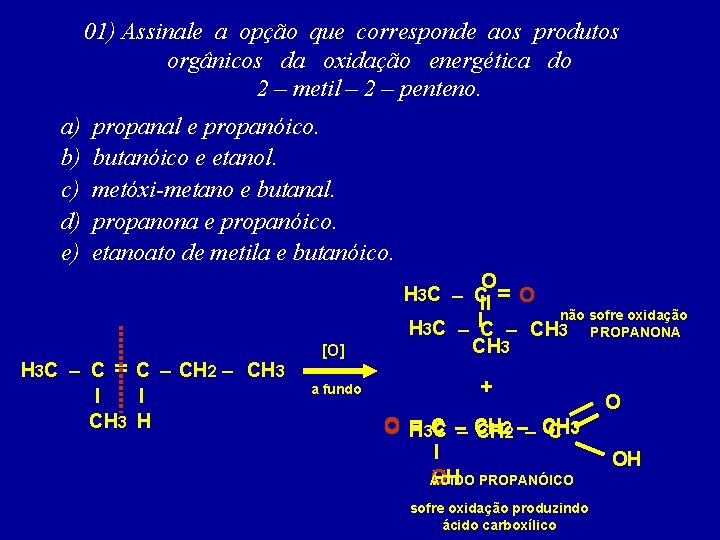
01) Assinale a opção que corresponde aos produtos orgânicos da oxidação energética do 2 – metil – 2 – penteno. a) b) c) d) e) propanal e propanóico. butanóico e etanol. metóxi-metano e butanal. propanona e propanóico. etanoato de metila e butanóico. H 3 C – C = C – CH 2 – CH 3 I I CH 3 H [O] a fundo O H 3 C – CII = O não sofre oxidação H 3 C – IC – CH 3 PROPANONA CH 3 + =3 C O H C –– CH CH 22 –– CH C 3 I OH ÁCIDO PROPANÓICO H sofre oxidação produzindo ácido carboxílico O OH

02) Um alceno “ X “ foi oxidado energeticamente pela mistura sulfomangânica (KMn. O 4 + H 2 SO 4). Os produtos da reação foram butanona e ácido metil propanóico. Logo, o alceno X é: H 3 C CH CH 3 1 C 2 O 3 O H OH 2, 4 – dimetil c) 2, 4 -dimetil-3 -hexeno. d) 2, 5 -dimetil-3 -hexeno. e) 3, 5 -dimetil-3 -hexeno. 5 C CH 2 CH 3 ÁCIDO METIL PROPANÓICO a) 2 -metil-3 -hexeno. b) 3 -metil-3 -hexeno. 4 BUTANONA – 3 – hexeno 6 CH 3

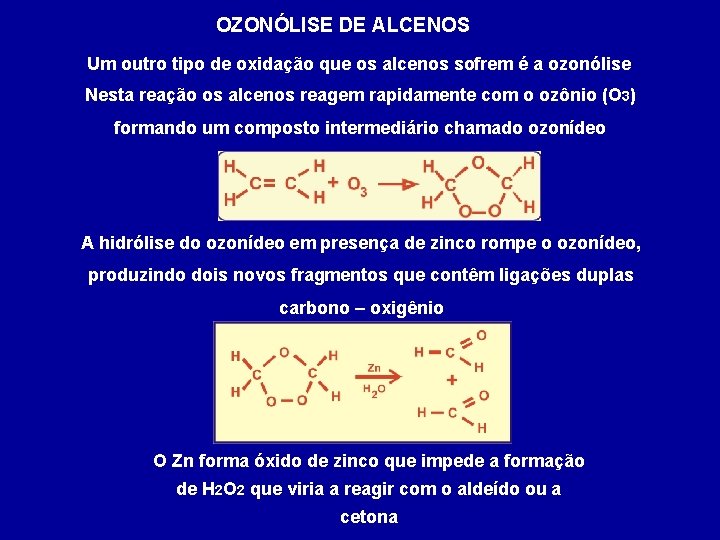
OZONÓLISE DE ALCENOS Um outro tipo de oxidação que os alcenos sofrem é a ozonólise Nesta reação os alcenos reagem rapidamente com o ozônio (O 3) formando um composto intermediário chamado ozonídeo A hidrólise do ozonídeo em presença de zinco rompe o ozonídeo, produzindo dois novos fragmentos que contêm ligações duplas carbono – oxigênio O Zn forma óxido de zinco que impede a formação de H 2 O 2 que viria a reagir com o aldeído ou a cetona

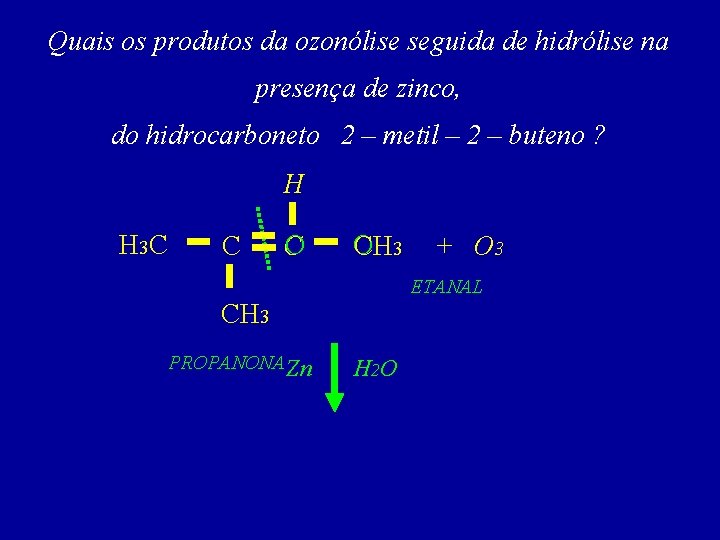
Quais os produtos da ozonólise seguida de hidrólise na presença de zinco, do hidrocarboneto 2 – metil – 2 – buteno ? H H 3 C C O CH 3 + O 3 ETANAL CH 3 PROPANONA Zn H 2 O
 Građa tijela čovjeka
Građa tijela čovjeka Foi graa
Foi graa Resolver
Resolver Profa campis
Profa campis Profa ma
Profa ma Internet profa
Internet profa Www.profa
Www.profa Internet profa
Internet profa Tipos de pronomes
Tipos de pronomes Era para falar ontem mas não encontrei em parte alguma
Era para falar ontem mas não encontrei em parte alguma Porto assegnato
Porto assegnato Caulos
Caulos Portuguese fortified wine
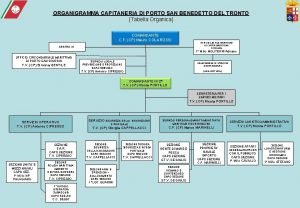
Portuguese fortified wine Capitaneria di porto san benedetto
Capitaneria di porto san benedetto Notalegal porto alegre
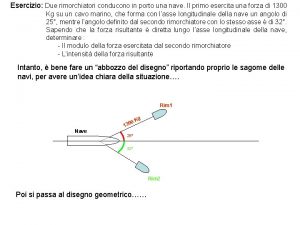
Notalegal porto alegre Due rimorchiatori trainano un imbarcazione
Due rimorchiatori trainano un imbarcazione Nightfood porto
Nightfood porto Concetta lo porto
Concetta lo porto Sistema porta
Sistema porta Celk saude porto belo
Celk saude porto belo Porto portas portat
Porto portas portat Porto systemic anastomosis
Porto systemic anastomosis Modelo de contrato social sociedade limitada
Modelo de contrato social sociedade limitada Porto kaval anastomozlar nedir
Porto kaval anastomozlar nedir Great saphenous
Great saphenous O que é função sintática
O que é função sintática Faculty of engineering university of porto
Faculty of engineering university of porto Alhashli
Alhashli Blagajnička priznanica je
Blagajnička priznanica je Geometria de via permanente
Geometria de via permanente Juan pablo porto urrutia
Juan pablo porto urrutia Esas porto
Esas porto Geciane silveira porto
Geciane silveira porto Eclusa porto primavera
Eclusa porto primavera Porto polio
Porto polio Schistosomaiasis
Schistosomaiasis The north wall
The north wall Financial system
Financial system Coutinho porto
Coutinho porto Porto
Porto Porto
Porto Geciane silveira porto
Geciane silveira porto Motorista estão bloqueando o acesso ao porto do pecém
Motorista estão bloqueando o acesso ao porto do pecém Gedweb usp
Gedweb usp Hypertension portale
Hypertension portale O meu barco vai firme ao porto seguro
O meu barco vai firme ao porto seguro Tarebi porto
Tarebi porto Porto latin
Porto latin Rua dr roberto frias porto
Rua dr roberto frias porto Identificas diferencias entre distintos tipos de movimiento
Identificas diferencias entre distintos tipos de movimiento Qué son los textos expositivos
Qué son los textos expositivos Diálogo entre una azafata y un pasajero
Diálogo entre una azafata y un pasajero Transitivo vs intransitivo
Transitivo vs intransitivo