Plan du cours Une courte introduction au Gnie

































- Slides: 54

Plan du cours § Une (courte) introduction au Génie des Procédés § Le reste du cours : 4 leçons • Comment produire de l’eau potable à partir d’eau de mer : l’opération d’osmose inverse (2 h) • Comment produire du whisky : l’opération de distillation (2 h) • Comment traiter les boues des stations d’épuration : les opérations de filtration et de fluidisation (2 h) • Comment traiter un gaz pollué avant son rejet à l’environnement : les cyclones et l’opération d’absorption gaz – liquide (3 h) Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 1

Plan du cours § Leçon 2 : Comment produire du whisky : l’opération de distillation • Introduction (principe, objectifs, appareillages, applications) • Dimensionnement d’une installation de distillation discontinue Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 2

Principe de la distillation Notion fondamentale : description de l’équilibre d’un mélange liquide binaire avec sa vapeur Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 3

Equilibre liquide – vapeur § Equilibre d’un liquide binaire avec sa vapeur § Variance du système : 2 + c – r – f = 2 • c : nombre de constituants • r : nombre de réactions chimiques • f : nombre de phases § Si pression fixée : une variable indépendante • Souvent la fraction molaire dans la phase liquide du composé le plus volatil – T et la fraction molaire de ce composé dans la phase gazeuse sont des fonctions univoques de cette variable Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 4

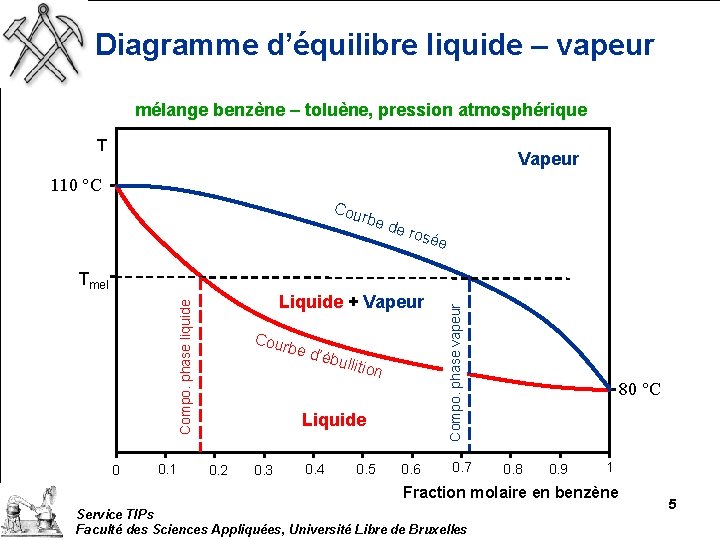
Diagramme d’équilibre liquide – vapeur mélange benzène – toluène, pression atmosphérique T Vapeur 110 °C rbe d Tmel 0. 1 sée Liquide + Vapeur Compo. phase liquide 0 e ro Cour be d ’ébul l ition Liquide 0. 2 0. 3 0. 4 0. 5 0. 6 Compo. phase vapeur Cou 0. 7 80 °C 0. 8 0. 9 1 Fraction molaire en benzène Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 5

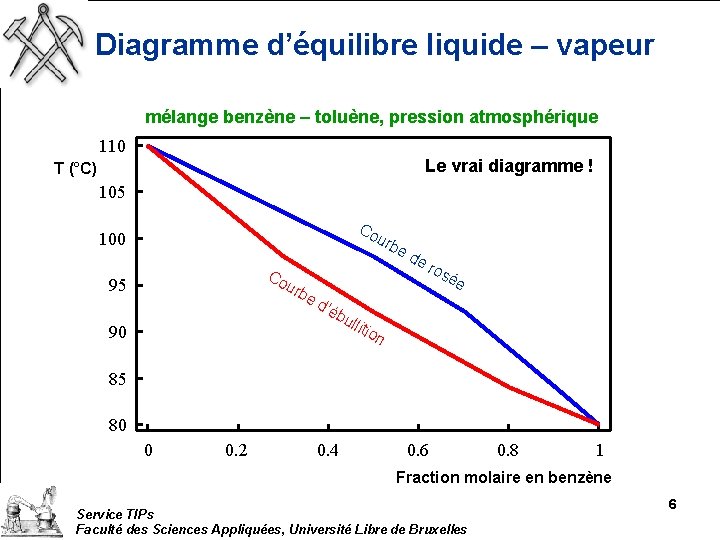
Diagramme d’équilibre liquide – vapeur mélange benzène – toluène, pression atmosphérique 110 Le vrai diagramme ! T (°C) 105 Co 100 urb Co u 95 rbe 90 d’é bu lliti ed er os ée on 85 80 0 0. 2 0. 4 0. 6 0. 8 1 Fraction molaire en benzène Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 6

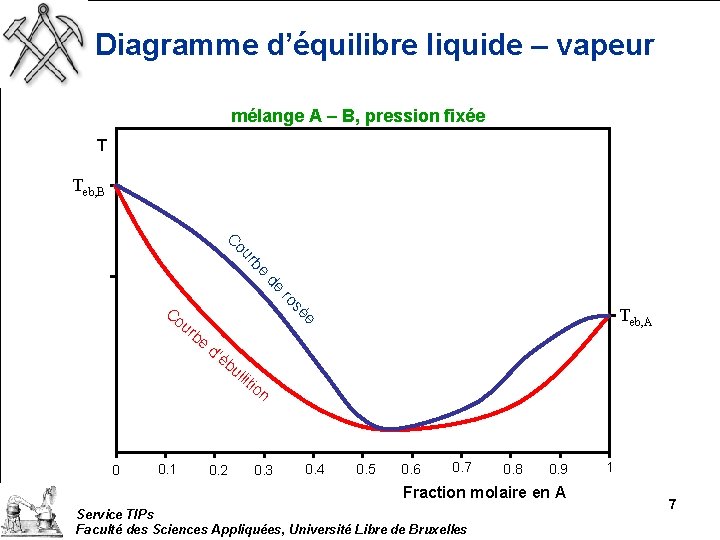
Diagramme d’équilibre liquide – vapeur mélange A – B, pression fixée T Teb, B r ou C be de ro e rb 0 0. 1 Teb, A sé Co u e d’ éb 0. 2 ul liti on 0. 3 0. 4 0. 5 0. 6 0. 7 0. 8 0. 9 Fraction molaire en A Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 1 7

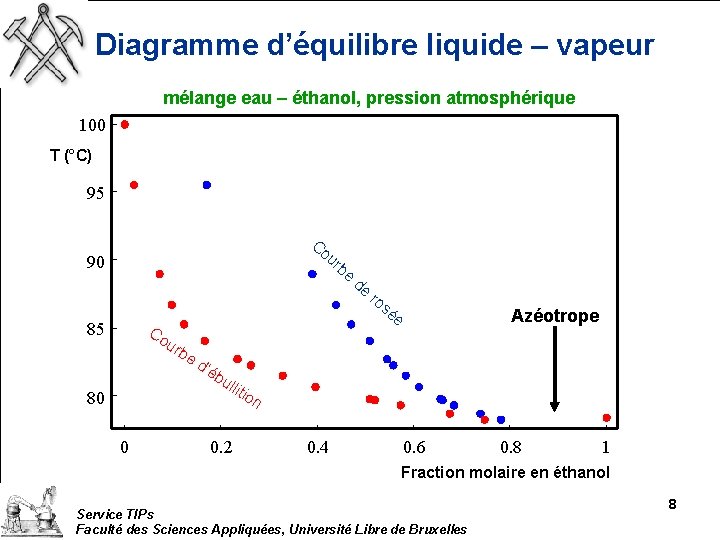
Diagramme d’équilibre liquide – vapeur mélange eau – éthanol, pression atmosphérique 100 T (°C) 95 Co ur be 90 85 urb ed 0 ro s ée Co 80 de ’éb ull 0. 2 itio Azéotrope n 0. 4 0. 6 0. 8 1 Fraction molaire en éthanol Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 8

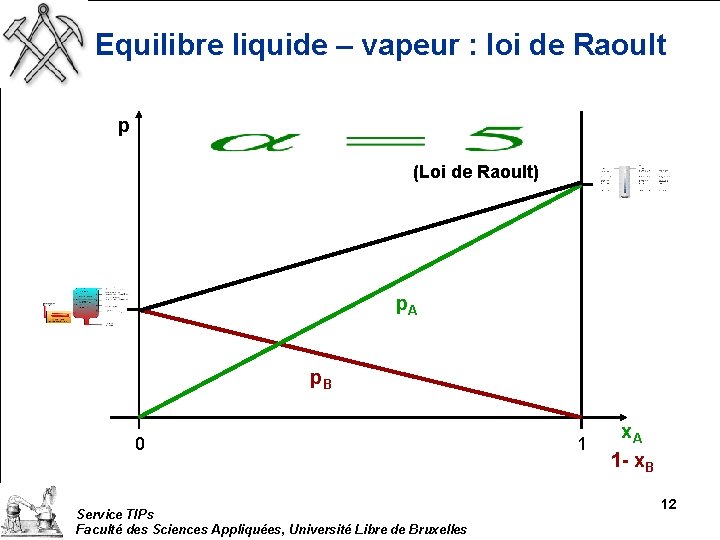
Equilibre liquide – vapeur : loi de Raoult § Equilibre d’une solution binaire liquide A – B (parfaite) avec sa vapeur (gaz parfait) • Formulation mathématique de l’équilibre : Phase v p. A, y. A = p. A/p p. B, y. B = p. B/p A T, p x A, x B B Phase l Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 9

Equilibre liquide – vapeur : loi de Raoult • Développement des potentiels chimiques : • Phase liquide incompressible : Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 10

Equilibre liquide – vapeur : loi de Raoult • Réarrangement : (équations de Raoult) Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 11

Equilibre liquide – vapeur : loi de Raoult p (Loi de Raoult) p. A p. B 0 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 1 x. A 1 - x. B 12

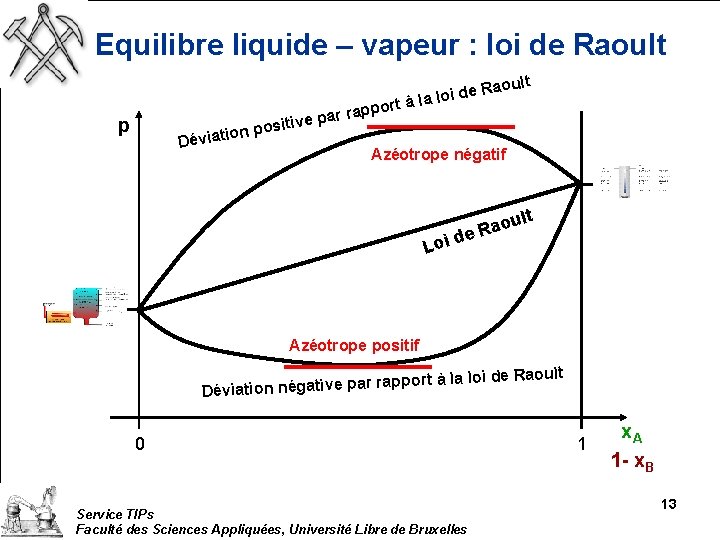
Equilibre liquide – vapeur : loi de Raoult p appor r r a p sitive oult a R e d i t à la lo n po io Déviat Azéotrope négatif ult o a e. R d Loi Azéotrope positif rapport à la ar p e iv at ég n n o ti ia Dév loi de Raoult 0 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 1 x. A 1 - x. B 13

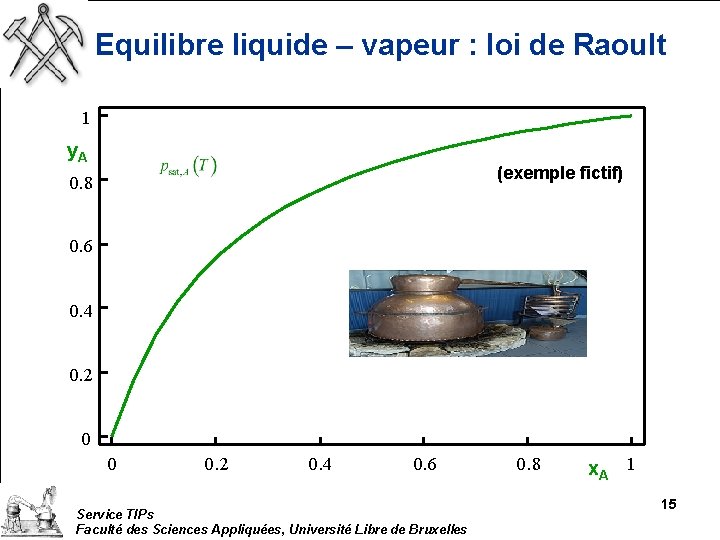
Equilibre liquide – vapeur : loi de Raoult • Equations de Raoult : Où : Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 14

Equilibre liquide – vapeur : loi de Raoult 1 y. A (exemple fictif) 0. 8 0. 6 0. 4 0. 2 0 0 0. 2 0. 4 0. 6 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 0. 8 x. A 1 15

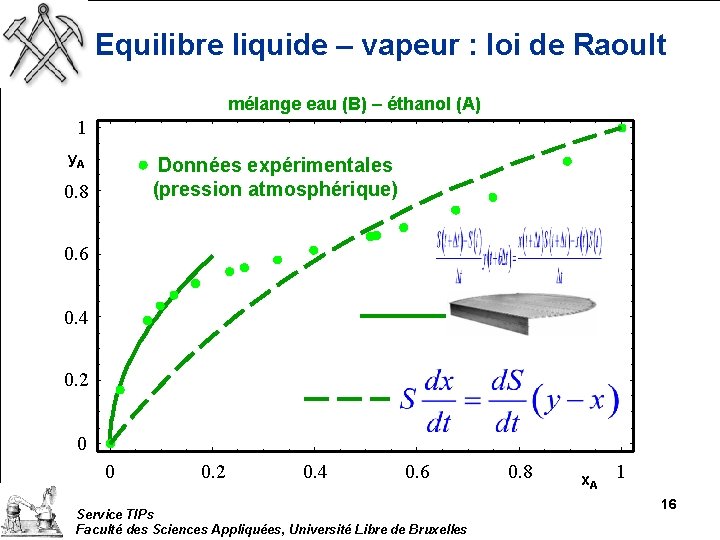
Equilibre liquide – vapeur : loi de Raoult mélange eau (B) – éthanol (A) 1 y. A Données expérimentales (pression atmosphérique) 0. 8 0. 6 0. 4 0. 2 0 0 0. 2 0. 4 0. 6 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 0. 8 x. A 1 16

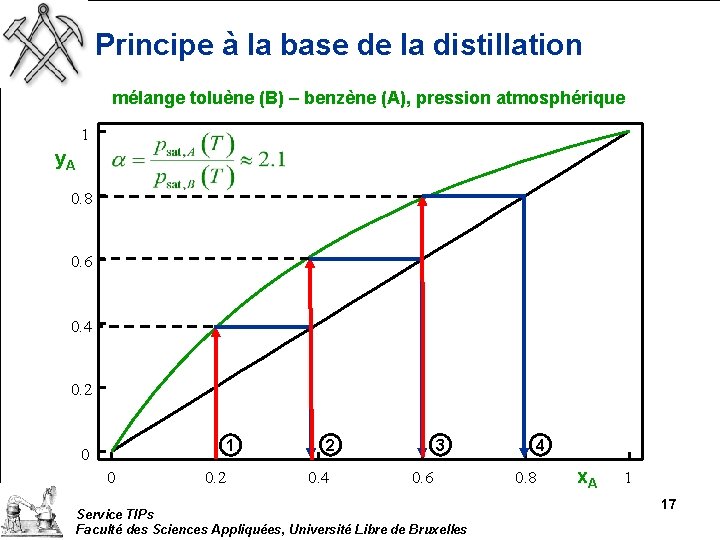
Principe à la base de la distillation mélange toluène (B) – benzène (A), pression atmosphérique 1 y. A 0. 8 0. 6 0. 4 0. 2 1 0 0 0. 2 2 0. 4 3 0. 6 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 4 0. 8 x. A 1 17

Principe à la base de la distillation En procédant par évaporations / condensations successives d’un mélange liquide dont les composés ont des températures d’ébullition différentes, on est capable d’isoler les différents composé de ce mélange. Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 18

Objectif de la distillation § Objectif : • Séparer les différents composants d’une même phase liquide § Pourquoi ? • Obtention d’une phase liquide concentrée en l’un des composants (production de bioéthanol, production d’alcool) • Séparation des différents composés d’un mélange, composés valorisables individuellement (raffinage du pétrole) § Deux grands types d’opération : • Distillation discontinue (différentielle) • Distillation continue fractionnée Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 19

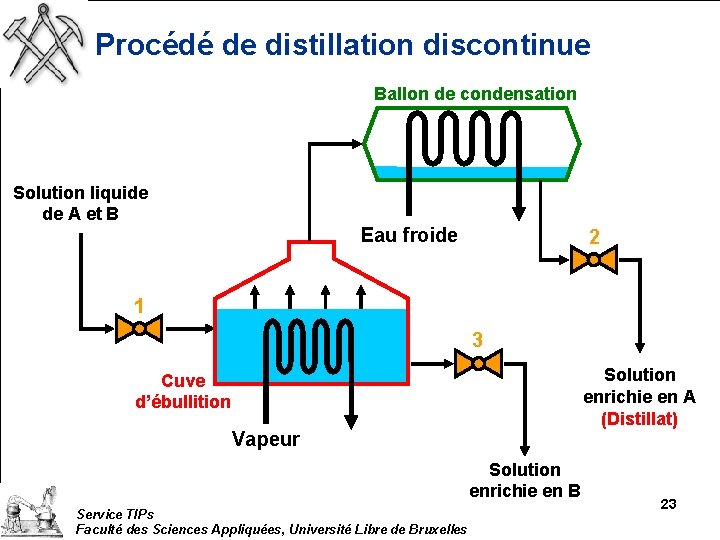
Procédé de distillation discontinue Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 20

Procédé de distillation discontinue Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 21

Procédé de distillation discontinue Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 22

Procédé de distillation discontinue Ballon de condensation Solution liquide de A et B Eau froide 2 1 3 Solution enrichie en A (Distillat) Cuve d’ébullition Vapeur Solution enrichie en B Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 23

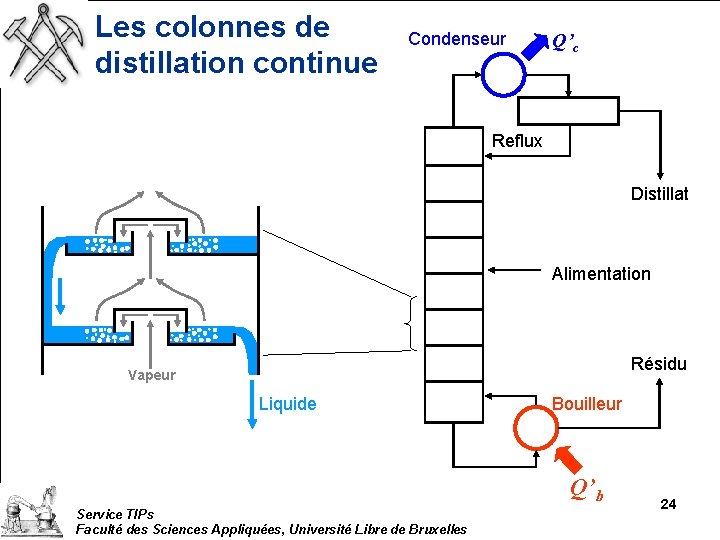
Les colonnes de distillation continue Condenseur Q’c Reflux Distillat Alimentation Résidu Vapeur Liquide Bouilleur Q’b Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 24

Les colonnes de distillation continue Plateaux perforés Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 25

Les colonnes de distillation continue Plateaux à cloches Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 26

Les colonnes de distillation continue Colonne pour la distillation du pétrole (raffinerie) Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 27

Quelques exemples d’applications § Production d’alcool, de bioéthanol § Raffinage du pétrole § Industrie pétrochimique (industrie des dérivés du pétrole) § Production d’oxygène et d’azote purs par distillation de l’air Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 28

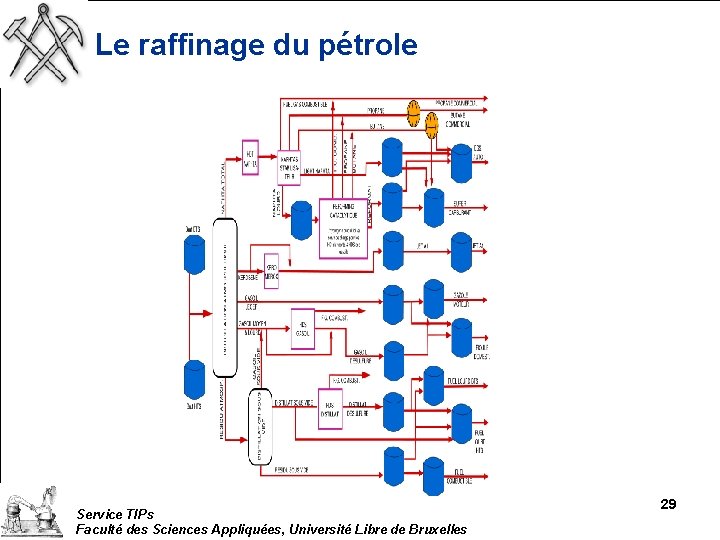
Le raffinage du pétrole Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 29

Le raffinage du pétrole Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 30

La raffinerie du Groupe Total à Anvers § La plus grande et la plus complexe des raffineries du Groupe TOTAL § 2ème raffinerie européenne par la taille § Le maillon essentiel du complexe pétrochimique intégré de TOTAL en Belgique • Traite 18 millions de tonnes de pétrole brut par an (360 000 barils/jour) • 35 unités de transformation • 75 produits finis différents, conformes aux spécifications européennes à venir • 1 000 collaborateurs Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 31

La raffinerie du Groupe Total à Anvers Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 32

La raffinerie du Groupe Total à Anvers Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 33

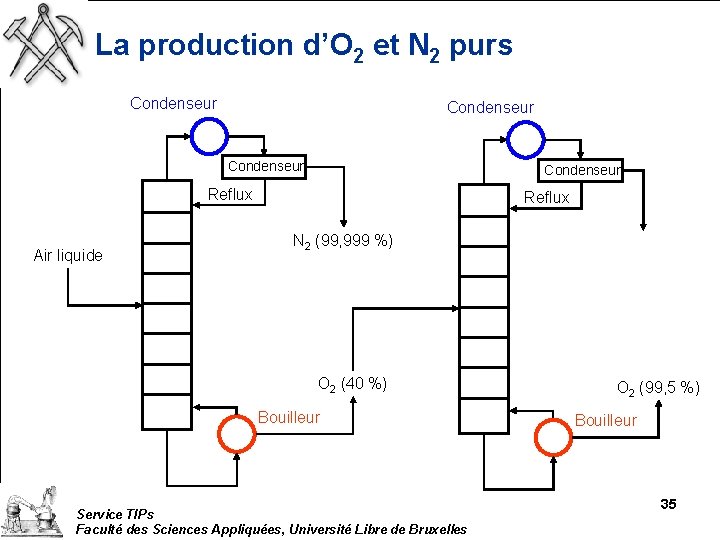
La production d’O 2 et N 2 purs Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 34

La production d’O 2 et N 2 purs Condenseur Reflux Air liquide Reflux N 2 (99, 999 %) O 2 (40 %) Bouilleur Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles O 2 (99, 5 %) Bouilleur 35

La production d’O 2 et N 2 purs Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 36

Plan du cours § Leçon 2 : Comment produire du whisky : l’opération de distillation • Introduction (principe, objectifs, appareillages, applications) • Dimensionnement d’une installation de distillation discontinue Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 37

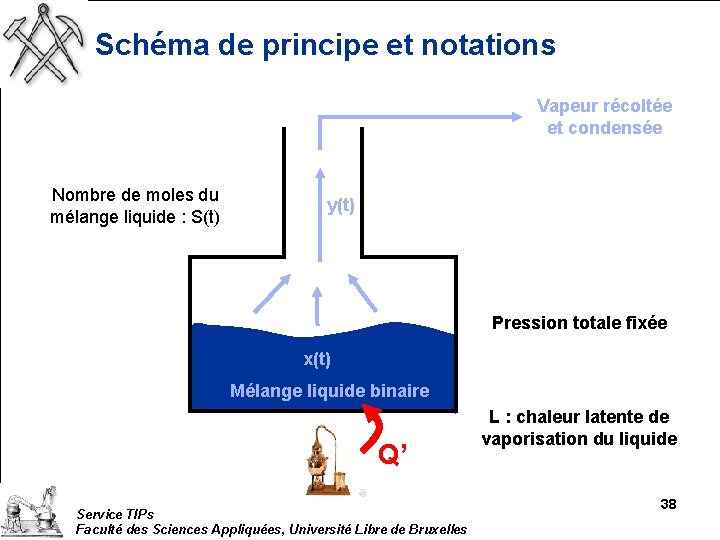
Schéma de principe et notations Vapeur récoltée et condensée Nombre de moles du mélange liquide : S(t) y(t) Pression totale fixée x(t) Mélange liquide binaire Q’ Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles L : chaleur latente de vaporisation du liquide 38

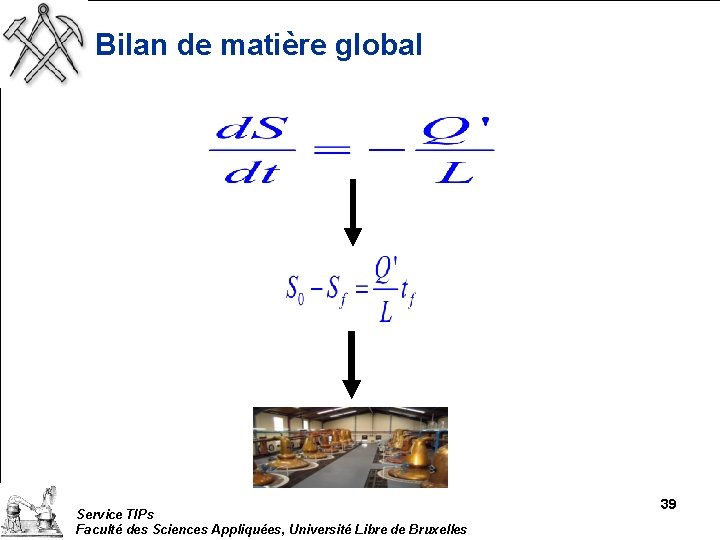
Bilan de matière global Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 39

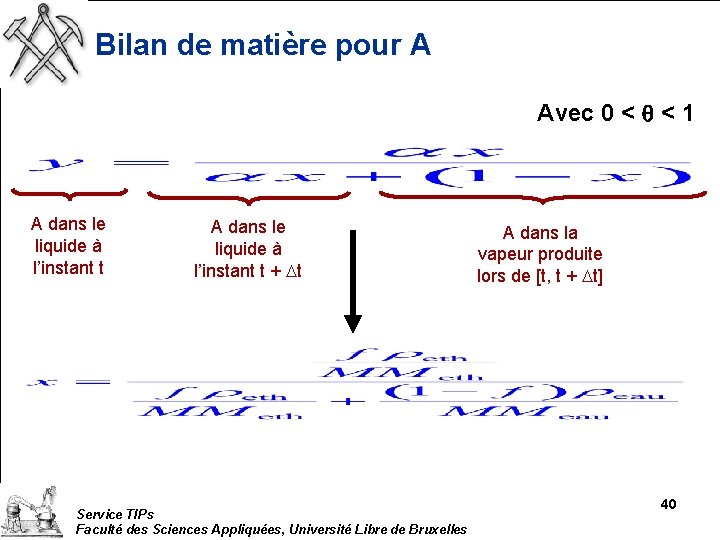
Bilan de matière pour A Avec 0 < q < 1 A dans le liquide à l’instant t + Dt Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles A dans la vapeur produite lors de [t, t + Dt] 40

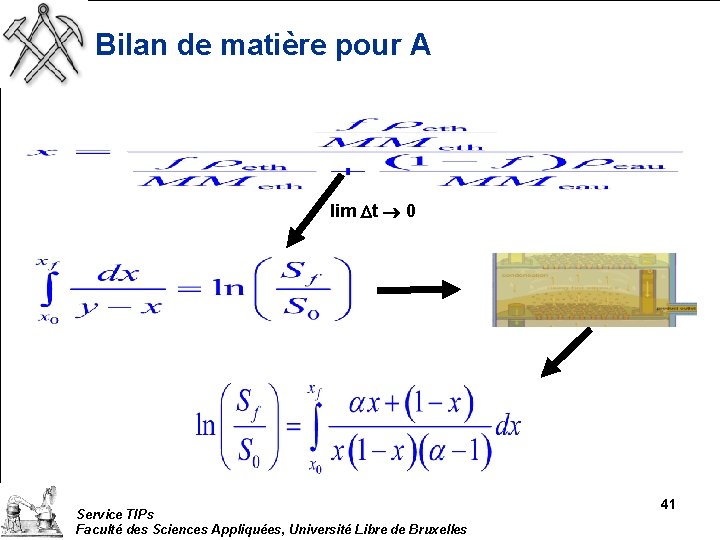
Bilan de matière pour A lim Dt 0 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 41

Composition moyenne du distillat § Paramètre important de l’opération de distillation discontinue : composition du distillat. • Noté x. D • Bilan : Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 42

Equations constitutives Equilibre entre les phases liquide et vapeur dans la cuve : (Equations de Raoult applicables) (relation empirique) Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 43

Bilan sur A + équation constitutive Après quelques calculs… Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 44

Bilan sur A + équation constitutive Après quelques calculs… Indice : Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 45

Récapitulatif ou + et = jeu d’équations permettant de solutionner tout problème de dimensionnement Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 46

Un exemple concret § Vous êtes engagé à la distillerie de Biercée afin d’y développer un nouveau procédé de production de Poire Williams • Le résultat de la fermentation pendant 4 semaines de morceaux de poires dans des cuves de fermentation de 10. 000 litres est une solution à 15% en volume d’éthanol • Par une première distillation discontinue, on désire obtenir une solution contenant 40% en volume d’alcool. Quel volume de la solution initiale doit être évaporé puis condensé pour cela ? Quelle puissance de chauffe sera nécessaire pour effectuer cette opération en 24 heures ? Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 47

Un exemple concret • Par une distillation discontinue de la solution titrant 40% d’alcool, on désire obtenir une solution contenant 70% en volume d’alcool qui sera placée en fûts de chêne pour vieillissement. Quelle volume de la solution à 40% d’alcool doit être évaporé puis condensé pour cela ? Quelle puissance de chauffe sera nécessaire pour effectuer cette opération en 12 heures ? Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 48

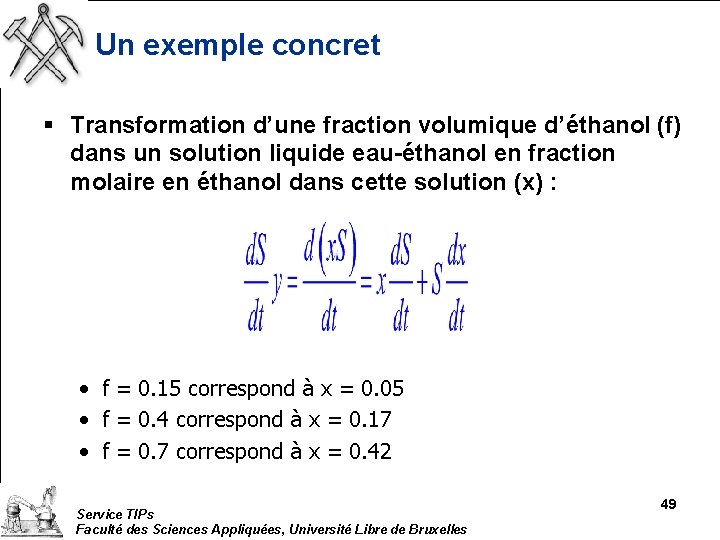
Un exemple concret § Transformation d’une fraction volumique d’éthanol (f) dans un solution liquide eau-éthanol en fraction molaire en éthanol dans cette solution (x) : • f = 0. 15 correspond à x = 0. 05 • f = 0. 4 correspond à x = 0. 17 • f = 0. 7 correspond à x = 0. 42 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 49

Un exemple concret § Première distillation : (2) (1) (3) Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 50

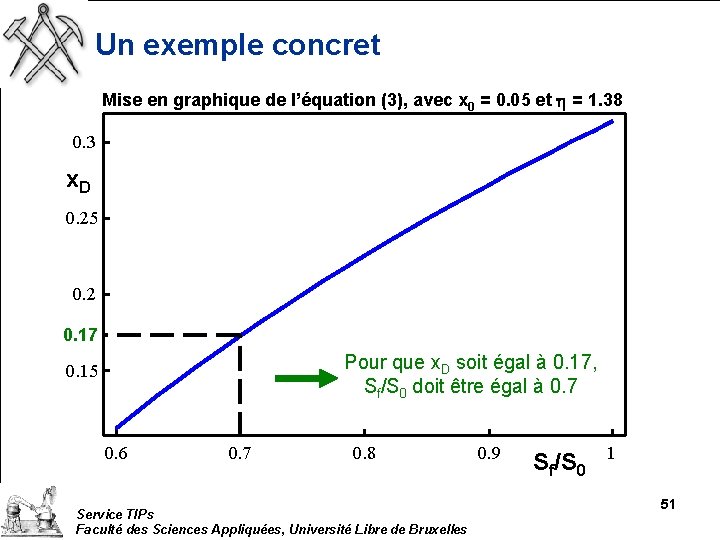
Un exemple concret Mise en graphique de l’équation (3), avec x 0 = 0. 05 et h = 1. 38 0. 3 x. D 0. 25 0. 2 0. 17 Pour que x. D soit égal à 0. 17, Sf/S 0 doit être égal à 0. 7 0. 15 0. 6 0. 7 0. 8 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 0. 9 Sf/S 0 1 51

Un exemple concret § Première distillation : • x 0 = 0. 05 • Sf/S 0 = 0. 7, donc (équation (1)) xf = 4. 3 10 -8 • Volume de liquide initial : 10 m 3 à 15% en volume d’éthanol – Volume d’éthanol = 1. 5 m 3 (donc 25728 moles) – Volume de liquide = 8. 5 m 3 (donc 471278 moles) – S 0 = 497006 moles et Sf = 0. 7 S 0 = 346528 moles • Liquide résiduel dans la cuve d’ébullition : que de l’eau (xf x 0 ) – Volume de liquide résiduel dans cuve = 6. 25 m 3 – Volume de liquide à évaporer = 3. 75 m 3 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 52

Un exemple concret § Première distillation : • S 0 = 497006 moles et Sf = 346528 moles • Bilan de matière global : – L = 37000 J/mol et tf = 24 h – Q’ = 64 k. W Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 53

Un exemple concret § Seconde distillation (à faire à la maison) : • x 0 = 0. 17 • Sf/S 0 = 0. 63, donc (équation (1)) xf = 0. 03 • Volume de liquide initial : 3. 75 m 3 à 40% en volume d’éthanol – S 0 = 150478 moles et Sf = 95375 moles – Q’ = 47 k. W • Volume de liquide résiduel dans cuve = 1. 83 m 3 – Volume de liquide a évaporer = 1. 92 m 3 Service TIPs Faculté des Sciences Appliquées, Université Libre de Bruxelles 54