Pharmacovigilance Les nouveaux dfis pour lOMS Shanthi PAL



















- Slides: 22

Pharmacovigilance Les nouveaux défis pour l’OMS Shanthi PAL, assistée par Serge Xueref Genève, Juin 2012 1

Plan de la présentation I. La problématique de l’effet indésirable II. Concept, Fonctionnement et Réalisations de la Pharmacovigilance III. Les nouveaux défis pour l’OMS et Partenaires 2

Paradoxe des Médicaments • Les industries pharmaceutiques développent des médicaments • Les agences de régulation délivrent des AMM • Les médecins prescrivent • Les pharmaciens délivrent • Les patients consomment • Les organismes de sécurité sociale remboursent Des médicaments qui, parfois, peuvent avoir des effets indésirables (EIs) graves voir mortels 3

4

Ampleur du Préjudice des Effets Indésirables Etats-Unis (Harvard Médical Study) : ─ 70% d’incapacité brève ─ 14% décès ─ Plus que les accidents de la voie publique, cancer du sein ─ Equivalent au crash de « 2 Boeing 747 tous les 3 jours » (Le Boston Globe) Royaume-Uni (Institute of Medicine study ) : ─ 44 000 - 98 000 décès annuels France (BMJ - 2003) : – décès aux EIM > 2 à 3 fois celui liés aux accidents de la route – 30. 000 personnes – 20. 000 personnes âgées de plus de 65 ans Canada (ICSP - 2005) : – 7, 5% des admissions hospitalières (185 000) – 36, 9 % sont jugés évitables – 20, 8% des patients décèdent Ampleur méconnue dans les pays à faible niveau socioéconomique 5

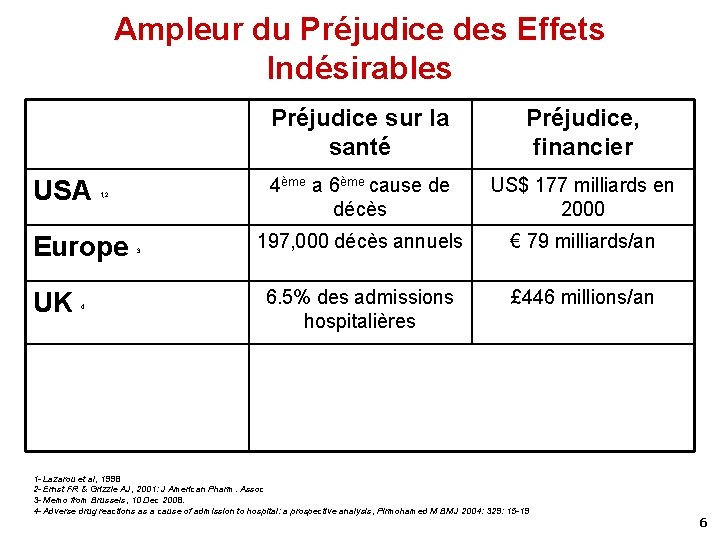
Ampleur du Préjudice des Effets Indésirables USA 1, 2 Europe UK 4 3 Préjudice sur la santé Préjudice, financier 4ème a 6ème cause de décès US$ 177 milliards en 2000 197, 000 décès annuels € 79 milliards/an 6. 5% des admissions hospitalières £ 446 millions/an 1 - Lazarou et al, 1998 2 - Ernst FR & Grizzle AJ, 2001: J American Pharm. Assoc 3 - Memo from Brussels, 10 Dec 2008. 4 - Adverse drug reactions as a cause of admission to hospital: a prospective analysis, Pirmohamed M BMJ 2004: 329: 15 -19 6

Ampleur du Préjudice des EIs, PSP • Iran Prévalence des EIs induits par les médicaments antituberculeux dans une population de patients TB hospitalisés: 45% 4 • Cambodge Prévalence de l’anémie dans une cohorte de patients VIH traités avec de l’AZT: 22% 5 • Inde Plus de 50% des EIs sont définitivement ou potentiellement évitables + Coût total hospitalier imputable aux admissions dues aux EIs dans une période de 6 semaines: USD 27, 358 6 4 - Javadi MR, Shalviri G, Gholami K et al. (University of Medical Sciences, Teheran, Islamic Republic of Iran). Adverse reactions of anti-tuberculosis drugs in hospitalized patients: incidence, severity and risk factors. Pharmacoepidemiol Drug Saf. 2007 Oct; 16(10): 1104 -10 5 - Isaakidis P et al. Evaluation of a systematic substitution of zidovudine for stavudine-based HAART in a program setting in rural Cambodia. J Acquir Immune Defic Syndr 49: 48 – 54, 2008 6 - BMC Clin Pharmacol. 2007; 7: 8) et Patel et al: BMC Clin Pharmacol. 2007; 7: 8 7

Plan de la présentation I. La problématique de l’effet indésirable II. Concept, Fonctionnement et Réalisations de la Pharmacovigilance III. Les nouveaux défis pour l’OMS et Partenaires 8

La Pharmacovigilance Ensemble de techniques, méthodes et procédures organisées pour identifier, analyser et prévenir le risque d’effet indésirable résultant de l’utilisation du médicament 9

Champs d’application de la Pharmacovigilance Produits de Santé • • Médicaments, vaccins et produits contraceptifs ; Produits de diagnostic biologique et radiologique Dispositifs médicaux Produits diététiques et additifs alimentaires ; Plantes et produits de la pharmacopée traditionnelle Produits homéopathiques ; Cosmétiques Produits vétérinaires. Les événements indésirables • • • EIs: Conditions normales d’utilisation Erreurs médicamenteuses Échecs thérapeutiques Interaction médicamenteuse Dépendance, tolérance résistance Usage abusif Intoxications, toxicomanie Mauvaise qualité ou contre façon 10

Méthode de travail • Notification Spontanée de tout effet indésirable par les professionnels de santé • Évaluation des cas par un personnel spécialisé au niveau des centres de pharmacovigilance • Centralisation des cas au niveau national et international • Génération d’alertes • Prise de décision 11

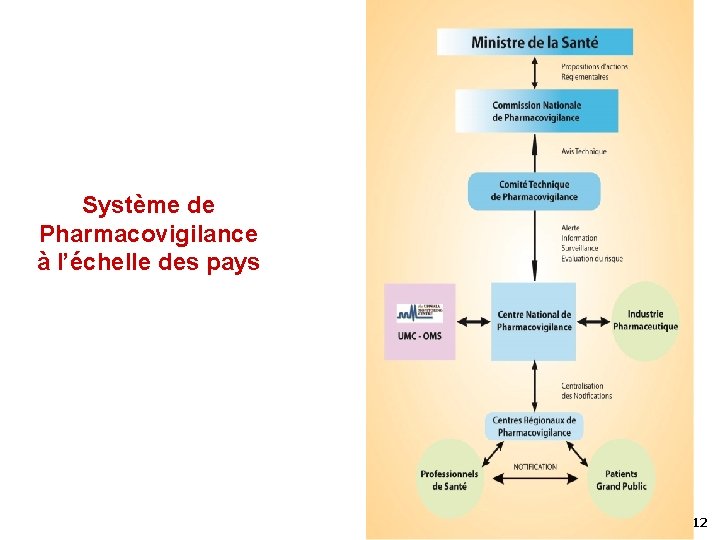
Système de Pharmacovigilance à l’échelle des pays 12

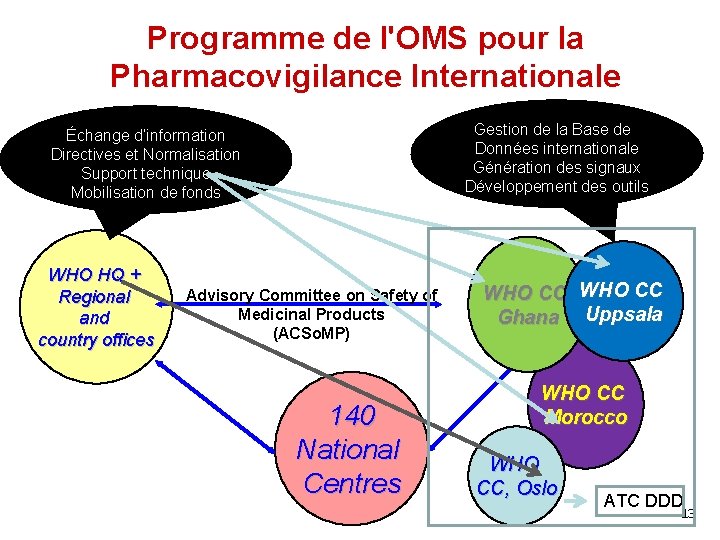
Programme de l'OMS pour la Pharmacovigilance Internationale Gestion de la Base de Données internationale Génération des signaux Développement des outils Échange d’information Directives et Normalisation Support technique Mobilisation de fonds WHO HQ + Regional and country offices Advisory Committee on Safety of Medicinal Products (ACSo. MP) 140 National Centres WHO CC Ghana Uppsala WHO CC Morocco WHO CC, Oslo ATC DDD 13

Les standards minimum en PV et la Boite à outil en PV • Sont des réalisations jointe de l’OMS, du Fonds Mondial (FM) et de leurs partenaires Le FM encourage fortement les pays à mettre en place ces standards minimum en PV: • – – – • Un centre de PV national, identifié, avec ressources (>1 staff), connecté avec WHO/UMC Un système national de notification spontané des EIs Une base de donnée nationale des EIs Un comité technique national sur les EIs Une stratégie de communication (y compris gestion de crise) La boite à outil en PV (‘PV toolkit’) est disponible sur http: //www. pvtoolkit. org/ 14

Plan de la présentation I. La problématique de l’effet indésirable II. Concept, Fonctionnement et Réalisations de la Pharmacovigilance III. Les nouveaux défis pour l’OMS et Partenaires 15

Défis • Notre vision: afin d’assurer au mieux la santé des patients, tout pays doit avoir un service de pharmacovigilance fonctionnel • Cela entraîne des défis notamment: – Politiques, – Stratégiques, – Techniques et – Financiers 16

Défis: politiques • Avocat au plus haut niveau politique, en démontrant le coût des effets indésirables, et le rapport coût-efficacité des systèmes PV • Améliorer implantation de PV dans tous les pays, dans toutes les régions: – Avec l’aide de partenaires comme les centres collaborateurs de l’OMS 17

Défis stratégiques • Passer du concept ‘Sécurité des produits de santé’ au concept ‘Sécurité du patient’ • Renforcer le rôle de la PV dans la détection des EIs hors utilisation normale: – Rôle dans l’usage rationnel des médicaments et la prévention des erreurs médicamenteuses • Intégrer toutes les vigilances pour une meilleure efficience du système – Vaccino, Phyto. V, Cosméto, Matério, Réacto… Vigilances • Développer la PV de produits spécifiques (bioéquivalents, génériques…) • Gérer les média, les industriels… 18

Défis: techniques • Normes et Standards (pour l’OMS et ses partenaires): – Développer et renforcer les Méthodes de référence (collecte de données, analyses…) – Suivi et Évaluation de PV – Harmonisation (définitions…) • Techniques: Améliorer les outils et les services – ‘PV toolkit’ – Fiches de référence techniques – Annuaire de partenaires techniques disponibles, dont les centres collaborateurs de l’OMS 19

Défis, financiers • Coordonner et optimiser les efforts internationaux – Assurer un support de la PV par les bailleurs de fonds (ex: Le Fonds Mondial, Gates, UNITAID…) • Assurer le financement de la PV au niveau national: – Assurer le soutien des décideurs politiques – En particulier, utiliser les fonds pour la PV, ou demander des fonds pour la PV, dans les subventions du Fonds Mondial 20

Conclusion Nous ne pouvons ignorer PV parce que, en détectant EI, et prendre les mesures nécessaires, nous pouvons • sauver des vies, • prévenir des dommages évitables, • réduire le coût global des soins de santé • réduire le gaspillage des ressources, • éviter de perdre des bons médicaments à un usage irrationnel et la résistance, et • d'assurer confiance sur des programmes de santé publique et sur le gouvernement PV est une responsabilité global: des organisations internationales, Gouvernements, de l'industrie et des patients 21

Thank you http: //www. who. int/medicines www. who. int/medicines/areas/quality_safety/safety_efficacy/en/index. html 22
 Dr shanthi paramothayan
Dr shanthi paramothayan Shanti raghavan
Shanti raghavan Wikipedia
Wikipedia Texte expressif caractéristiques
Texte expressif caractéristiques Haribo c'est beau la vie
Haribo c'est beau la vie Coop pour toi et pour moi
Coop pour toi et pour moi Pvnet pharmacovigilance
Pvnet pharmacovigilance What is pharmacovigilance
What is pharmacovigilance Pharmacovigilance quality assurance
Pharmacovigilance quality assurance Application of pharmacovigilance in zambia
Application of pharmacovigilance in zambia Cem stands for in pharmacovigilance
Cem stands for in pharmacovigilance International pharmacovigilance centre
International pharmacovigilance centre Mru medication authority
Mru medication authority Indegene pharmacovigilance
Indegene pharmacovigilance Lareb netherlands
Lareb netherlands Cohort event monitoring in pharmacovigilance
Cohort event monitoring in pharmacovigilance Pharmacovigilance signal detection methods
Pharmacovigilance signal detection methods Pharmacovigilance definition
Pharmacovigilance definition Kålbrok
Kålbrok Principles of pharmacovigilance
Principles of pharmacovigilance Solicited reports in pharmacovigilance
Solicited reports in pharmacovigilance Aims of pharmacovigilance
Aims of pharmacovigilance Pharmacovigilance compliance
Pharmacovigilance compliance