Pharmacovigilance Les nouveaux dfis pour lOMS Pr R





























- Slides: 37

Pharmacovigilance Les nouveaux défis pour l’OMS Pr R. Soulaymani Bencheikh Centre Anti-Poison et de Pharmacovigilance du Maroc rsoulaymani@gmail. com Genève Juin 2011

Plan de la présentation • La problématique de l’effet indésirable • Concept, Fonctionnement et Réalisations de la Pharmacovigilance • Les nouveaux défis pour l’OMS

Paradoxe des Médicaments • Les industries pharmaceutiques développent des médicaments • Les agences de régulation délivrent des AMM • Les médecins prescrivent • Les pharmaciens délivrent • Les patients consomment • Les organismes de sécurité sociale remboursent Des médicaments qui, parfois, peuvent avoir des effets indésirables graves voir mortels

Ampleur du Préjudice Etats-Unis (Harvard Médical Study) : ─ 70% d’incapacité brève ─ 14% décès ─ Plus que les accidents de la voie publique, cancer du sein, SIDA ─ Equivalent au crash de « 2 Boeing 747 tous les 3 jours » (Le Boston Globe) Royaume-Uni (Institute of Medicine study ) : ─ 44 000 - 98 000 décès annuels France (BMJ - 2003) : – décès aux EIM > 2 à 3 fois celui liés aux accidents de la route – 30. 000 personnes – 20. 000 personnes âgées de plus de 65 ans Canada (ICSP - 2005) : – 7, 5% des admissions hospitalières (185 000) – 36, 9 % sont jugés évitables – 20, 8% des patients décèdent OMS: 60 % de ces effets sont évitables Ampleur méconnue dans les pays à faible niveau socio-économique

Effet Indésirable Médicamenteux Définition: Réaction nocive et non voulue faisant suite à l’utilisation d’un produit de santé, se produisant Aux doses normalement utilisées chez l'homme pour la prophylaxie, le diagnostic ou le traitement d’une maladie ou la modification d’une fonction physiologique (et aussi dans toutes les autres conditions) Tout médicament peut être à l’origine d’effets indésirables EI= Incident, Accident ou Pathologie • • Bénin ou grave aigu ou chronique Précoce ou tardif Réversible ou irréversible

Gestion du risque médicamenteux • L’effet indésirable le plus difficile à prévenir est celui qu’on ne connaît pas Tous les médicaments – Tous les effets indésirables doivent être sous la loupe • Le risque médicamenteux : Combinaison entre la probabilité de survenue et la gravité des conséquences d’un évènement • Appréciation du Risque : Identification - Evaluation - Hiérarchisation

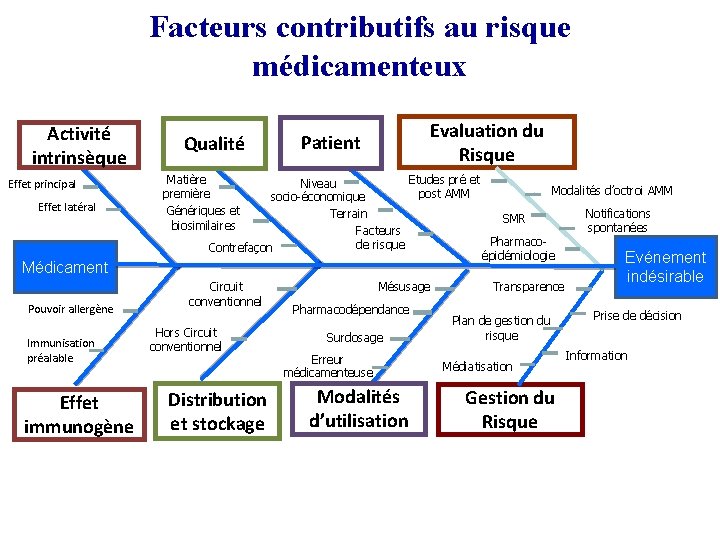
Facteurs contributifs au risque médicamenteux Activité intrinsèque Effet principal Effet latéral Médicament Pouvoir allergène Immunisation préalable Effet immunogène Qualité Evaluation du Risque Patient Matière première Génériques et biosimilaires Etudes pré et Niveau Modalités d’octroi AMM post AMM socio-économique Notifications Terrain SMR spontanées Facteurs Pharmacode risque Contrefaçon épidémiologie Evénement Circuit conventionnel Hors Circuit conventionnel Distribution et stockage Mésusage Pharmacodépendance Surdosage Erreur médicamenteuse Modalités d’utilisation Transparence Plan de gestion du risque Médiatisation Gestion du Risque indésirable Prise de décision Information

La Pharmacovigilance Ensemble de techniques, méthodes et procédures organisées pour identifier, analyser et prévenir le risque d’effet indésirable résultant de l’utilisation du médicament • • 450 ans avant JC: Hippocrate « Primum no nocere » 1960: Organisation internationale de PV 1990: internationalisation du terme Pharmacovigilance Aujourd’hui: – Un pré requis indispensable pour : • Les organismes de réglementation, • Les donateurs: Fond Mondial, fondation Gates etc… • Le fonctionnement légal des firmes pharmaceutiques – Un sujet de médiatisation et de débat – Un modèle pour l’implantation des autres Vigilances Sanitaires

Naissance de la Pharmacovigilance 16ème Assemblée Mondiale en 1963 Résolution de l’Assemblée 16. 36 Clinical and Pharmacological Evaluation of Drugs INVITE les pays membres à créer un système de collecte et de partage de l’information sur les effets indésirables des médicaments

Champs d’application de la Pharmacovigilance Produits de Santé • • Médicaments, vaccins et produits contraceptifs ; Produits de diagnostic biologique et radiologique Dispositifs médicaux Produits diététiques et additifs alimentaires ; Plantes et produits de la pharmacopée traditionnelle Produits homéopathiques ; Cosmétiques Produits vétérinaires. Effets indésirables • • • Conditions normales d’utilisation Erreurs médicamenteuses Echecs thérapeutiques Interaction médicamenteuse Dépendance, tolérance résistance Usage abusif Erreurs médicamenteuses Intoxications, toxicomanie Mauvaise qualité ou contre façon

Méthode de travail • Notification Spontanée de tout effet indésirable par les professionnels de santé • Évaluation des cas par un personnel spécialisé au niveau des centres de pharmacovigilance • Centralisation des cas au niveau national et international • Génération d’alertes • Prise de décision

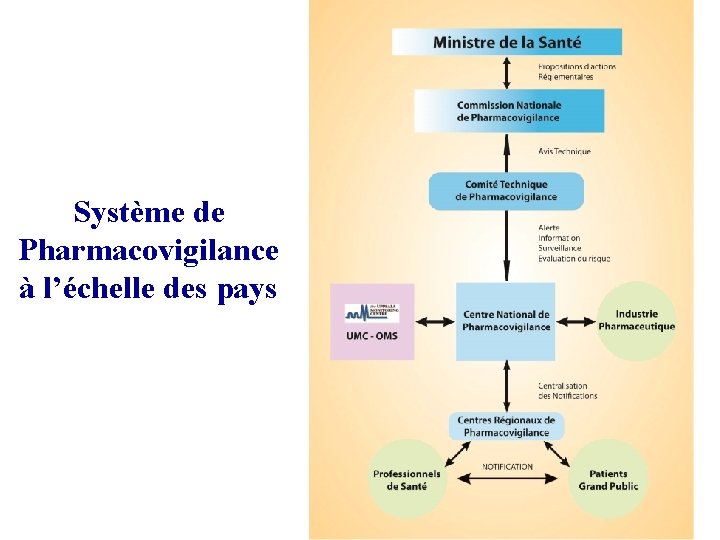
Système de Pharmacovigilance à l’échelle des pays

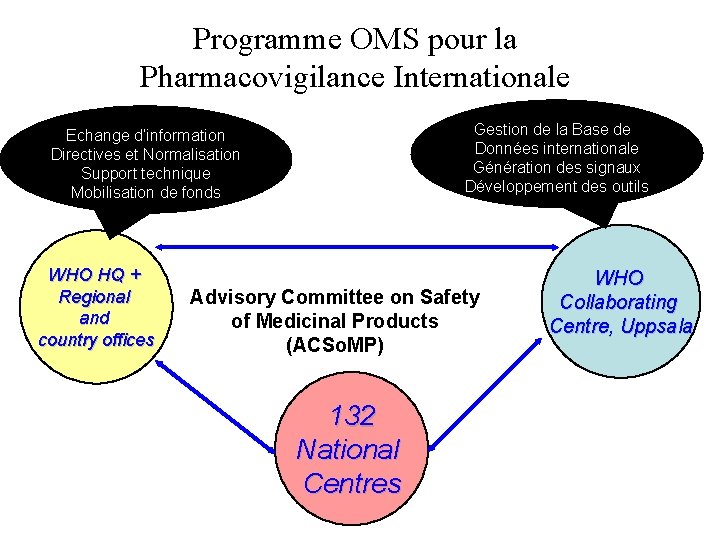
Programme OMS pour la Pharmacovigilance Internationale Gestion de la Base de Données internationale Génération des signaux Développement des outils Echange d’information Directives et Normalisation Support technique Mobilisation de fonds WHO HQ + Regional and country offices Advisory Committee on Safety of Medicinal Products (ACSo. MP) 132 National Centres WHO Collaborating Centre, Uppsala

Les réalisations de L’OMS § • Echange d’information Publications (WHO Pharm Newsletter, Restricted Pharm List, Drug Alerts, WHO Drug Information) International Conference of Drug Regulatory Authorities (ICDRA)

Les réalisations de L’OMS § • Echange d’information Publications (WHO Pharm Newsletter, Restricted Pharm List, Drug Alerts, WHO Drug Information) International Conference of Drug Regulatory Authorities (ICDRA) Guidelines • • • How to set up a PV centre (1996) Importance of Pharmacovigilance (2002) Safety Reporting; detecting and reporting adverse drug reactions (2002) Policy perspectives on medicines ( 2004) Safety monitoring of herbal medicines (2004) Pharmacovigilance in Public Health

Les réalisations de L’OMS § • Echange d’information Publications (WHO Pharm Newsletter, Restricted Pharm List, Drug Alerts, WHO Drug Information) International Conference of Drug Regulatory Authorities (ICDRA) Supports spécifiques aux pays • Cours de pharmacovigilance (Regional UMC, HQs, Maroc. . ) • Formation spécifiques: kava, ARVs, antimalarials…. • Réunion annuelle des centres Guidelines • • • How to set up a PV centre (1996) Importance of Pharmacovigilance (2002) Safety Reporting; detecting and reporting adverse drug reactions (2002) Policy perspectives on medicines ( 2004) Safety monitoring of herbal medicines (2004) Pharmacovigilance in Public Health

Les réalisations de L’OMS § • Echange d’information Publications (WHO Pharm Newsletter, Restricted Pharm List, Drug Alerts, WHO Drug Information) International Conference of Drug Regulatory Authorities (ICDRA) Guidelines • • • How to set up a PV centre (1996) Importance of Pharmacovigilance (2002) Safety Reporting; detecting and reporting adverse drug reactions (2002) Policy perspectives on medicines ( 2004) Safety monitoring of herbal medicines (2004) Pharmacovigilance in Public Health • • • Suports spécifiques aux pays • Cours de pharmacovigilance (Regional UMC, HQs, Maroc. . ) • Formation spécifiques: kava, ARVs, antimalarials…. • Réunion annuelle des centres • • • Partnariat au sein de l’OMS Malaria, HIV/AID, Lepre, Chagas Lymphatic Filariasis, Leishmaniasis Vaccines, Traditional Medicines Patient Safety Poisons and Chemicals Safety

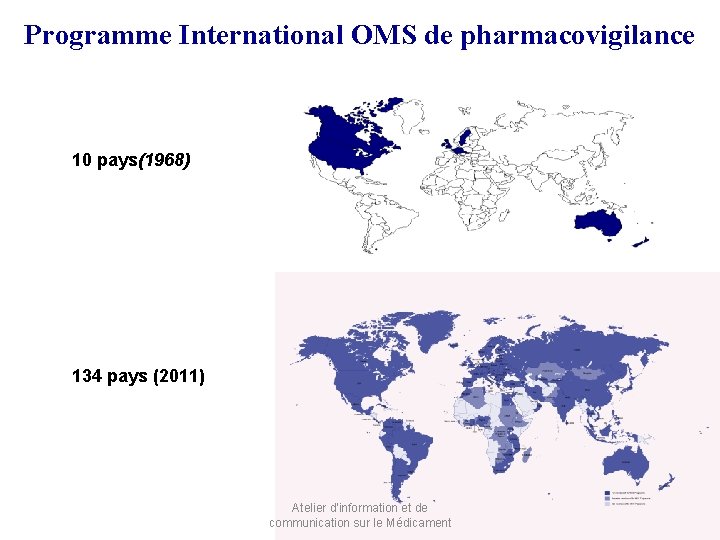
Programme International OMS de pharmacovigilance 10 pays(1968) 134 pays (2011) Atelier d'information et de communication sur le Médicament

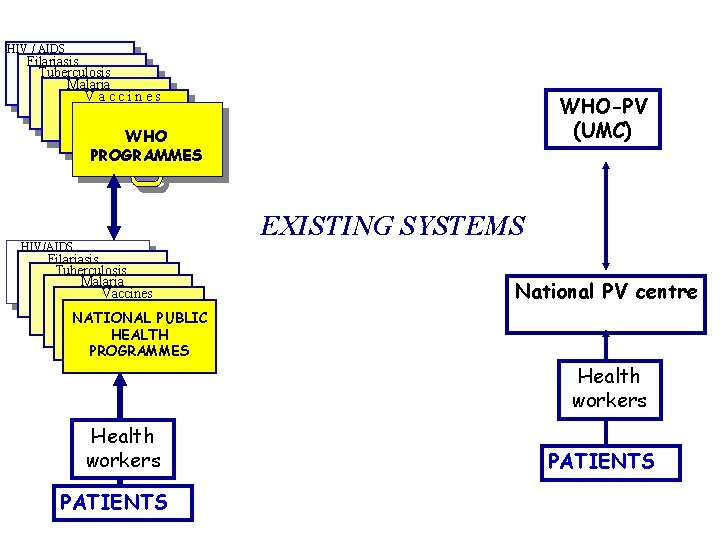
Développement de la pharmacovigilance au sein des programmes de santé

HIV / AIDS Filariasis Tuberculosis Malaria Vaccines WHO-PV (UMC) WHO PROGRAMMES EXISTING SYSTEMS HIV/AIDS Filariasis Tuberculosis Malaria Vaccines National PV centre NATIONAL PUBLIC HEALTH PROGRAMMES Health workers PATIENTS

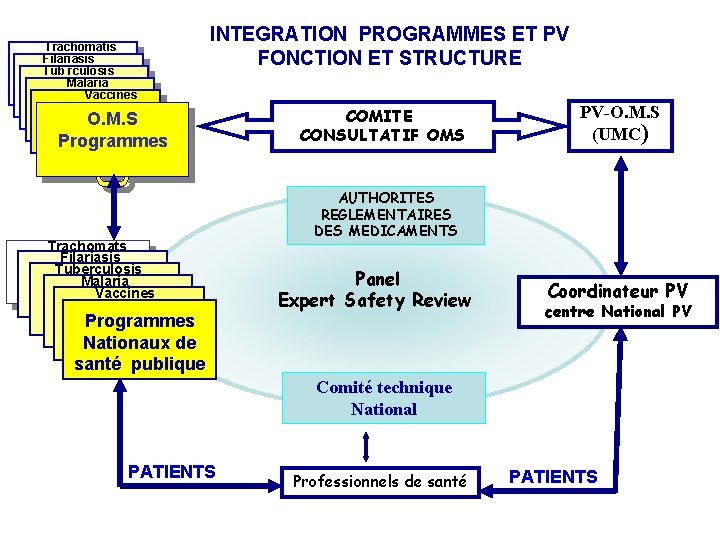
Trachomatis Filariasis Tub rculosis Malaria Vaccines INTEGRATION PROGRAMMES ET PV FONCTION ET STRUCTURE O. M. S Programmes Trachomats Filariasis Tuberculosis Malaria Vaccines Programmes Nationaux de santé publique COMITE CONSULTATIF OMS PV-O. M. S (UMC) AUTHORITES REGLEMENTAIRES DES MEDICAMENTS Panel Expert Safety Review Coordinateur PV centre National PV Comité technique National PATIENTS Professionnels de santé PATIENTS

Défi (1) Promouvoir l’image de la pharmacovigilance • A l’échelle internationale: – Le rôle déterminant du réseau international avec toutes ses instances – Auprès des leaders d’opinion et des bailleurs de fond – Promouvoir son indépendance scientifique • A l’échelle des pays: – Auprès des autorités sanitaires – Auprès des organismes de réglementation sur les médicaments – Auprès des académies et des associations professionnelles

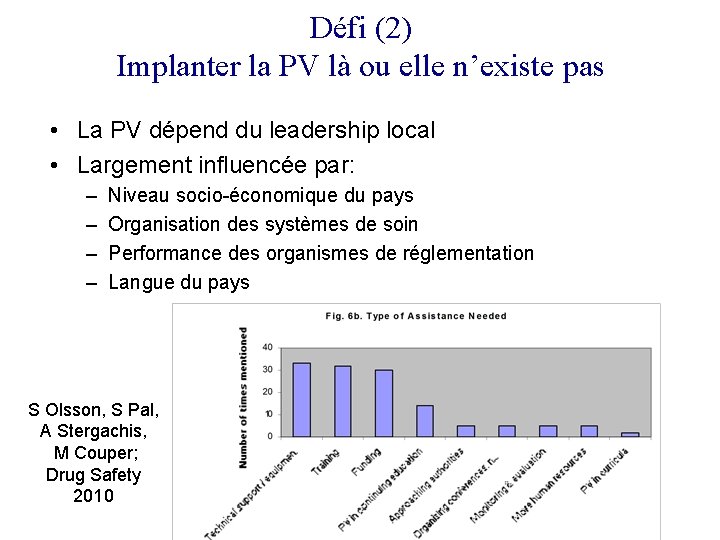
Défi (2) Implanter la PV là ou elle n’existe pas • La PV dépend du leadership local • Largement influencée par: – – Niveau socio-économique du pays Organisation des systèmes de soin Performance des organismes de réglementation Langue du pays S Olsson, S Pal, A Stergachis, M Couper; Drug Safety 2010

Défi (3) Développer des nouvelles méthodes et techniques • Collecte des données: Renforcer les données de la notification spontanée par d’autres méthodes: ‘Cohort Event monitoring’, épidémiologie rétrospective et prospective etc • Travailler plus pour la collecte de données sur le dénominateur pour l’évaluation de la fréquence des EI • Développer des méthodes de PV intensive chez les populations à risque: enfants, femme enceinte, pathologie spéciale etc. . • Développer les Méthodes pour l'identification et l' analyse des signaux (approche de “data-mining”à l'analyse des signaux) • Evaluation de la performance des systèmes de PV: indicateurs,

Défi(4) Harmoniser les termes et les définitions • A l’intérieur du réseau international de Pharmacovigilance: – Adverse réaction, Adverse event, Side effect – Signal, Serious reaction – Causality: certain, probable/likely, possibleunlikely conditional/unclassifiable, Unassessable • Entre différents départements de l’OMS: ex: Alliance Mondiale pour la sécurité du Patient – Adverse event, preventable adverse, Medication error event etc… – P Method, Root cause analysis etc…

Défi (5) Réorienter les objectifs de la PV • Renforcer le rôle de la PV dans la détection des EI hors utilisation normale: rôle dans l’usage rationnel des médicaments et la prévention des erreurs médicamenteuses • Passer du concept ‘Sécurité des produits de santé’ au concept ‘Sécurité du patient’ • Intégrer toutes les vigilances pour une meilleure efficience du système: , Vaccino, Phyto. V, Cosméto, Matério, Réacto… Vigilances

Défi (6) Développer la PV de produits spécifiques Générique • Si la bioéquivalence est assurée: Le profil de PV est identique au Princeps • La PV peut révéler des problèmes de différence entre princeps et générique • Attention aux génériques en cancérologie Bio similaire • Le profil de PV est différent du Bio médicament Princeps • EI communs • Risques Accrus: – Infectieux – Immun allergiques

Défi (7) Anticiper les rumeurs et les actions unilatérales • Média: plus rapides que les organismes de réglementation: – Recherche de Scoop – Disponibilité de l’information sur internet – Influent sur la décision à prendre • Industriels: – Parfois manque de transparence: Rofecoxib, Cerivestatine etc – Prise de décisions univoque • Agences de réglementation des pays: – Prise de décision unilatérale – Influent sur les autres agences: Association Dextropropexyphène. Paracetamol

Dextropropoxyphène - Paracétamol Une histoire qui a duré 40 ans • • 1960 : Autorisation de mise sur le marché dans le monde Union Européenne – 2005 : Suède et Royaume-Uni: retrait pour décès par intoxication – 2008 -2009 : réévaluation défavorable du rapport bénéfice risque – 2010 : retrait sur 15 mois des pays de l’Union européenne • FDA – 2009 : Rapport bénéfice risque n’est plus favorable – 2010 : aux doses thérapeutiques maximales, modifications de l’ECG, troubles du rythme cardiaque, à l’origine de mort subite • France • Maroc – enquête du CAPM – 2006 : Les centres antipoison : décès inférieur à d'autres médicaments antidouleur dits de "palier II" • Septembre 2010 : n’a pas montré de risque élevé par intoxication – Commission Nationale de PV: • 09 oct. 2010 : maintient sur le marché et réévaluer dans un délai de 12 mois la disponibilité d’alternatives thérapeutiques • 26 nov. 2010 : propose le retrait de ces spécialités

Cérivastatine – Rofécoxib Une histoire de transparence Rofécoxib Cérivastatine VIOXX ® STALTOR ® CHOLSTAT ® (2004) (2001) • • Effets indésirable: Rhabdomyolyses dose dépendante • Effets indésirables cardiovasculaires • Effet de type A (inhibition de la prostacycline) risque appréhendé par les pharmacologues • Non détecté par les notifications spontanées • Etude au long cours: excès de mortalité par accidents cardio vasculaires • Retrait par décision du laboratoire Potentialisé par l’association avec des fibrates (LIPUR®) • Aucune information au réseau international • 53 cas de décès en majorité aux USA • Retrait Par décision du laboratoire

Défi (8) Coordonner et optimiser les efforts internationaux • PV dans les programmes de Santé • Support des bailleurs de fond • Les initiatives de l’industrie pharmaceutique • Les sociétés de sous-traitance de la PV

Défi (9) Décentraliser l’expertise et la coordination • Centres collaborateurs de l’OMS: – UMC Africa (Guana) – UMC Arabic (Maroc) – Autres • Centres d’excellence: Maroc: centre pour la formation aux pays francophone Mexico? Singapore? • Collaborations Régionales (WAHO, EAC, ASEAN? ) • Pharmacovigilance sans frontières

Défi (10) Intégrer la notion de plan de gestion du risque Le plan de gestion du risque doit être obligatoire pour: – Toute nouvelle substance active – Tout bio similaire – Tout médicament générique lorsqu’un problème de sécurité d’emploi a déjà été identifié avec le médicament princeps – Les thérapeutiques avancées – Une demande d’extension impliquant un changement significatif (nouveau dosage, nouvelle voie d’administration, nouveau procédé de fabrication d’un produit issu des biotechnologies, nouvelle indication, extension pédiatrique) – A la demande des autorités compétentes

Défi (11) Renforcer le support budgetaire • Réalisé: – Gates foundation: surveillance des EI dans les traitements antipaludéens – Commission Européenne – Fond Mondial: PV Minimum Requirement – Autres: • A prospecter et à renforcer

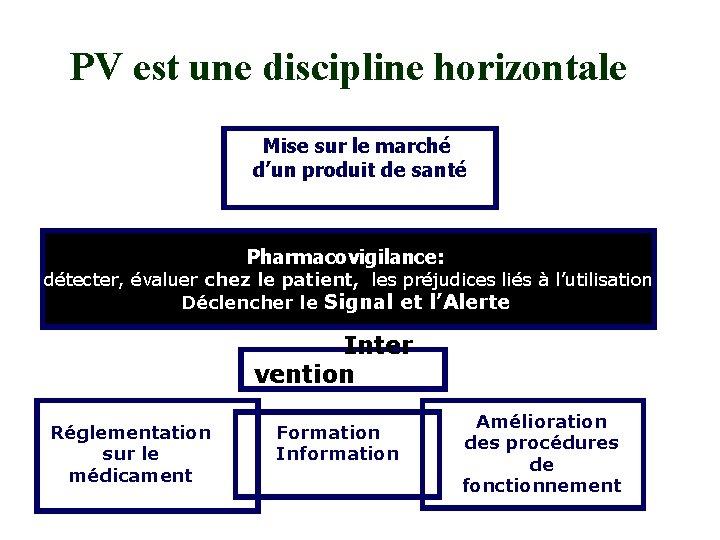
PV est une discipline horizontale Mise sur le marché d’un produit de santé Pharmacovigilance: détecter, évaluer chez le patient, les préjudices liés à l’utilisation Déclencher le Signal et l’Alerte Inter vention Réglementation sur le médicament Formation Information Amélioration des procédures de fonctionnement

Conclusion Les gouvernements Les organisations professionnelles et internationales doivent remplir leurs obligations envers les populations pour que les médicaments soient : – – Administrés en conformité avec les besoins des malades Efficaces, avec une bonne innocuité, un bon coût Prescrits en adéquation avec les états physiques des patients Dispensés de manière sécurisée

Thank you http: //www. who. int/medicines/areas/quality_safety/safety_efficacy/en/index. html
 Wikipedia
Wikipedia Dragibus soft calories
Dragibus soft calories Texte argumentatif et expressif
Texte argumentatif et expressif Coop mazout
Coop mazout Cem stands for in pharmacovigilance
Cem stands for in pharmacovigilance International pharmacovigilance centre
International pharmacovigilance centre Pharmacovigilance definition
Pharmacovigilance definition Adrereport
Adrereport Ainlp
Ainlp Netherlands pharmacovigilance centre lareb
Netherlands pharmacovigilance centre lareb Cohort event monitoring
Cohort event monitoring Pharmacovigilance signal detection methods
Pharmacovigilance signal detection methods Pharmacovigilance definition
Pharmacovigilance definition Pharmacovigilance kursus
Pharmacovigilance kursus Solicited reports in pharmacovigilance
Solicited reports in pharmacovigilance Jamasoft
Jamasoft Pharmacovigilance compliance
Pharmacovigilance compliance Pvnet pharmacovigilance
Pvnet pharmacovigilance Principles of pharmacovigilance
Principles of pharmacovigilance Pharmacovigilance quality assurance
Pharmacovigilance quality assurance Application of pharmacovigilance in zambia
Application of pharmacovigilance in zambia Hggsp de nouveaux espaces de conquête
Hggsp de nouveaux espaces de conquête Explorer de nouveaux horizons
Explorer de nouveaux horizons Demi-fond eps nouveaux programmes
Demi-fond eps nouveaux programmes Activité vivre ensemble maternelle
Activité vivre ensemble maternelle A de nouveaux combats partition
A de nouveaux combats partition Accueil des nouveaux arrivants
Accueil des nouveaux arrivants Pyramide de bird pour les nuls
Pyramide de bird pour les nuls Sd wan pour les nuls
Sd wan pour les nuls Il faut chanter pour toutes les mamans du monde
Il faut chanter pour toutes les mamans du monde Outils pour les cfds
Outils pour les cfds Construire les premiers outils pour structurer sa pensée
Construire les premiers outils pour structurer sa pensée бетмига
бетмига Outil pour arracher les dents
Outil pour arracher les dents Comment faire pour rendre une femme heureuse
Comment faire pour rendre une femme heureuse Chiac pour les dummies
Chiac pour les dummies Pour toutes les mamans
Pour toutes les mamans Il faut chanter pour toutes les mamans du monde partition
Il faut chanter pour toutes les mamans du monde partition