Perchalcune reazioni decorrono spontaneamentefino alla conversione comple dei









![a. A + b. B c. C + d. D c ·[D]d [C] DG a. A + b. B c. C + d. D c ·[D]d [C] DG](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-30.jpg)
![a. A + b. B c. C + d. D c ·[D] d C a. A + b. B c. C + d. D c ·[D] d C](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-31.jpg)
![a. A + b. B c. C + d. D c ·[D]d [C] DG a. A + b. B c. C + d. D c ·[D]d [C] DG](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-32.jpg)
![a. A + b. B c. C + d. D c ·[D]d [C] DG a. A + b. B c. C + d. D c ·[D]d [C] DG](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-33.jpg)



- Slides: 41

Perchéalcune reazioni decorrono spontaneamentefino alla conversione comple dei reagenti nei prodotti mentre altre decorrono spontaneamente fino a raggiungere uno stato di equilibrio ?

I due principî della termodinamica 1° L’energia di un sistema termodinamico isolato non si crea né si distrugge ma si trasforma passando da una forma a un'altra 2° In ogni processo spontaneo l’entropia dell’universo aumenta

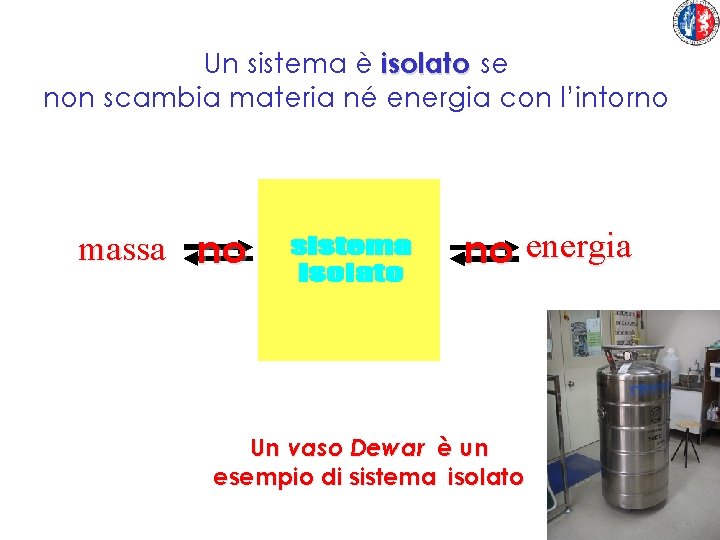
Un sistema è isolato se non scambia materia né energia con l’intorno massa no no energia Un vaso Dewar è un esempio di sistema isolato

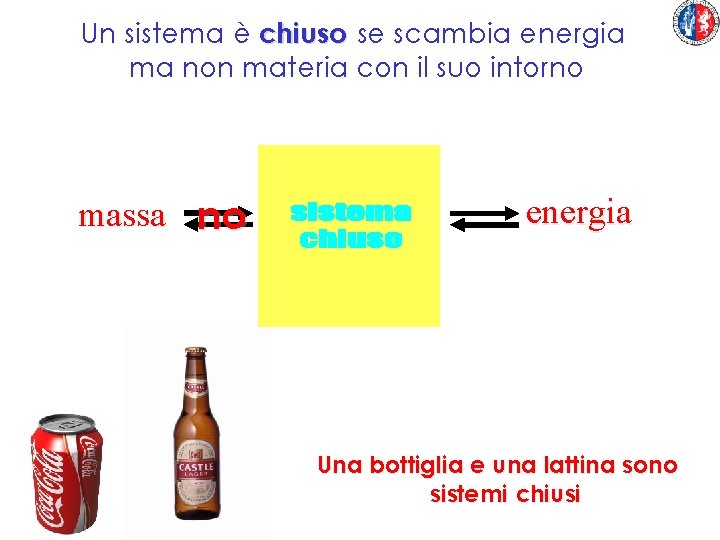
Un sistema è chiuso se scambia energia ma non materia con il suo intorno massa no energia Una bottiglia e una lattina sono sistemi chiusi

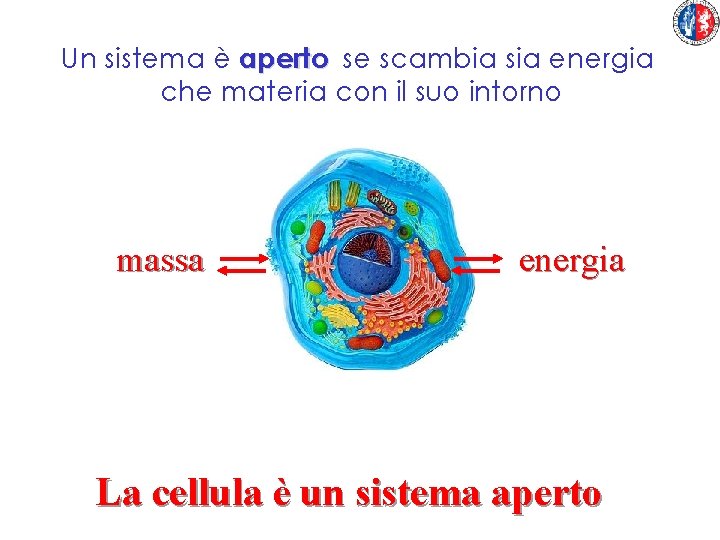
Un sistema è aperto se scambia sia energia che materia con il suo intorno massa energia La cellula è un sistema aperto

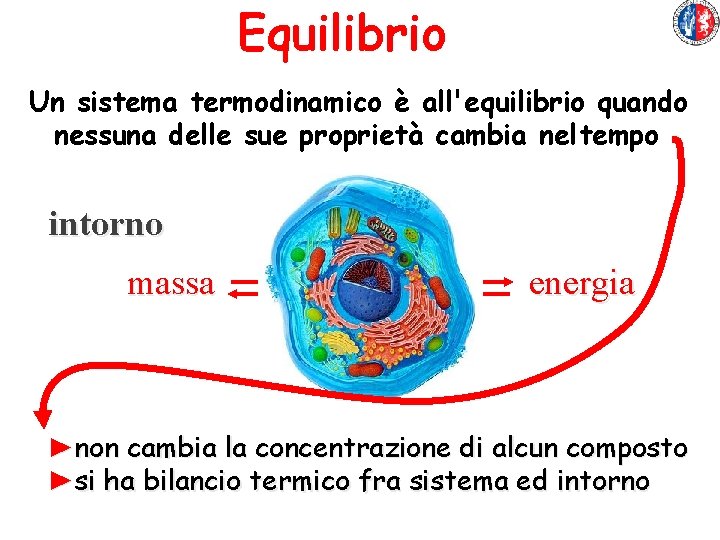
Equilibrio Un sistema termodinamico è all'equilibrio quando nessuna delle sue proprietà cambia nel tempo intorno massa energia ►non cambia la concentrazione di alcun composto ►si ha bilancio termico fra sistema ed intorno

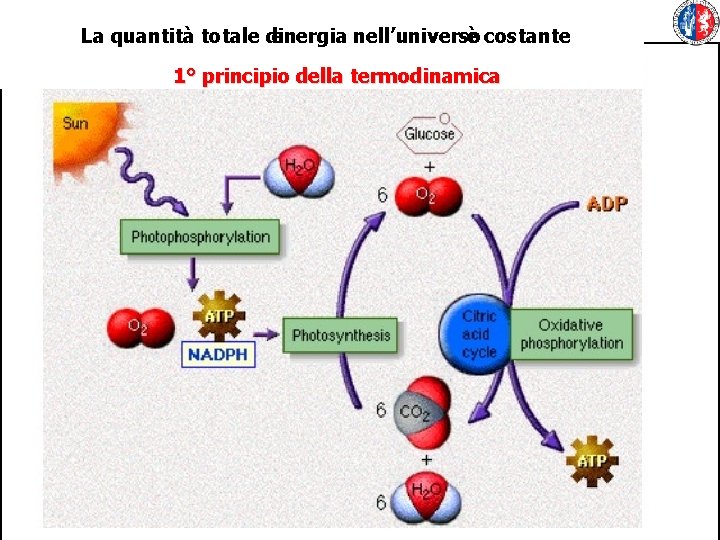
Primo principio della termodinamica L’energia in un sistema termodinamico isolato non si crea né si distrugge ma si trasforma passando da una forma a un'altra

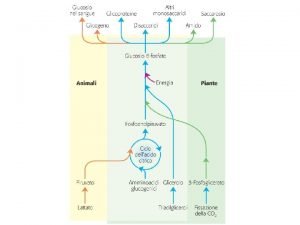
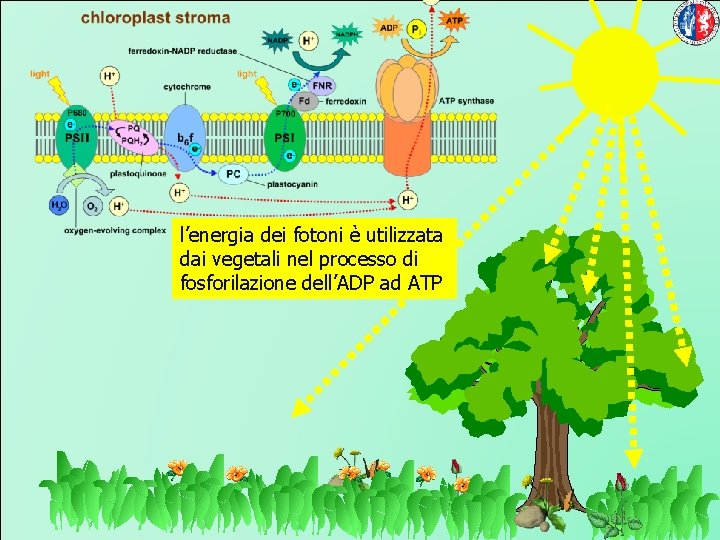
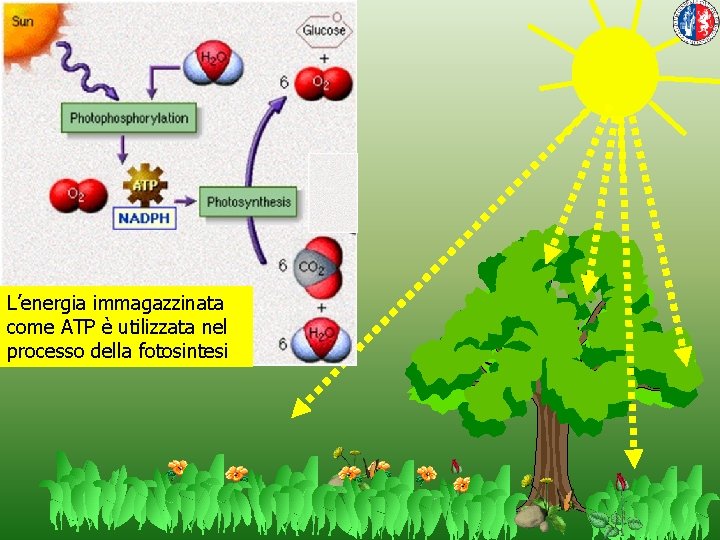
l’energia dei fotoni è utilizzata dai vegetali nel processo di fosforilazione dell’ADP ad ATP

L’energia immagazzinata come ATP è utilizzata nel processo della fotosintesi

Gli animali erbivori traggono dai vegetali l’energia necessaria per la sintesi delle macromolecole e per compiere lavoro. Anche l’uomo converte l’energia chimica degli alimenti in lavoro ed in nuove strutture molecolari

La quantità totale di energia nell’universo è costante 1° principio della termodinamica

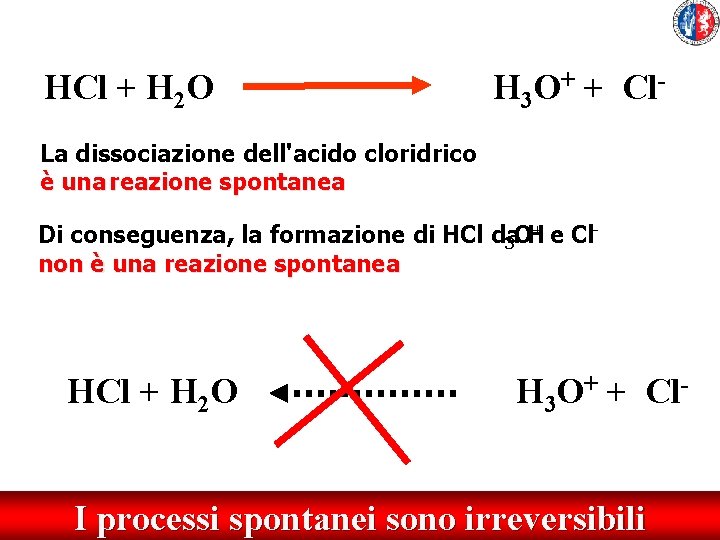
Secondo principio della termodinamica I processi spontanei sono irreversibili Tomba del tuffatore (480 -470 a. C. ) Tempa del prete – Paestum

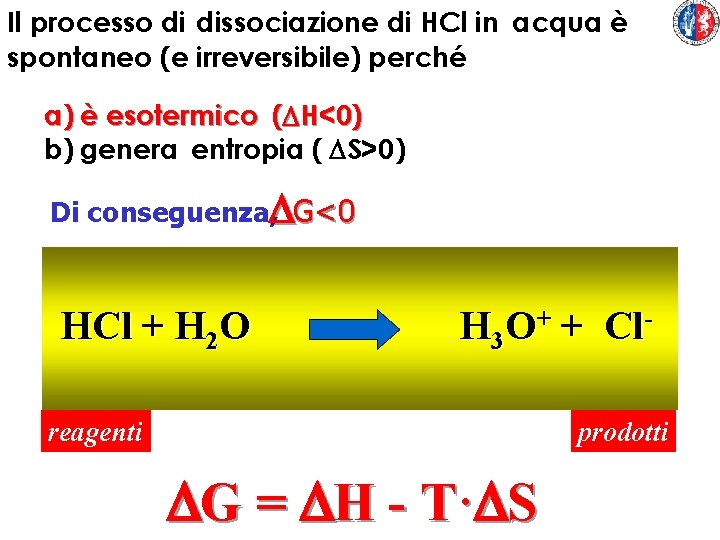
HCl + H 2 O H 3 O+ + Cl- La dissociazione dell'acido cloridrico è una reazione spontanea + Di conseguenza, la formazione di HCl da 3 OH e Cl non è una reazione spontanea HCl + H 2 O H 3 O+ + Cl- I processi spontanei sono irreversibili

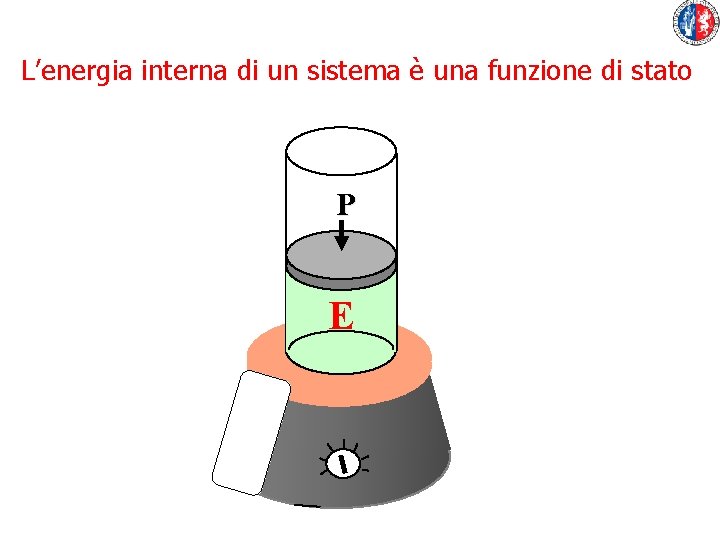
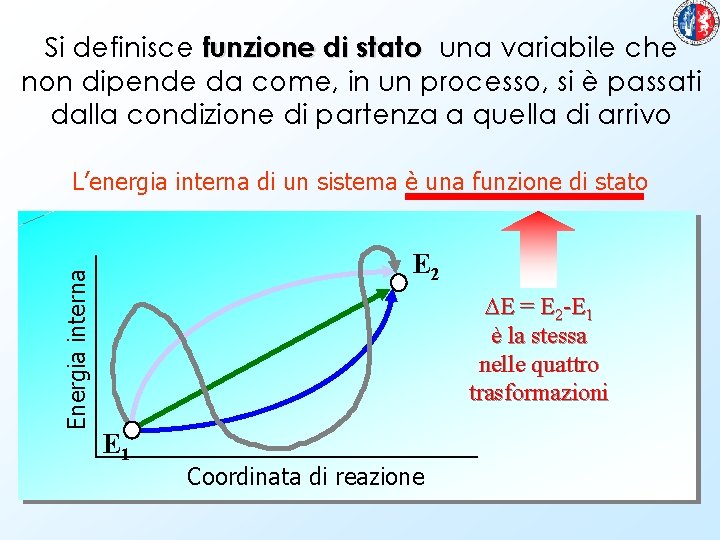
L’energia interna di un sistema è una funzione di stato P E

Si definisce funzione di stato una variabile che non dipende da come, in un processo, si è passati dalla condizione di partenza a quella di arrivo Energia interna L’energia interna di un sistema è una funzione di stato E 2 DE = E 2 -E 1 è la stessa nelle quattro trasformazioni E 1 Coordinata di reazione

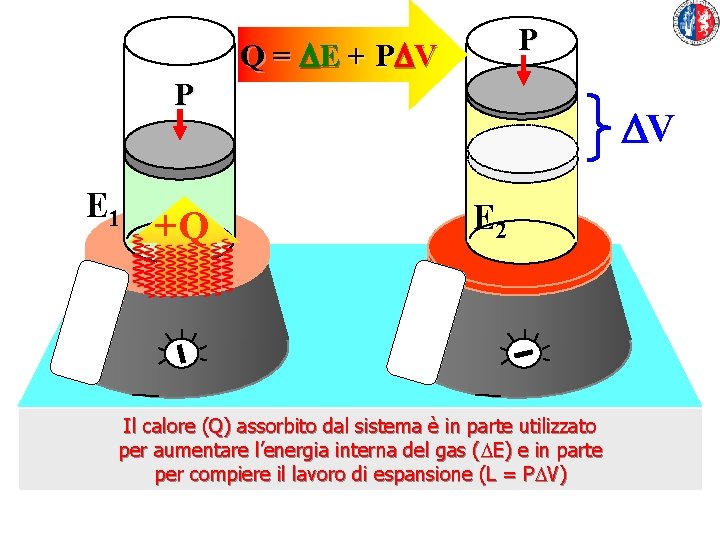
P Q = DE + PDV P E 1 +Q DV E 2 Il calore (Q) assorbito dal sistema è in parte utilizzato per aumentare l’energia interna del gas (DE) e in parte per compiere il lavoro di espansione (L = PDV)

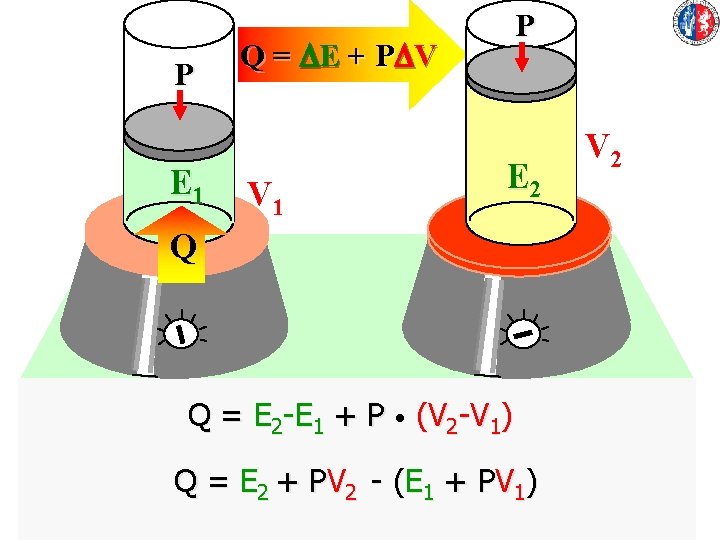
P E 1 P Q = DE + PDV V 1 E 2 Q Q = E 2 -E 1 + P • (V 2 -V 1) Q = E 2 + P V 2 - ( E 1 + P V 1 ) V 2

Definendo una nuova funzione di stato: l’entalpia H dalla equazione. . . Q = E 2 + PV 2 - (E 1 + PV 1) deriva che il calore scambiato, a pressione costante, fra il sistema e il suo intorno è: Q = H 2 - H 1 = DH DH > 0 DH < 0 processo endotermico processo esotermico

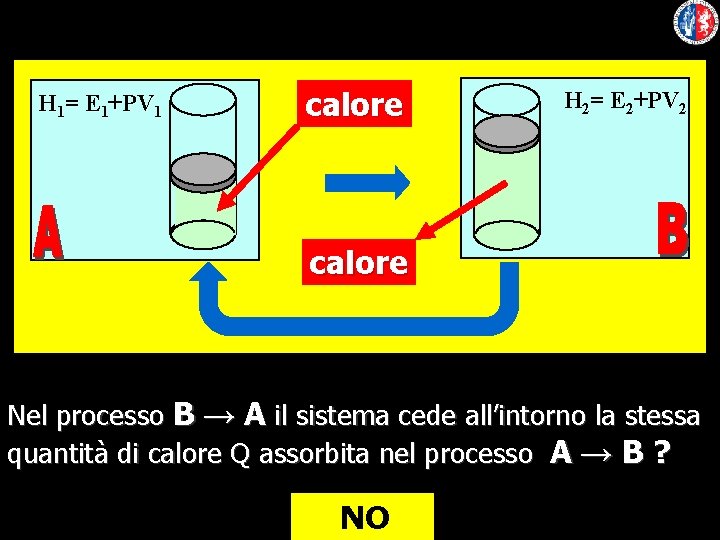
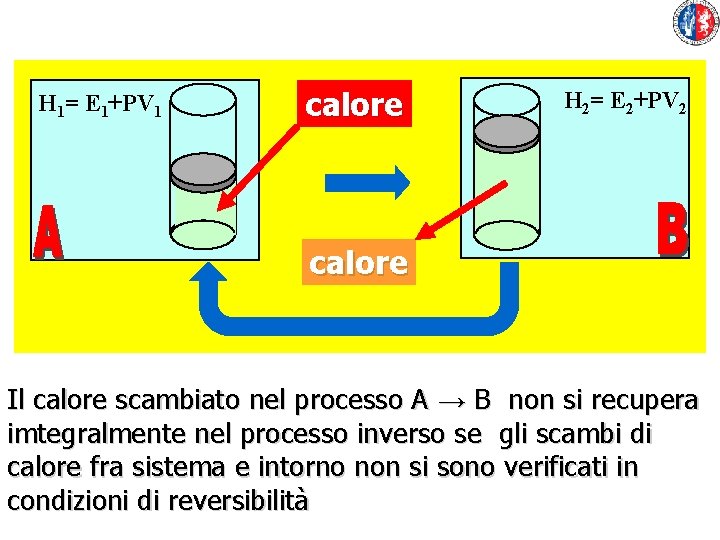
H 1= E 1+PV 1 calore H 2= E 2+PV 2 calore Nel processo B → A il sistema cede all’intorno la stessa quantità di calore Q assorbita nel processo A → B ? NO

H 1= E 1+PV 1 calore H 2= E 2+PV 2 calore Il calore scambiato nel processo A → B non si recupera imtegralmente nel processo inverso se gli scambi di calore fra sistema e intorno non si sono verificati in condizioni di reversibilità

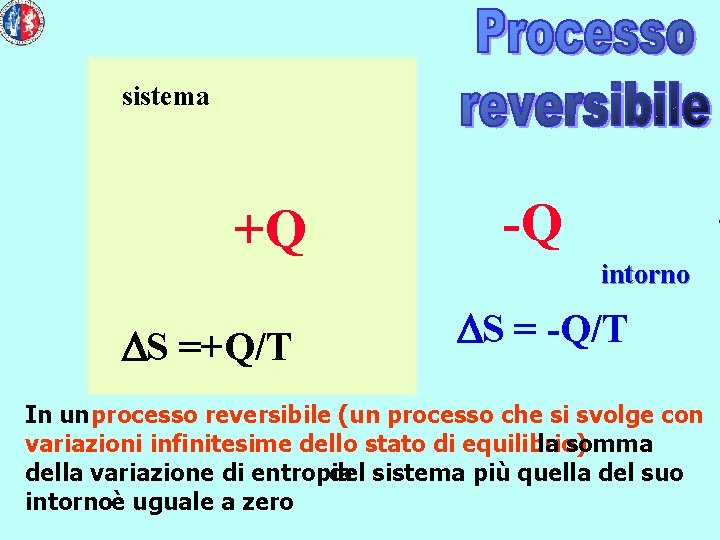
Q S = T Si definisceentropiadi un sistema il rapporto fra il suo contenuto termico e la sua temperaturaassoluta

sistema +Q DS =+Q/T -Q intorno DS = -Q/T In un processo reversibile (un processo che si svolge con variazioni infinitesime dello stato di equilibrio) la somma della variazione di entropia del sistema più quella del suo intornoè uguale a zero

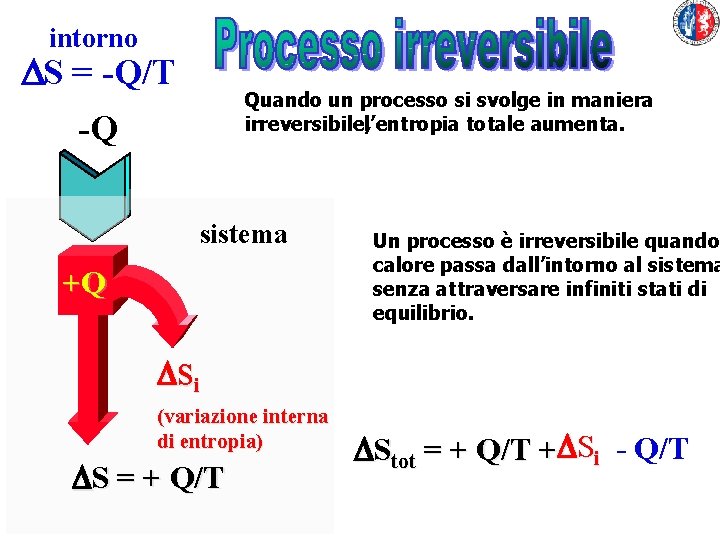
intorno DS = -Q/T Quando un processo si svolge in maniera irreversibile, l’entropia totale aumenta. -Q sistema +Q Un processo è irreversibile quando calore passa dall’intorno al sistema senza attraversare infiniti stati di equilibrio. D si (variazione interna di entropia) DS = + Q/T DStot = + Q/T +DSi - Q/T

La funzione di stato ENERGIA LIBERA è definita come G=H- . TS Essendo H , S , T funzioni di stato, anche G è una funzione di stato. In un processo isotermo in cui varîno sia H che S: G 2 -G 1 = H 2 -H 1 - T· (S 2 -S 1) DG = DH - T·DS

Il processo di dissociazione di HCl in acqua è spontaneo (e irreversibile) perché a) è esotermico (DH<0) b) genera entropia ( DS>0 ) Di conseguenza, DG<0 HCl + H 2 O H 3 O+ + Cl- reagenti prodotti DG = DH - T·DS

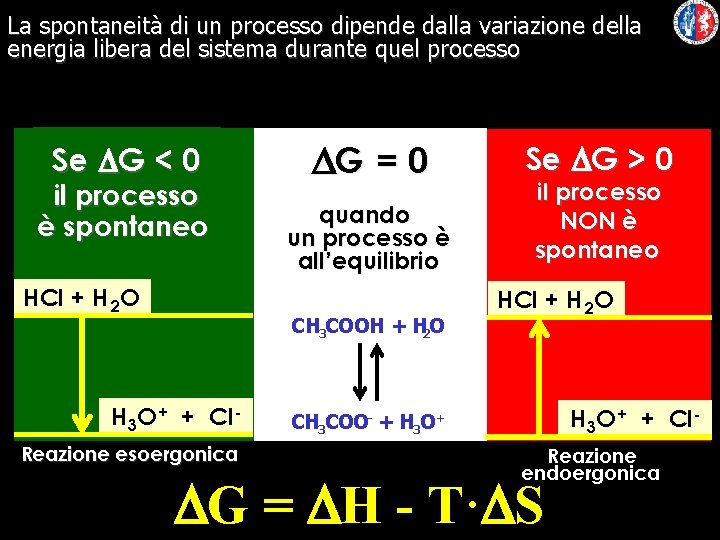
La spontaneità di un processo dipende dalla variazione della energia libera del sistema durante quel processo Se DG < 0 il processo è spontaneo HCl + H 2 O DG = 0 quando un processo è all’equilibrio CH 3 COOH + H 2 O H 3 O + + Cl Reazione esoergonica Se DG > 0 il processo NON è spontaneo HCl + H 2 O H 3 O + + Cl - CH 3 COO- + H 3 O+ Reazione endoergonica DG = DH - T·DS


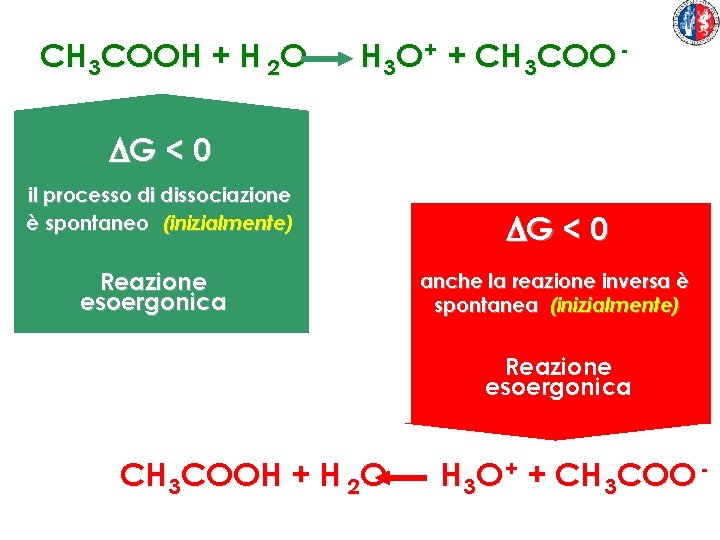
CH 3 COOH + H 2 O H 3 O + + CH 3 COO - DG < 0 il processo di dissociazione è spontaneo (inizialmente) Reazione esoergonica DG < 0 anche la reazione inversa è spontanea (inizialmente) Reazione esoergonica CH 3 COOH + H 2 O H 3 O + + CH 3 COO -

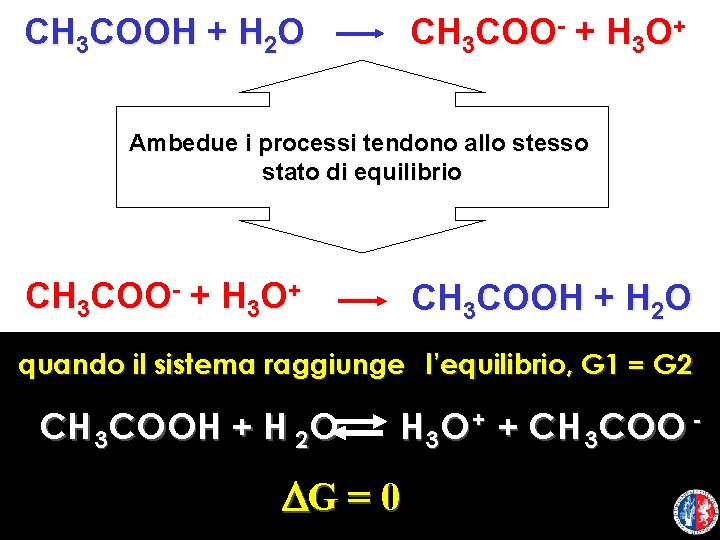
CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ Ambedue i processi tendono allo stesso stato di equilibrio CH 3 COO- + H 3 O+ CH 3 COOH + H 2 O quando il sistema raggiunge l’equilibrio, G 1 = G 2 CH 3 COOH + H 2 O H 3 O + + CH 3 COO - DG = 0
![a A b B c C d D c Dd C DG a. A + b. B c. C + d. D c ·[D]d [C] DG](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-30.jpg)
a. A + b. B c. C + d. D c ·[D]d [C] DG = DGo + RT·ln [A]a ·[B]b Data una reazione di equilibrio generica, il DG è funzione delle concentrazioni di reagenti e prodotti
![a A b B c C d D c D d C a. A + b. B c. C + d. D c ·[D] d C](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-31.jpg)
a. A + b. B c. C + d. D c ·[D] d C D [C] DG = DGo + RT·ln A a ·[B] Bb [A] Se le concentrazioni di reagenti e prodotti sono 1 M si ha: c · 1 d 1 DG = DGo + RT·ln a b 1 · 1 Qualsiasi sia il valore dei coefficienti stechiometrici a, b, c, d, risulta, in queste condizioni, che: D G = D Go
![a A b B c C d D c Dd C DG a. A + b. B c. C + d. D c ·[D]d [C] DG](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-32.jpg)
a. A + b. B c. C + d. D c ·[D]d [C] DG = DGo + RT·ln [A]a ·[B]b Il valore di DGo si può ricavare dalla costante di equilibrio (e viceversa)
![a A b B c C d D c Dd C DG a. A + b. B c. C + d. D c ·[D]d [C] DG](https://slidetodoc.com/presentation_image_h2/7a655e4f202ff71f6c871e2efb71177e/image-33.jpg)
a. A + b. B c. C + d. D c ·[D]d [C] DG = DGo + RT·ln [A]a ·[B]b Se si è all’equilibrio, equilibrio DG = 0 , e quindi : c ·[D]d [C] 0 = DGo + RT·ln a [A] ·[B]b Essendo il sistema all’equilibrio, le concentrazioni di reagenti e prodotti sono le concentrazioni di equilibrio e quindi si ha: DGo = - RT·ln K

a. A + b. B c. C + d. D Se il sistema non è all’equilibrio e le concentrazioni sono tutte diverse da 1 M, per stabilire se una reazione come questa è spontanea verso destra o verso sinistra si applica l’equazione: [C]c ·[D]d DG = DGo + RT·ln [A]a ·[B]b Se DG< 0 a. A + b. B c. C + d. D Se DG> 0 a. A + b. B c. C + d. D


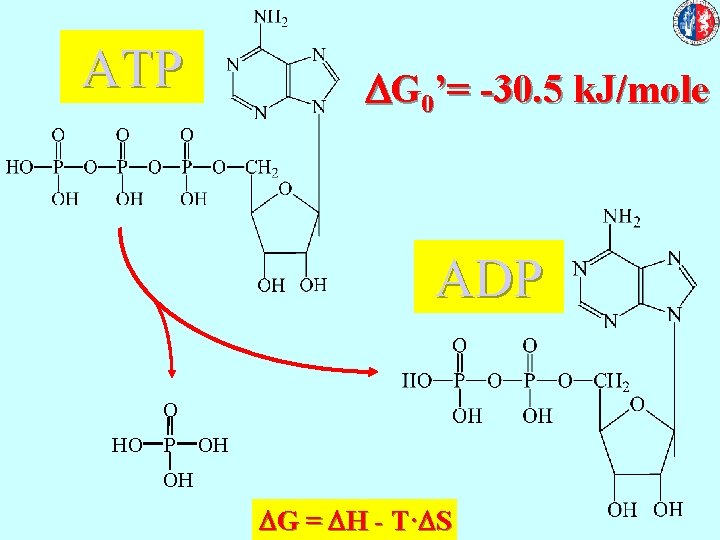
ATP DG 0’= -30. 5 k. J/mole ADP O HO P OH OH DG = DH - T·DS

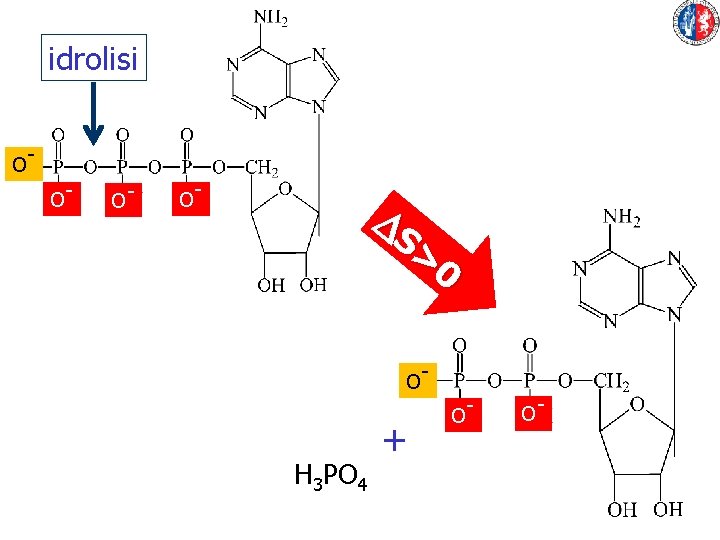
idrolisi OO- O- O- DS > 0 O- H 3 PO 4 + O- O-

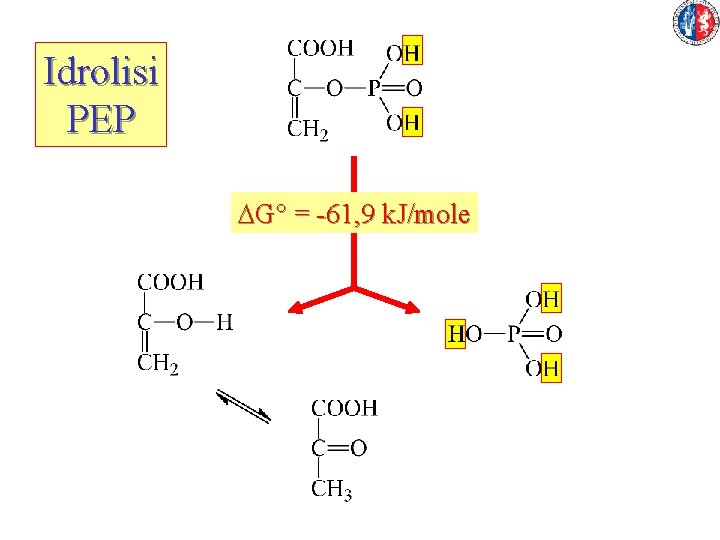
Idrolisi PEP DG° = -61, 9 k. J/mole

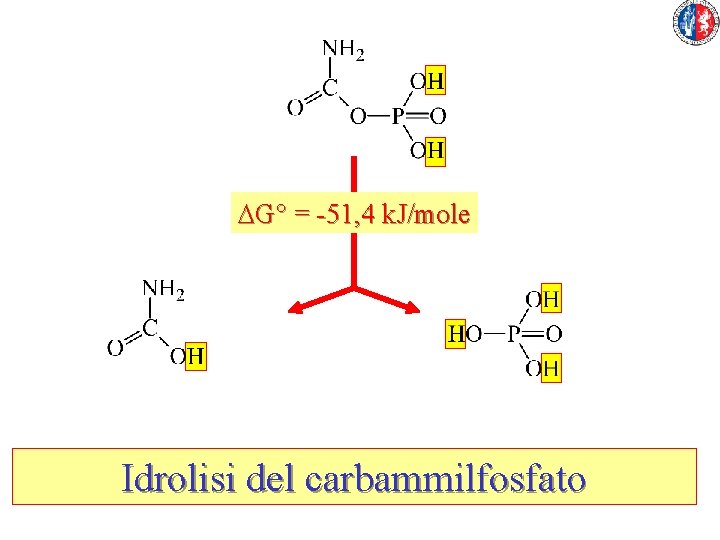
DG° = -51, 4 k. J/mole Idrolisi del carbammilfosfato

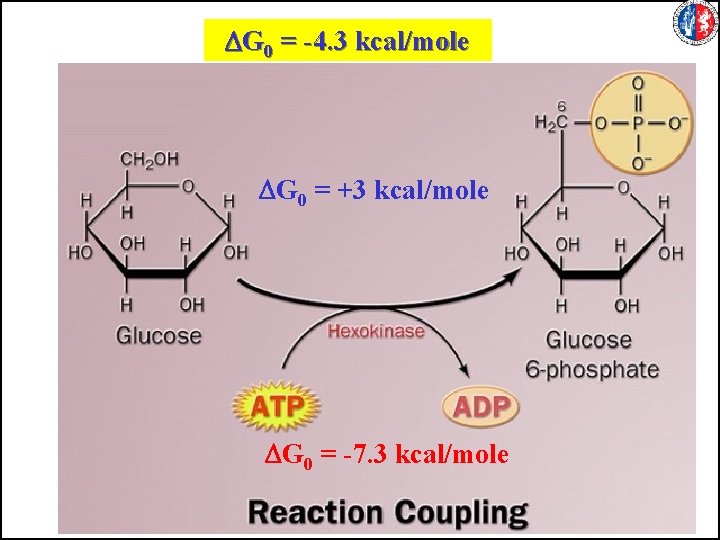
DG 0 = -4. 3 kcal/mole DG 0 = +3 kcal/mole DG 0 = -7. 3 kcal/mole

 Comples sentences
Comples sentences Conversione al cattolicesimo dei longobardi
Conversione al cattolicesimo dei longobardi Con el vino de jerez y el vinillo de rioja
Con el vino de jerez y el vinillo de rioja Mas alla de mis miedos mas alla
Mas alla de mis miedos mas alla Alla ricerca dei colori perduti
Alla ricerca dei colori perduti Regiospecifica
Regiospecifica Bilanciamento reazioni redox
Bilanciamento reazioni redox Equianalgesia tapentadolo morfina
Equianalgesia tapentadolo morfina Disturbo conversione
Disturbo conversione Reazioni ossido riduzione
Reazioni ossido riduzione Reazioni di precipitazione
Reazioni di precipitazione Soluzioni chimica capitolo 17
Soluzioni chimica capitolo 17 Glicolisi reazioni
Glicolisi reazioni Conversione al verismo di verga
Conversione al verismo di verga Reazioni chimiche esempi
Reazioni chimiche esempi Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17 Disturbo di conversione
Disturbo di conversione Dalle soluzioni all'elettrochimica soluzioni capitolo 16
Dalle soluzioni all'elettrochimica soluzioni capitolo 16 Formule chimiche esempi
Formule chimiche esempi Dall'erudizione al bello significato
Dall'erudizione al bello significato Bilanciamento reazioni
Bilanciamento reazioni Sessualizzazione meccanismo di difesa
Sessualizzazione meccanismo di difesa Reazione di sintesi
Reazione di sintesi Unibo conversione voti erasmus
Unibo conversione voti erasmus Equazioni cardinali della statica esercizi svolti
Equazioni cardinali della statica esercizi svolti Conversione gradi francesi gradi tedeschi
Conversione gradi francesi gradi tedeschi Cellula hfr
Cellula hfr Stechiometria zanichelli
Stechiometria zanichelli Reazioni avverse
Reazioni avverse Reazioni di ossido riduzione
Reazioni di ossido riduzione Ossidoriduzioni
Ossidoriduzioni Reazioni tardive al mezzo di contrasto iodato
Reazioni tardive al mezzo di contrasto iodato Sessagesimale a centesimale
Sessagesimale a centesimale Sample and hold spiegazione
Sample and hold spiegazione Scoperte geografiche mappa concettuale
Scoperte geografiche mappa concettuale Conversione dal bello al vero
Conversione dal bello al vero Reazioni di precipitazione
Reazioni di precipitazione Diritti dei bambini canzone
Diritti dei bambini canzone Immagini poligoni regolari
Immagini poligoni regolari Agnus dei agnus dei qui tollis peccata peccata mundi
Agnus dei agnus dei qui tollis peccata peccata mundi Ltp pru p3 allergia
Ltp pru p3 allergia Uccellini in padella alla bresciana
Uccellini in padella alla bresciana