Perch soltanto alcune reazioni decorrono spontaneamente Perch altre

























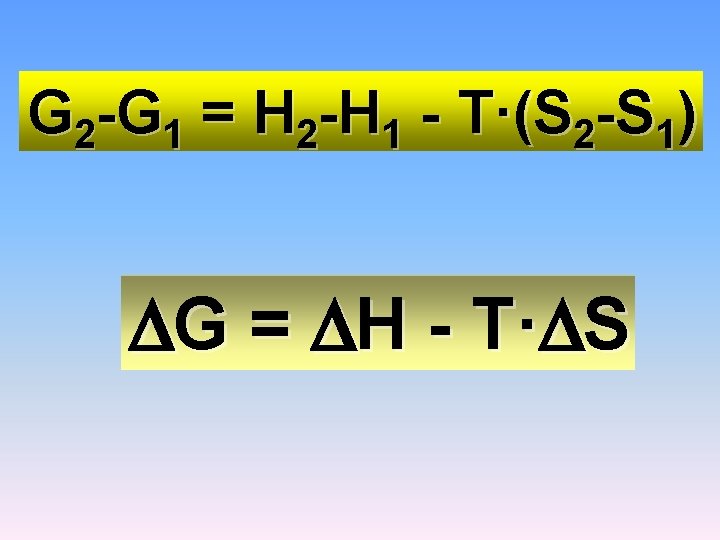








![a. A + b. B c. C + d. D c ·[D]d [C] G a. A + b. B c. C + d. D c ·[D]d [C] G](https://slidetodoc.com/presentation_image_h2/59d05fa199f00019fcc5603b44ead8a1/image-53.jpg)
![a. A + b. B c. C + d. D c ·[D]d [C] G a. A + b. B c. C + d. D c ·[D]d [C] G](https://slidetodoc.com/presentation_image_h2/59d05fa199f00019fcc5603b44ead8a1/image-54.jpg)




![a. A + b. B al tempo t c. C + d. D [C]c a. A + b. B al tempo t c. C + d. D [C]c](https://slidetodoc.com/presentation_image_h2/59d05fa199f00019fcc5603b44ead8a1/image-59.jpg)



- Slides: 66

Perché soltanto alcune reazioni decorrono spontaneamente ? Perché altre reazioni decorrono spontaneamente fino a raggiungere uno stato di equilibrio ?

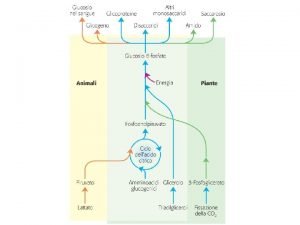
Reagenti Prodotti Durante questo processo vi è scambio di energia Esistono vari tipi di energie che caratterizzano una molecola: - Energia cinetica - Energia radiante - Energia termica - Energia chimica - Energia potenziale Si definisce ENERGIA INTERNA, il contenuto energetico globale di un sistema

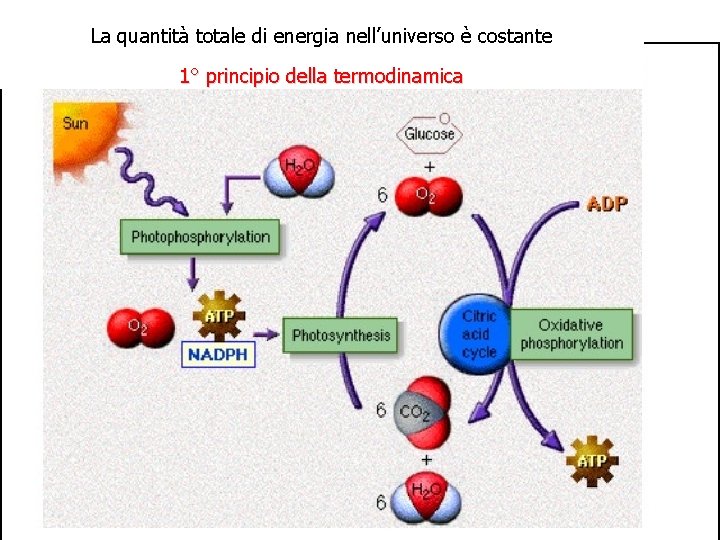
Primo principio della termodinamica La quantità totale di energia nell’universo è costante La termodinamica chimica si occupa degli scambi di energia che accompagnano le reazioni chimiche e l’energia viene generalmente definita come “la capacità di un sistema di compiere lavoro”

Primo principio della termodinamica L’energia di un sistema termodinamico isolato non si crea né si distrugge ma si trasforma passando da una forma a un'altra

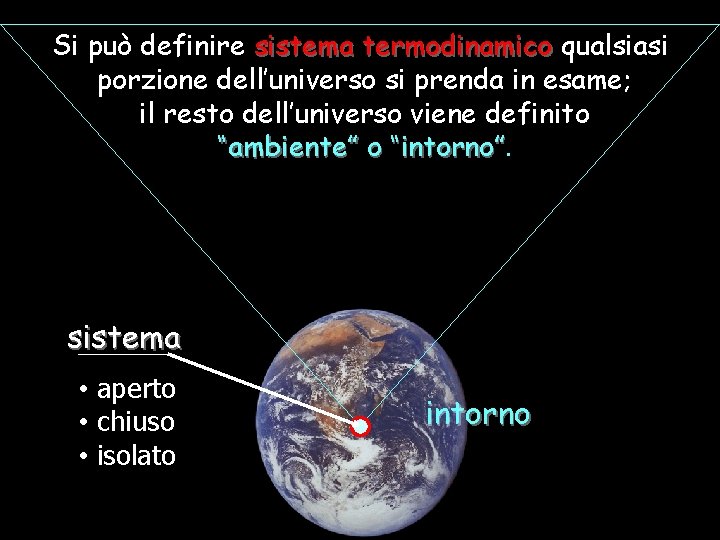
Si può definire sistema termodinamico qualsiasi porzione dell’universo si prenda in esame; il resto dell’universo viene definito “ambiente” o “intorno”

Si può definire sistema termodinamico qualsiasi porzione dell’universo si prenda in esame; il resto dell’universo viene definito “ambiente” o “intorno” sistema • aperto • chiuso • isolato intorno

Un sistema è isolato se non scambia materia né energia con l’intorno massa no no energia Un contenitore per azoto liquido (vaso Dewar) è un sistema isolato

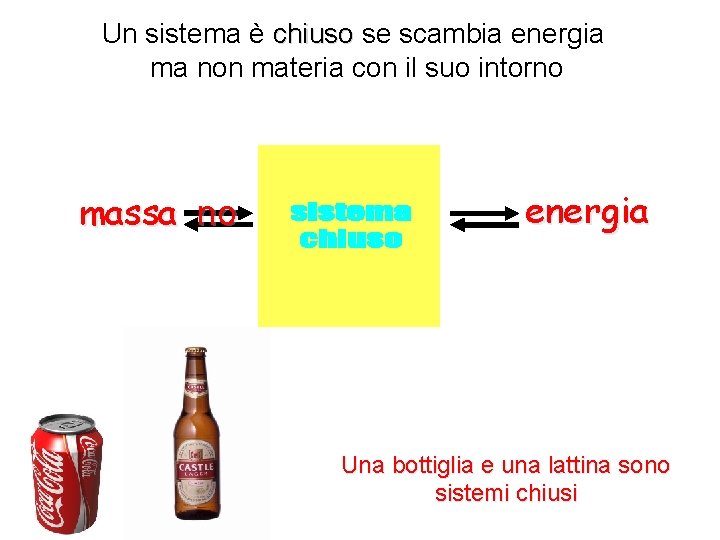
Un sistema è chiuso se scambia energia ma non materia con il suo intorno massa no energia Una bottiglia e una lattina sono sistemi chiusi

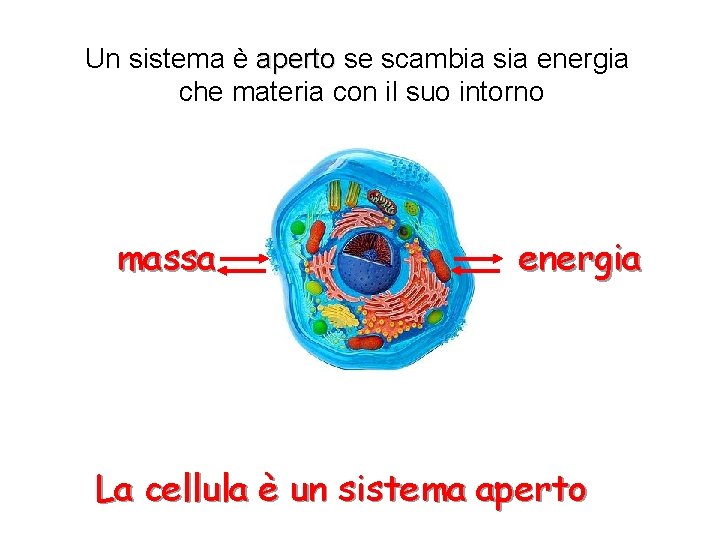
Un sistema è aperto se scambia sia energia che materia con il suo intorno massa energia La cellula è un sistema aperto

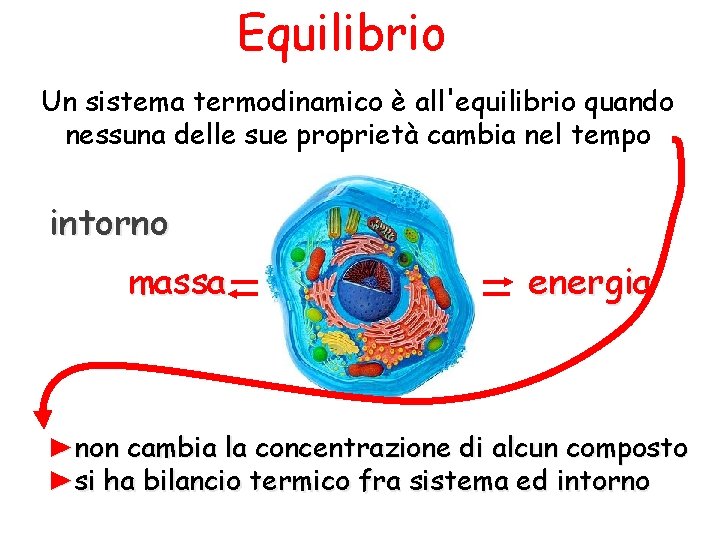
Equilibrio Un sistema termodinamico è all'equilibrio quando nessuna delle sue proprietà cambia nel tempo intorno massa energia ►non cambia la concentrazione di alcun composto ►si ha bilancio termico fra sistema ed intorno

La quantità totale di energia nell’universo è costante 1° principio della termodinamica

Si definisce funzione di stato una variabile che non dipende da come, in un processo, si è passati dalla condizione di partenza a quella di arrivo Per esempio, sono funzioni di stato: • Volume • Temperatura • Pressione • Energia cinetica • Massa • Altitudine • …….

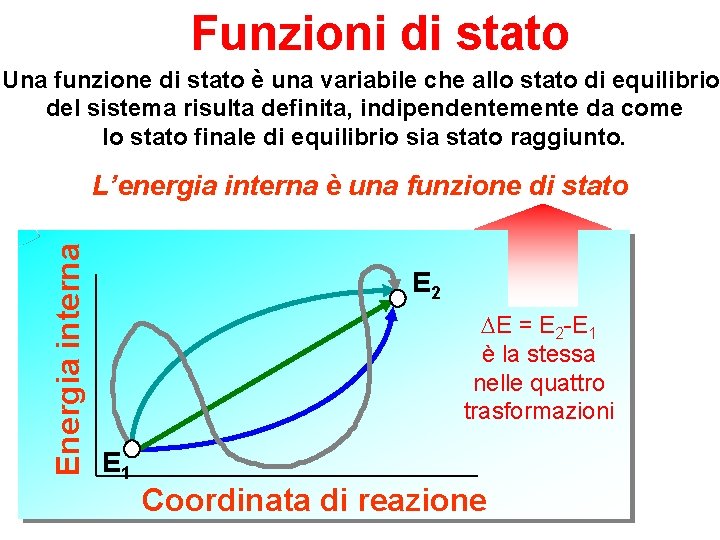
Funzioni di stato Una funzione di stato è una variabile che allo stato di equilibrio del sistema risulta definita, indipendentemente da come lo stato finale di equilibrio sia stato raggiunto. Energia interna L’energia interna è una funzione di stato E 2 E = E 2 -E 1 è la stessa nelle quattro trasformazioni E 1 Coordinata di reazione

funzioni termodinamiche definiscono lo stato di un sistema stato iniziale Ei Hi stato finale energia interna entalpia Ef Hf Gi energia libera Gf Si entropia Sf trasformazione

Energia cinetica traslazionale vibrazionale, rotazionale. . . e tutte le forme di energia. . .

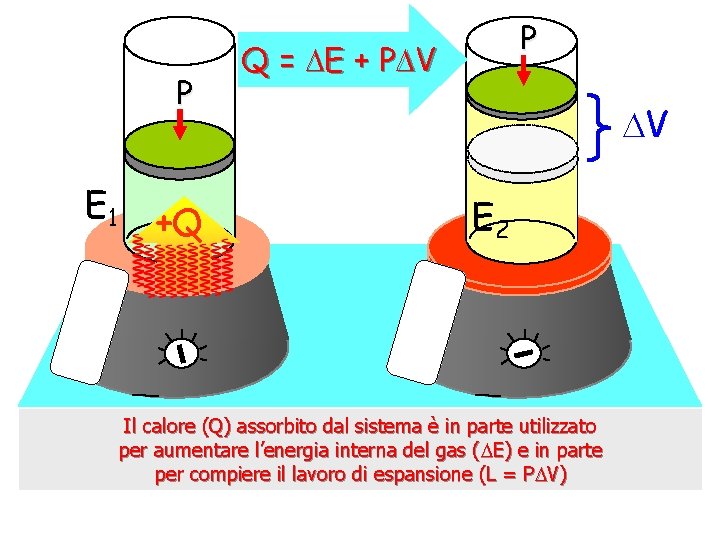
P E 1 +Q P Q = E + P V V E 2 Il calore (Q) assorbito dal sistema è in parte utilizzato per aumentare l’energia interna del gas ( E) e in parte per compiere il lavoro di espansione (L = P V)

P E 1 Q P Q = E + P V V 1 E 2 Q = E 2 -E 1 + P • (V 2 -V 1) Q = E 2 + P V 2 - ( E 1 + P V 1 ) V 2

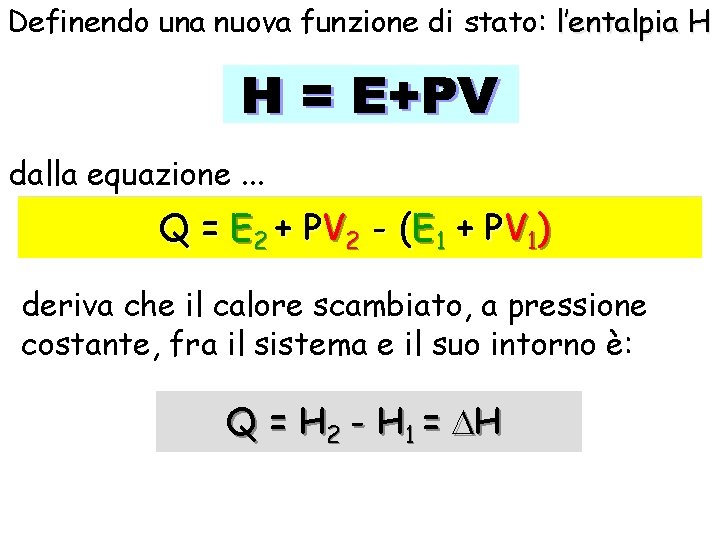
Definendo una nuova funzione di stato: l’entalpia H dalla equazione. . . Q = E 2 + P V 2 - ( E 1 + P V 1) deriva che il calore scambiato, a pressione costante, fra il sistema e il suo intorno è: Q = H 2 - H 1 = H

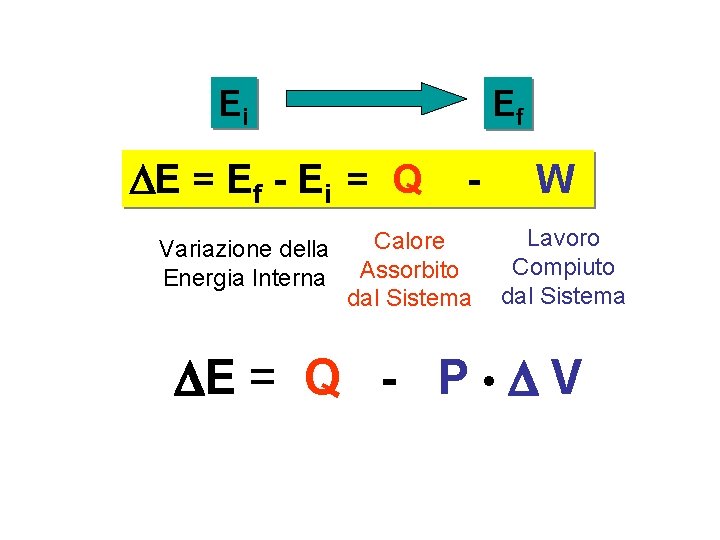
Ei Ef E = Ef - Ei = Q Variazione della Energia Interna - Calore Assorbito dal Sistema W Lavoro Compiuto dal Sistema E = Q - P • V

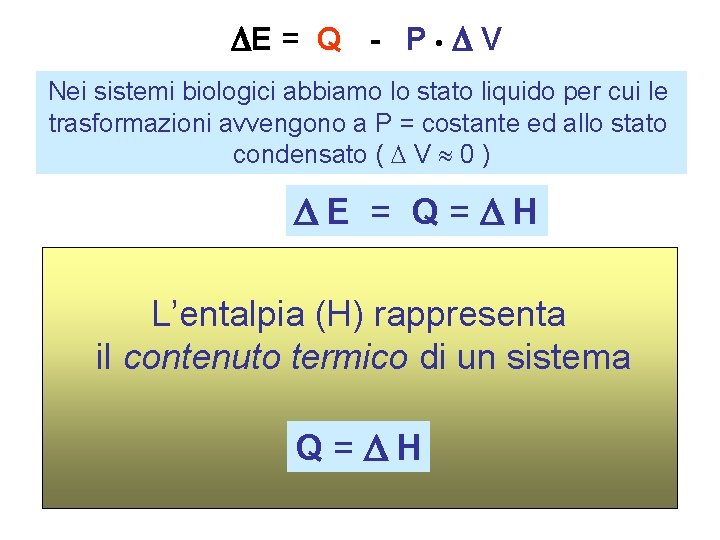
E = Q - P • V Nei sistemi biologici abbiamo lo stato liquido per cui le trasformazioni avvengono a P = costante ed allo stato condensato ( V 0 ) E = Q= H L’entalpia (H) rappresenta il contenuto termico di un sistema Q= H

La variazione di entalpia ( H = Hf - Hi) rappresenta la quantità di calore emessa ( H < 0 processo esotermico) O assorbita ( H > 0 processo endotermico) nel corso di una trasformazione (a pressione costante)

Il calore può essere considerato come un reagente (nelle reazioni endotermiche) o come un prodotto nelle reazioni (esotermiche) e come tale deve essere indicato nell’equazione: N 2(g) + 3 H 2(g) 2 NH 3(g) + 92, 4 KJ N 2(g) + 3 H 2(g) Legge di Hess Dato che l’entalpia è una funzione di stato, il H di una reazione dipende solo dagli stati iniziale e finale del sistema e quindi ha lo stesso valore indipendentemente dal fatto che essa avvenga in un solo stadio o attraverso una serie di passaggi intermedi.

Reazione spontanea a 800° C CH 4 + 2 O 2 213 Kcal ® CO 2 + 2 H 2 O + entalpia CH 4 + 2 O 2 H = - 213 Kcal/mole La reazione avviene con sviluppo di calore: reazione esotermica Le 213 Kcal/mole emesse rappresentano la variazione di Entalpia che avviene nel corso della reazione. H reagenti > H prodotti CO 2 + 2 H 2 O H = Hf - Hi = - 213 Kcal/mole

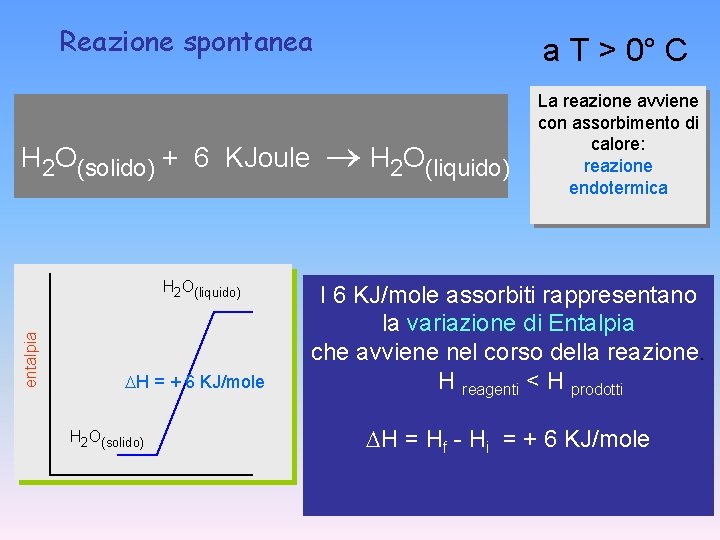
Reazione spontanea H 2 O(solido) + 6 KJoule entalpia H 2 O(liquido) H = + 6 KJ/mole H 2 O(solido) a T > 0° C ® H 2 O(liquido) La reazione avviene con assorbimento di calore: reazione endotermica I 6 KJ/mole assorbiti rappresentano la variazione di Entalpia che avviene nel corso della reazione. H reagenti < H prodotti H = Hf - Hi = + 6 KJ/mole

Lo sviluppo di calore non è condizione sufficiente per stabilire la spontaneità di un processo

La spontaneità di un processo dipende anche dalla variazione di una funzione termodinamica chiamata entropia Si definisce entropia di un sistema il rapporto fra il suo contenuto termico e la temperatura assoluta Q S = T

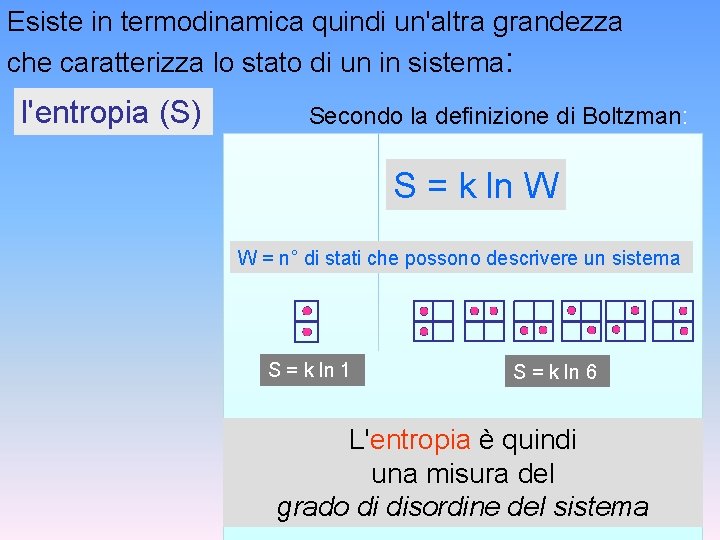
Esiste in termodinamica quindi un'altra grandezza che caratterizza lo stato di un in sistema: l'entropia (S) Secondo la definizione di Boltzman: S = k ln W W = n° di stati che possono descrivere un sistema S = k ln 1 S = k ln 6 L'entropia è quindi una misura del grado di disordine del sistema

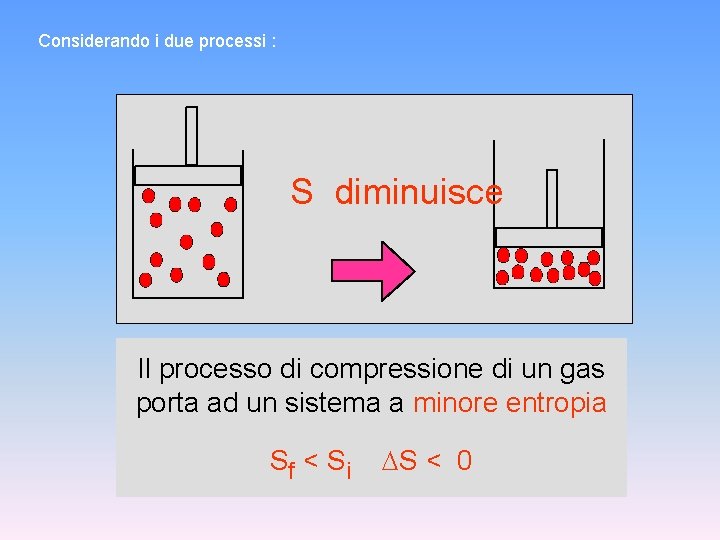
Considerando i due processi : S diminuisce Il processo di compressione di un gas porta ad un sistema a minore entropia Sf < S i S < 0

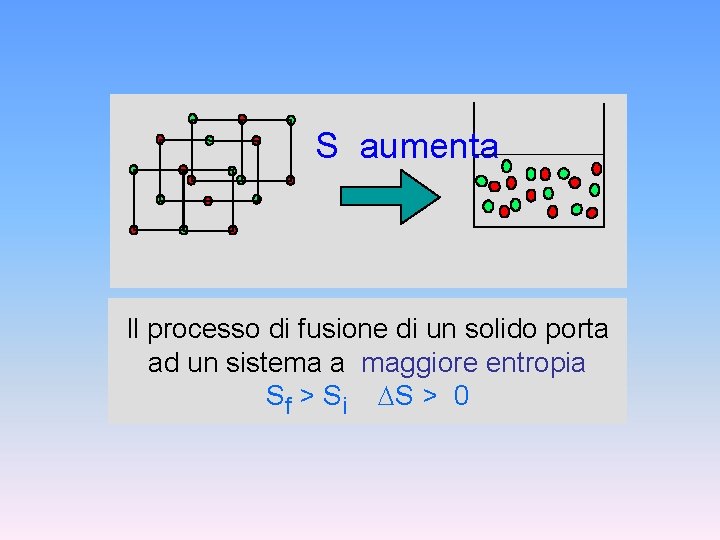
S aumenta Il processo di fusione di un solido porta ad un sistema a maggiore entropia Sf > Si S > 0

L'entropia è una misura del grado di disordine del sistema………. . si definiscono spontanei i processi che comportano un aumento della entropia totale (Stot). Stot = entropia del sistema + entropia dell’intorno

Possono quindi avvenire (cioè sono spontanei) solo quei processi nei quali si verifica un aumento della Suniverso Indipendentemente dalla variazione di Ssistema L'entropia dell'universo è in aumento (2° principio della Termodinamica)

Secondo principio della termodinamica L’entropia dell’universo aumenta in ogni processo spontaneo e rimane invariata in ogni processo all’equilibrio

… e quindi : Ogni processo spontaneo genera entropia altro enunciato del Secondo principio della termodinamica

2° Principio della termodinamica

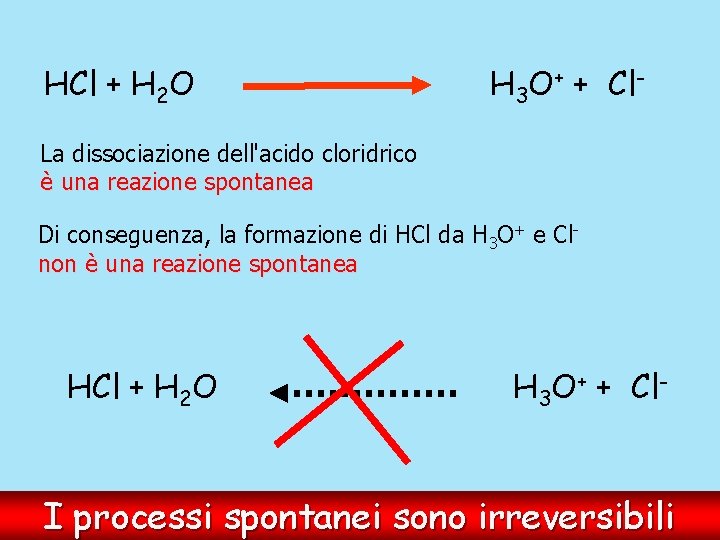
HCl + H 2 O H 3 O+ + Cl- La dissociazione dell'acido cloridrico è una reazione spontanea Di conseguenza, la formazione di HCl da H 3 O+ e Clnon è una reazione spontanea HCl + H 2 O H 3 O+ + Cl- I processi spontanei sono irreversibili

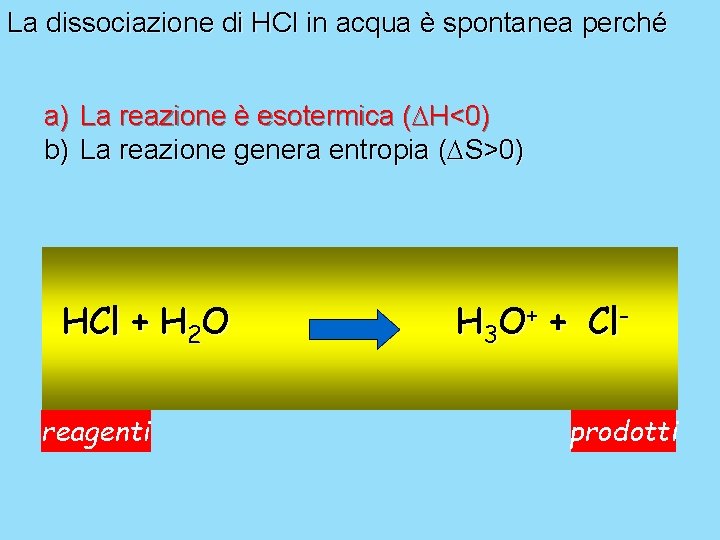
La dissociazione di HCl in acqua è spontanea perché a) La reazione è esotermica ( H<0) b) La reazione genera entropia ( S>0) HCl + H 2 O reagenti H 3 O+ + Clprodotti

. . . questo processo non è spontaneo!!!

Ogni processo spontaneo è irreversibile Questo è un processo spontaneo

L'aumento dell'entropia del sistema ( S > 0) non è condizione sufficiente per stabilire la spontaneità di un processo

J. W. Gibbs definì una nuova grandezza termodinamica per caratterizzare lo stato di un sistema:

La funzione di stato ENERGIA LIBERA è definita come G=H- . TS È possibile valutare la spontaneità o la non spontaneità di un processo dalla variazione della energia libera del sistema durante quel processo
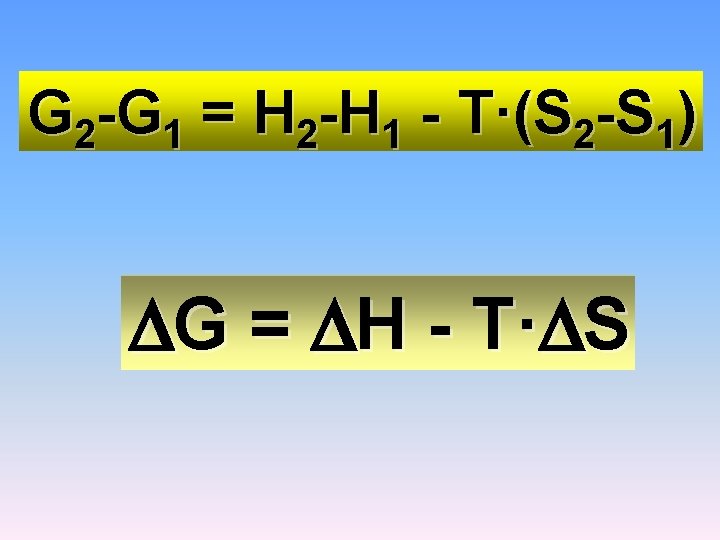
G 2 -G 1 = H 2 -H 1 - T·(S 2 -S 1) G = H - T· S

G = H - T • S Energia utile (convertibile in lavoro) Quantità di calore coinvolta per rendere il sistema più ordinato ( S<0) Quantità di calore prodotta ( H<0) più disordinato ( S>0) assorbita ( H>0) dal sistema

il processo è spontaneo se G < 0 Reazione esoergonica il sistema è all’equilibrio se G = 0 Reazione all’equilibrio se G > 0 il processo non è spontaneo Reazione endoergonica (è invece spontaneo il processo di trasformazione dei prodotti in reagenti)

Sono spontanei (e quindi avvengono) solo quei processi che comportano una diminuzione dell'energia libera del sistema. L'energia libera emessa in un processo (- G) (utilizzabile per compiere lavoro) indica quanta energia il sistema è in grado di spendere per aumentare l'entropia dell'universo (cioè per disordinarlo).


a T = + 10° C (283° K) Si considerino i due processi: H 2 O (solido) ® H 2 O (liquido) il processo è spontaneo il sistema assorbe calore H = + 6, 03. 103 J/mole il sistema aumenta la sua entropia S = + 22, 1 J/°K. mole G = H - T S G = + 6, 03. 103 - [ 283. (+ 22, 1)] = - 224, 3 J/mole

a T = - 10° C (263° K) : H 2 O (liquido) ® H 2 O (solido) il processo è spontaneo il sistema cede calore H = - 6, 03. 103 J/mole il sistema diminuisce la sua entropia S = - 22, 1 J/°K. mole G = H - T S G = - 6, 03. 103 - [ 263. ( - 22, 1)] = - 217, 7 J/mole

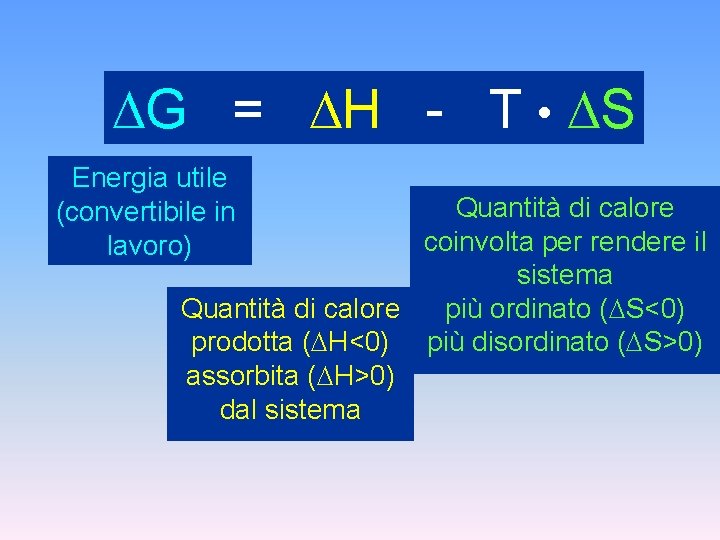
Inoltre, calcolando i G per entrambi i processi a 273° K ( 0° C ) : G fusione = G congel. = 0 Nessuno dei due processi sarà in grado di compiere lavoro utile A 0° C si ha infatti l'equilibrio: H 2 O solido H 2 Oliquido G < 0 caratterizza un processo spontaneo G = 0 caratterizza un processo all’equilibrio G > 0 caratterizza un processo impossibile

Gli effetti dei segni di H e di S e l’effetto della temperatura sulla spontaneità di un processo possono essere così schematizzati: H S G - + - + reazione non spontanea a ogni temperatura + + +/- reazione spontanea solo a elevate temperature - - +/- reazione spontanea solo a bassa temperatura reazione spontanea a ogni temperatura


a. A + b. B c. C + d. D G = Go + RT·ln [C]c ·[D]d [A]a ·[B]b Data una reazione di equilibrio generica, il G risulta essere una funzione delle concentrazioni di reagenti e prodotti
![a A b B c C d D c Dd C G a. A + b. B c. C + d. D c ·[D]d [C] G](https://slidetodoc.com/presentation_image_h2/59d05fa199f00019fcc5603b44ead8a1/image-53.jpg)
a. A + b. B c. C + d. D c ·[D]d [C] G = Go + RT·ln [A]a ·[B]b Che cosa è Go ?
![a A b B c C d D c Dd C G a. A + b. B c. C + d. D c ·[D]d [C] G](https://slidetodoc.com/presentation_image_h2/59d05fa199f00019fcc5603b44ead8a1/image-54.jpg)
a. A + b. B c. C + d. D c ·[D]d [C] G = Go + RT·ln a [A] ·[B]b Se si è all’equilibrio G = 0 e quindi : c ·[D]d [C] 0 = Go + RT·ln [A]a ·[B]b Essendo il sistema all’equilibrio, le concentrazioni di reagenti e prodotti sono le concentrazioni di equilibrio e quindi si ha: Go = - RT·ln K

Come posso conoscere il valore del Go se non conosco K ? Go = - RT·ln K

a. A + b. B G = Go + RT·ln c. C + d. D [C]c ·[D]d [A]a ·[B]b Ponendo uguali a 1 M la concentrazione di reagenti e prodotti si ha: c · 1 d 1 G = Go + RT·ln a b 1 · 1 Qualsiasi sia il valore dei coefficienti stechiometrici a, b, c, d, risulta che, in queste condizioni: condizioni G = Go

Il Go è quindi il valore che assume il G della reazione quando tutti i reagenti e tutti i prodotti sono a concentrazione 1 M. Per la reazione a. A + b. B c. C + d. D G = Go Quando [A] = [B] = [C] = [D] = 1 M

E se, noto K, tutte le concentrazioni sono diverse da 1 M, come faccio a sapere se la reazione è spontanea ? G = Go + RT·ln [C]c ·[D]d [A]a ·[B]b
![a A b B al tempo t c C d D Cc a. A + b. B al tempo t c. C + d. D [C]c](https://slidetodoc.com/presentation_image_h2/59d05fa199f00019fcc5603b44ead8a1/image-59.jpg)
a. A + b. B al tempo t c. C + d. D [C]c ·[D]d G = Go + RT·ln [A]a ·[B]b Se si indica con la lettera Q la frazione [C]c ·[D]d =Q a b [A] ·[B] essendo Go = - RT ln K all’equilibrio, si può riscrivere l’equazione come G = - RT ln K + RT·ln Q

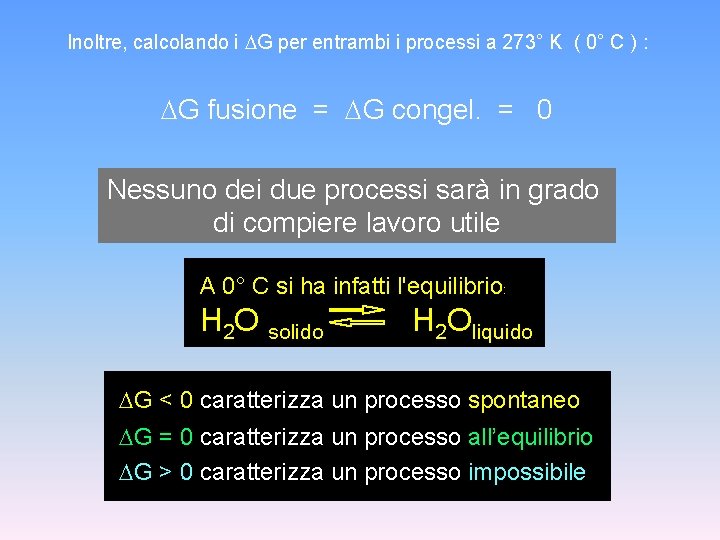
Se il valore del rapporto Q/K è maggiore di 1 il G è positivo (la reazione non è spontanea) Se il rapporto Q/K è minore di 1 il G è negativo (la reazione è spontanea) G = RT·ln Q K G = - RT ln K + RT·ln Q a. A + b. B c. C + d. D

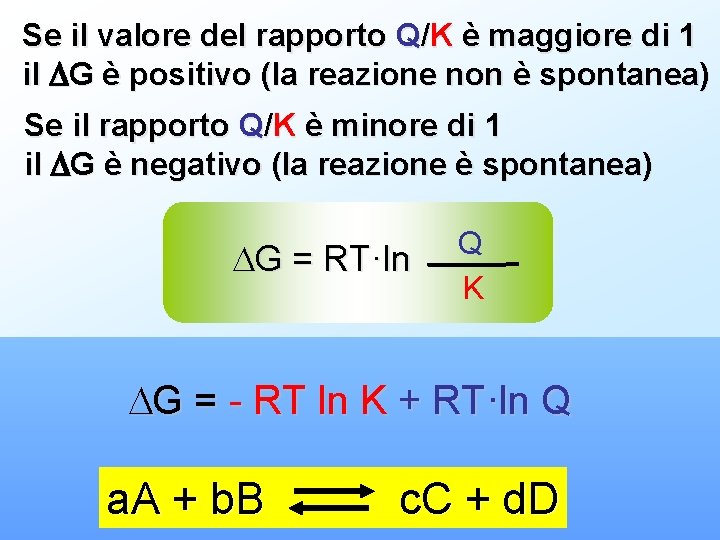
ATP G 0’= -30. 5 k. J/mole ADP O HO P OH OH G = H - T· S

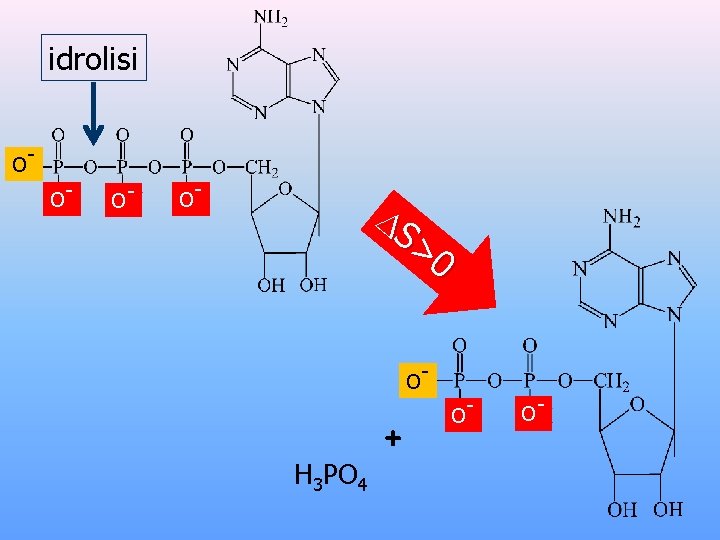
idrolisi OO- O- O- S >0 O- H 3 PO 4 + O- O-

Idrolisi PEP G° = -61, 9 k. J/mole

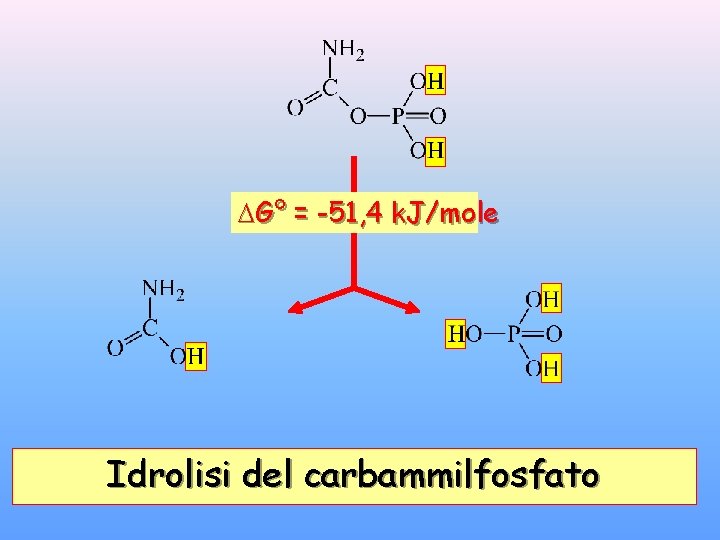
G° = -51, 4 k. J/mole Idrolisi del carbammilfosfato

G 0 = -4. 3 kcal/mole G 0 = +3 kcal/mole G 0 = -7. 3 kcal/mole

 Sono al buio estraggo alcune scarpe
Sono al buio estraggo alcune scarpe Frasi convivenza
Frasi convivenza Pianeti di altre galassie
Pianeti di altre galassie Amor che move il sole e l'altre stelle
Amor che move il sole e l'altre stelle Quando fra l'altre donne ad ora ad ora
Quando fra l'altre donne ad ora ad ora Trasfigurazione di laura
Trasfigurazione di laura Soluzioni chimica più capitolo 17
Soluzioni chimica più capitolo 17 Dalle soluzioni all'elettrochimica soluzioni capitolo 16
Dalle soluzioni all'elettrochimica soluzioni capitolo 16 Bilanciamento reazioni redox
Bilanciamento reazioni redox Patrizia amadio
Patrizia amadio Formule chimiche esempi
Formule chimiche esempi Reazioni chimiche esempi
Reazioni chimiche esempi Mappe concettuali reazioni chimiche
Mappe concettuali reazioni chimiche Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17 Reazioni redox
Reazioni redox Reazioni di precipitazione
Reazioni di precipitazione Reazioni chimiche esempi
Reazioni chimiche esempi Fbpasi
Fbpasi Reazioni avverse
Reazioni avverse Le reazioni chimiche zanichelli capitolo 14
Le reazioni chimiche zanichelli capitolo 14 Vincolo manicotto
Vincolo manicotto Reazioni tardive al mezzo di contrasto iodato
Reazioni tardive al mezzo di contrasto iodato Sistema omogeneo
Sistema omogeneo Ossidazione e riduzione
Ossidazione e riduzione Regiospecificità
Regiospecificità In una reazione di ossidoriduzione
In una reazione di ossidoriduzione Inbreeding in humans pictures
Inbreeding in humans pictures Virtual perch dissection
Virtual perch dissection Lizard dichotomous classification key
Lizard dichotomous classification key Internal anatomy of a perch
Internal anatomy of a perch Perch la fenolftaleina stata aggiunta allacido
Perch la fenolftaleina stata aggiunta allacido Perch nmr software
Perch nmr software Perch testes
Perch testes Limiting factor examples
Limiting factor examples Gastric cecae
Gastric cecae External perch anatomy
External perch anatomy