CAPITOLO 12 Le reazioni di ossidoriduzione e lelettrochimica















- Slides: 20

CAPITOLO 12 Le reazioni di ossido-riduzione e l’elettrochimica Indice 1. Reazioni di ossido-riduzione 2. Reazioni di ossido-riduzione in soluzione 3. Come riconoscere le reazioni di ossido-riduzione 4. Ossidanti e riducenti nelle reazioni redox 5. Bilanciamento delle reazioni redox: metodo del numero di ossidazione 6. Bilanciamento delle reazioni redox: metodo con le semireazioni 7. Le pile o celle voltaiche 8. La scala dei potenziali standard 9. La corrosione 10. Elettrolisi Mappa concettuale: Celle elettrochimiche © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

1 Reazioni di ossido-riduzione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Le reazioni chimiche portano alla formazione di composti ionici sono reazioni di ossido-riduzione e avvengono con trasferimento di elettroni. Una reazione in cui una specie chimica, atomo o ione, perde elettroni è detta di ossidazione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

1 Reazioni di ossido-riduzione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Una reazione in cui una specie chimica, atomo o ione, acquista elettroni è detta di riduzione. Una ossidazione si verifica sempre contemporaneamente ad una riduzione: reazioni di questo tipo sono dette di ossido-riduzione o reazioni redox. Nelle reazioni chimiche portano alla formazione di composti covalenti non si verifica trasferimento di elettroni. In questi composti il doppietto elettronico condiviso è più spostato verso l’atomo più elettronegativo. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 3

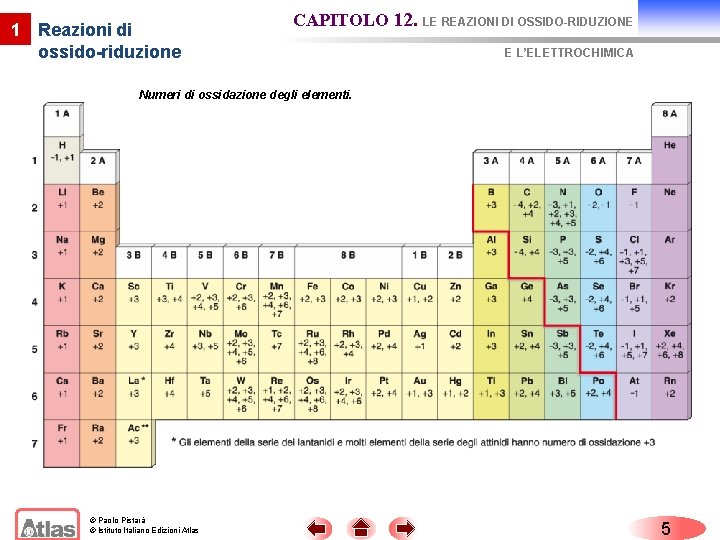
1 Reazioni di ossido-riduzione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA A ciascun atomo di una molecola o di uno ione si assegna un numero (positivo o negativo), il numero di ossidazione (n. o. ) che è in relazione con la perdita o l’acquisto reale o apparente di elettroni rispetto all’atomo isolato. I numeri di ossidazione permettono di seguire il trasferimento degli elettroni durante una reazione. È possibile assegnare il numero di ossidazione ad un atomo in un composto applicando semplici regole. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

1 Reazioni di ossido-riduzione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Numeri di ossidazione degli elementi. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

2 Reazioni di ossido-riduzione in soluzione L’ammoniaca e la candeggina (soluzione di ipoclorito di sodio) non devono mai essere miscelate perché reagiscono formando cloramina (NH 2 Cl), un gas molto pericoloso. NH 3 + Cl. O− NH 2 Cl + OH− © Paolo Pistarà © Istituto Italiano Edizioni Atlas CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA L’acido muriatico (soluzione di HCl) e la candeggina non devono mai essere miscelati perché reagiscono formando cloro, un gas molto pericoloso. 2 H+ + Cl. O− + Cl− Cl 2 + H 2 O Il ferro reagisce con l’acido cloridrico con formazione di idrogeno e di una soluzione di Fe. Cl 2. Fe + 2 H+ Fe 2+ + H 2 6

CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE 2 Reazioni di ossido-riduzione in soluzione E L’ELETTROCHIMICA Il concetto di numero di ossidazione conduce ad una definizione operativa dei termini ossidazione e riduzione 0 +1 +2 0 Fe(s) + 2 H+(aq) Fe 2+(aq) + H 2(g) ossidazione Una semireazione in cui un atomo aumenta il numero di ossidazione è detta di ossidazione. Una semireazione in cui un atomo abbassa (diminuisce) il numero di ossidazione è detta di riduzione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 7

3 Come riconoscere le reazioni di ossido-riduzione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Se vi è variazione del numero di ossidazione di due differenti elementi una reazione è detta di ossido-riduzione. Consideriamo la reazione tra magnesio e cloro che dà cloruro di magnesio. 0 0 +2 – 1 Mg + Cl 2 Mg 2+ + 2 Cl– Poiché sia il magnesio che il cloro variano il loro numero di ossidazione, la reazione in esame è di ossido-riduzione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 8

CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE 4 Ossidanti e riducenti nelle reazioni redox E L’ELETTROCHIMICA In una reazione redox è detta: - riducente la specie chimica che rilascia elettroni e provoca la riduzione di un’altra specie chimica. - ossidante la specie chimica che acquista elettroni e provoca l’ossidazione di un’altra specie chimica 0 Cu(s) agente riducente © Paolo Pistarà © Istituto Italiano Edizioni Atlas + 2 +1 Ag+ (aq) +2 Cu 2+ 0 (aq) + 2 Ag(s) agente ossidante 9

5 Bilanciamento delle reazioni CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE redox: metodo del numero di ossidazione E L’ELETTROCHIMICA Per il bilanciamento segui i seguenti passaggi: a. Assegna i numeri di ossidazione agli atomi. b. Traccia un ponte tra gli atomi che hanno variato il numero di ossidazione. c. Uguaglia gli elettroni ceduti e acquistati. d. Bilancia la reazione in termini di massa. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 10

6 Bilanciamento delle reazioni redox: metodo con le semireazioni CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Molte reazioni di ossido-riduzione si verificano in soluzione acquosa, cioè tra ioni. In questo caso la reazione redox viene divisa in due semireazioni, una di riduzione e l’altra di ossidazione e, per il bilanciamento, si utilizzano i numeri di ossidazione. Si addiziona in uno dei due membri della semireazione ioni H+ se l’ambiente è acido e ioni OH− se l’ambiente è basico e, inoltre, molecole di H 2 O nell’altro membro. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 11

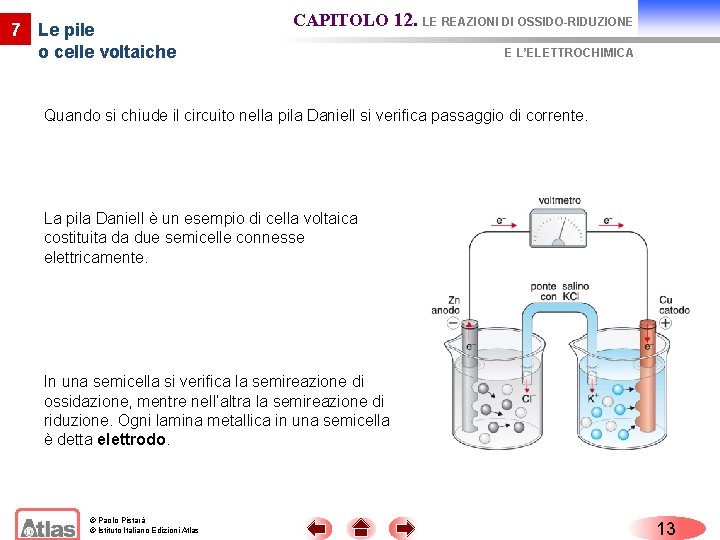
7 Le pile o celle voltaiche CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Le pile (o celle voltaiche) sono dispositivi in cui l’energia chimica di una reazione di ossido-riduzione spontanea è convertita in energia elettrica. La pila Daniell è un dispositivo costituito da: - una lamina di zinco immersa in un becher che contiene una soluzione di solfato di zinco (1 M); - una lamina di rame immersa in un altro becher contenente una soluzione di solfato di rame (II); - un filo metallico, in cui si muovono gli elettroni ceduti dallo zinco, collega le due lamine; - un ponte salino, attraverso il quale migrano gli ioni per chiudere il circuito, mette in contatto le due soluzioni; - un voltmetro inserito nel circuito. © Paolo Pistarà © Istituto Italiano Edizioni Atlas La pila di Daniell è costituita da una semicella a zinco e da una semicella a rame. Le due semicelle sono collegate elettricamente mediante un ponte salino. 12

7 Le pile o celle voltaiche CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Quando si chiude il circuito nella pila Daniell si verifica passaggio di corrente. La pila Daniell è un esempio di cella voltaica costituita da due semicelle connesse elettricamente. In una semicella si verifica la semireazione di ossidazione, mentre nell’altra la semireazione di riduzione. Ogni lamina metallica in una semicella è detta elettrodo. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 13

7 Le pile o celle voltaiche CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA L’elettrodo dove si verifica l’ossidazione costituisce l’anodo della pila e corrisponde al polo negativo ( ). L’elettrodo dove si verifica la riduzione costituisce il catodo della pila e corrisponde al polo positivo (+). In una pila tra le due semicelle esiste una differenza di potenziale elettrico che permette il flusso spontaneo degli elettroni dall’anodo al catodo. La differenza di potenziale è chiamata forza elettromotrice (FEM) o potenziale di cella ed è misurata in V (volt). FEM = Ecatodo Eanodo La FEM della pila Danielle è 1, 10 V. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 14

8 La scala dei potenziali standard di riduzione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Per conoscere il potenziale di una singola semicella si ricorre ad un elettrodo standard come confronto, un elettrodo standard a idrogeno. All’elettrodo a idrogeno si assegna per convenzione potenziale uguale a zero. E° H+ (1 M) / H 2 (g, 1 bar) = 0, 00 V © Paolo Pistarà © Istituto Italiano Edizioni Atlas Schema di una semicella standard a idrogeno (elettrodo a idrogeno). L’elettrodo di platino non prende parte ai processi redox e serve a trasferire gli elettroni. 15

8 La scala dei potenziali standard di riduzione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Secondo la IUPAC i potenziali elettrodici sono riferiti alle semireazioni scritte come riduzioni. Utilizzando soluzioni 1 M alla temperatura di 25 °C essi prendono il nome di potenziali standard di riduzione. Con i. I valori dei potenziali standard di riduzione è possibile: a. individuare quale tra le due coppie di una pila si comporta da anodo (polo –) b. calcolare la FEM di una pila © Paolo Pistarà © Istituto Italiano Edizioni Atlas 16

9 La corrosione CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Per corrosione s’intende il deterioramento dei metalli in seguito a reazioni chimiche con l’ambiente. La corrosione del ferro è un processo di ossido-riduzione in cui sono coinvolti sia l’ossigeno che l’umidità. Un metodo di protezione dalla corrosione è detto ad “anodo sacrificale”. Consiste nel collegare la struttura in ferro da proteggere con blocchi di magnesio o di zinco. Questo metodo di protezione è anche chiamato protezione catodica. Processo di corrosione del ferro. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 17

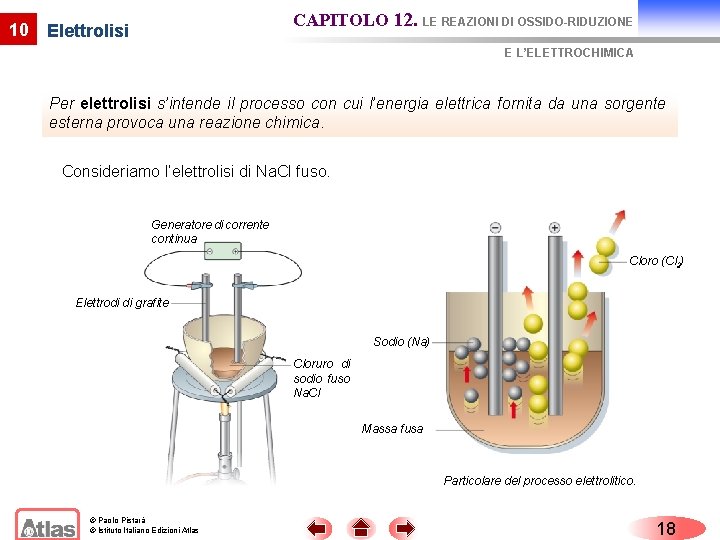
10 CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE Elettrolisi E L’ELETTROCHIMICA Per elettrolisi s’intende il processo con cui l’energia elettrica fornita da una sorgente esterna provoca una reazione chimica. Consideriamo l’elettrolisi di Na. Cl fuso. Generatore di corrente continua Cloro (Cl 2) Elettrodi di grafite Sodio (Na) Cloruro di sodio fuso Na. Cl Massa fusa Particolare del processo elettrolitico. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 18

10 Elettrolisi CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE E L’ELETTROCHIMICA Agli elettrodi si verificano le seguenti reazioni: ( ) Catodo, riduzione 2 Na+ + 2 e 2 Na (+) Anodo, ossidazione 2 Cl 2 + 2 e reazione netta © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2 Na+ + 2 Cl 2 Na + Cl 2 19

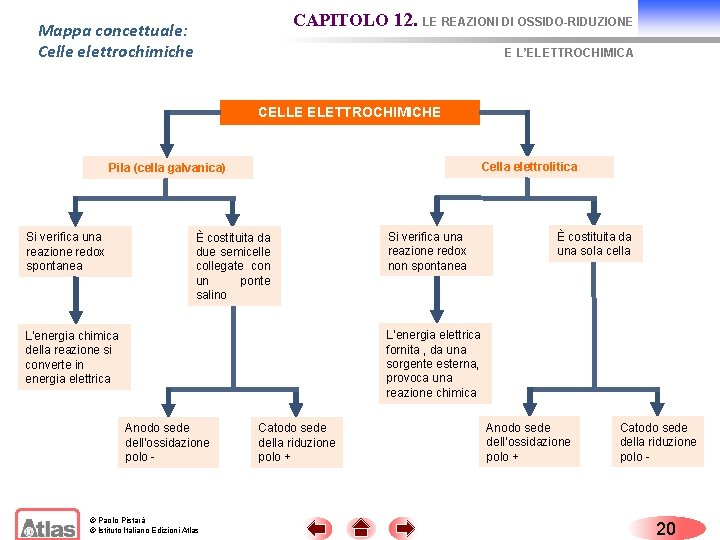
CAPITOLO 12. LE REAZIONI DI OSSIDO-RIDUZIONE Mappa concettuale: Celle elettrochimiche E L’ELETTROCHIMICA CELLE ELETTROCHIMICHE Cella elettrolitica Pila (cella galvanica) Si verifica una reazione redox spontanea È costituita da due semicelle collegate con un ponte salino Si verifica una reazione redox non spontanea È costituita da una sola cella L’energia elettrica fornita , da una sorgente esterna, provoca una reazione chimica L’energia chimica della reazione si converte in energia elettrica Anodo sede dell’ossidazione polo - © Paolo Pistarà © Istituto Italiano Edizioni Atlas Catodo sede della riduzione polo + Anodo sede dell’ossidazione polo + Catodo sede della riduzione polo - 20
 Le reazioni chimiche capitolo 16
Le reazioni chimiche capitolo 16 Dissociazione chimica
Dissociazione chimica Reazioni ossido riduzione
Reazioni ossido riduzione Reazione ossidoriduzione
Reazione ossidoriduzione Potenziometria
Potenziometria Patrizia amadio
Patrizia amadio Soluzioni chimica più capitolo 17
Soluzioni chimica più capitolo 17 Mappe concettuali reazioni chimiche
Mappe concettuali reazioni chimiche Reazioni chimiche esempi
Reazioni chimiche esempi Fbpasi
Fbpasi Ossidazione e riduzione
Ossidazione e riduzione Reazioni chimiche esempi
Reazioni chimiche esempi Luana ferri
Luana ferri Esempio di idrossido
Esempio di idrossido Ossidazione e riduzione
Ossidazione e riduzione Gradi di vincolo pattino
Gradi di vincolo pattino Stechiometria zanichelli
Stechiometria zanichelli Regiospecifica
Regiospecifica Reazioni tardive al mezzo di contrasto iodato
Reazioni tardive al mezzo di contrasto iodato Bilanciamento reazioni redox
Bilanciamento reazioni redox Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17