Penentuan H reaksi melalui 1 Menggunakan konsep Hess






















- Slides: 26

Penentuan ΔH reaksi melalui: 1. Menggunakan konsep Hess a. Dengan rumusan Hess b. Mengubah reaksi-reaksi yang diketahui kemudian menjumlahkan berdasar reaksi yang ditanyakan (dengan perintah: balik, kali) 2. Menggunakan data energi ikatan. ∆Hreaksi = ∑ energi ikatan kiri - ∑ energi ikatan kanan 3. Dalam percobaan menggunakan kalorimeter. By Farid Qim Iya SMAN 1 1

KONSENTRASI Adalah besaran yang menyatakan hubungan kuantitatif antara zat terlarut (solute) dan zat pelarut (solven) Konsentrasi = kerapatan partikel dalam system homogen. Satuan konsentrasi diantaranya: 1. Molaritas (M) Adalah banyaknya mol zat terlarut dalam 1 liter larutan. Mol = liter x Molaritas mmol = m. L x Molaritas By Farid Qim Iya SMAN 1 2

Hubungan massa jenis larutan dengan massa larutan Massa jenis larutan ρ = massa / Volum Massa larutan= V(larutan) x ρ Hitung massa larutan dari 100 m. L HCl 0, 5 M jika ρ larutan dianggap sama dengan ρ air yaitu 1 g/m. L = 1 kg/liter Jawab : massa larutan HCl = 100 m. L x 1 g/m. L = 100 gram By Farid Qim Iya SMAN 1 3

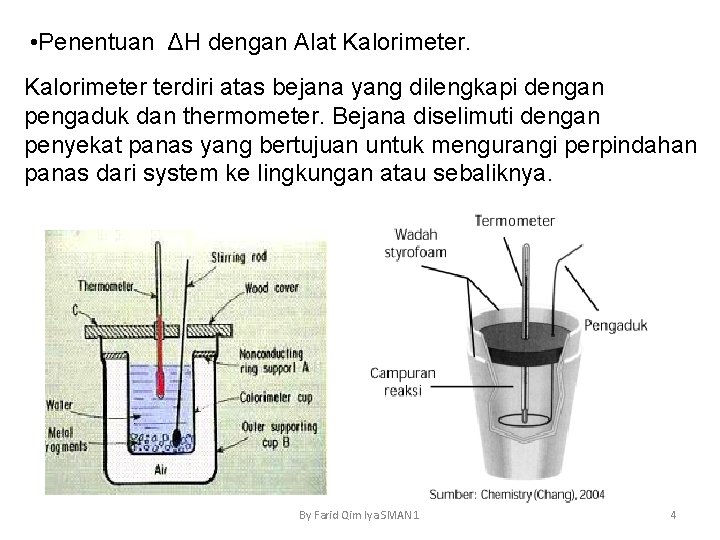
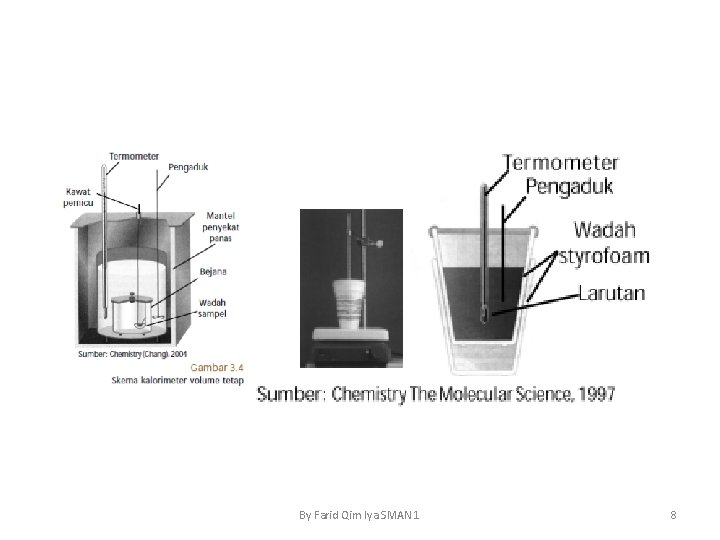
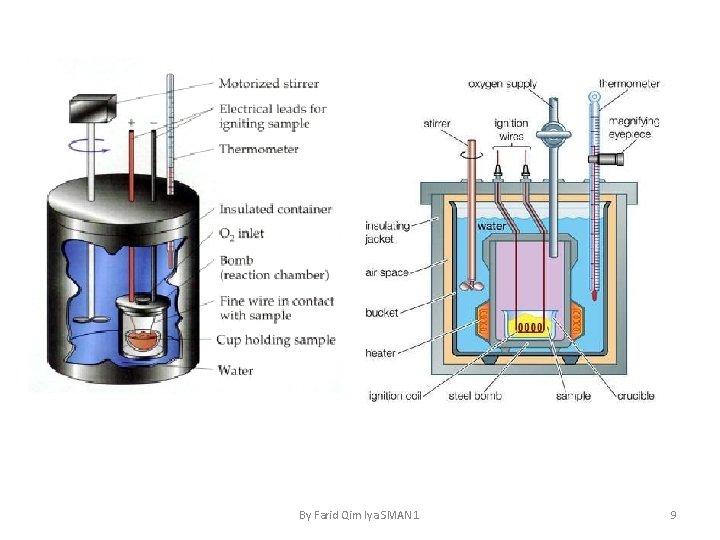
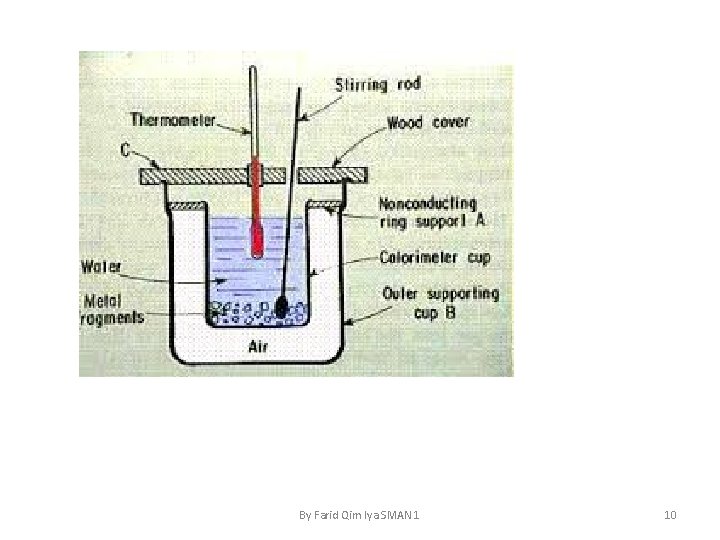
• Penentuan ΔH dengan Alat Kalorimeter terdiri atas bejana yang dilengkapi dengan pengaduk dan thermometer. Bejana diselimuti dengan penyekat panas yang bertujuan untuk mengurangi perpindahan panas dari system ke lingkungan atau sebaliknya. By Farid Qim Iya SMAN 1 4

Untuk mengukur kalor reaksi yang diserap atau dikeluarkan oleh system reaksi, data yang diperlukan adalah sebagai berikut : 1) perubahan (selisih) suhu sebelum dan sesudah reaksi 2) massa total larutan (m) 3) kalor jenis larutan (c) Secara matematis, jumlah kalor yang diserap atau dikeluarkan, dapat dirumuskan sebagai berikut: Q = m. c. ΔT Keterangan: Q = kalor yang diserap atau dikeluarkan m = massa zat c = kalor jenis ΔT = perubahan suhu By Farid Qim Iya SMAN 1 5

Kekekalan energi: q sistem + q lingkungan = 0 q sistem = - q lingkungan Dalam reaksi kimia yang dimaksud dengan sistem adalah reaksi itu sendiri, sehingga q sistem = q reaksi = - q lingkungan ΔH reaksi = q reaksi / mol zat q lingkungan dapat meliputi: ü q larutan = mlarutan. c. Δ T ü q air = mair. c. Δ T ü q kalorimeter = Ckalorimeter. Δ T c = kalor jenis J/g. K C = kapasitas kalor = J/K By Farid Qim Iya SMAN 1 6

Hukum Kekekalan Energi tidak dapat diciptakan dimusnahkan. Alam Sistem dan Lingkungan Jika energi sistem berkurang maka energi lingkungan bertambah Jika energi sistem bertambah maka energi lingkungan berkurang. q sistem + q lingkungan = 0 q sistem = q reaksi q lingkungan = q larutan + q kalorimeter q lingkungan = m x c x ∆T q kalorimeter = C x ∆T By Farid Qim Iya SMAN 1 m = massa c = kalor jenis m. c = C = kapasitas kalor T = suhu 7

By Farid Qim Iya SMAN 1 8

By Farid Qim Iya SMAN 1 9

By Farid Qim Iya SMAN 1 10

1. Bila 100 m. L larutan Na. OH 1 M direaksikan dengan 100 m. L larutan HCl 0, 5 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu larutan pada kalorimeter dari 29 °C menjadi 35, 5 °C. Tentukan mol zat yang menentukan kenaikan suhu larutan tersebut: Jawab: Mol Na. OH = 100 m. L x 1 M = 100 mmol = 0, 1 mol Mol HCl = 100 m. L x 0, 5 M = 50 mmol = 0, 05 mol Reaksi setelah disetarakan: Na. OH(aq) + Mol mula 2 : 0, 1 Mol bereaksi : 0, 05 Mol sisa : 0, 05 HCl (aq) Na. Cl (aq) + 2 H 2 O(l) 0, 05 - 0, 05 0, 1 Besarnya mol zat yang menentukan kenaikan suhu sebesar 0, 05 mol HCl atau 0, 05 mol Na. OH By Farid Qim Iya SMAN 1 11

2. Bila 100 m. L larutan Na. OH 1 M direaksikan dengan 100 m. L larutan H 2 SO 4 1 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu larutan pada kalorimeter dari 29 °C menjadi 35, 5 °C. Tentukan besarnya mol zat yang menentukan kenaikan suhu larutan tersebut: Jawab: Mol Na. OH = 100 m. L x 1 M = 100 mmol = 0, 1 mol Mol H 2 SO 4 = 100 m. L x 1 M = 100 mmol = 0, 1 mol Reaksi setelah disetarakan: 2 Na. OH(aq) + H 2 SO 4 (aq) Na 2 SO 4 (aq) + 2 H 2 O(l) Mol mula 2 : 0, 1 Mol bereaksi : 0, 1 ½ x 0, 1 = 0, 05 Mol sisa : 0, 05 0, 1 Mol zat yang menentukan kenaikan suhu larutan adalah : 0, 05 mol H 2 SO 4 atau 0, 05 mol Na. OH (untuk 1 molekul Na. OH) By Farid Qim Iya SMAN 1 12

3. Bila 100 m. L larutan Ca(OH)2 1 M direaksikan dengan 100 m. L larutan HCl 1 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu larutan pada kalorimeter dari 29 °C menjadi 35, 5 °C. Tentukan mol zat yang menentukan kenaikan suhu larutan tersebut: Jawab: Mol Ca(OH)2 = 100 m. L x 1 M = 100 mmol = 0, 1 mol Mol HCl = 100 m. L x 1 M = 100 mmol = 0, 1 mol Reaksi setelah disetarakan: Ca(OH)2(aq) + 2 HCl (aq) Ca. Cl 2 (aq) + 2 H 2 O(l) Mol mula 2 : 0, 1 Mol bereaksi : ½ x 0, 1 = 0, 05 Mol sisa : 0, 05 0, 1 Mol zat yang menentukan kenaikan suhu larutan adalah : 0, 05 mol HCl (untuk 1 molekul HCl) atau 0, 05 mol Ca(OH)2 By Farid Qim Iya SMAN 1 13

Dalam kalorimeter dicampurkan 100 m. L larutan HCl 1 M dan 100 m. L larutan Na. OH 1 M ternyata terjadi kenaikan suhu campuran sebesar 10 C. Jika massa jenis larutan adalah 1 gram/m. L dan kalor jenis larutan 4, 2 J/gram 0 C dan kapasitas kalorimeter 2, 2 J/o. C, maka perubahan entalpi reaksi HCl + Na. OH Na. Cl + H 2 O (CATATAN kalorimeter diabaikan) Penyelesaian , hitung lebih dahulu a) Volume campuran (larutan) b) Massa larutan (rumus massa = Volum x massa jenis) c) Qlarutan (kalor yang diserap larutan) rumus q = m. c. T d) qreaksi = - qlarutan e) Mol zat yang bereaksi (rumus mol = liter x molaritas) f) Menghitung ∆H dengan rumus: By Farid Qim Iya SMAN 1 14

4. Bila 50 m. L larutan Na. OH 1 M direaksikan dengan 50 m. L larutan HCI 1 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu larutan pada kalorimeter dari 29 °C menjadi 35, 5 °C. Bila kalor jenis larutan dianggap sama dengan air yaitu 4, 2 joule/g°C, (ρ larutan = 1 g/m. L) maka tentukan harga perubahan entalpi standar reaksi berikut! Na. OH(aq) + HCl(aq) Na. Cl(aq) + H 2 O(l) By Farid Qim Iya SMAN 1 15

Jawab: Volume larutan (campuran) = 100 m. L Massa larutan = massa jenis x volume = 1 g/ml x 100 ml = 100 gram Terjadi kenaikan suhu larutan berarti larutan menyerap kalor Q larutan = m. C. ∆T = 100 g x 4, 2 J/g °C x 6, 5 °C = 2. 730 joule = 2, 73 k. J q reaksi = - q larutan = - 2, 73 k. J 50 m. L Na. OH 1 M = 50 mmol = 0, 05 mol 50 m. L HCl 1 M = 50 mmol = 0, 05 mol By Farid Qim Iya SMAN 1 16

5. Bila 100 m. L larutan Na. OH 0, 1 M direaksikan dengan 100 m. L larutan HCI 0, 2 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu pada kalorimeter dari 30 °C menjadi 35 °C. Bila kalor jenis larutan dianggap sama dengan air yaitu 4, 2 joule/g°C, maka tentukan harga perubahan entalpi standar reaksi berikut! Na. OH(aq) + HCl(aq) Na. Cl(aq) + H 2 O(l) By Farid Qim Iya SMAN 1 17

5. Bila 100 m. L larutan Na. OH 0, 1 M direaksikan dengan 100 m. L larutan HCI 0, 2 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu pada kalorimeter dari 30 °C menjadi 35 °C. Bila kalor jenis larutan dianggap sama dengan air yaitu 4, 2 joule/g°C, maka tentukan harga perubahan entalpi standar reaksi berikut! Na. OH(aq) + HCl(aq) Na. Cl(aq) + H 2 O(l) Jawab: 100 m. L Na. OH 0, 1 M = 10 mmol = 0, 01 mol 100 m. L HCl 0, 2 M = 20 mmol = 0, 02 mol Na. OH + HCl Na. Cl + H 2 O Mol mula 2 : 0, 01 0, 02 mol bereaksi : 0, 01 Mol sisa : 0, 01 Q larutan = m. C. ∆T = 200 g x 4, 2 J/g °C x 5 °C = 4200 joule = 4, 2 k. J Q sistem = - Q larutan By Farid Qim Iya SMAN 1 18

6. Bila 100 m. L larutan Ca(OH)2 0, 3 M direaksikan dengan 100 m. L larutan HCl 0, 2 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu larutan pada kalorimeter dari 29 °C menjadi 34 °C. Tentukan perubahan entalpi untuk reaksi tersebut jika kalor jenis larutan = 4, 2 J/g o. C dan massa jenis larutan = 1 g/m. L Jawab: Mol Ca(OH)2 = 100 m. L x 0, 3 M = 30 mmol = 0, 03 mol Mol HCl = 100 m. L x 0, 2 M = 20 mmol = 0, 02 mol Reaksi setelah disetarakan: Ca(OH)2(aq) + 2 HCl (aq) Ca. Cl 2 (aq) + 2 H 2 O(l) Q larutan = m. C. ∆T = 200 g x 4, 2 J/g °C x 5 °C = 4200 joule = 4, 2 k. J Q sistem = - Q larutan By Farid Qim Iya SMAN 1 19

Jawab: Mol Ca(OH)2 = 100 m. L x 0, 3 M = 30 mmol = 0, 03 mol Mol HCl = 100 m. L x 0, 2 M = 20 mmol = 0, 02 mol Reaksi setelah disetarakan: Ca(OH)2(aq) + 2 HCl (aq) Ca. Cl 2 (aq) + 2 H 2 O(l) Mol mula 2 : 0, 03 0, 02 Mol bereaksi : ½ x 0, 02 = 0, 01 Mol sisa : 0, 02 0, 01 0, 02 Mol zat yang menentukan kenaikan suhu larutan adalah : 0, 01 mol HCl (untuk 1 molekul HCl) atau 0, 01 mol Ca(OH)2 By Farid Qim Iya SMAN 1 20

1. Dalam bom kalorimeter X gram karbon dibakar ternyata dapat menaikkan 2 liter air dari suhu 25 o. C menjadi 45 o. C. Jika massa jenis air 1 kg/L, kalor jenis air = 1 kkal/Kgo C dan kalor pembakaran standar C = -80 kkal maka harga X adalah (Ar C=12) 2. Sepotong besi mempunyai kapasitas kalor 6 J/o. C. Berapa Joule diperlukan untuk memanaskan besi dari 25 o C hingga 55 o C: By Farid Qim Iya SMAN 1 21

3. Pada pembakaran 0, 786 g belerang dalam kalorimeter terjadi kenaikan suhu dari 25 o. C menjadi 28 o. C : 1/8 S 8(s) + O 2(g) SO 2(g). Jika kapasitas kalorimeter dan isinya adalah 10, 8 k. Jo. C-1 maka perubahan entalpi pembakaran 32 g belerang adalah? 4. Pada pelarutan 17 g natrium nitrat dalam kalorimeter terjadi penurunan suhu Dari 25 o. C menjadi 21 o. C. Jika kapasitas kalor larutan dan kalorimeter adalah 1070 k. J/o. C maka tentukan perubahan entalpi pelarutan 1 mol Na. NO 3. (Ar Na=23 O=16 , N=14) Reaksi Na. NO 3(s) Na. NO 3(aq) ∆H= ? Atau Na. NO 3(s) Na+(aq) + NO 3 -(aq) ∆H= ? By Farid Qim Iya SMAN 1 22

5. Dalam kalorimeter direaksikan 50 m. L larutan Na. OH 1 M dengan 50 m. L HCl 2 M , Massa jenis larutan sama dengan massa jenis air (1 g/m. L) kalor jenis larutan 4, 2 J/go. C , tentukan perubahan entalpi reaksi tersebut jika terjadi kenaikan suhu dari 25 o. C menjadi 30 o. C HCl(aq) + Na. OH(aq) Na. Cl(aq) + H 2 O(l) ∆H= ? 6. Diketahui persamaan termokimia HCl(aq) + Mg(OH)2(aq) Mg. Cl 2(aq) + H 2 O(l) ∆H= -50 k. J Hitunglah perubahan suhu yang terjadi jika 50 m. L larutan Mg(OH)2 1 M direaksikan dengan 50 m. L HCl 2 M (Massa jenis larutan sama dengan massa jenis air (1 g/m. L) dan kalor jenis larutan = 4, 2 J/go. C) By Farid Qim Iya SMAN 1 23

7. . Bila 100 m. L larutan Na. OH 1 M direaksikan dengan 100 m. L larutan H 2 SO 4 1 M ke dalam alat kalorimeter menyebabkan kenaikkan suhu larutan pada kalorimeter dari 29 °C menjadi 35 °C. Bila kalor jenis larutan dianggap sama dengan air yaitu 4, 2 joule/g°C, (ρ larutan = 1 g/m. L) maka tentukan harga perubahan entalpi standar reaksi berikut Na. OH + H 2 SO 4 Na 2 SO 4 + 2 H 2 O By Farid Qim Iya SMAN 1 24

Dalam kalorimeter dicampurkan 100 m. L larutan HCl 1 M dan 100 m. L larutan Na. OH 1 M ternyata terjadi kenaikan suhu campuran sebesar 10 C. Jika massa jenis larutan adalah 1 gram/m. L dan kalor jenis larutan 4, 2 J/gram 0 C dan kapasitas kalorimeter 2, 2 J/o. C, maka perubahan entalpi reaksi HCl + Na. OH Na. Cl + H 2 O (CATATAN kalorimeter diperhitungkan) Jawab: Kalor yang diserapoleh larutan Q larutan = m. c. ∆T = 200. 4, 2. 10 = 8400 J = 8, 4 kj Kalor yang diserap oleh kalorimeter Q kalorimeter = C. ∆T = 2, 2. 10 = 22 J = 0, 022 kj By Farid Qim Iya SMAN 1 25

Kalor yang diserapoleh larutan Q larutan = m. c. ∆T = 200. 4, 2. 10 = 8400 J = 8, 4 kj Kalor yang diserap oleh kalorimeter Q kalorimeter = C. ∆T = 2, 2. 10 = 22 J = 0, 022 kj Qreaksi = - (Qlarutan + Qkalorimeter) = - 8, 422 kj 100 m. L larutan HCl 1 M Mol HCl = 100 mmol = 0, 1 mol 100 m. L larutan Na. OH 1 M Mol Na. OH = 100 mmol = 0, 1 mol By Farid Qim Iya SMAN 1 26
 Pengertian gas mulia
Pengertian gas mulia Gugus penarik elektron
Gugus penarik elektron Reaksi redoks adalah gabungan dari reaksi.... *
Reaksi redoks adalah gabungan dari reaksi.... * Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi
Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi Contoh oksidasi
Contoh oksidasi Konsep aliran melalui lubang dan peluap
Konsep aliran melalui lubang dan peluap Peluap
Peluap Hess cycle formation
Hess cycle formation Eksoterm
Eksoterm Ich score
Ich score David c. hess, md
David c. hess, md Enthalpy of combustion formula ib
Enthalpy of combustion formula ib Hess law definition
Hess law definition Mid oceanic ridge
Mid oceanic ridge Victor hess balloon experiment
Victor hess balloon experiment Hess goal.com
Hess goal.com Hess law constant heat summation
Hess law constant heat summation Enthalpy of formation hess law
Enthalpy of formation hess law Amy hess fischl
Amy hess fischl Susan hess golftini
Susan hess golftini Julia hess
Julia hess Entalpia
Entalpia Hess expanded on wegener’s theory of .
Hess expanded on wegener’s theory of . Molar enthalpy
Molar enthalpy 이미지 출처 표기법
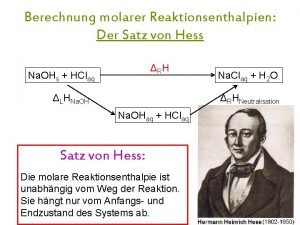
이미지 출처 표기법 Satz von hess
Satz von hess Germain henri hess
Germain henri hess