LAJU REAKSI 1 KONSEP LAJU REAKSI 2 FAKTOR



















- Slides: 26

LAJU REAKSI 1. KONSEP LAJU REAKSI 2. FAKTOR YANG MEMPENGARUHI LAJU REAKSI 3. PERSAMAAN LAJU REAKSI 4. TEORI TUMBUKAN

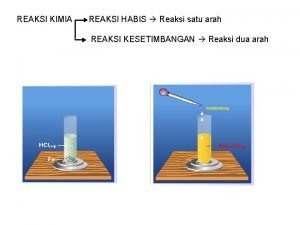
1. KONSEP LAJU REAKSI v PENGERTIAN LAJU REAKSI Laju reaksi dapat dinyatakan sebagai laju berkurangnya pereaksi dan laju terbentuknya (bertambahnya ) produk v PENENTUAN LAJU REAKSI Dapat ditentukan melalui percobaan dengan mengukur banyaknya pereaksi yang dihabiskan atau banyaknya produk yang dihasilkan pada selang waktu tertentu. • Contoh : Reaksi antara logam magnesium dengan asam klorida dapat ditentukan dengan mengukur jumlah satu produknya yaitu gas hydrogen. • Reaksi : Mg (s) + HCl (aq) Mg. Cl 2 (aq) + H 2 (g)

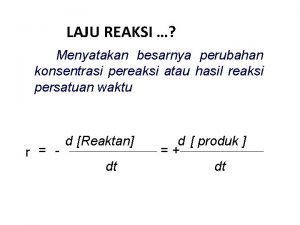
1. KONSEP LAJU REAKSI v. UNGKAPAN LAJU REAKSI Untuk system homogen, cara yang umum digunakan untuk menyatakan laju reaksi adalah laju pengurangan konsentrasi molar pereaksi atau laju pertambahan konsentrasi molar produk dalam satuan waktu sebagai berikut : v. Reaksi : m R n P

UNGKAPAN LAJU REAKSI • Dengan : R = pereaksi (reaktan) ; P = produk (hasilreaksi); V = laju reaksi ; t = waktu ∆[R] = perubahan konsentrasi molar pereaksi ∆ [P] = perubahan konsentrasi molar produk • Satuan laju reaksi dinyatakan dalam mol L -1 s -1 atau M s -1

UNGKAPAN LAJU REAKSI • CONTOH : • Amonia dapat dibuat dari gas nitrogen dan gas hydrogen. Jika dalam ruang 1 liter pada suhu dan tekanan tertentu dimasukkan 6 mol gas hydrogen dan 5 mol gas nitrogen, ternyata dalam waktu 10 detik dalam ruangan terbentuk 4 mol gas amonia. Tentukanlah : • laju pembentukan gas ammonia • laju berkurangnya gas hydrogen dan gas nitrogen

FAKTOR YANG MEMPENGARUHI LAJU REAKSI a. Luas permukaan semakin luas maka laju reaksi semakin cepat. • Kepingan zat padat yang lebih halus bereaksi lebih cepat. • Kepingan zat padat yang lebih kasar bereaksi lebih lambat b. Konsentrasi pereaksi semakin besar maka laju reaksi semakin cepat.

FAKTOR YANG MEMPENGARUHI LAJU REAKSI c. Tekanan ruang semakin besar volume ruang semakin kecil Konsentrasi semakin besar, maka laju reaksi semakin cepat. d. Suhu Pada suhu yang lebih tinggi reaksi akan berjalan lebih cepat

FAKTOR YANG MEMPENGARUHI LAJU REAKSI • Rumus : dimana va = laju pada saat ta (akhir) vo = laju pada saat to (awal) ∆v = pertambahan laju (percepatan) ∆T = koefisien kenaikan suhu

FAKTOR YANG MEMPENGARUHI LAJU REAKSI Contoh soal : • Suatu reaksi berlangsung dua kali lebih cepat setiap kali suhu dinaikkan 10 o. C. Jika laju suatu reaksi pada suhu 25 o. C adalah 0, 02 M/s, maka berapakah laju reakisi pada suhu 75 o. C ? • Suatu reaksi berlangsung selama 3 menit pada suhu kamar. Tentukan waktu yang diperlukan jika reaksi berlangsung pada suhu 61 o. C (setiap kenaikan 12 o. C reaksi berlangsung dua kali lebih cepat)

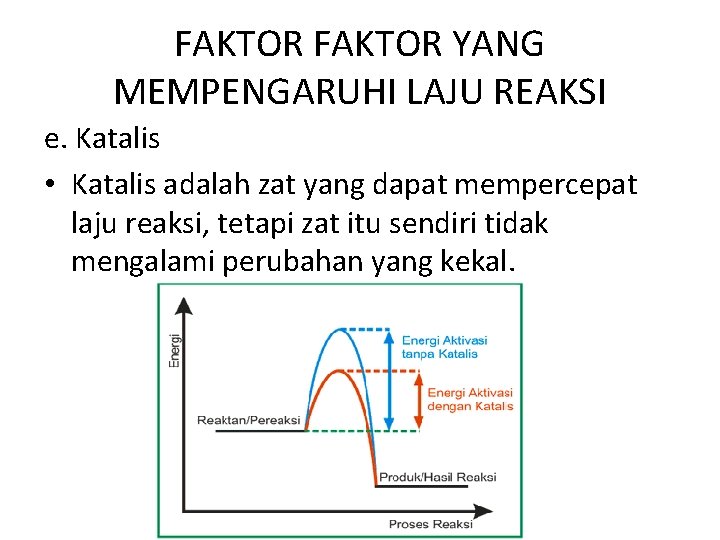
FAKTOR YANG MEMPENGARUHI LAJU REAKSI e. Katalis • Katalis adalah zat yang dapat mempercepat laju reaksi, tetapi zat itu sendiri tidak mengalami perubahan yang kekal.

FAKTOR YANG MEMPENGARUHI LAJU REAKSI Katalis dibedakan : a. katalis homogen ( katalis yang sefase dengan zat yang dikatalis) Contoh : Larutan besi (III) klorida pada reaksi peruraian H 2 O 2 b. katalis heterogen (katalis yang tidak sefase dengan zat yang dikatalis) Contoh : Serbuk Mn. O 2 pada peruraian Kalium klorat

PERSAMAAN LAJU REAKSI • Hubungan kuantitatif antara pereaksi dengan laju reaksi dinyatakan dalam suatu persamaan yaitu persamaan laju reaksi. • Bentuk persamaan laju reaksi Untuk reaksi : m A + n B p C + q D • Persamaan laju : V = k [A] x [B] y dimana: k = konstanta laju reaksi; x dan y = orde reaksi

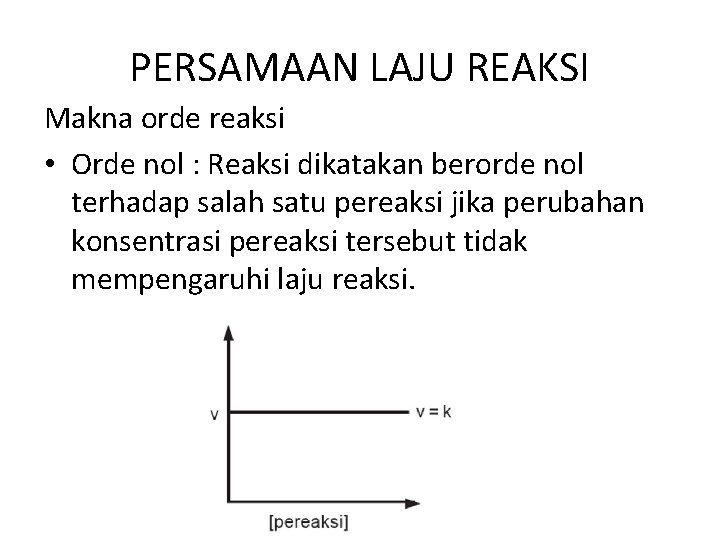
PERSAMAAN LAJU REAKSI Makna orde reaksi • Orde nol : Reaksi dikatakan berorde nol terhadap salah satu pereaksi jika perubahan konsentrasi pereaksi tersebut tidak mempengaruhi laju reaksi.

PERSAMAAN LAJU REAKSI Makna orde reaksi • Orde satu : Reaksi dikatakan berorde satu terhadap salah satu pereaksi jika laju reaksi berbanding lurus dengan konsentrasi pereaksi tersebut.

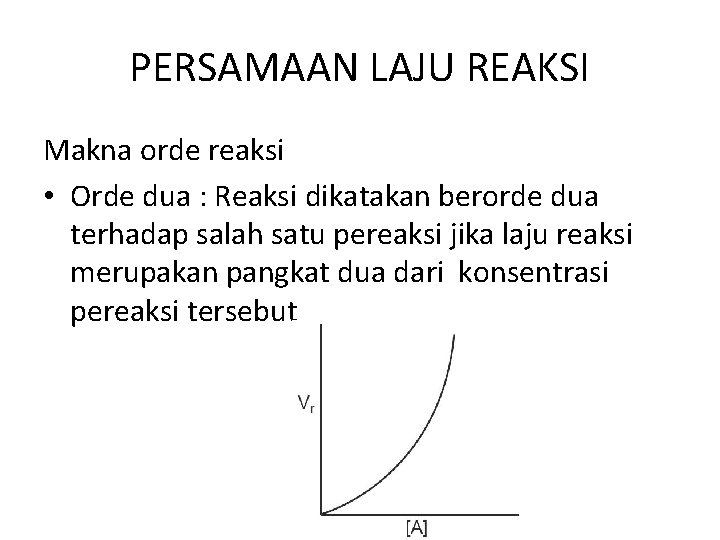
PERSAMAAN LAJU REAKSI Makna orde reaksi • Orde dua : Reaksi dikatakan berorde dua terhadap salah satu pereaksi jika laju reaksi merupakan pangkat dua dari konsentrasi pereaksi tersebut

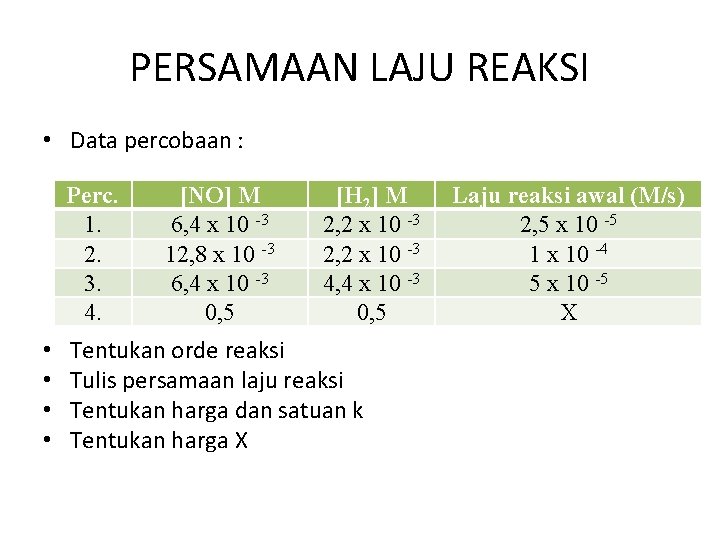
PERSAMAAN LAJU REAKSI Menentukan persamaan laju reaksi • Persamaan laju reaksi ditentukan dari eksperimen. Salah satu cara menentukan persamaan laju reaksi adalah metode laju awal. • Contoh : Nitrogen oksida (NO) bereaksi dengan Hidrogen (H 2) membentuk dinitrogen oksida (N 2 O) dan uap air. • Reaksi : 2 NO (g) + H 2 N 2 O + H 2 O

PERSAMAAN LAJU REAKSI • Data percobaan : Perc. 1. 2. 3. 4. • • [NO] M 6, 4 x 10 -3 12, 8 x 10 -3 6, 4 x 10 -3 0, 5 [H 2] M 2, 2 x 10 -3 4, 4 x 10 -3 0, 5 Tentukan orde reaksi Tulis persamaan laju reaksi Tentukan harga dan satuan k Tentukan harga X Laju reaksi awal (M/s) 2, 5 x 10 -5 1 x 10 -4 5 x 10 -5 X

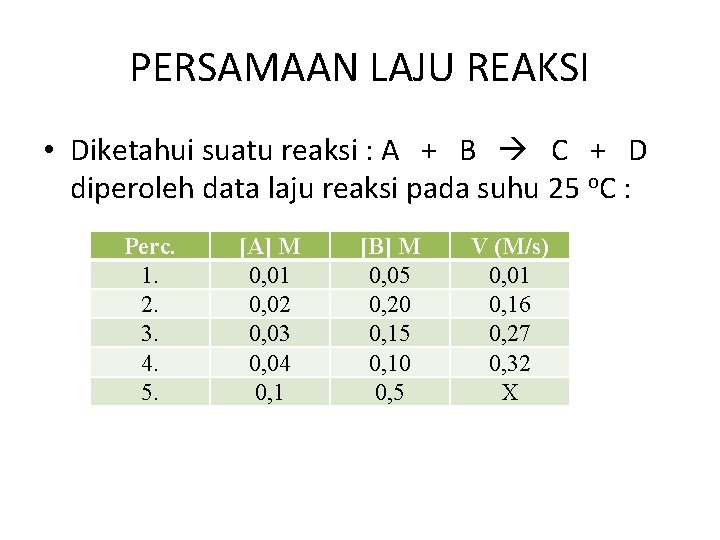
PERSAMAAN LAJU REAKSI • Diketahui suatu reaksi : A + B C + D diperoleh data laju reaksi pada suhu 25 o. C : Perc. 1. 2. 3. 4. 5. [A] M 0, 01 0, 02 0, 03 0, 04 0, 1 [B] M 0, 05 0, 20 0, 15 0, 10 0, 5 V (M/s) 0, 01 0, 16 0, 27 0, 32 X

PERSAMAAN LAJU REAKSI a. b. c. d. e. Tentukan orde reaksi Tulis persamaan laju reaksi Tentukan harga dan satuan k Tentukan harga X jika suhu dinaikkan menjadi 73 o. C; dimana setiap kenaikan 12 o. C laju reaksi menjadi 3 kali lebih cepat.

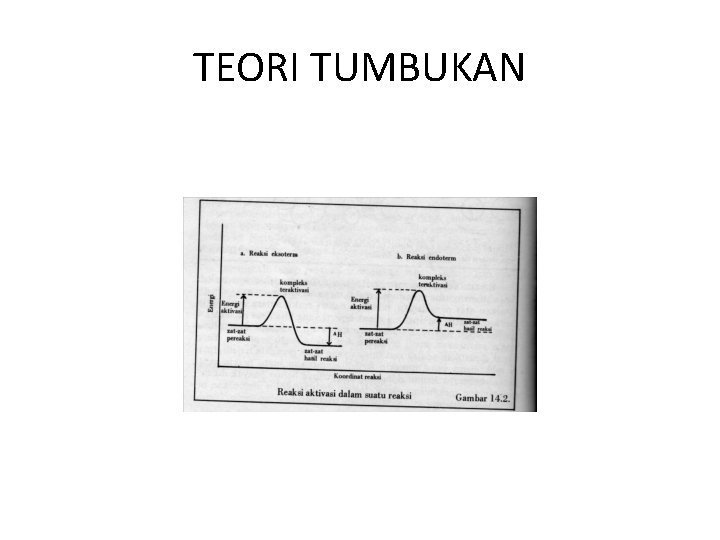
TEORI TUMBUKAN • Tumbukan yang menghasilkan reaksi adalah tumbukan antar partikel yang memiliki energi cukup serta arah tumbukan yang tepat. Jadi laju reaksi bergantung pada tiga hal yaitu: - frekwensi tumbukan - energi partikel pereaksi - arah tumbukan.



TEORI TUMBUKAN • Energi pengaktifan (Ea = energi aktivasi) : Energi minimum yang harus dimiliki oleh partikel pereaksi sehingga menghasilkan tumbukan efektif. • Semua reaksi eksoterm maupun endoterm memerlukan energi pengaktifan

TEORI TUMBUKAN

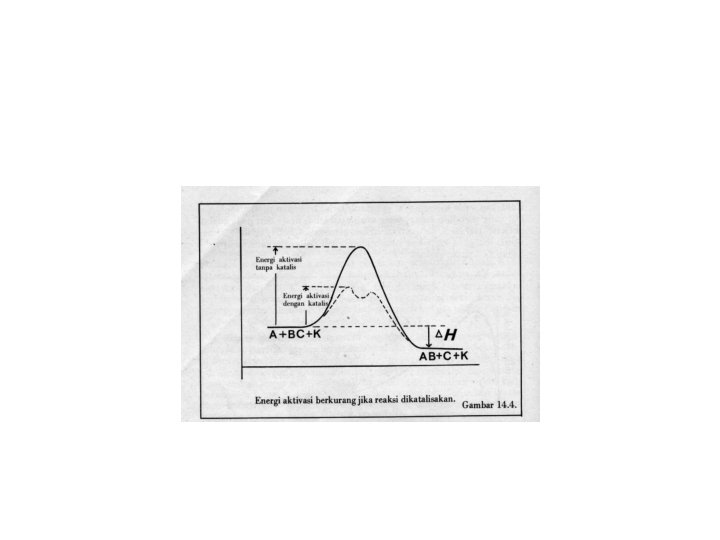
TEORI TUMBUKAN • Semakin besar konsentrasi, semakin besar pula frekwensi tumbukan • Semakin tinggi suhu, semakin banyak molekul yang mencapai energi pengaktifan • Katalis bekerja dengan menurunkan energi aktivasi, tetapi tidak mengubah perubahan entalpi reaksi • Katalis bersifat spesifik dan diperlukan dalam jumlah sedikit • Katalis tidak mengalami perubahan yang kekal, tetapi terlibat dalam mekanisme reaksi • diperlukan dalam jumlah sedikit

 Laju reaksi
Laju reaksi Tindakan berikut akan memperbesar laju reaksi kecuali
Tindakan berikut akan memperbesar laju reaksi kecuali Laju reaksi
Laju reaksi Ch3-ch2-ch=ch2 + hcl →
Ch3-ch2-ch=ch2 + hcl → Reaksi reaksi pada gas mulia
Reaksi reaksi pada gas mulia Contoh amina dalam kehidupan sehari-hari
Contoh amina dalam kehidupan sehari-hari Bilangan oksidasi unsur bebas adalah +1 *
Bilangan oksidasi unsur bebas adalah +1 * Faktor pendorong kematian dan faktor penghambat kematian
Faktor pendorong kematian dan faktor penghambat kematian Faktor kedatangan kuasa barat ke negara kita tingkatan 3
Faktor kedatangan kuasa barat ke negara kita tingkatan 3 Faktor-faktor yang mempengaruhi besar energi listrik adalah
Faktor-faktor yang mempengaruhi besar energi listrik adalah Faktro yang mempengaruhi viskositas kinematik
Faktro yang mempengaruhi viskositas kinematik Faktor-faktor pokok dalam pengolahan hasil pertanian
Faktor-faktor pokok dalam pengolahan hasil pertanian Pada 1 februari 1948
Pada 1 februari 1948 Brojeve koje množimo zovemo
Brojeve koje množimo zovemo Motif kognitif dan gratifikasi media
Motif kognitif dan gratifikasi media Faktor pemengaruh menyimak
Faktor pemengaruh menyimak Langkah menuju keberhasilan kewirausahaan
Langkah menuju keberhasilan kewirausahaan Faktor yang mempengaruhi kebutuhan nutrisi adalah
Faktor yang mempengaruhi kebutuhan nutrisi adalah Matlamat ekonomi pendudukan jepun
Matlamat ekonomi pendudukan jepun Alteration or alternation
Alteration or alternation Faktor faktor yang mempengaruhi persepsi
Faktor faktor yang mempengaruhi persepsi Bentuk pengingkaran kewajiban warga negara
Bentuk pengingkaran kewajiban warga negara Contoh emulsi oil in water
Contoh emulsi oil in water Faktor-faktor yang mempengaruhi nilai opsi
Faktor-faktor yang mempengaruhi nilai opsi Faktor faktor perang dingin
Faktor faktor perang dingin Sebutkanlah barang substitusi dan komplementer bawang.
Sebutkanlah barang substitusi dan komplementer bawang. Faktor daya ikat konstitusi
Faktor daya ikat konstitusi