STANDAR KOMPETENSI DASAR INDIKATOR MATERI EVALUASI Memahami kinetika




















- Slides: 27


STANDAR KOMPETENSI DASAR INDIKATOR MATERI EVALUASI

Memahami kinetika reaksi, kesetimbangan kimia dan faktor yang mempengaruhinya serta penerapannya dalam kehidupan sehari dan industri

Menyelidiki faktor yang mempengaruhi laju reaksi dan menyimpulkan hasilnya. Kompetensi dasar

Pengertian laju reaksi dan faktor yang mempengaruhi laju reaksi

Kecepatan Besarnya Perubahan Jarak akhir dan jarak awal (meter)Per satuan waktu (detik) Laju Reaksi Besarnya perubahan jumlah pereaksi dan hasil reaksi Per satuan waktu dinyatakan dengan perubahan konsentrasi.

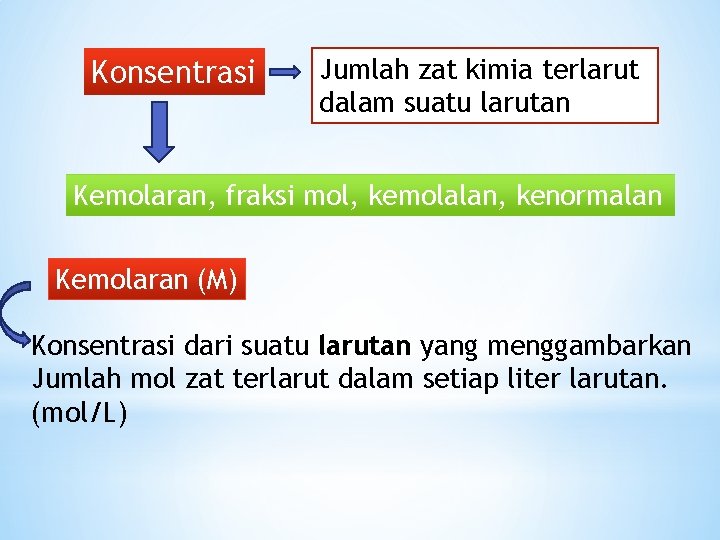
Konsentrasi Jumlah zat kimia terlarut dalam suatu larutan Kemolaran, fraksi mol, kemolalan, kenormalan Kemolaran (M) Konsentrasi dari suatu larutan yang menggambarkan Jumlah mol zat terlarut dalam setiap liter larutan. (mol/L)

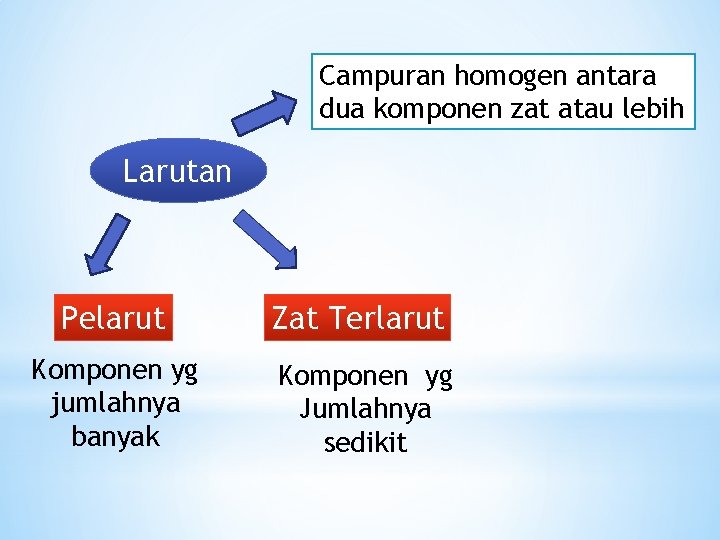
Campuran homogen antara dua komponen zat atau lebih Larutan Pelarut Zat Terlarut Komponen yg jumlahnya banyak Komponen yg Jumlahnya sedikit

M = Mol Zat Terlarut Liter Larutan M=n V M = massa zat terlarut x 1000 Mr Volume pelarut (ml)

Cara Membuat Larutan 1. Melarutkan Zat Padat Ex: Bagaimana cara membuat larutan Na. Cl 0. 01 M dengan volume 200 ml (Mr Na. Cl = 58) 2. Mengencerkan Larutan Pekat V 1 x M 1 = V 2 x M 2 V 1 = Volume larutan sebelum diencerkan M 1= Kemolaran larutan sebelum di encerkan V 2 = Volume Larutan Sesudah di encerkan M 1= Kemolaran Larutan Sesudah di encerkan

Ex: 100 ml larutan H 2 SO 4 0. 1 M diencerkan sehingga konsentrasinya menjadi 0. 01 M. Hitunglah volume larutan setelah diencerkan ! 3. Mencampurkan Larutan M = V 1. M 1 + V 2. M 2 V 1 + V 2

Ex: 100 ml larutan HCl 0. 1 M dicampurkan dengan 150 ml larutan HCl 0. 2 M Tentukan konsentrasi larutan setelah dicampurkan !

laju reaksi? ? ? Laju yang menyatakan seberapa cepat atau seberapa lambatnya suatu proses reaksi itu berlangsung,

1. konsentrasi Magnesium 1 gr Larutan HCl 1 M Magnesium 1 gr Larutan HCl 2 M

Bahwa semakin besar konsentrasi, semakin cepat reaksi berlangsung. Dan sebaliknya semakin kecil konsentrasi, semakin lambat reaksi berlangsung

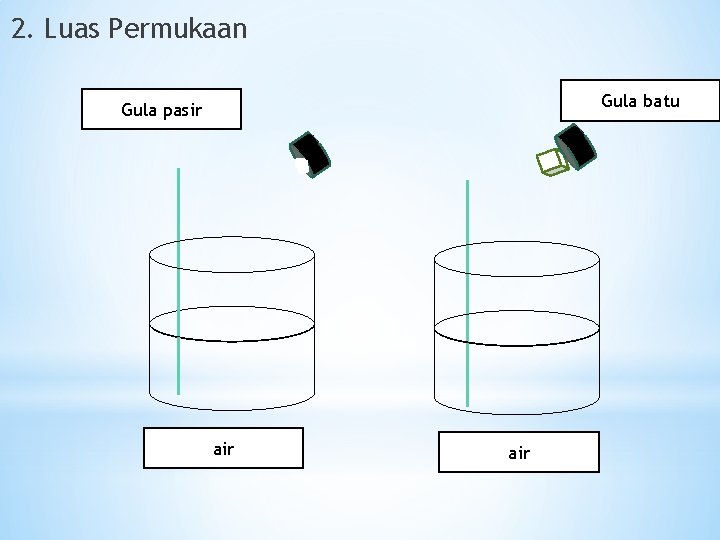
2. Luas Permukaan Gula batu Gula pasir air

Semakin besar luas permukaan, semakin cepat laju reaksi berlangsung. Dan sebaliknya semakin kecil luas permukaan, semakin lambat laju reaksinya kesimpulan

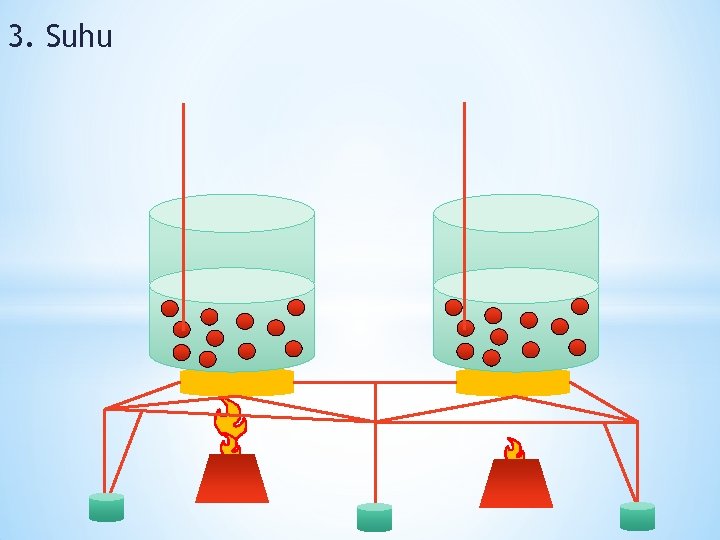
3. Suhu

Semakin tinggi suhu, semakin cepa reaksi berlangsung. Dan sebaliknya, semakin rendah suhu, semakin lambat reaksi berlangsung. kesimpulan

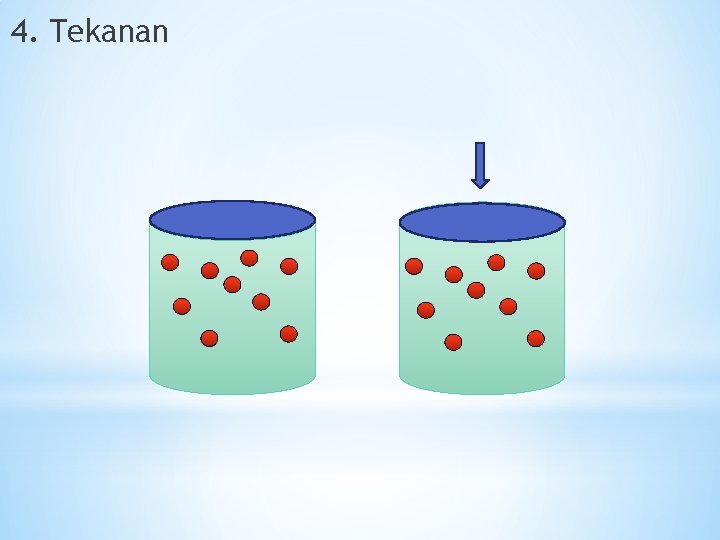
4. Tekanan

Penambahan tekanan dengan memperkecil volume. Akan memperbesar konsentrasi sehingga dapat mempercepat laju reaksi. Kesimpulan

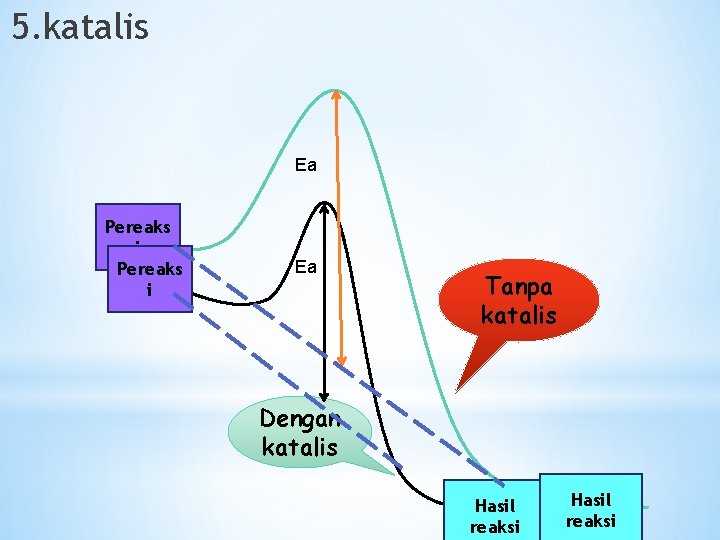
5. katalis Ea Pereaks i Ea Tanpa katalis Dengan katalis Hasil reaksi

Katalis dapat mempercepat laju reaksi, dibandingkan tidak menggunakan katalis, laju reaksi berjalan lambat Kesimpulan

1. Diantara faktor yang mempengaruhi laju reaksi, manakah yang bukan faktor yang mempengaruhi laju reaksi? A. suhu B. p. H C. tekanan D. Luas permukaan E. Katalis

2. Tindakan berikut akan memperbesar laju raksi, kecuali. . . A. Pada suhu tetap ditambah suatu katalis B. Suhu dinaikkan C. Pada suhu tetap tekanan diperbasar D. Pada suhu tetap volume diperbesar E. Pada volume tetap ditambah zat pereaksi lebih banyak

3. Diantara pasangan pereaksi berikut, yang bereaksi paling cepat adalah A. 20 m. L HCl 0, 2 M + 20 m. L Na 2 S 2 O 3 0, 1 M pada suhu 30 C B. 20 m. L HCl 0, 1 M + 20 m. L Na 2 S 2 O 3 0, 1 M + 10 Ml air pada 30 C C. 20 m. L HCl 0, 1 M + 20 m. L Na 2 S 2 O 3 0, 1 M pada suhu 40 C D. 20 m. L HCl 0, 2 M + 20 m. L Na 2 S 2 O 3 0, 1 M pada suhu 40 C E. 20 m. L HCl 0, 2 M + 20 m. L Na 2 S 2 O 3 0, 1 M + 20 ML air pada suhu 40 C

Sekian Terrima kasih