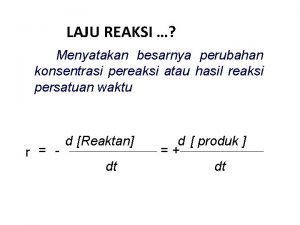
Kinetika Kimia Studikajian tentang laju reaksi Pengertian Laju

![PENGARUH TEMPERATUR TERHADAP LAJU REAKSI Persamaan hukum laju reaksi: v [A], [B] m, n PENGARUH TEMPERATUR TERHADAP LAJU REAKSI Persamaan hukum laju reaksi: v [A], [B] m, n](https://slidetodoc.com/presentation_image_h/8de7b6b35de2ec0b70fc7fac3abbc5f0/image-2.jpg)









- Slides: 22

Kinetika Kimia Studi/kajian tentang laju reaksi ØPengertian Laju reaksi ØPengukuran Laju ØPenentuan Hk. Laju ØPengaruh Temperatur terhadap Laju reaksi ØMekanisme Reaksi ØKatalisis
![PENGARUH TEMPERATUR TERHADAP LAJU REAKSI Persamaan hukum laju reaksi v A B m n PENGARUH TEMPERATUR TERHADAP LAJU REAKSI Persamaan hukum laju reaksi: v [A], [B] m, n](https://slidetodoc.com/presentation_image_h/8de7b6b35de2ec0b70fc7fac3abbc5f0/image-2.jpg)
PENGARUH TEMPERATUR TERHADAP LAJU REAKSI Persamaan hukum laju reaksi: v [A], [B] m, n k = laju reaksi = konsentrasi-konsentrasi reaktan = orde reaksi reaktan-reaktan = tetapan laju reaksi T ? ? ? Fakta: Laju sebagian besar reaksi bertambah dengan meningkatnya temperatur (T)

PERSAMAAN ARRHENIUS ØArrhenius mengamati bahwa kurva ln k versus 1/T menghasilkan garis lurus pada hampir semua kasus Ønilai gradien adalah karakteristik dari suatu reaksi dan selalu berharga negatif. ØPersamaan Arrhenius: Persamaan hukum laju reaksi menjadi:

PERSAMAAN ARRHENIUS x ln, maka: ln e = 1 y = ln k; a = ln A; b = A = Faktor Arrhenius ; dan x = Ea = Energi aktivasi T = Temperatur in Kelvin

Faktor Arrhenius (A): • Reaksi kimia akan berlangsung sebagai akibat dari tumbukan antara molekul-molekul reaktan. • Molekul-molekul reaktan yang bertumbukan harus memiliki energi yang cukup untuk membentuk produk. Total tumbukan dengan energi yang melampaui Ea: z = total collisions e is Euler’s number (opposite of ln = 2, 72) R = ideal gas constant (8, 314 J. K -1. mol-1 ) Jika seluruh tumbukan melampaui Ea menghasilkan reaksi: A=z

Arrhenius (A): Faktor Sterik/Orientasi molekul �» 100 tumbukan antara molekul-molekul A & B: A›‹B → 100 AB ? ? ? ? �Laju reaksi yang diamati selalu lebih rendah dari jumlah tumbukan �Hanya tumbukan efektif yang menghasilkan reaksi �Tumbukan yang efektif terkait dengan orientasi molekul (faktor sterik) �Dalam persamaan Arhenius faktor sterik ditulis sebagai p �Sehingga: A = pz

TEORI TUMBUKAN A. 1 A. B A. 2 3 B B B A. A. B B B A. A B. A. A. B A. A. B B B A B. B A. A. B B A B. A. → B A B. A. B A. → B → A B A B A B B A B A B A A B A A B A B A B A B B A A A k=z B A B B 16 A » « 16 B → 16 AB B 16 A» « 16 B → 12 AB + 4 A + 4 B B A A A B B B 16 A» « 16 B → 8 AB + 8 A + 8 B

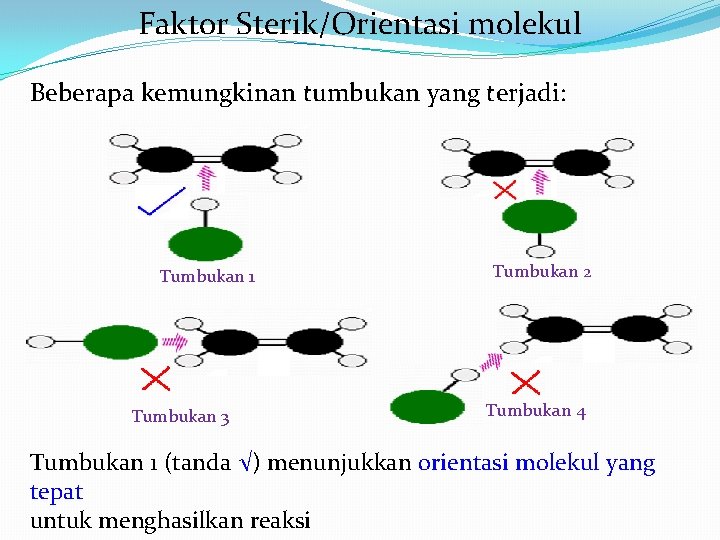
Faktor Sterik/Orientasi molekul Beberapa kemungkinan tumbukan yang terjadi: Tumbukan 1 Tumbukan 3 Tumbukan 2 Tumbukan 4 Tumbukan 1 (tanda √) menunjukkan orientasi molekul yang tepat untuk menghasilkan reaksi

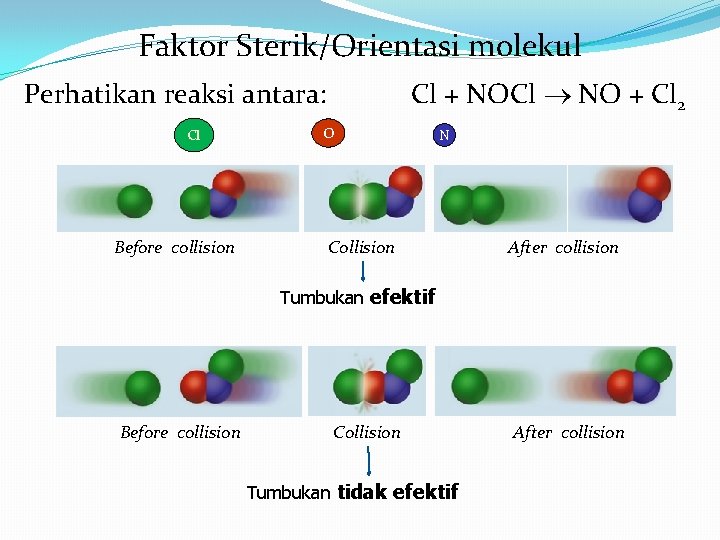
Faktor Sterik/Orientasi molekul Cl + NOCl NO + Cl 2 Perhatikan reaksi antara: Cl Before collision O N Collision After collision Tumbukan efektif Before collision Collision Tumbukan tidak efektif After collision

Faktor Sterik/Orientasi molekul Bagaimana kemungkinan tumbukan antara molekul-molekul NO dan N 2 O ut. bereaksi membentuk NO 2 dan N 2? Tumbukan menghasilkan reaksi jika atom O dari molekul N 2 O bertumbukan dengan atom N dari molekul NO (effective) Tumbukan antara atom N dari molekul N 2 O dengan atom N dari molekul NO tidak menghasilkan reaksi (ineffective) Tumbukan antara atom O dari molekul NO dengan atom N dari molekul N 2 O tidak menghasilkan reaksi (ineffective)

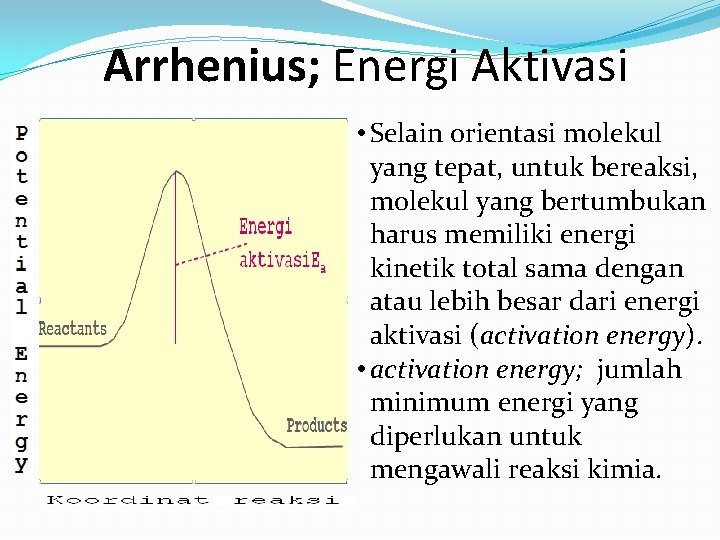
Arrhenius; Energi Aktivasi • Selain orientasi molekul yang tepat, untuk bereaksi, molekul yang bertumbukan harus memiliki energi kinetik total sama dengan atau lebih besar dari energi aktivasi (activation energy). • activation energy; jumlah minimum energi yang diperlukan untuk mengawali reaksi kimia.

Energi Aktivasi Beberapa point tentang Ea �Ea Selalu positif. �Semakin besar nilai Ea, semakin lambat suatu reaksi �Semakin besar nilai Ea semakin tajam slope (ln k) vs. (1/T). �The value of Ea itself DOES NOT CHANGE with temperature.

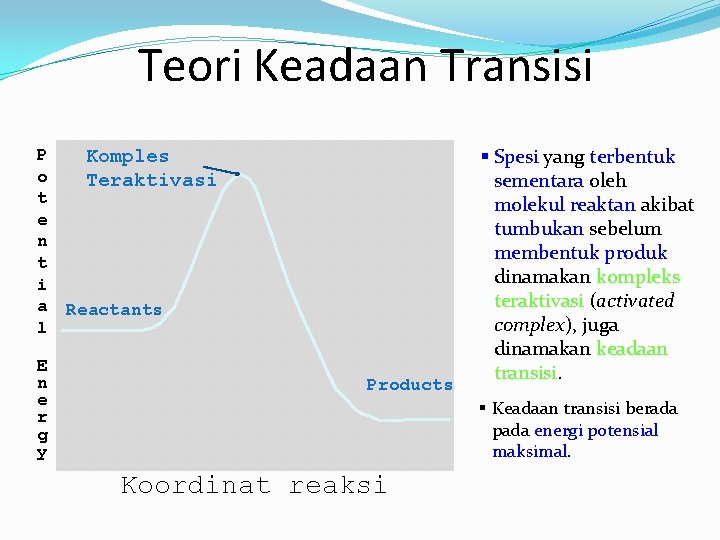
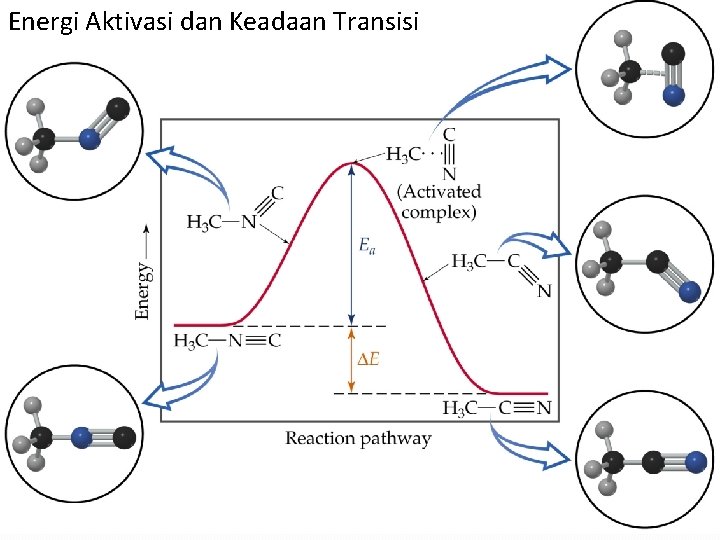
Teori Keadaan Transisi P o t e n t i a l E n e r g y Komples Teraktivasi Reactants Products § Spesi yang terbentuk sementara oleh molekul reaktan akibat tumbukan sebelum membentuk produk dinamakan kompleks teraktivasi (activated complex), juga dinamakan keadaan transisi. § Keadaan transisi berada pada energi potensial maksimal. Koordinat reaksi

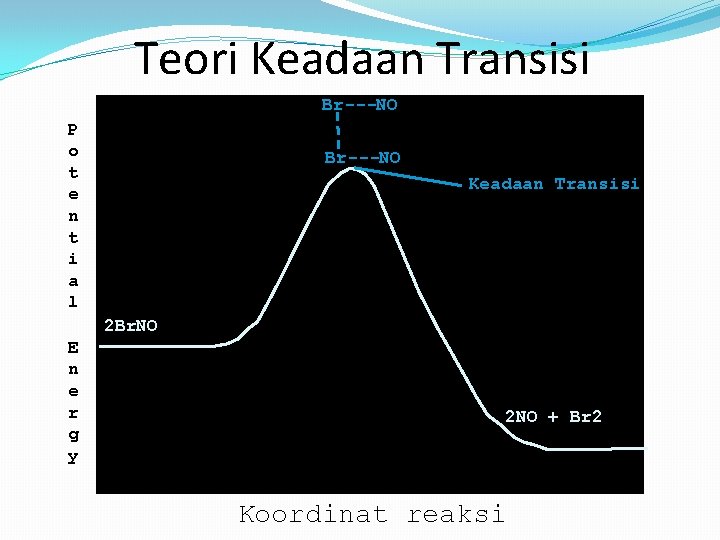
Teori Keadaan Transisi Br---NO P o t e n t i a l Br---NO Keadaan Transisi 2 Br. NO E n e r g y 2 NO + Br 2 Koordinat reaksi

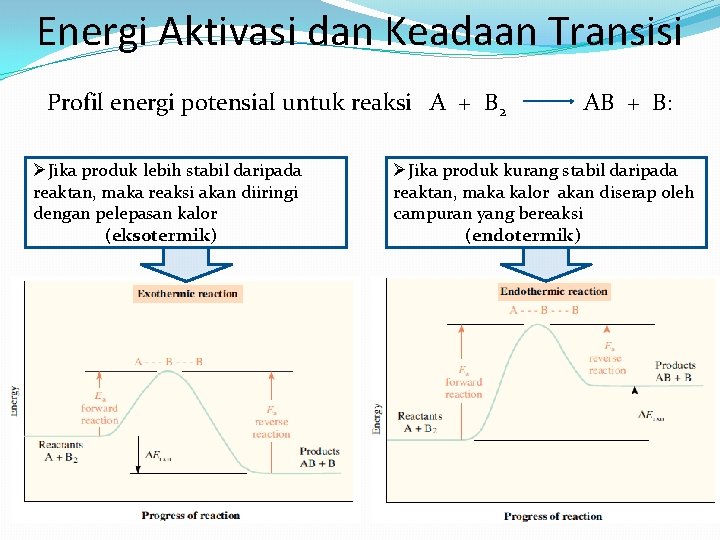
Energi Aktivasi dan Keadaan Transisi Profil energi potensial untuk reaksi A + B 2 ØJika produk lebih stabil daripada reaktan, maka reaksi akan diiringi dengan pelepasan kalor (eksotermik) AB + B: ØJika produk kurang stabil daripada reaktan, maka kalor akan diserap oleh campuran yang bereaksi (endotermik)

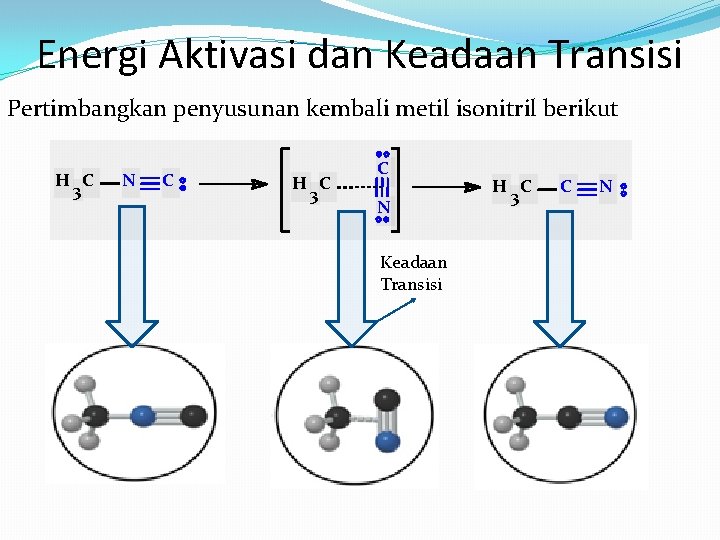
Energi Aktivasi dan Keadaan Transisi Pertimbangkan penyusunan kembali metil isonitril berikut H C 3 N C H C 3 C N Keadaan Transisi H C 3 C N

Energi Aktivasi dan Keadaan Transisi 17

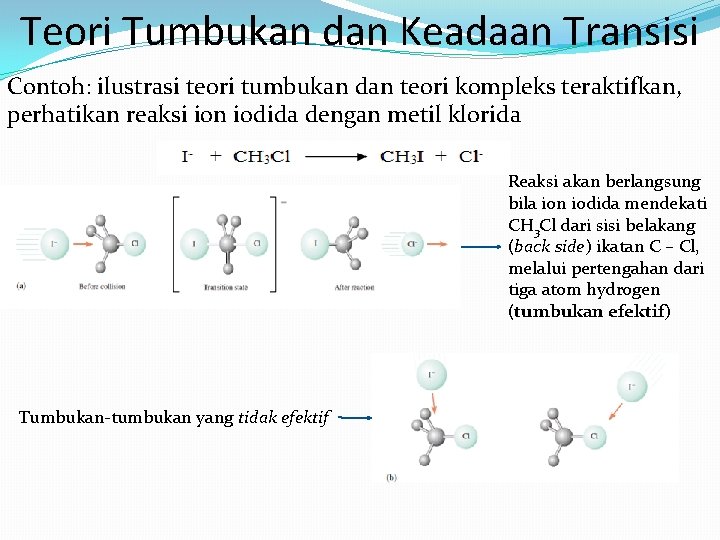
Teori Tumbukan dan Keadaan Transisi Contoh: ilustrasi teori tumbukan dan teori kompleks teraktifkan, perhatikan reaksi ion iodida dengan metil klorida Reaksi akan berlangsung bila ion iodida mendekati CH 3 Cl dari sisi belakang (back side) ikatan C – Cl, melalui pertengahan dari tiga atom hydrogen (tumbukan efektif) Tumbukan-tumbukan yang tidak efektif

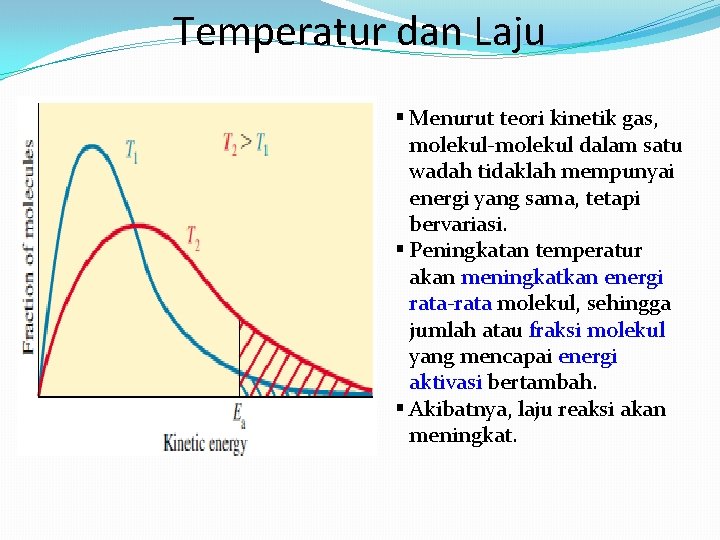
Temperatur dan Laju § Menurut teori kinetik gas, molekul-molekul dalam satu wadah tidaklah mempunyai energi yang sama, tetapi bervariasi. § Peningkatan temperatur akan meningkatkan energi rata-rata molekul, sehingga jumlah atau fraksi molekul yang mencapai energi aktivasi bertambah. § Akibatnya, laju reaksi akan meningkat.

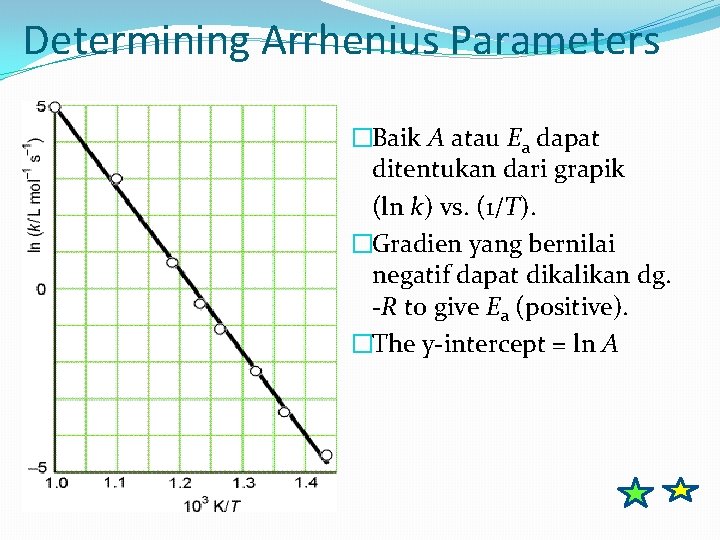
Determining Arrhenius Parameters o. Jika terdapat dua nilai konstanta laju, katakan k 1 dan k 2, pada suhu T 1 and T 2 o Persamaan yang digunakan untuk menghitung energi aktivasi atau untuk menentukan k pada suhu lain jika energi aktivasinya diketahui, yaitu dengan aplikasi persamaan Arrhenius pada dua kondisi: dan

Determining Arrhenius Parameters �Baik A atau Ea dapat ditentukan dari grapik (ln k) vs. (1/T). �Gradien yang bernilai negatif dapat dikalikan dg. -R to give Ea (positive). �The y-intercept = ln A

Determining Arrhenius Parameters 1. Tentukan A dan Ea dari data berikut T/K 300 350 400 450 500 k/M-1 s-1 7. 9 E 6 3. 0 E 7 7. 9 E 7 1. 7 E 8 3. 2 E 8 2. Konstanta laju, k, untuk reaksi orde pertama N 2 O 5 → NO 2 + NO 3 adalah 9, 16 x 10 -3 s-1 pada 0°C. Energi aktivasi dari reaksi ini adalah 88, 0 k. J/mol. Tentukan nilai k pada 2°C! 3. Dekomposisi ethyl iodide pada fasa gas menghasilkan ethylene dan hydrogen iodide merupakan reaksi orde pertama. C 2 H 5 I → C 2 H 4 + HI Pada 600 K nilai k adalah 1, 60 x 10 -5 s-1. Ketika temperatur dinaikkan 700 K, nilai k meninggkat menjadi 6, 36 x 10 -3 s-1. Berapakah energi aktivasi untuk reaksi ini?
 Hukum laju terintegrasi
Hukum laju terintegrasi Termokimia adalah cabang ilmu kimia yang mempelajari…
Termokimia adalah cabang ilmu kimia yang mempelajari… Tindakan berikut akan memperbesar laju reaksi, kecuali
Tindakan berikut akan memperbesar laju reaksi, kecuali Faktor laju reaksi
Faktor laju reaksi Salah satu reaksi gas yang terjadi dalam kendaraan adalah
Salah satu reaksi gas yang terjadi dalam kendaraan adalah Hemijska kinetika
Hemijska kinetika Dapat dibedakan menjadi
Dapat dibedakan menjadi Neraca massa dengan reaksi kimia
Neraca massa dengan reaksi kimia Reaksi kimia dalam larutan air
Reaksi kimia dalam larutan air Gambar kimia
Gambar kimia Reaksi kimia anabolisme
Reaksi kimia anabolisme Reaksi kimia adalah
Reaksi kimia adalah Kuosien reaksi adalah
Kuosien reaksi adalah Algoritma yang merupakan gabungan dari beberapa rbm adalah
Algoritma yang merupakan gabungan dari beberapa rbm adalah Reaksi ch2=ch2 + hcl ... ch3-ch2-cl disebut reaksi
Reaksi ch2=ch2 + hcl ... ch3-ch2-cl disebut reaksi Reaksi pada gas mulia
Reaksi pada gas mulia Sikloheksanamina
Sikloheksanamina Hakikat metode ilmiah
Hakikat metode ilmiah Rumus empiris
Rumus empiris Laju perubahan usaha yang dilakukan tiap detik
Laju perubahan usaha yang dilakukan tiap detik Laju pengembalian formula
Laju pengembalian formula Laju bunyi dalam merkuri adalah 1410
Laju bunyi dalam merkuri adalah 1410 Peribahasa jiwa besar
Peribahasa jiwa besar