N P 15 skupina 5 valennch elektron Prvek














![Kyseliny, soli H 3 PO 2, H[PH 2 O 2] – dihydrido-dioxofosforečná (kys. fosforná, Kyseliny, soli H 3 PO 2, H[PH 2 O 2] – dihydrido-dioxofosforečná (kys. fosforná,](https://slidetodoc.com/presentation_image_h2/5181814112e43cc6646b0809c50bec1c/image-29.jpg)
![H 3 PO 3, H 2[PHO 3] – hydrido-trioxofosforečná (kys. fosforitá, fosfonová) • • H 3 PO 3, H 2[PHO 3] – hydrido-trioxofosforečná (kys. fosforitá, fosfonová) • •](https://slidetodoc.com/presentation_image_h2/5181814112e43cc6646b0809c50bec1c/image-30.jpg)


![Difosfazeny 3 PCl 5 + NH 4 Cl [Cl 3 P=N-PCl 3]+PCl 6 - Difosfazeny 3 PCl 5 + NH 4 Cl [Cl 3 P=N-PCl 3]+PCl 6 -](https://slidetodoc.com/presentation_image_h2/5181814112e43cc6646b0809c50bec1c/image-35.jpg)






- Slides: 43

N, P

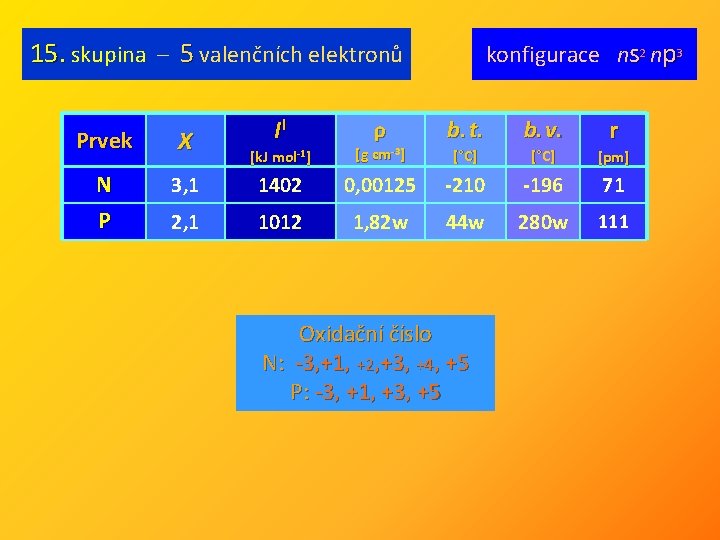
15. skupina – 5 valenčních elektronů Prvek X N P II ρ konfigurace ns 2 np 3 r b. t. b. v. [°C] [pm] [k. J mol-1] [g cm-3] 3, 1 1402 0, 00125 -210 -196 71 2, 1 1012 1, 82 w 44 w 280 w 111 Oxidační číslo N: -3, +1, +2, +3, +4, +5 P: -3, +1, +3, +5

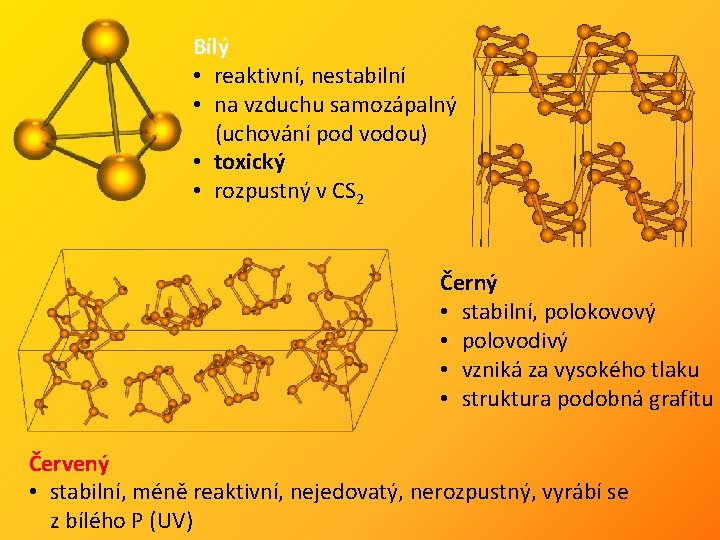
Obecné informace • 99, 6 % 14 N a 0, 4 % 15 N; 31 P 100 %, významné jsou i 32 P a 33 P • obsah N 2 v ovzduší 78 % - ve všech skupenstvích molekuly N 2 Přírodní zdroje N: atmosféra, Na. NO 3 – chilský ledek, KNO 3 – ledek, NH 4 NO 3 Přírodní zdroje P: apatity - Ca 5(OH)(PO 4)3, Ca 5 F(PO 4)3 Krystalové modifikace P: bílý, červený, fialový a černý fosfor bílý červený fialový černý

Bílý • reaktivní, nestabilní • na vzduchu samozápalný (uchování pod vodou) • toxický • rozpustný v CS 2 Černý • stabilní, polokovový • polovodivý • vzniká za vysokého tlaku • struktura podobná grafitu Červený • stabilní, méně reaktivní, nejedovatý, nerozpustný, vyrábí se z bílého P (UV)

N • nereaktivní – vysoká energie vazby N≡N (6 x silnější než jednoduchá) • třetí nejelektronegativnější prvek (po fluoru a kyslíku) • ve vodě se rozpouští (kesonová/dekompresní nemoc) • tvoří sloučeniny se všemi prvky (kromě vzácných plynů) ale až za žáru • za nízké teploty pouze s Li, Mg a Ca • tvoří maximálně 4 σ-vazby (nedostupnost d-orbitalů) – NH 4+/NR 4+ P • tvoří sloučeniny se všemi prvky • V kapalině tetraedry P 4, v plynné fázi tvoří molekuly P 2

Výroba a použití • dusík se vyrábí frakční destilací kapalného vzduchu (b. v. -196 °C) • laboratorně pak rozkladem vhodných sloučenin 2 Na. N 3 2 Na + 3 N 2 NH 4 NO 2 N 2 + 2 H 2 O • používá se jako účinné chladivo (supravodiče, syntézy), ochr. atm. , sloučeniny – amoniak, kys. dusičná, dusičnany, hydrazin, močovina • fosfor redukcí uhlíkem v pecích 4 Na. PO 3 + 2 Si. O 2 + 10 C 2 Na 2 Si. O 3 + 10 CO + P 4 • vyrábí se z něj oxid fosforečný, kyselina fosforečná, fosforečnany – detergenty, insekticity, herbicidy, halogenofosforečnany účinné neurotoxiny

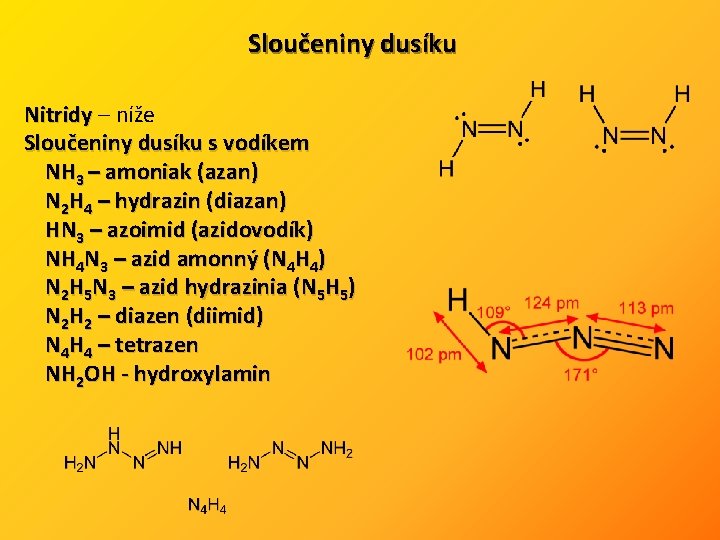
Sloučeniny dusíku Nitridy – níže Sloučeniny dusíku s vodíkem NH 3 – amoniak (azan) N 2 H 4 – hydrazin (diazan) HN 3 – azoimid (azidovodík) NH 4 N 3 – azid amonný (N 4 H 4) N 2 H 5 N 3 – azid hydrazinia (N 5 H 5) N 2 H 2 – diazen (diimid) N 4 H 4 – tetrazen NH 2 OH - hydroxylamin

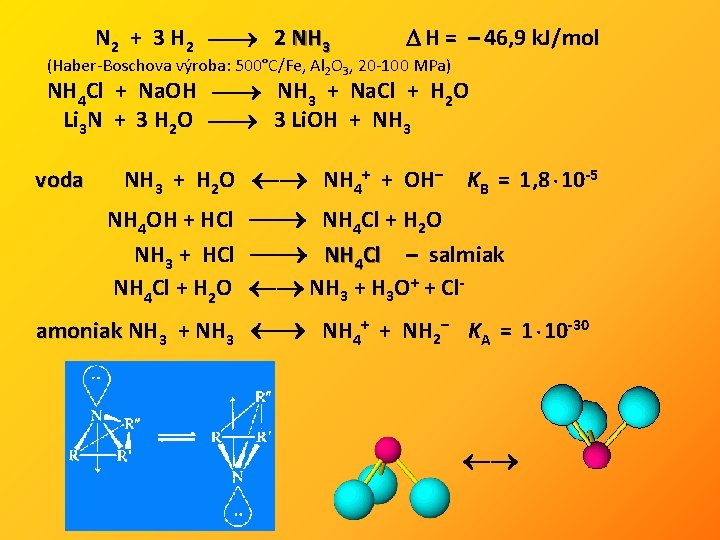
N 2 + 3 H 2 2 NH 3 H = – 46, 9 k. J/mol (Haber-Boschova výroba: 500°C/Fe, Al 2 O 3, 20 -100 MPa) NH 4 Cl + Na. OH NH 3 + Na. Cl + H 2 O Li 3 N + 3 H 2 O 3 Li. OH + NH 3 voda NH 3 + H 2 O NH 4+ + OH– KB = 1, 8 · 10 -5 NH 4 OH + HCl NH 4 Cl + H 2 O NH 3 + HCl NH 4 Cl – salmiak NH 4 Cl + H 2 O NH 3 + H 3 O+ + Clamoniak NH 3 + NH 3 NH 4+ + NH 2– KA = 1 · 10 -30

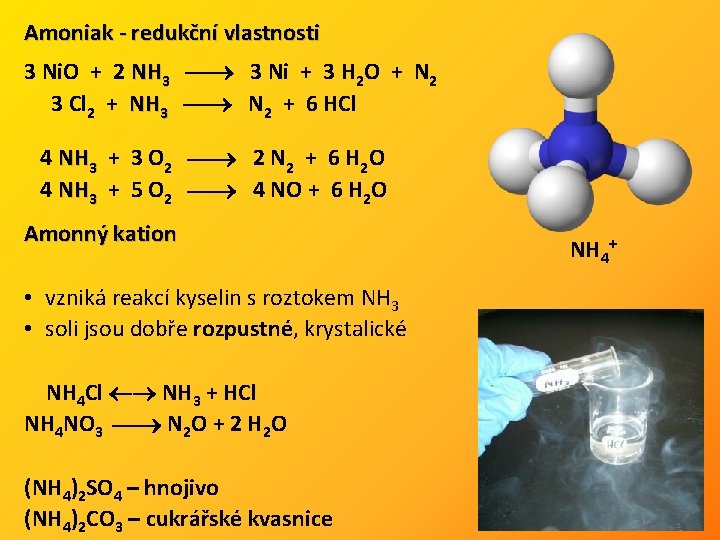
Amoniak - redukční vlastnosti 3 Ni. O + 2 NH 3 3 Ni + 3 H 2 O + N 2 3 Cl 2 + NH 3 N 2 + 6 HCl 4 NH 3 + 3 O 2 2 N 2 + 6 H 2 O 4 NH 3 + 5 O 2 4 NO + 6 H 2 O Amonný kation • vzniká reakcí kyselin s roztokem NH 3 • soli jsou dobře rozpustné, krystalické NH 4 Cl NH 3 + HCl NH 4 NO 3 N 2 O + 2 H 2 O (NH 4)2 SO 4 – hnojivo (NH 4)2 CO 3 – cukrářské kvasnice NH 4+

Deriváty amoniaku Amidy • vznikají např. reakcí alkalických kovů s kapalným amoniakem • NH 2 - je velmi silná baze NH 2 - + H 2 O NH 3 + OHNH 2 - + OH- NH 3 + O 2 Imidy • známé jen u Li, Ca, Ge, Sn a Pb • vznikají tepelným rozkladem amidů, nebo: Pb. I 2 + 2 KNH 2 Pb. NH + 2 KI + NH 3

Nitridy • vznikají reakcí s N 2, rozkladem amidů či imidů a reakcí s amoniakem Dělení: • iontové: Li 3 N, Mg 3 N 2, Ca 3 N 2 (bezbarvé vodou se rozkládájící) Mg 3 N 2 + 6 D 2 O 2 ND 3 + 3 Mg(OD)2 (příprava deuteroamoniaku pro NMR) • intersticiální: XN, X 2 N (tvrdé, odolné a vodivé) • kovalentní: Al. N, BN, S 4 N 4

Halogenderiváty NX 3 (NHX 2 a NH 2 X) NF 3 • vzniká elektrolýzou NH 4 HF 2, bezbarvý inertní plyn NCl 3, NHCl 2 a NH 2 Cl • vznikají reakcí Cl 2 s NH 4 Cl • p. H > 8, 5 NH 2 Cl; p. H = 5 NHCl 2; p. H < 4, 5 NCl 3 • chloramin i dichloramin existují jen ve zředěném roztoku • NCl 3 „chlorid dusitý“ - nestálá kapalina, explozivní NCl 3 + H 2 O NH 3 + 3 HOCl (bělení) NBr 3. 6 NH 3, NI 3. NH 3 • vznikají reakcí Br 2 s kapalným amoniakem či I 2 s roztokem amoniaku • třaskavé („jododusík“ - NI 3. NH 3)

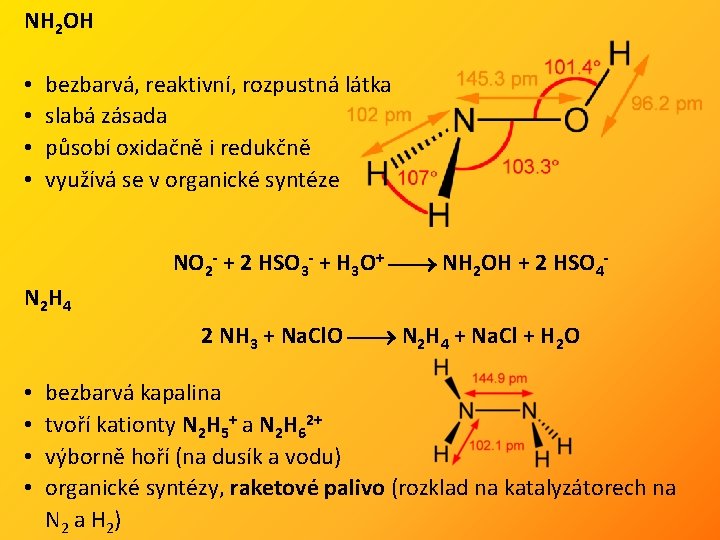
NH 2 OH • • bezbarvá, reaktivní, rozpustná látka slabá zásada působí oxidačně i redukčně využívá se v organické syntéze NO 2 - + 2 HSO 3 - + H 3 O+ NH 2 OH + 2 HSO 4 - N 2 H 4 2 NH 3 + Na. Cl. O N 2 H 4 + Na. Cl + H 2 O • • bezbarvá kapalina tvoří kationty N 2 H 5+ a N 2 H 62+ výborně hoří (na dusík a vodu) organické syntézy, raketové palivo (rozklad na katalyzátorech na N 2 a H 2 )

HN 3 • bezbarvá, vysoce toxická kapalina • má redukční i oxidační vlastnosti N 2 H 4 + HNO 2 HN 3 + 2 H 2 O • soli (slabá – jako kys. octová) - azidy, iontové jsou stálé (Na. N 3), kovalentní třaskavé (Pb(N 3)2, Cu(N 3)2) – rozbušky Oxidy dusíku N 2 O – rajský plyn, laughing gas (i film s Chaplinem, 1914) • netoxický, dobře rozpustný v tucích – ovlivňuje nervovou soustavu • podporuje hoření (rozkladem vzniká O) – oxidovadlo do raket i do aut

• plnění bombiček se šlehačkou • anestetikum NH 4 NO 3 N 2 O + 2 H 2 O • vyrábí se z něj i azid sodný N 2 O + Na. NH 2 Na. N 3 + H 2 O NO • bezbarvý plyn, paramagnetický – ale příliš nedimeruje (srov. NO 2) • ligand (nitrosyl) • vzdušným kyslíkem se rychle oxiduje na hnědý NO 2 3 Cu + 8 HNO 3 3 Cu(NO 3)2 + 2 NO + 4 H 2 O 2 NO + O 2 2 NO 2 (hnědé dýmy)

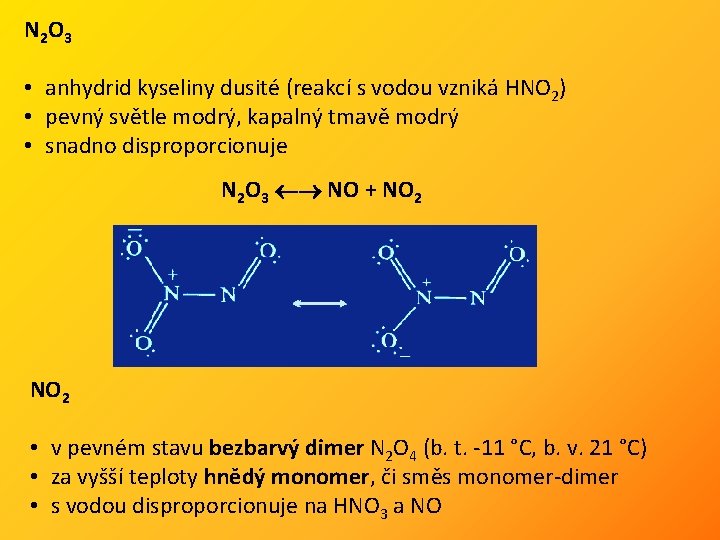
N 2 O 3 • anhydrid kyseliny dusité (reakcí s vodou vzniká HNO 2) • pevný světle modrý, kapalný tmavě modrý • snadno disproporcionuje N 2 O 3 NO + NO 2 • v pevném stavu bezbarvý dimer N 2 O 4 (b. t. -11 °C, b. v. 21 °C) • za vyšší teploty hnědý monomer, či směs monomer-dimer • s vodou disproporcionuje na HNO 3 a NO

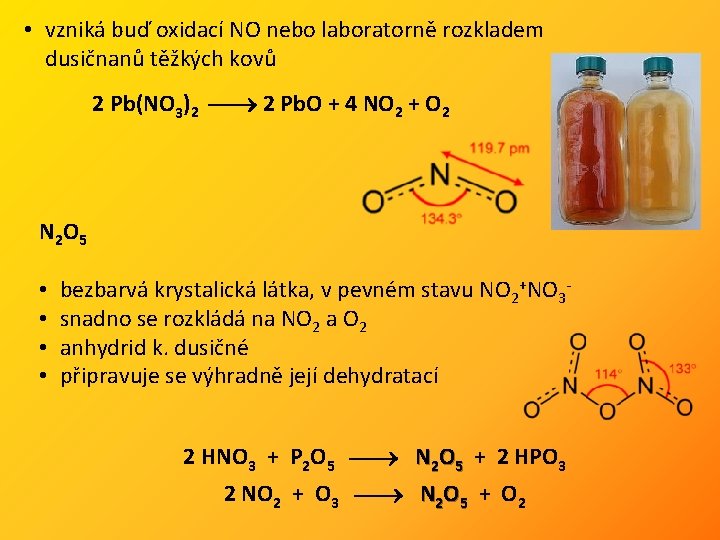
• vzniká buď oxidací NO nebo laboratorně rozkladem dusičnanů těžkých kovů 2 Pb(NO 3)2 2 Pb. O + 4 NO 2 + O 2 N 2 O 5 • • bezbarvá krystalická látka, v pevném stavu NO 2+NO 3 snadno se rozkládá na NO 2 anhydrid k. dusičné připravuje se výhradně její dehydratací 2 HNO 3 + P 2 O 5 N 2 O 5 + 2 HPO 3 2 NO 2 + O 3 N 2 O 5 + O 2

Kyslíkaté kyseliny Vzorec Název Poznámky H 2 N 2 O 2 kyselina didusná Slabá kyselina HON=NOH, izomerní s nitramidem H 2 N–NO 2, soli jsou známy {HNO} nitroxyl Reaktivní intermediát, soli jsou známy H 2 N 2 O 3 kyselina dihydrogendidusnatá Známá v roztoku a jako soli, např. Angeliho sůl Na 2(ON=NO 2) H 4 N 2 O 4 kyselina nitroxylová Explozívní; známá sodná sůl Na 4(O 2 NNO 2)

Vzorec Název HNO 2 kyselina dusitá HOONO kyselina peroxodusitá kyselina dusičná HNO 3 HNO 4 kyselina peroxodusičná Poznámky Nestálá, slabá kyselina, známé jsou stálé soli – dusitany Nestálá, izomerní s kyselinou dusičnou; některé soli jsou stabilnější Stálá, silná kyselina HONO 2, známo mnoho solí – dusičnanů Nestálé, explozívní krystaly HOONO 2 HNO 2 N 2 O 3 + H 2 O 2 HNO 2 • středně silná kyselina, připravuje se reakcí dusitanů s neoxidujícími kyselinami • dusitany pak redukcí či termickým rozkladem dusičnanů či: 2 Na. OH + N 2 O 3 2 Na. NO 2 + H 2 O

• • jsou dobře rozpustné ve vodě alkalické lze tavit, ostatní se rozkládají mírně toxický – konzervace masa využívá se i v organických syntézách NOX – halogenidy nitrosylu • reaktivní, nestabilní, ve vodě hydrolyzují na kys. dusitou a halogenovodík • připravují se z halogenu a NO HNO 3 • • bezbarvá kapalina, silné oxidační činidlo, silná kyselina rozpouští tedy i ušlechtilé kovy dá se připravit působením kyseliny sírové na dusičnany průmyslově z amoniaku – patří mezi tři hlavní průmyslové kyseliny

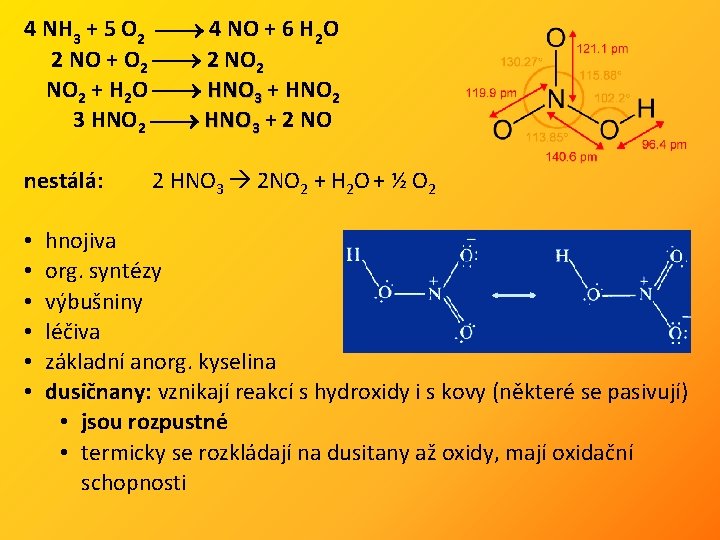
4 NH 3 + 5 O 2 4 NO + 6 H 2 O 2 NO + O 2 2 NO 2 + H 2 O HNO 3 + HNO 2 3 HNO 2 HNO 3 + 2 NO nestálá: • • • 2 HNO 3 2 NO 2 + H 2 O + ½ O 2 hnojiva org. syntézy výbušniny léčiva základní anorg. kyselina dusičnany: vznikají reakcí s hydroxidy i s kovy (některé se pasivují) • jsou rozpustné • termicky se rozkládají na dusitany až oxidy, mají oxidační schopnosti

NO 2 X – halogenidy nitrylu • bezbarvé plyny • s vodou hydrolyzují na k. dusičnou a halogenovodík Sloučeniny fosforu Fosfidy • • přímou reakcí prvků M 4 P až MP 15 bohaté na kov jsou tvrdé, křehké, nereaktivní bohaté na P jsou reaktivní, polovodivé

Hydridy - PH 3 a P 2 H 4 - několik homologických řad (řetězovité i cyklické, klusterové) PH 3 • bezbarvý, toxický, páchne po česneku • vyrábí se rozkladem fosfidů vodou či kyselinami • snadno se oxiduje (silné redukční činidlo) PH 3 + 4 Cl 2 PCl 5 + 2 HCl P 2 H 4 • reaktivní bezbarvá kapalina • vyrábí se z PH 3 elektrickým výbojem

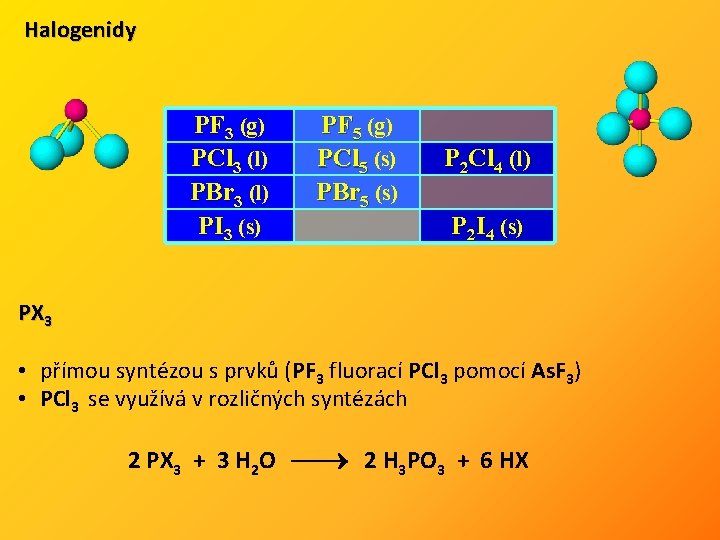
Halogenidy PF 3 (g) PCl 3 (l) PBr 3 (l) PI 3 (s) PF 5 (g) PCl 5 (s) PBr 5 (s) P 2 Cl 4 (l) P 2 I 4 (s) PX 3 • přímou syntézou s prvků (PF 3 fluorací PCl 3 pomocí As. F 3) • PCl 3 se využívá v rozličných syntézách 2 PX 3 + 3 H 2 O 2 H 3 PO 3 + 6 HX

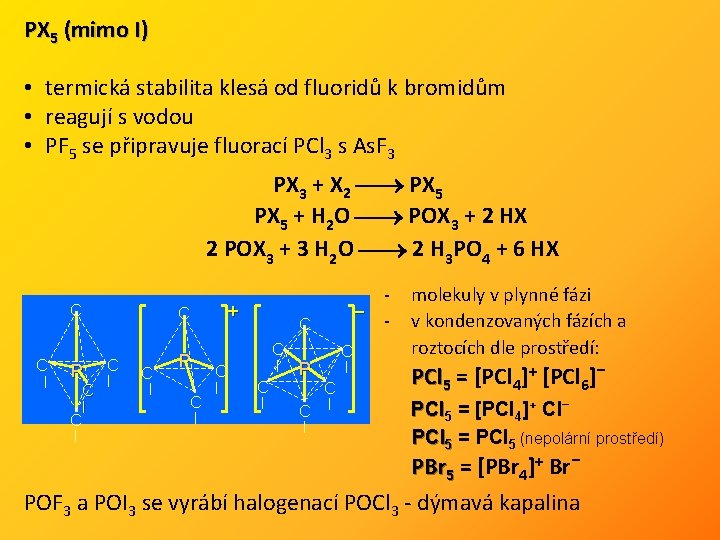
PX 5 (mimo I) • termická stabilita klesá od fluoridů k bromidům • reagují s vodou • PF 5 se připravuje fluorací PCl 3 s As. F 3 PX 3 + X 2 PX 5 + H 2 O POX 3 + 2 HX 2 POX 3 + 3 H 2 O 2 H 3 PO 4 + 6 HX C l P C l C l C l P C l + C l C l P C C l l – C l molekuly v plynné fázi v kondenzovaných fázích a roztocích dle prostředí: PCl 5 = [PCl 4]+ [PCl 6]– PCl 5 = [PCl 4]+ Cl– PCl 5 = PCl 5 (nepolární prostředí) PBr 5 = [PBr 4]+ Br – POF 3 a POI 3 se vyrábí halogenací POCl 3 - dýmavá kapalina

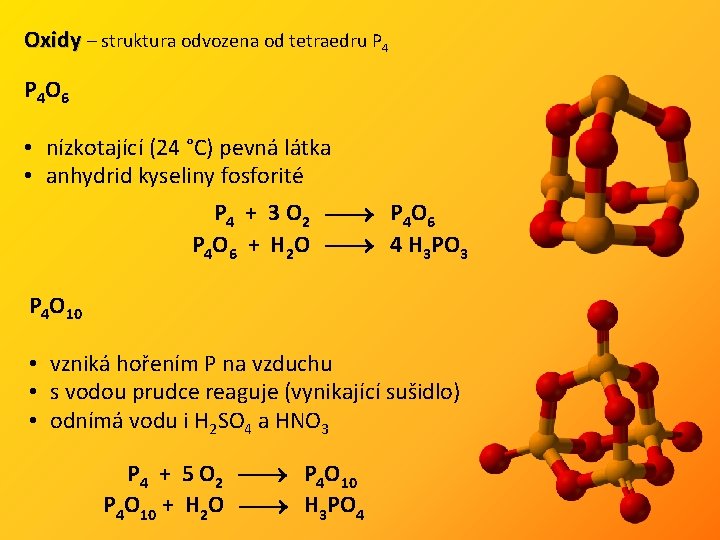
Oxidy – struktura odvozena od tetraedru P 4 O 6 • nízkotající (24 °C) pevná látka • anhydrid kyseliny fosforité P 4 + 3 O 2 P 4 O 6 + H 2 O 4 H 3 PO 3 P 4 O 10 • vzniká hořením P na vzduchu • s vodou prudce reaguje (vynikající sušidlo) • odnímá vodu i H 2 SO 4 a HNO 3 P 4 + 5 O 2 P 4 O 10 + H 2 O H 3 PO 4

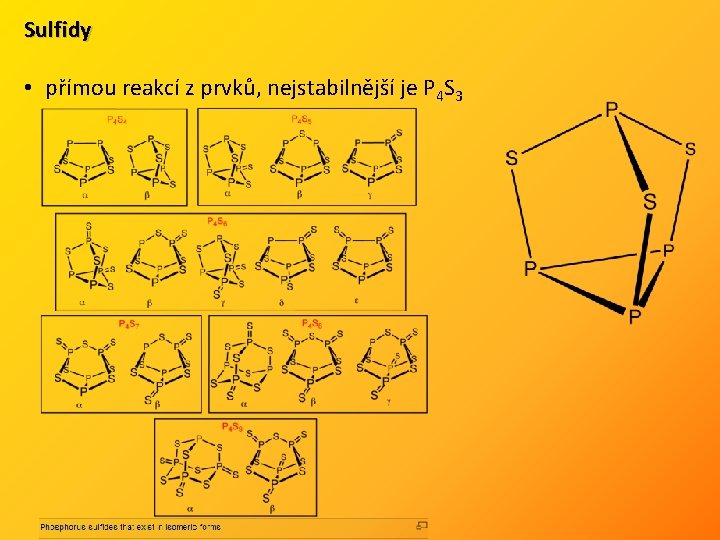
Sulfidy • přímou reakcí z prvků, nejstabilnější je P 4 S 3

Oxokyseliny, soli • mono- i polykyseliny - struktury lineární i cyklické • Strukturní principy: 1) Všechny atomy fosforu mají koordinační číslo 4 2) Obsahují nejméně jednu jednotku P=O 3) Všechny atomy fosforu mají alespoň jednu skupinu P-OH (ionizovatelné) 4) Mohou obsahovat skupinu P-H (neionizovatelné) 5) Řetězení se děje můstky P-O-P, případně P-P
![Kyseliny soli H 3 PO 2 HPH 2 O 2 dihydridodioxofosforečná kys fosforná Kyseliny, soli H 3 PO 2, H[PH 2 O 2] – dihydrido-dioxofosforečná (kys. fosforná,](https://slidetodoc.com/presentation_image_h2/5181814112e43cc6646b0809c50bec1c/image-29.jpg)
Kyseliny, soli H 3 PO 2, H[PH 2 O 2] – dihydrido-dioxofosforečná (kys. fosforná, fosfinová) PH 3 + 2 I 2 + 2 H 2 O H 3 PO 2+ 4 I- + 4 H+ • • • silná (p. Ka = 1, 1) , jednosytná kyselina soli jsou dobře rozpustné, jsou silná redukovadla Na[PH 2 O 2]. H 2 O se průmyslově využívá (bezproudé niklování) farmaceutický průmysl konverze Ar. N 2+ to Ar-H průmyslová výroba: P 4 + 3 OH− + 3 H 2 O 3 H 2 PO 2− + PH 3 H 2 PO 2− + H+ H 3 PO 2
![H 3 PO 3 H 2PHO 3 hydridotrioxofosforečná kys fosforitá fosfonová H 3 PO 3, H 2[PHO 3] – hydrido-trioxofosforečná (kys. fosforitá, fosfonová) • •](https://slidetodoc.com/presentation_image_h2/5181814112e43cc6646b0809c50bec1c/image-30.jpg)
H 3 PO 3, H 2[PHO 3] – hydrido-trioxofosforečná (kys. fosforitá, fosfonová) • • silná (p. KA 1 = 1, 3; p. KA 2 = 6, 7), dvojsytná kyselina slabší redukovadlo, než kys. fosforná fosforitany alkalických a těžkých kovů jsou málo rozpustné fosforitan draselný se používá jako antibakteriální látka laboratorně se vyrábí hydrolýzou PCl 3 v CCl 4 organické deriváty: OPR(OR)2 apod. – P(OR)3 výroby: P 4 O 6 + 6 H 2 O 4 HP(O)(OH)2 PCl 3 + 3 H 2 O HP(O)(OH)2 + 3 HCl K 2 HPO 3 + 2 HCl 2 KCl + H 3 PO 3

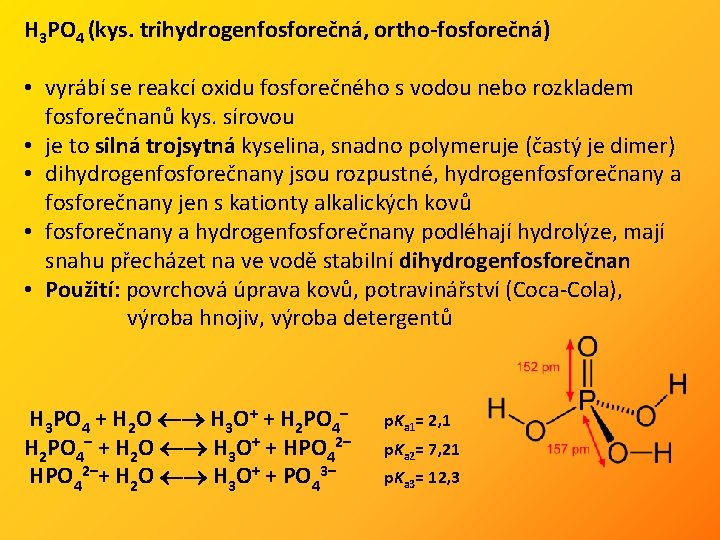
H 3 PO 4 (kys. trihydrogenfosforečná, ortho-fosforečná) • vyrábí se reakcí oxidu fosforečného s vodou nebo rozkladem fosforečnanů kys. sírovou • je to silná trojsytná kyselina, snadno polymeruje (častý je dimer) • dihydrogenfosforečnany jsou rozpustné, hydrogenfosforečnany a fosforečnany jen s kationty alkalických kovů • fosforečnany a hydrogenfosforečnany podléhají hydrolýze, mají snahu přecházet na ve vodě stabilní dihydrogenfosforečnan • Použití: povrchová úprava kovů, potravinářství (Coca-Cola), výroba hnojiv, výroba detergentů H 3 PO 4 + H 2 O H 3 O+ + H 2 PO 4– + H 2 O H 3 O+ + HPO 42–+ H 2 O H 3 O+ + PO 43– p. Ka 1= 2, 1 p. Ka 2= 7, 21 p. Ka 3= 12, 3

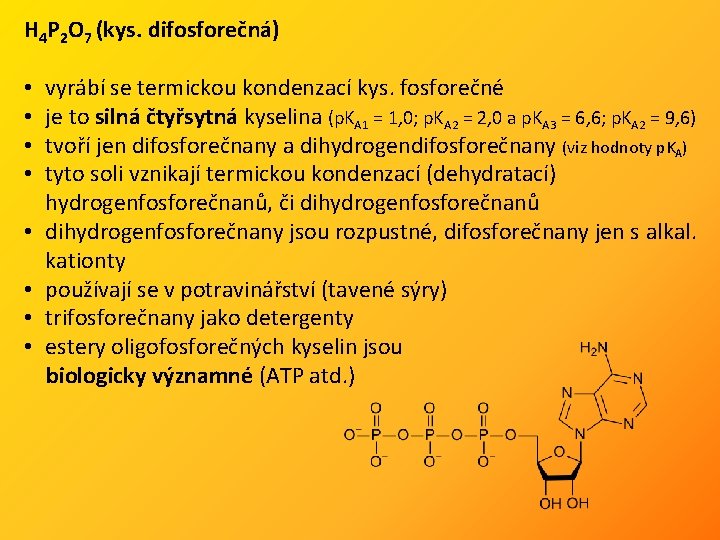
H 4 P 2 O 7 (kys. difosforečná) • • vyrábí se termickou kondenzací kys. fosforečné je to silná čtyřsytná kyselina (p. KA 1 = 1, 0; p. KA 2 = 2, 0 a p. KA 3 = 6, 6; p. KA 2 = 9, 6) tvoří jen difosforečnany a dihydrogendifosforečnany (viz hodnoty p. KA) tyto soli vznikají termickou kondenzací (dehydratací) hydrogenfosforečnanů, či dihydrogenfosforečnanů dihydrogenfosforečnany jsou rozpustné, difosforečnany jen s alkal. kationty používají se v potravinářství (tavené sýry) trifosforečnany jako detergenty estery oligofosforečných kyselin jsou biologicky významné (ATP atd. )


(HPO 3)x (kyselina monohydrogenfosforečná, meta-fosforečná) • připravuje se dehydratací, kys. trihydrogenfosforečné • je to sklovitá polymerní látka • soli se připravují termickou dehydratací dihydrogenfosforečnanů či dihydrogendifosforečnanů alkalických kovů Fosfazeny (fosfazany) • sloučeniny s vazbou P=N (P-N), početná skupina sloučenin • organicky substituované sloučeniny (Kirsanovova reakce): (C 6 H 5)3 PCl 2 + C 6 H 5 NH 2 (C 6 H 5)3 P=N-C 6 H 5 + 2 HCl
![Difosfazeny 3 PCl 5 NH 4 Cl Cl 3 PNPCl 3PCl 6 Difosfazeny 3 PCl 5 + NH 4 Cl [Cl 3 P=N-PCl 3]+PCl 6 -](https://slidetodoc.com/presentation_image_h2/5181814112e43cc6646b0809c50bec1c/image-35.jpg)
Difosfazeny 3 PCl 5 + NH 4 Cl [Cl 3 P=N-PCl 3]+PCl 6 - + 4 HCl • reakce probíhá v chlorovaných uhlovodících jako Cl 3 C-CCl 3, CCl 4 apod. Nejrozsáhlejší jsou cyklické fosfazeny n PCl 5 + n NH 4 Cl (PNCl 2)n + 4 n HCl • vzniká takto směs fosfazenů, cyklické (n = 3 – 8), lineární (n = ∞), (PNCl 2)3 – hexachloro-cyklo-trifosfazen Hydrolýza chloro-cyklo-fosfazenů (PNCl 2)n + H 2 O (PN(OH)2)n cyklo-nitridofosforečná kyselina

Fluoro-cyklo-fosfazeny (PNCl 2)4 + 8 KSO 2 F (PNF 2)4 + 8 KCl + 8 SO 2 Zahříváním směsi chloro-cyklo-fosfazenů vzniká polymer (PNCl 2)n „anorganický kaučuk“. Organofosforečné sloučeniny • např. P(C 6 H 5)5 - pentafenylfosforan

Toxicita N 2 • netoxický, ale nedýchatelný • za tlaku se rozpouští v krvi, při snížení tlaku se z krve vylučuje – kesonová nemoc Oxidy dusíku • dráždí dýchací cesty, vedoucí až k edému plic • jsou součástí městského oxidačního smogu Kyselina dusičná, dusičnany • kyselina je silně leptavá, dusičnany jsou téměř netoxické • biotransformují se ale na dusitany

Dusitany • LD 50 = 4 g, způsobují oxidaci hemoglobinu na methemoglobin (používají se jako protijed ke kyanidové otravě) • způsobují roztažení cév • podezřelé z karcinogenity, neboť mohou být biotransformovány na N-nitrososloučeniny, které poté přecházejí na diazosloučeniny • ty jsou silně elektrofilní a mohou tak velice snadno alkylovat DNA, čímž dochází ke vzniku mutací Estery kyseliny dusičné a dusité • ethylenglykoldinitrát a glyceroltrinitrát (nitroglycerin) • léčba anginy pectoris, vysoce jedovaté látky • vyvolávají oxidaci hemoglobinu na methemoglobin, vznik chudokrevnosti, poškození srdečního svalu, ledvin, jater a sleziny • estery kyseliny dusité jsou kardiotoxické a neurotoxické

Amoniak • leptá sliznice, včetně očí, nad 3, 5 g/m 3 nastává smrt • amonné soli jsou málo toxické Hydrazin • dráždivé a leptavé účinky, toxický pro játra, ledviny i srdce • poškozuje embryo • velmi snadno reaguje s kteroukoliv ketoskupinou za vzniku hydrazonu, čímž inhibuje mnohé enzymy (reaguje např. s koenzymem pyridoxalfosfátem), může tak ale též reagovat s bázemi DNA Azidy • napodobují chloridové ionty, čímž ovlivňují otevírání a zavírání nervových kanálů, poškozují zejména nervy, HN 3 jed. jako HCN

P Bílý fosfor P 4 • • • samozápalný, působí destrukce tkání a těžce se hojící popáleniny narušuje metabolismus cukrů, tuků i bílkovin brání též ukládání glykogenu v játrech poškozuje játra, ledviny a nervovou soustavu při chronické otravě dochází k poškozování kostí LD 50 = 70 mg (oxo)Halogenidy fosforečné(ité) • silně dráždivé látky, po expozici může vznikat edém plic

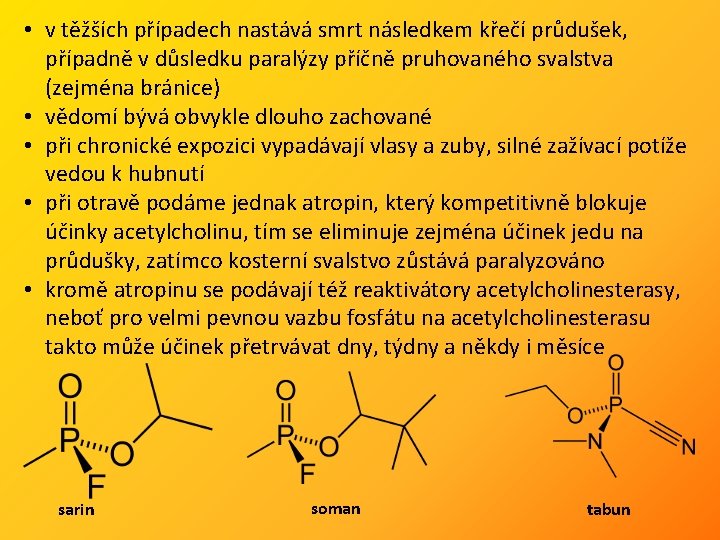
Organofosfáty – organické estery kyseliny fosforečné • vysoce toxické, bývají využívány jako insekticidy nebo ve válkách jako nervové plyny • extrémně toxické jsou pak fluorofosfáty • nevratným způsobem inhibují enzym acetylcholinesterasu, který na nervových zakončeních katalyzuje rozklad nervového přenašeče acetylcholinu na cholin a kyselinu octovou • inhibice tohoto rozkladu vede ke zvýšeným koncentracím acetylcholinu na nervových zakončeních • otrava se projevuje jednak příznaky trávicí soustavy (křeče, zvracení, průjmy), dále slzením, pocením, snížením krevního tlaku, svalovou slabostí až paralýzou • otrávený je neklidný, nemůže se soustředit, objevují se též poruchy paměti a spánku, dýchání je oslabeno • bývá pozorováno poškození slinivky břišní, ledvin, krvácení do jater a do dalších orgánů

• v těžších případech nastává smrt následkem křečí průdušek, případně v důsledku paralýzy příčně pruhovaného svalstva (zejména bránice) • vědomí bývá obvykle dlouho zachované • při chronické expozici vypadávají vlasy a zuby, silné zažívací potíže vedou k hubnutí • při otravě podáme jednak atropin, který kompetitivně blokuje účinky acetylcholinu, tím se eliminuje zejména účinek jedu na průdušky, zatímco kosterní svalstvo zůstává paralyzováno • kromě atropinu se podávají též reaktivátory acetylcholinesterasy, neboť pro velmi pevnou vazbu fosfátu na acetylcholinesterasu takto může účinek přetrvávat dny, týdny a někdy i měsíce sarin soman tabun

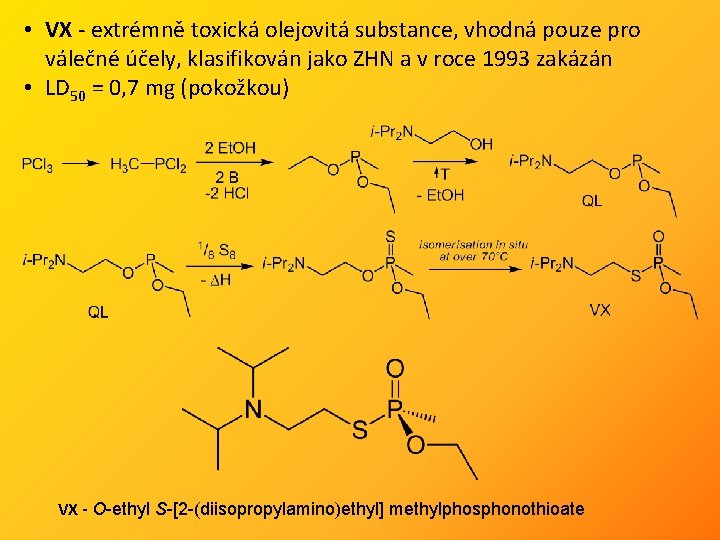
• VX - extrémně toxická olejovitá substance, vhodná pouze pro válečné účely, klasifikován jako ZHN a v roce 1993 zakázán • LD 50 = 0, 7 mg (pokožkou) VX - O-ethyl S-[2 -(diisopropylamino)ethyl] methylphosphonothioate
 Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Solvokyselina
Solvokyselina Nekovový prvek žluté barvy
Nekovový prvek žluté barvy Lehký stříbřitý kovový prvek
Lehký stříbřitý kovový prvek čtvrtý nejrozšířenější prvek zemské atmosféry
čtvrtý nejrozšířenější prvek zemské atmosféry Prvek
Prvek Prvek
Prvek Klimatizace odpisová skupina
Klimatizace odpisová skupina Poluacetalna skupina
Poluacetalna skupina Karboksilna skupina
Karboksilna skupina Vakovenka
Vakovenka Aromatick
Aromatick Soumrační živočichové
Soumrační živočichové Bajt bit
Bajt bit Skupina
Skupina česká metalová skupina křížovka
česká metalová skupina křížovka Odilon redon zavřené oči
Odilon redon zavřené oči Skupina ohnice
Skupina ohnice Ryby (osteichthyes)
Ryby (osteichthyes) Pomrn
Pomrn Vi.a skupina
Vi.a skupina Germánské jazyky
Germánské jazyky Skupina ps
Skupina ps Vazba genov
Vazba genov Vladimir meniny
Vladimir meniny Skupina bonks
Skupina bonks Karbonylová skupina vzorec
Karbonylová skupina vzorec Dotazník naša trieda
Dotazník naša trieda Smile skupina
Smile skupina Skupina 42 prezentace
Skupina 42 prezentace Hlavonožci zástupci
Hlavonožci zástupci Skupina mongolidov
Skupina mongolidov Alkilna skupina nastala iz etana
Alkilna skupina nastala iz etana Eterska skupina
Eterska skupina Iii.a skupina
Iii.a skupina Halogen br
Halogen br Thiolová skupina
Thiolová skupina Strunarji
Strunarji Genesis skupina
Genesis skupina Chalkogeny
Chalkogeny Karbonilna jedinjenja
Karbonilna jedinjenja Vrstevnická skupina
Vrstevnická skupina Coh skupina
Coh skupina Kyselina
Kyselina