NZEV KOLY Zkladn kola Stranice okres Prahavchod AUTOR









![Zdroje a citace • • • Emil Votoček: foto. Www. cvut. cz [online]. 2006 Zdroje a citace • • • Emil Votoček: foto. Www. cvut. cz [online]. 2006](https://slidetodoc.com/presentation_image_h/86e7d6e2dbaf4d10d16106fcfa820b37/image-12.jpg)
- Slides: 12

NÁZEV ŠKOLY: Základní škola Strančice, okres Praha-východ AUTOR: Ing. Ivana Fiedlerová NÁZEV: VY_32_INOVACE_3. 2. 4. 3. F 04 TEMA: Chemie – Názvosloví dvouprvkových sloučenin ČÍSLO PROJEKTU: CZ. 1. 07/1. 4. 00/21. 2976

Anotace • Tento materiál je určen pro žáky 8. ročníku ZŠ, • Týká se tvorby názvosloví dvouprvkových sloučenin, • Vysvětluje postup tvorby názvu na konkrétní dvouprvkové sloučenině

Názvosloví dvouprvkových sloučenin

Profesor Emil Votoček • byl českým chemikem světového jména, profesorem experimentální anorganické i organické chemie na pražské technice, jedním ze zakladatelů českého chemického názvosloví

Názvosloví • Oxidační číslo prvků je základní pojem, na kterém je názvosloví anorganické chemie vybudováno OXIDAČNÍ ČÍSLO: • Může být kladné, záporné nebo nula • Píšeme ho římskými číslicemi ke značce prvku vpravo nahoru(př. Na+I, Cl-I) • Ve dvouprvkových sloučeninách mají vždy atomy jednoho prvku kladné oxidační číslo a atomy druhého prvku záporné oxidační číslo.

Dvouprvkové sloučeniny • HALOGENIDY (F, Cl, Br, I + prvek) Chlorid, fluorid, bromid, jodid HCl, Ag. Br, Na. Cl • OXIDY (O + prvek) CO 2, Al 2 O 3 • SULFIDY (S + prvek) Fe. S,

Název sloučenin je dvouslovný: v PODSTATNÉ JMÉNO • u dvouprvkových sloučenin má koncovku –id • prvek má záporné oxidační číslo v PŘÍDAVNÉ JMÉNO • je odvozeno od druhého prvku příslušnou koncovkou • prvek má kladné oxidační číslo

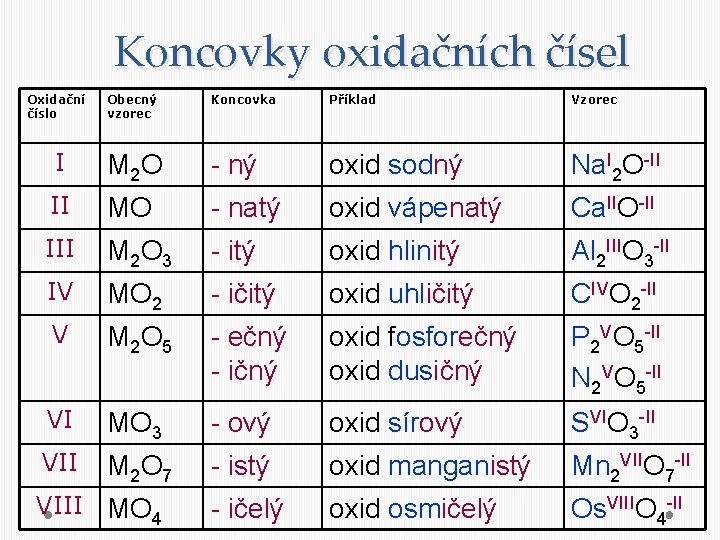
Koncovky oxidačních čísel Oxidační číslo Obecný vzorec Koncovka Příklad Vzorec I M 2 O - ný oxid sodný Na. I 2 O-II II MO - natý oxid vápenatý Ca. IIO-II III M 2 O 3 - itý oxid hlinitý Al 2 IIIO 3 -II IV MO 2 - ičitý oxid uhličitý CIVO 2 -II V M 2 O 5 - ečný - ičný oxid fosforečný oxid dusičný P 2 VO 5 -II N 2 VO 5 -II VI MO 3 - ový oxid sírový SVIO 3 -II VII M 2 O 7 - istý oxid manganistý Mn 2 VIIO 7 -II - ičelý oxid osmičelý Os. VIIIO 4 -II VIII MO 4

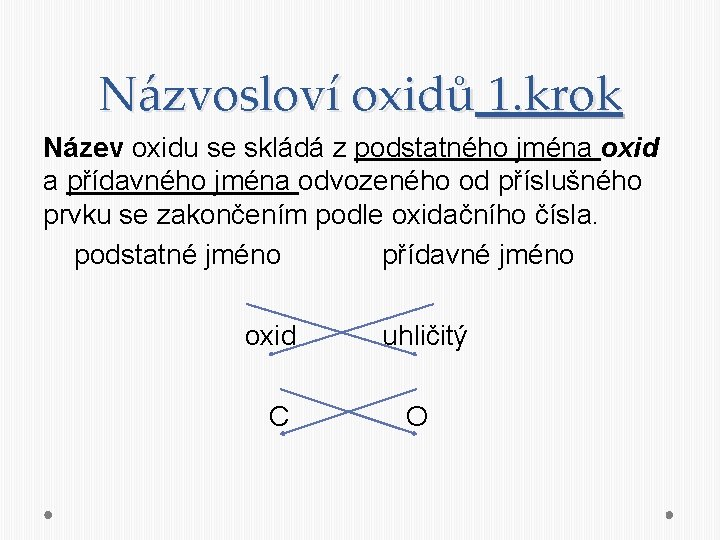
Názvosloví oxidů 1. krok Název oxidu se skládá z podstatného jména oxid a přídavného jména odvozeného od příslušného prvku se zakončením podle oxidačního čísla. podstatné jméno přídavné jméno oxid uhličitý C O

Názvosloví oxidů 2. krok • Doplníme ke značkám prvků oxidační čísla: vpravo nahoru římskými číslovkami • Ve všech oxidech mají atomy kyslíku oxidační číslo II: zapisujeme O-II • K uhlíku napíšeme oxidační číslo, které odpovídá koncovce přídavného jména… číslo, oxidační číslo tohoto prvku má kladnou hodnotu : +IV C+IV O-II Křížové pravidlo C 2 O 4 indexy vždy krátíme, číslo 1 nepíšeme 1 2 • Výsledný vzorec : CO 2

Napiš vzorce oxidů • • • oxid draselný oxid hořečnatý oxid boritý oxid uhličitý oxid dusičný oxid fosforečný oxid sírový oxid chloristý oxid osmičelý
![Zdroje a citace Emil Votoček foto Www cvut cz online 2006 Zdroje a citace • • • Emil Votoček: foto. Www. cvut. cz [online]. 2006](https://slidetodoc.com/presentation_image_h/86e7d6e2dbaf4d10d16106fcfa820b37/image-12.jpg)
Zdroje a citace • • • Emil Votoček: foto. Www. cvut. cz [online]. 2006 [cit. 2011 -12 -09]. Dostupné z: http: //www. cvut. cz/fotobanka/osobnosti/rektori/r 58. jpg/view ČTRNÁCTOVÁ, CSC. , Doc. RNDr. Hana, Prof. Ing. Karel KOLÁŘ, CSC. , Paed. Dr. Miloslava SVOBODOVÁ a RNDr. František ZEMÁNEK. Přehled chemie pro základní školy. 1. vydání. Praha: SPN-pedagogické nakladatelství, a. s. , 2006. ISBN 80 -7235 -260 -1. BENEŠ, CSC. , Prof. RNDr. Pavel, Ph. Dr. Václav PUMPR, CSC. a Doc. RNDr. Jiří BANÝR, CSC. Základy praktické chemie: pro 8. ročník základní školy. 2. aktualizované vydání. Praha: Nakladatelství FORTUNA, 2006. ISBN 80 -7168 -879 -7.























