16 skupina 1 16 skupina VI A skupina








- Slides: 16

16. skupina 1

16. skupina (VI. A skupina) Chalkogeny Kyslík síra Symbol: Mezinárodní název: Elektronegativita (X): Počet protonů (Z): Atom. Relat. hmotnost (Ar): Počet valenčních elektronů: Elektronová konfigurace: Oxidační čísla: -II, -1/2, O, I, II selen tellur Radioaktivní polonium -II, IV a VI Ó Slečno Sejměte Též Podkolenku 2

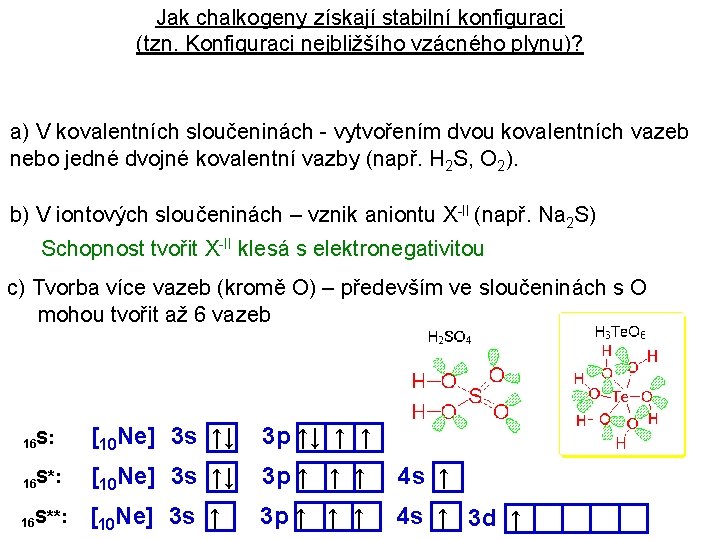
Jak chalkogeny získají stabilní konfiguraci (tzn. Konfiguraci nejbližšího vzácného plynu)? a) V kovalentních sloučeninách - vytvořením dvou kovalentních vazeb nebo jedné dvojné kovalentní vazby (např. H 2 S, O 2). b) V iontových sloučeninách – vznik aniontu X-II (např. Na 2 S) Schopnost tvořit X-II klesá s elektronegativitou c) Tvorba více vazeb (kromě O) – především ve sloučeninách s O mohou tvořit až 6 vazeb 16 S: [10 Ne] 3 s ↑↓ 3 p ↑↓ ↑ ↑ 16 S*: [10 Ne] 3 s ↑↓ 3 p ↑ ↑ ↑ 4 s ↑ 16 S**: [10 Ne] 3 s ↑ 3 p ↑ ↑ ↑ 4 s ↑ 3 d ↑

Síra výskyt: a) volná: sopky (sopečný plyn) b) ve sloučeninách: Pyrit Fe. S 2 biogenní prvek (v bílkovinách) sulfidy: Sfalerit Zn. S Rumělka Hg. S 4

Ve sloučeninách: Pyrit Fe. S 2 Galenit Pb. S biogenní prvek (v bílkovinách) sulfidy: Sfalerit Zn. S Rumělka Hg. S Chalkozin Cu 2 S Chalkopyrit Cu. Fe. S 2 sírany: Glauberova sůl Na 2 SO 4. 10 H 2 O Baryt Ba. SO 4 Sádrovec Ca. SO 4. 2 H 2 O 5

těžba síry: Roztavení síry v podzemních ložiscích přehřátou vodní parou. Zkapalněná síra je vyháněna stlačeným vzduchem. modifikace síry: Kosočtverečná-stálá Jednoklonná z cyklických molekul S 8 Amorfní (plastická síra) -S-SSirný květ (ochlazení sirných par – S 2) vlastnosti síry: Za norm. podmínek pevná žlutá látka. Nerozp. V H 2 O ale rozp. v nepol. rozp. (CS 2) 6

užití síry: Základní surovina v chem. Průmyslu: H 2 SO 4, H 2 S, siřičitany a sulfidy Zápalky Vulkanizace kaučuku Prostředky proti rostlinným škůdcům. 7

Sloučeniny síry: H 2 S= sulfan, sirovodík Prudce jedovatý plyn odporného zápachu. Sulfidy, S 2 - (např. Pb. S, Na 2 S) Slabá dvojsytná kyselina. Hydrogensulfidy, HS- (např. Na. HS) příprava sulfidů: srážení roztoků kovů sulfanem: Pb 2+ (Cd 2+, Cu 2+, Sb 3+…) + H 2 S Pb. S (Cd. S, Cu. S, Sb 2 S 3) + 2 H+ 8

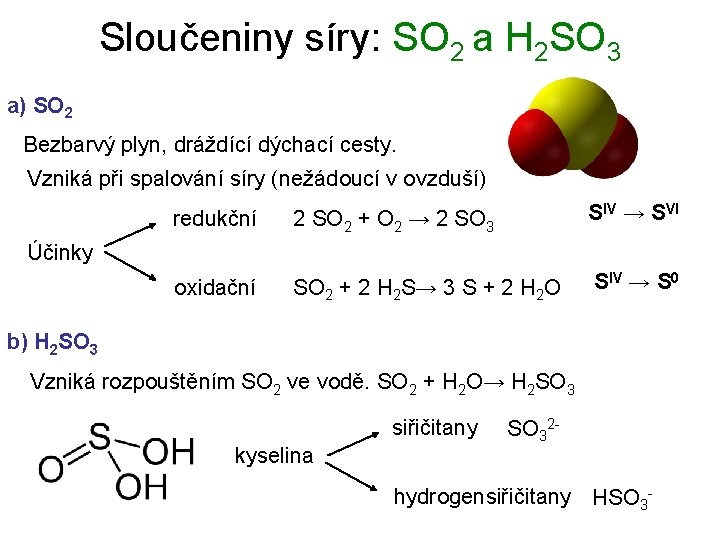
Sloučeniny síry: SO 2 a H 2 SO 3 a) SO 2 Bezbarvý plyn, dráždící dýchací cesty. Vzniká při spalování síry (nežádoucí v ovzduší) redukční 2 SO 2 + O 2 → 2 SO 3 SIV → SVI oxidační SO 2 + 2 H 2 S→ 3 S + 2 H 2 O SIV → S 0 Účinky b) H 2 SO 3 Vzniká rozpouštěním SO 2 ve vodě. SO 2 + H 2 O→ H 2 SO 3 siřičitany kyselina SO 32 - hydrogensiřičitany HSO 3 -

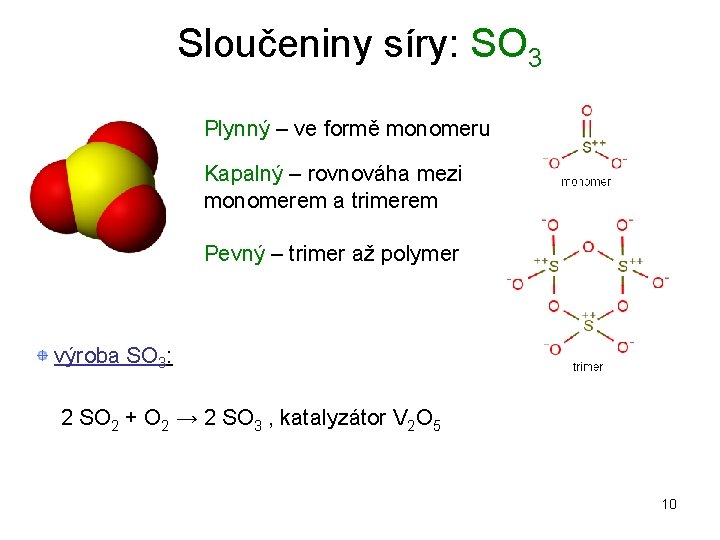
Sloučeniny síry: SO 3 Plynný – ve formě monomeru Kapalný – rovnováha mezi monomerem a trimerem Pevný – trimer až polymer výroba SO 3: 2 SO 2 + O 2 → 2 SO 3 , katalyzátor V 2 O 5 10

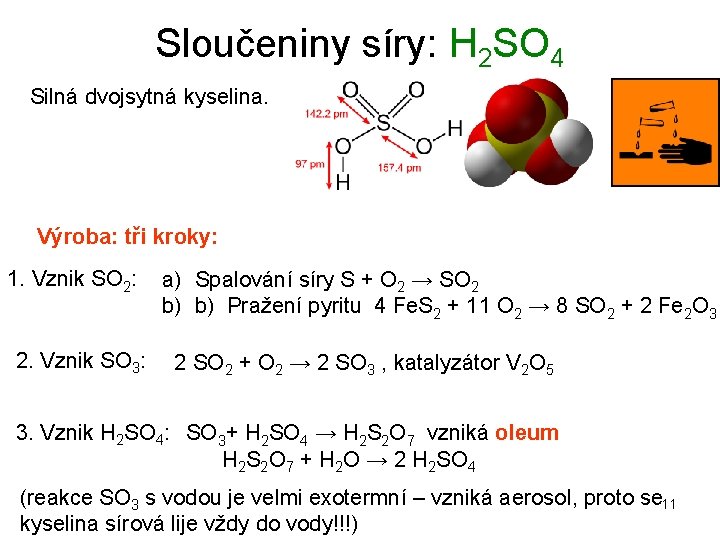
Sloučeniny síry: H 2 SO 4 Silná dvojsytná kyselina. Výroba: tři kroky: 1. Vznik SO 2: 2. Vznik SO 3: a) Spalování síry S + O 2 → SO 2 b) b) Pražení pyritu 4 Fe. S 2 + 11 O 2 → 8 SO 2 + 2 Fe 2 O 3 2 SO 2 + O 2 → 2 SO 3 , katalyzátor V 2 O 5 3. Vznik H 2 SO 4: SO 3+ H 2 SO 4 → H 2 S 2 O 7 vzniká oleum H 2 S 2 O 7 + H 2 O → 2 H 2 SO 4 (reakce SO 3 s vodou je velmi exotermní – vzniká aerosol, proto se 11 kyselina sírová lije vždy do vody!!!)

1. Koncentrovaná kyselina – dehydratační činidlo 2. za horka oxidační vlastnosti Cu (ušlecht. ) + H 2 SO 4 → Cu. O + SO 2 + H 2 O (oxiduje i ušlechtilé kovy) 2. Zředěná kyselina Ve zředěném roztoku ztrácí oxidační vlastnosti, reaguje pouze s neušlech. kovy Zn (neušlecht. )+ H 2 SO 4 → Zn. SO 4 + H 2 (vytěsňuje vodík) Soli: Silná dvojsytná kyselina – dvě řady solí hydrogensírany Podvojné sírany = kamence KCr(SO 4)2. 12 H 2 O = dodekahydrát síranu draselno-chromitého Užití kyseliny: základní průmyslová chemikálie (k výrobě hnojiv – superfosfáty), k plnění akumulátorů, výroba vláken…) 12

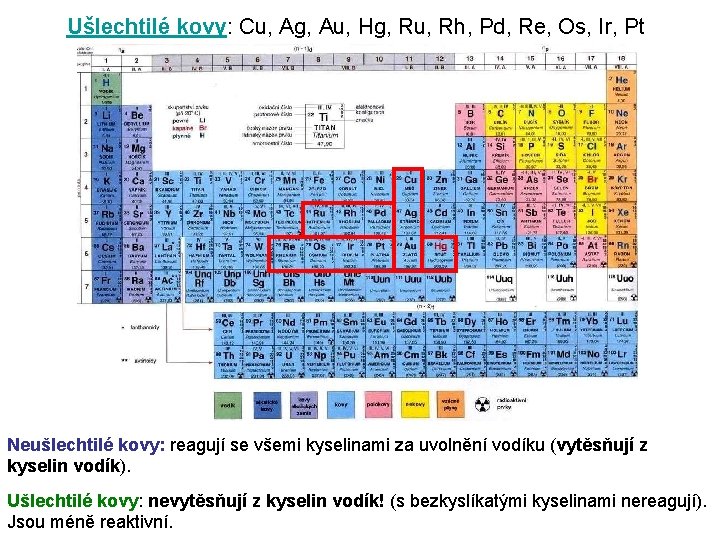
Ušlechtilé kovy: Cu, Ag, Au, Hg, Ru, Rh, Pd, Re, Os, Ir, Pt Neušlechtilé kovy: reagují se všemi kyselinami za uvolnění vodíku (vytěsňují z kyselin vodík). Ušlechtilé kovy: nevytěsňují z kyselin vodík! (s bezkyslíkatými kyselinami nereagují). 13 Jsou méně reaktivní.


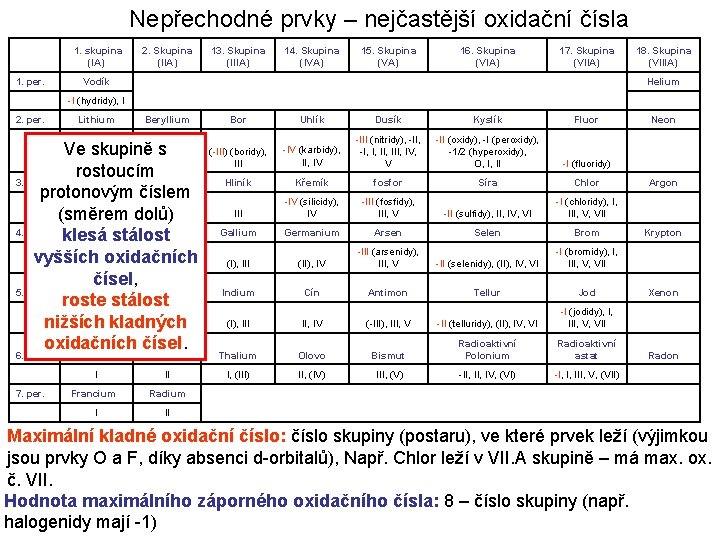
Nepřechodné prvky – nejčastější oxidační čísla 1. skupina (IA) 1. per. 2. Skupina (IIA) 13. Skupina (IIIA) 14. Skupina (IVA) 15. Skupina (VA) 16. Skupina (VIA) 17. Skupina (VIIA) Vodík 18. Skupina (VIIIA) Helium -I (hydridy), I 2. per. Lithium Beryllium Ve skupině s I II rostoucím 3. per. Sodík Hořčík protonovým číslem I (směrem dolů)II 4. per. Draslík Vápník klesá stálost vyšších. I oxidačních II čísel, 5. per. Rubidium Stroncium roste stálost II nižších. I kladných oxidačních čísel. 6. per. 7. per. Bor Uhlík Dusík Kyslík Fluor (-III) (boridy), III -IV (karbidy), II, IV -III (nitridy), -II, -I, I, III, IV, V -II (oxidy), -I (peroxidy), -1/2 (hyperoxidy), O, I, II -I (fluoridy) Hliník Křemík fosfor Síra Chlor III -IV (silicidy), IV -III (fosfidy), III, V -II (sulfidy), II, IV, VI -I (chloridy), I, III, V, VII Gallium Germanium Arsen Selen Brom (I), III (II), IV -III (arsenidy), III, V -II (selenidy), (II), IV, VI -I (bromidy), I, III, V, VII Indium Cín Antimon Tellur Jod (I), III II, IV (-III), III, V -II (telluridy), (II), IV, VI -I (jodidy), I, III, V, VII Cesium Baryum Thalium Olovo Bismut Radioaktivní Polonium Radioaktivní astat I II I, (III) II, (IV) III, (V) -II, IV, (VI) -I, I, III, V, (VII) Francium Radium I II Neon Argon Krypton Xenon Radon Maximální kladné oxidační číslo: číslo skupiny (postaru), ve které prvek leží (výjimkou jsou prvky O a F, díky absenci d-orbitalů), Např. Chlor leží v VII. A skupině – má max. ox. č. VII. Hodnota maximálního záporného oxidačního čísla: 8 – číslo skupiny (např. halogenidy mají -1)

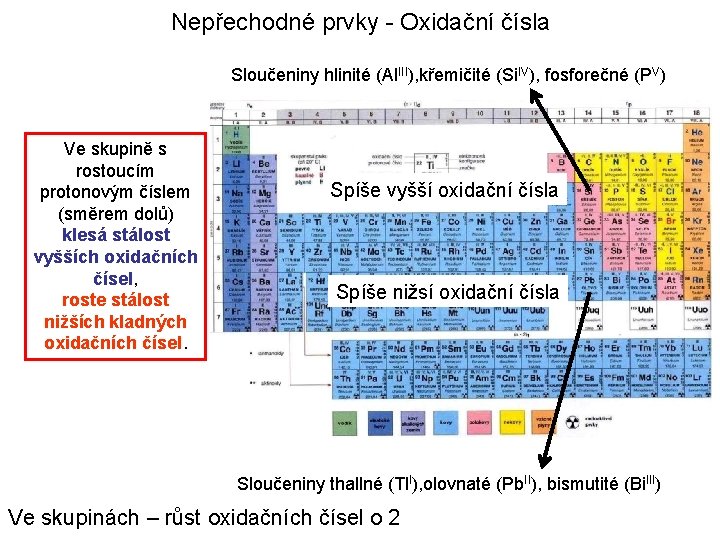
Nepřechodné prvky - Oxidační čísla Sloučeniny hlinité (Al. III), křemičité (Si. IV), fosforečné (PV) Ve skupině s rostoucím protonovým číslem (směrem dolů) klesá stálost vyšších oxidačních čísel, roste stálost nižších kladných oxidačních čísel. Spíše vyšší oxidační čísla Spíše nižsí oxidační čísla Sloučeniny thallné (Tl. I), olovnaté (Pb. II), bismutité (Bi. III) Ve skupinách – růst oxidačních čísel o 2