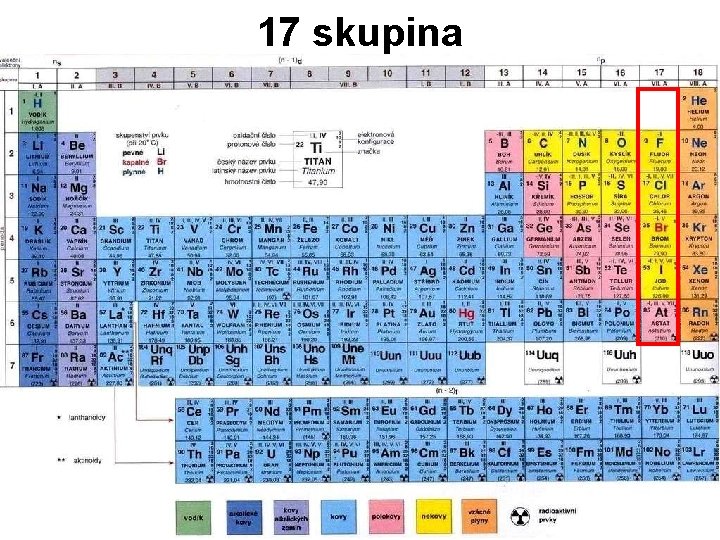
17 skupina 1 17 skupina VII A skupina








- Slides: 11

17 skupina 1

17. skupina (VII. A skupina) Halogeny Fluor chlor Symbol: Mezinárodní název: Elektronegativita (X): Počet protonů (Z): Atom. Relat. hmotnost (Ar): Počet valenčních elektronů: Elektronová konfigurace: Oxidační čísla: -I, O, I (pouze v HOF) brom jod radioaktivní astat -I, I, III, V, VII nekovy Páry halogenů leptají sliznice !!! Skupenství (F, Cl – plyny), Br – kapalina a I je pevná látka. Vysoká elektronegativita – velmi reaktivní.

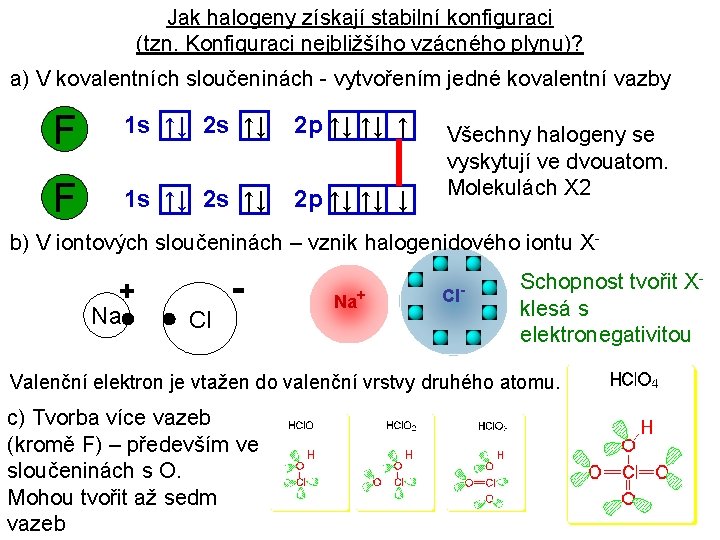
Jak halogeny získají stabilní konfiguraci (tzn. Konfiguraci nejbližšího vzácného plynu)? a) V kovalentních sloučeninách - vytvořením jedné kovalentní vazby F 1 s ↑↓ 2 p ↑↓ ↑↓ ↑ F 1 s ↑↓ 2 p ↑↓ ↑↓ ↓ Všechny halogeny se vyskytují ve dvouatom. Molekulách X 2 b) V iontových sloučeninách – vznik halogenidového iontu X- + Na Cl - Na+ Cl- Schopnost tvořit Xklesá s elektronegativitou Valenční elektron je vtažen do valenční vrstvy druhého atomu. c) Tvorba více vazeb (kromě F) – především ve sloučeninách s O. Mohou tvořit až sedm vazeb

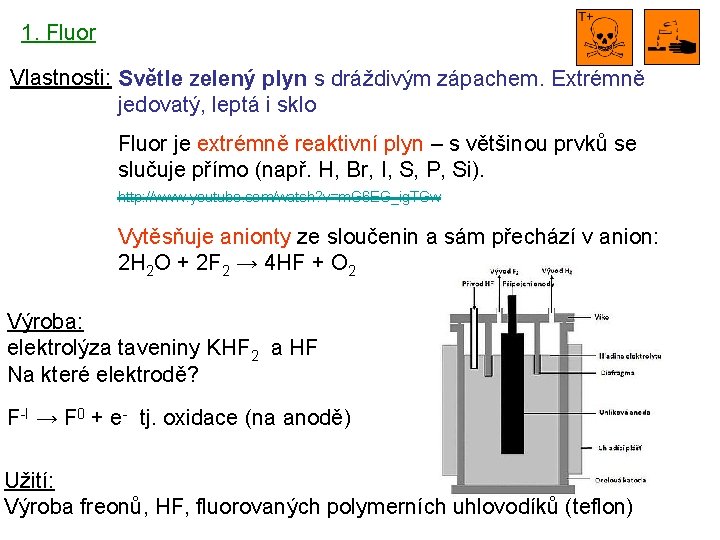
1. Fluor Výskyt: kazivec (fluorit) Ca. F 2 Kryolit Na 3 Al. F 6 Apatit Ca 5(PO 4)3 F 4 Kosti, zubní sklovina

1. Fluor Vlastnosti: Světle zelený plyn s dráždivým zápachem. Extrémně jedovatý, leptá i sklo Fluor je extrémně reaktivní plyn – s většinou prvků se slučuje přímo (např. H, Br, I, S, P, Si). http: //www. youtube. com/watch? v=m. G 6 EG_ig. TGw Vytěsňuje anionty ze sloučenin a sám přechází v anion: 2 H 2 O + 2 F 2 → 4 HF + O 2 Výroba: elektrolýza taveniny KHF 2 a HF Na které elektrodě? F-I → F 0 + e- tj. oxidace (na anodě) Užití: Výroba freonů, HF, fluorovaných polymerních uhlovodíků (teflon)

2. Chlor Výskyt: soli: Na. Cl (sůl kamnná), KCl, Mg. Cl 2 (v mořské vodě) Vlastnosti: Žlutozelený plyn. Velmi reaktivní. Příprava: 4 HCl + Mn. O 2 → Cl 2 + Mn. Cl 2 + 2 H 2 O http: //www. youtube. com/watch? v=z 7 XXBo. Ozx. Ng Výroba: Elektrolýza vodného roztoku Na. Cl (na které elektrodě? ) http: //www. youtube. com/watch? v=Xc. BAJ 0 NMa. II Užití: plasty, HCl, bělící a dezinfekční účinek

3. Brom a jod Br - Červenohnědá kapalina. I – fialová krystalická látka Výskyt: Br – ve formě bromidů v mořské vodě I – v mořských řasách, korálech…, Na. IO 3 v chilském ledku (Na. NO 3) I je biogenní prvek Příprava: (díky vysoké elektronegativitě chloru) Cl 2 + 2 KBr → Br 2 + 2 KCl Cl 2 + 2 KI → I 2 + 2 KCl Užití: jodová tinktura (na dezinfekce)

Sloučeniny halogenů 1. Sloučeniny halogenů s vodíkem HX Halogenovodíky Bezbarvé, ostře páchnoucí plyny. Výroba – přímá syntéza z prvků. Příprava a) Přímá syntéza z prvků b) Působení silných kyselin na halogenidy Na. Cl + H 2 SO 4 →HCl + Na. HSO 4 (až Na 2 SO 4) Halogenovodíkové kyseliny (= vodné roztoky halogenvodíků) HF – slabá, ostatní silné (nejsilnější HI). HCl– dříve – kyselina solná díky výrobě z Na. Cl. důležitá funkce při trávení 8

2. Halogenidy = Sloučeniny halogenů s elektropozitivními prvky Příprava – několik způsobů a) Přímá syntéza z prvků 2 Na + Cl 2 → 2 Na. Cl http: //www. youtube. com/watch? v=2 mz. Dwgyk 6 QM&feature=related b) Neušlechtilý kovy (oxidy, hydroxidy, soli slabých kyselin) + HX Zn + 2 HCl → Zn. Cl 2 + H 2 (výroba vodíku!) c) Soli některých kovů + HX nebo rozpustných MX (srážecí reakce) http: //www. youtube. com/watch? v=8 Rm. Vwz 2 f. NGc Ag. NO 3 + Na. Cl (Na. I) → Ag. Cl (Ag. I) + Na. NO 3 Význam a využití halogenidů KCl – draselné hnojivo Na. Cl – kuchyňská sůl (viz laborky) 9

3. Sloučeniny halogenů s kyslíkem - Oxidy, kyslík. kyseliny, soli a fluoridy kyslíku Fluoridy kyslíku (OF 2, O 2 F 2, O 4 F 4…) Oxidy jsou většinou nestálé. Nejsilnější je I 2 O 5. Kyslíkaté kyseliny: Síla roste s oxidačním číslem. (HCl. O < HCl. O 2 < HCl. O 3 < HCl. O 4) Avšak klesá jejich oxidační schopnost. HCl. O a chlornany Směs Na. Cl a Na. Cl. O = bělící louh (k bělení vláken) Směs Ca. Cl 2 a Ca(Cl. O)2 = chlorové vápno (k dezinfekci) Chlorečnany Výroba výbušnin a zápalek (bengálský oheň) Chloristany V pyrotechnice (místo nebezpečných chlorečnanů) 10

Pro zajímavost – některé reakce H 2 O 2 + KMn. O 4 (příprava kyslíku) http: //www. youtube. com/watch? v=z. T 8 k. IB 4 X 4 io&feature=related Přípravy halogenidů: Ag. NO 3 + Na. Cl (Na. I) → Ag. Cl (Ag. I) + Na. NO 3 http: //www. youtube. com/watch? v=y. R 0 Ldab. Bb. Iw&feature=related Cu. O + 2 HCl → Cu. Cl 2 + H 2 O http: //www. youtube. com/watch? v=PPHVP 6 y. Akpg&feature=related 2 Fe + 6 HCl → 2 Fe. Cl 3 + 3 H 2 http: //www. youtube. com/watch? v=Az. GZZ 7 m. He. VQ&feature=related 11