Mtodos Eletroanaltica compreende um grupo de mtodos analticos





























![EA = const. – 59, 2 m. V x Log [analito]A EA+P = const. EA = const. – 59, 2 m. V x Log [analito]A EA+P = const.](https://slidetodoc.com/presentation_image_h/c93612c28fb04e1e6d2cbf2fcedcdcb3/image-55.jpg)
- Slides: 55

Métodos Eletroanalítica compreende um grupo de métodos analíticos baseado nas propriedades elétricas das soluções - Potenciometria - Condutimetria - Voltametria Propriedades elétricas monitoradas: Diferença de potencial Resistência Corrente em função do potencial aplicado Em alguns casos as propriedades elétricas são medidas em função do tempo Baixos limites de detecção, especiação química, instrumentação barata

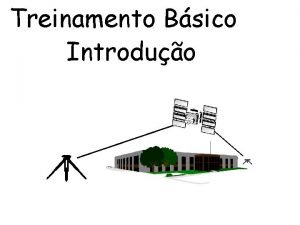
Tipos de métodos eletroanalíticos

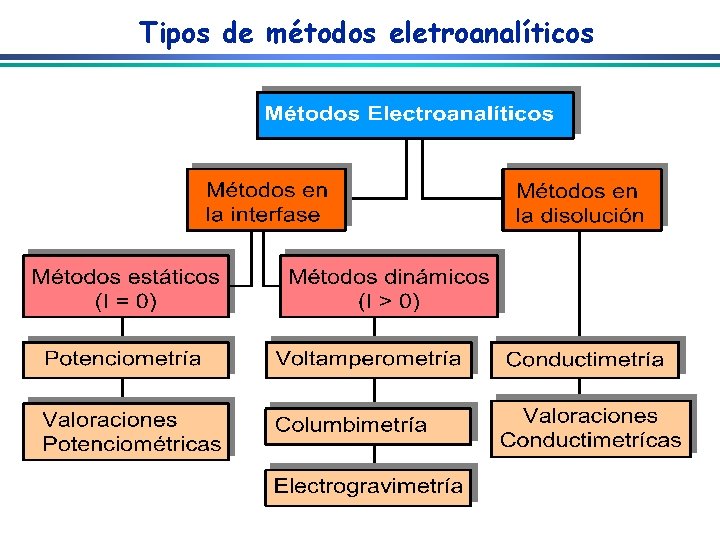
Condução de Eletricidade I = d. Q/dt e- Condutor Eletrônico Condutor iônico

Condutores Eletrônicos e Iônicos Eletrônicos: Obedecem a lei de Ohm (E = IR) E = Diferença de Potencial (volts) devido ao movimento de elétrons R = Resistência (ohms) do condutor à passagem de Corrente I = Corrente (amperes) Iônicos: Obedecem a lei de Ohm para pequenos valores de corrente E = Diferença de Potencial (volts) devido ao movimento de íons R = Resistência (ohms) do eletrólito à passagem de corrente I = Corrente(amperes)

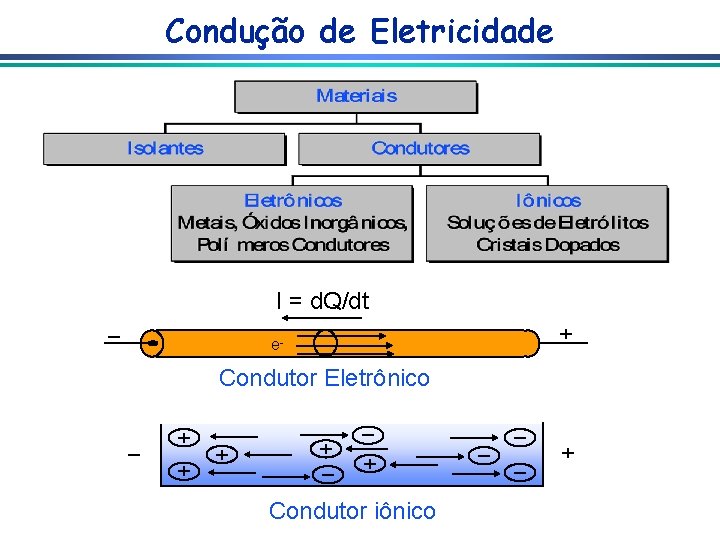
Interface Eletrodo-Solução Um sistema eletroquímico é um sistema heterogêneo onde existe uma diferença de potencial elétrico entre duas fases Zinco Metálico. Zn 2+ Zn 2+ ee- Zn 2+ e Solução de Zn 2+ Zn 2+ 2+ Interface Zn Eletrodo-Solução Zn 2+ e- Zn 2+ Zn Zn 2+ ee. Zn 2+ e- Zn 2+ ee. Zn 2+ e 2+ Zn 2+(metal) + 2 e-(metal) Zn 2+(sol. ) + 2 e-(sol. )

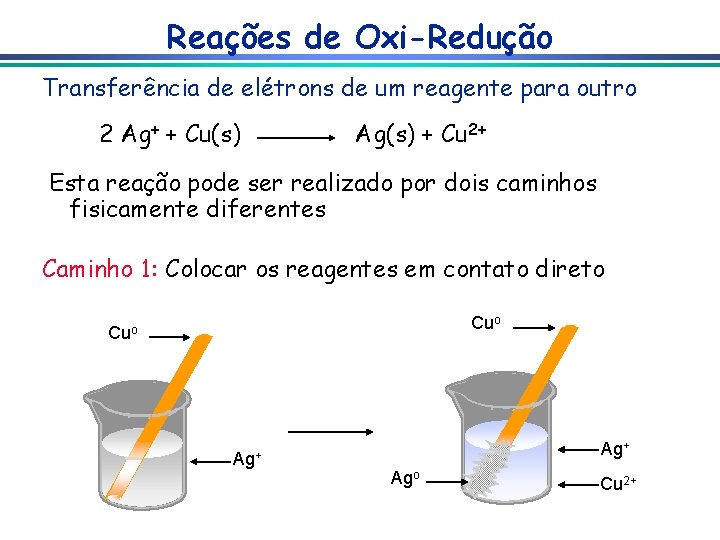
Reações de Oxi-Redução Transferência de elétrons de um reagente para outro 2 Ag+ + Cu(s) Ag(s) + Cu 2+ Esta reação pode ser realizado por dois caminhos fisicamente diferentes Caminho 1: Colocar os reagentes em contato direto Cuo Ag+ Ago Cu 2+

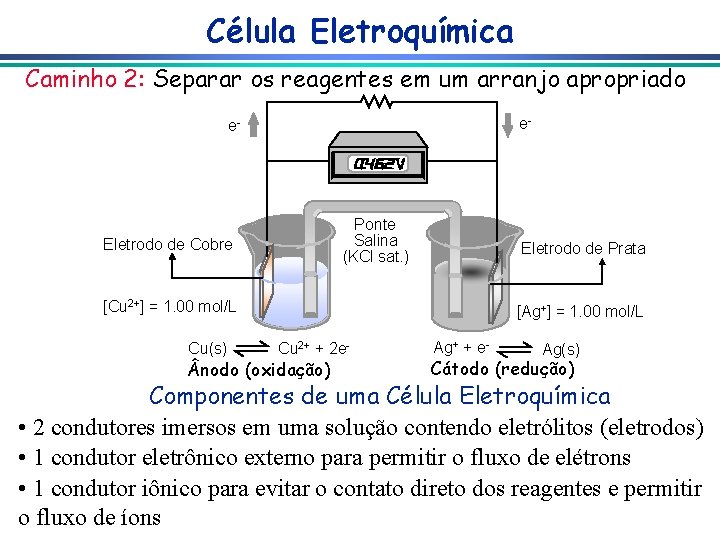
Célula Eletroquímica Caminho 2: Separar os reagentes em um arranjo apropriado e- e- Ponte Salina (KCl sat. ) Eletrodo de Cobre Eletrodo de Prata [Cu 2+] = 1. 00 mol/L Cu(s) [Ag+] = 1. 00 mol/L Cu 2+ + 2 e- nodo (oxidação) Ag+ + e- Ag(s) Cátodo (redução) Componentes de uma Célula Eletroquímica • 2 condutores imersos em uma solução contendo eletrólitos (eletrodos) • 1 condutor eletrônico externo para permitir o fluxo de elétrons • 1 condutor iônico para evitar o contato direto dos reagentes e permitir o fluxo de íons

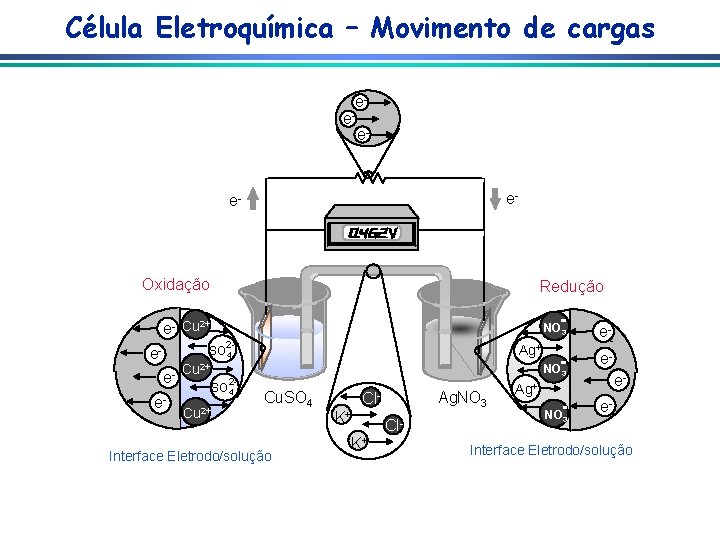
Célula Eletroquímica – Movimento de cargas e- e- e- Oxidação Redução e- Cu 2+ NO 3 2 - Ag+ SO 4 eee- Cu 2+ SO 4 Cu 2+ NO 3 2 - Cu. SO 4 Interface Eletrodo/solução Ag. NO 3 Cl. K+ K+ Cl- Ag+ NO 3 e-eee- Interface Eletrodo/solução

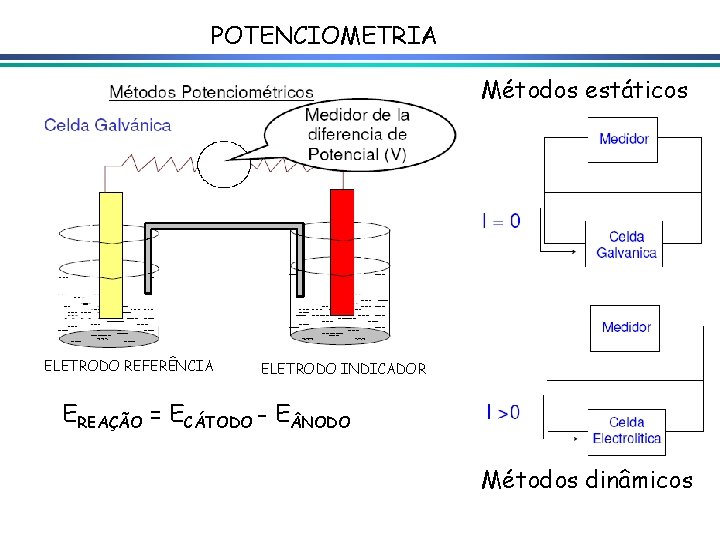
Potenciometria Métodos potenciométricos de análise baseiam-se na medida do potencial de uma cela eletroquímica na ausência de corrente utilizada para detectar ponto final de titulações (titulações potenciométricas), ou para determinação direta de um constituinte em uma amostra, através da medida do potencial de um eletrodo íon-seletivo equipamento simples e barato, constituído de um eletrodo de referência, um eletrodo indicador e um dispositivo para leitura do potencial

POTENCIOMETRIA Métodos estáticos ELETRODO REFERÊNCIA ELETRODO INDICADOR EREAÇÃO = ECÁTODO - E NODO Métodos dinâmicos

atividades vs concentração molar Equação de Nernst atividades EREAÇÃO = E 0 REDUÇÃO – 0, 0592 Vx. Log areduzida/aoxidada n Substituição de atividades por concentrações molares somente para soluções diluídas a = g [X] g = coef. atividade Em soluções concentradas, cálculos utilizando-se concentrações molares ao invés de atividades leva a erros consideráveis

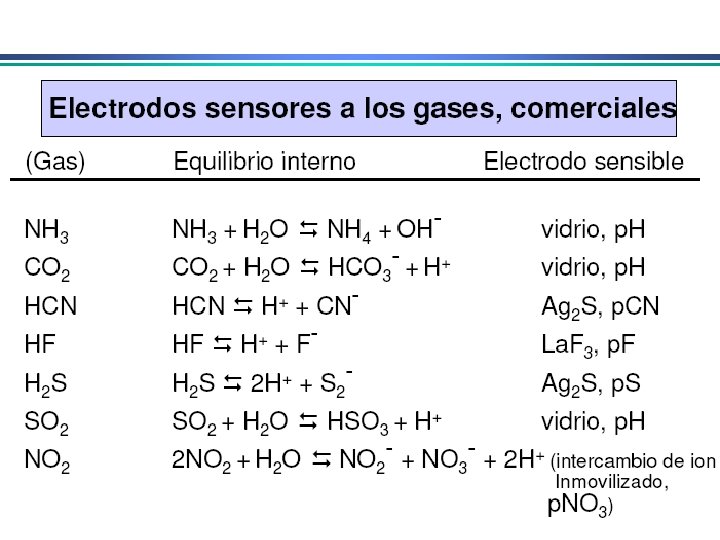
TIPOS DE ELETRODOS

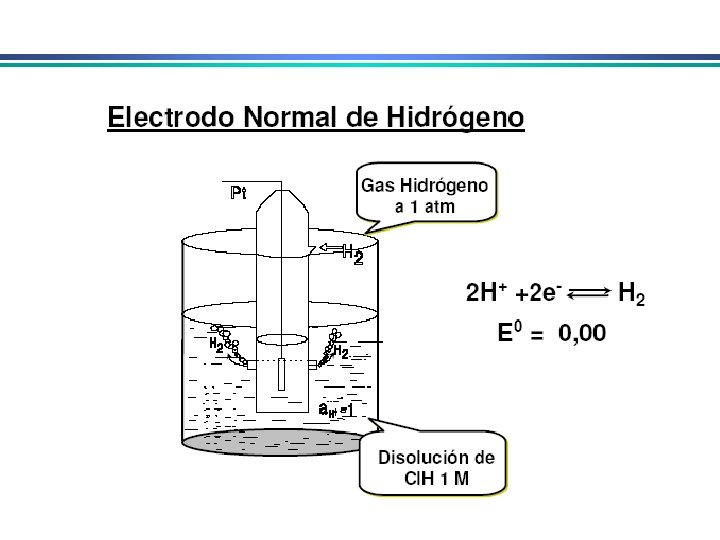
Eletrodos de referência Em aplicações eletroanalíticas, é desejável que um dos eletrodos tenha potencial conhecido, constante e completamente insensível à composição da solução em estudo Eletrodo de referência ideal: i) Reversível e obedece a eq. de Nernst; ii) Exibe potencial constante com o tempo; iii) Retorna ao seu potencial original após submetido a pequenas correntes; iv) Exibe baixa histerese com variações de temperatura


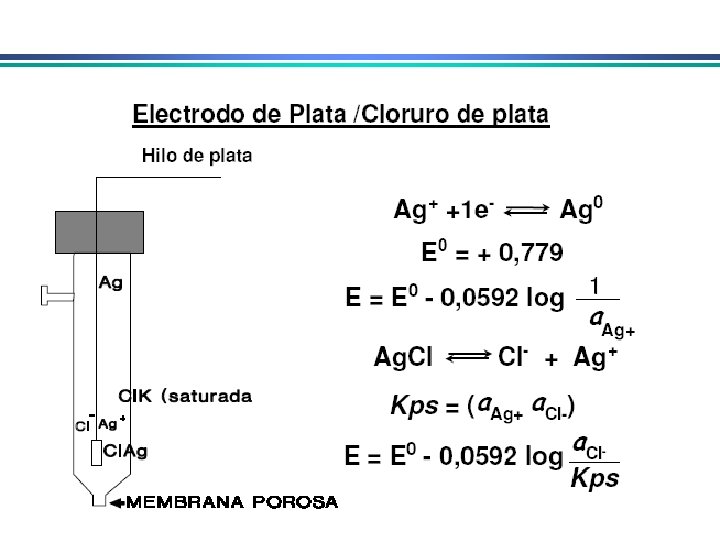
Eletrodo de prata/cloreto de prata Eletrodo de prata imerso em uma solução de KCl saturada com Ag. Cl Ag Ag. Cl(sat. ), KCl (x mol. L-1) Ag. Cl(s) + e- Ag(s) + Cl- Podem ser utilizados em T > 60 o. C, ao contrário do ECS Quando [Cl-] = 1 mol. L-1 o potencial do eletrodo é de +0, 222 V E quando é saturado com KCl o potencial é de +0, 197 V


Eletrodo de calomelano (ESC ou SCE) Eletrodo formado por mercúrio em contato com solução saturada de Hg 2 Cl 2 (calomelano) e que contém uma quantidade conhecida de KCl Hg Hg 2 Cl 2(sat), KCl (x mol. L-1) Hg 2 Cl 2(s) + 2 e- 2 Hg(l) + 2 Cl- Potencial depende de x Quando [Cl-] = 1 mol. L-1 o potencial do eletrodo é de +0, 268 V E quando é saturado com KCl o potencial é de +0, 241 V


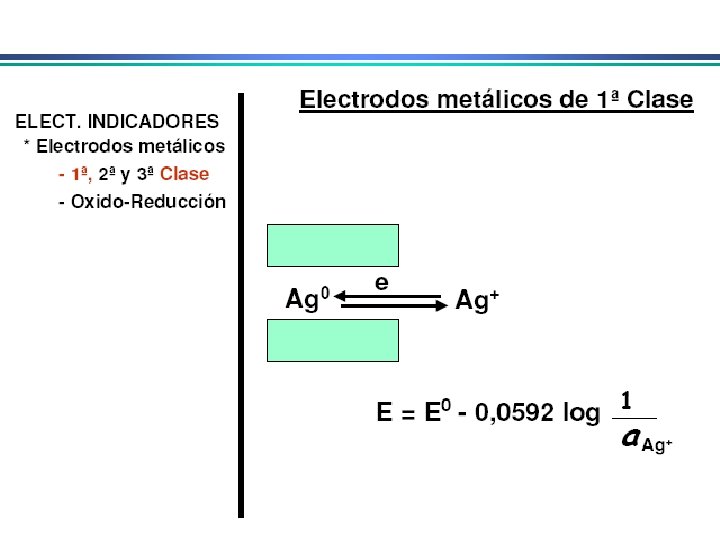
Eletrodos Indicadores Metálicos Eletrodo indicador depende da atividade de uma espécie iônica 1. Eletrodos indicadores metálicos do 1 o. tipo • estão em equilíbrio direto com o cátion derivado do metal Eletrodo de Cu (fio de Cu): u’ma única reação envolvida: Cu 2+ + 2 e- Cu(s) Eo. R = 0, 339 V O potencial deste eletrodo será E = E 0 Cu – n. F ln 1 RT a. Cu 2+ Eletrodo de Cu fornece uma medida direta da a. Cu 2+ na sol. Pouco utilizado: pouco seletivos (respondem a outros cátions que podem ser reduzidos presentes na solução); podem dissolver em meio ac. /básico; podem ser facilmente oxidados em algumas soluções


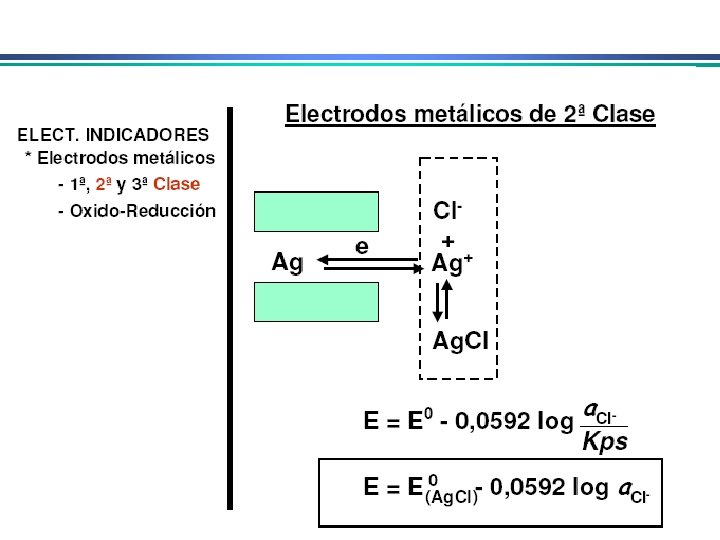
Eletrodos Indicadores Metálicos 2. Eletrodos indicadores metálicos do 2 o. tipo Um eletrodo metálico que responde à atividade de um ânion ao qual seu cátion forma um precipitado ou um complexo estável Ex: prata como eletrodo do 2 o. Tipo para haletos: Ag+ + e. Ag(s) Eo. R= 0, 799 V Ag. I(s) + e. Ag(s) + IE = Eo – RT ln 1 n. F a. I-


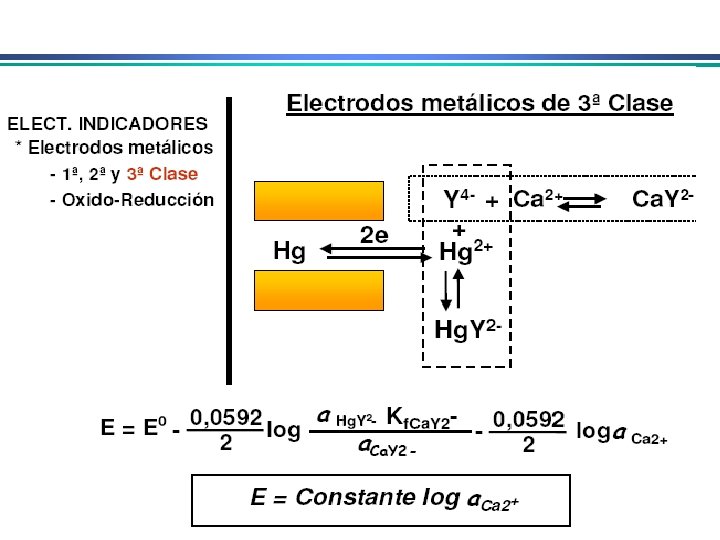
Eletrodos Indicadores Metálicos 3. Eletrodos indicadores metálicos do 3 o. tipo Um eletrodo metálico pode, em algumas circunstâncias, responder a cátions diferentes Ex. Eletrodo de mercúrio para determinar a [Ca 2+] em solução 4. Eletrodos indicadores metálicos redox Eletrodos de Pt, Au, Pd e metais inertes servem como indicadores em sistemas de oxidação/redução. Eletrodos atuam como fonte para elétrons transferidos de um sistema redox em solução. Ex. Eletrodo de platina em solução contendo Ce 3+ e Ce 4+ E = Eo – RT ln a. Ce 3+ n. F a. Ce 4+



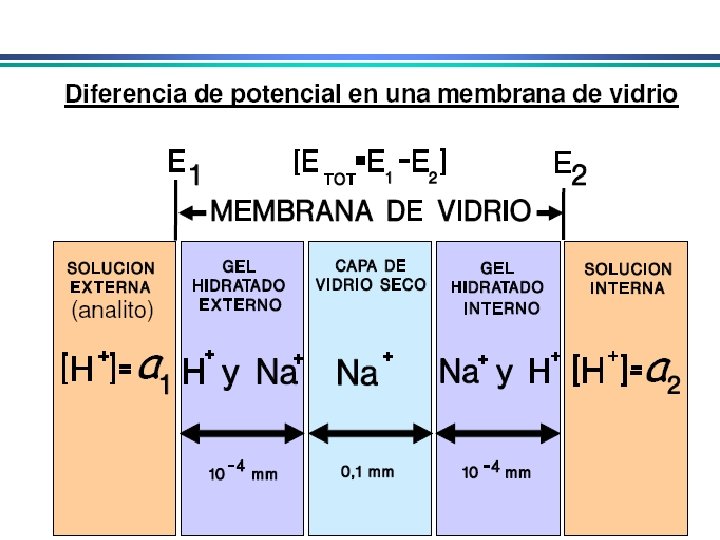
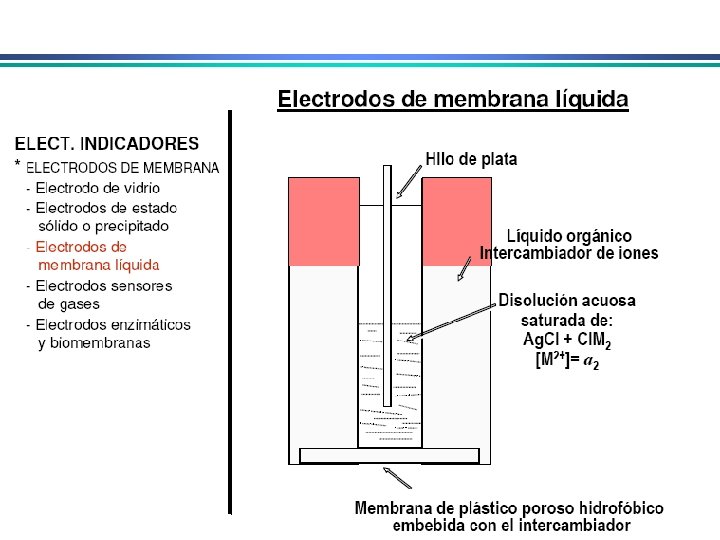
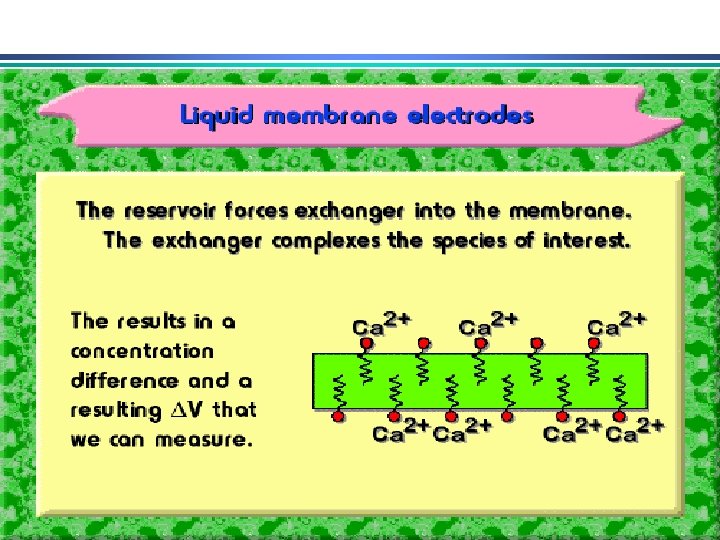
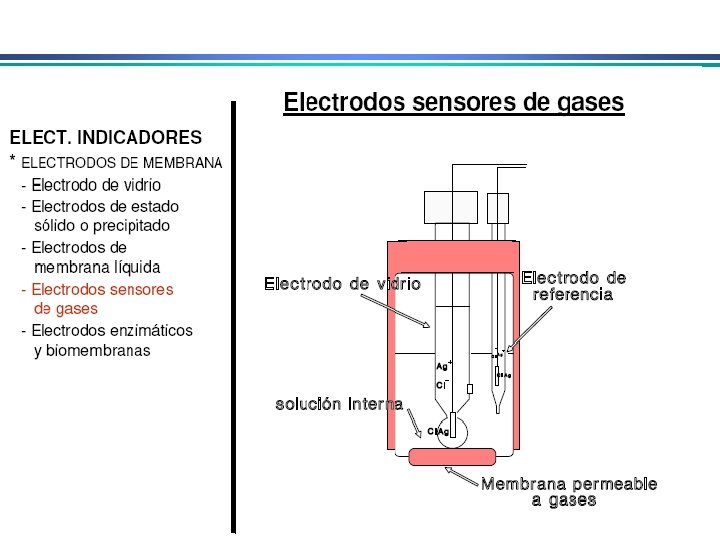
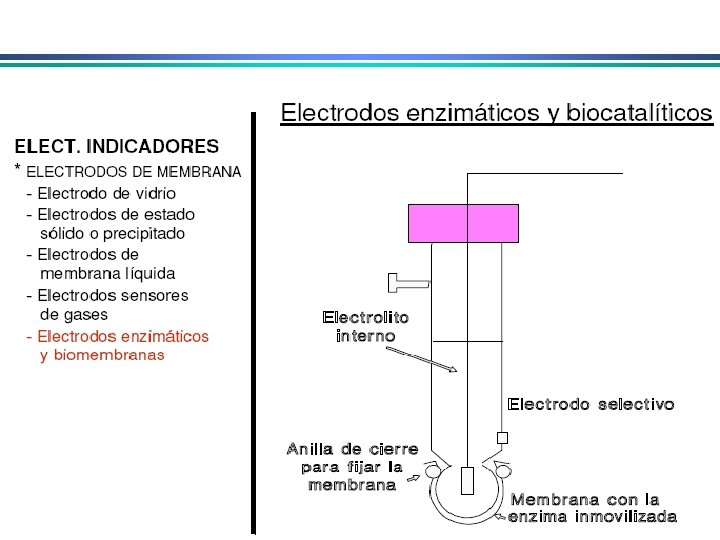
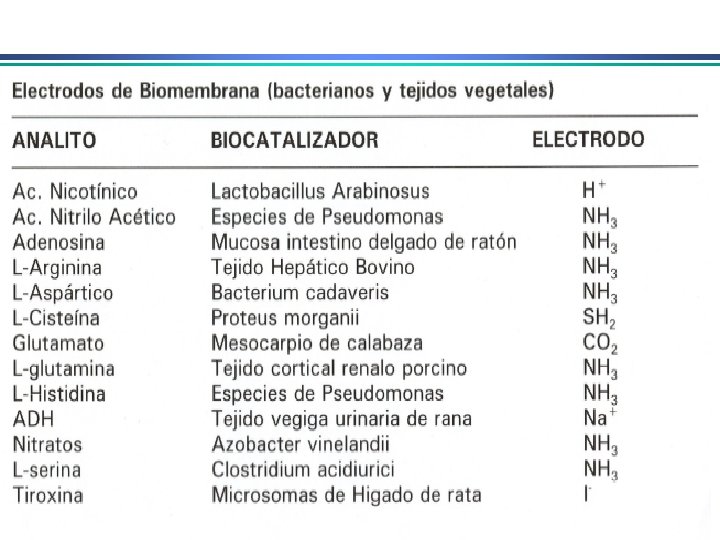
Eletrodos Indicadores de Membrana • determinação rápida e seletiva de vários cátions e ânions através de medida potenciométrica direta • conhecidos como eletrodos íon-seletivo ou eletrodos p. Ion Diferente do eletrodo metálico: potencial no eletrodo metálico deriva da tendência de uma reação redox ocorrer na superfície do metal. Em eletrodos de membrana, potencial se deve a um potencial de junção entre a membrana que separa a solução do eletrodo da solução da espécie a ser analisada 1. Membranas cristalinas (mono ou policristalinas) 2. Membranas não-cristalinas (vidro, líquido, polímeros, etc. )

Eletrodos Indicadores de Membrana Propriedades de membranas íon-seletivas: i) Mínima solubilidade – solubilidade da membrana na solução da espécie a ser analisada deve ser praticamente zero; ii) Condutividade elétrica – membrana deve apresentar um mínimo de condutividade elétrica iii) Reatividade seletiva com a espécie a ser determinada – a membrana deve ser capaz de ligar-se seletivamente ao íon que pretende-se determinar (troca-iônica, complexação, cristalização)

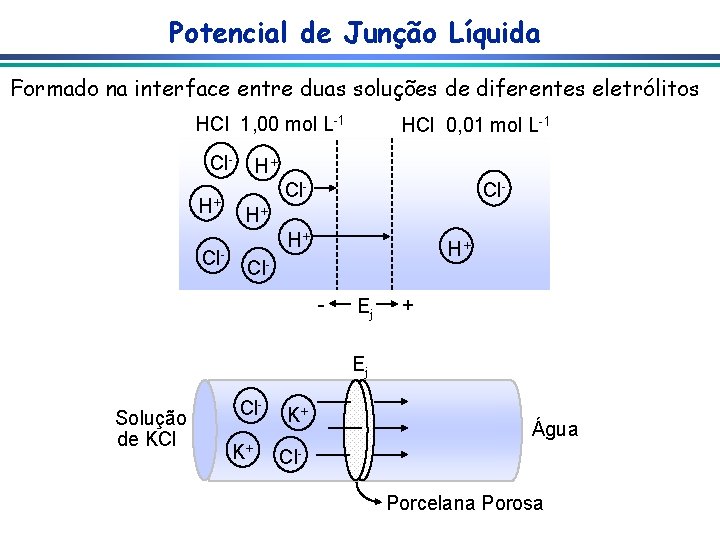
Potencial de Junção Líquida Formado na interface entre duas soluções de diferentes eletrólitos HCl 1, 00 mol L-1 Cl. H+ Cl- HCl 0, 01 mol L-1 H+ Cl- H+ H+ H+ Cl- Ej + Ej Solução de KCl Cl. K+ K+ Água Cl. Porcelana Porosa

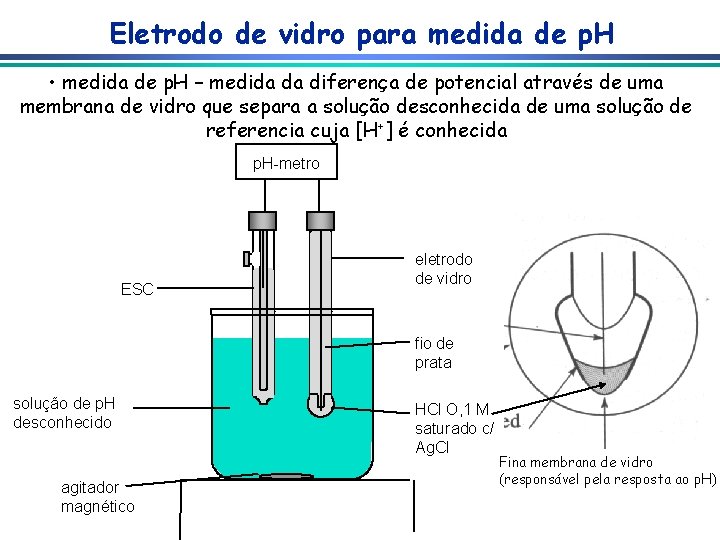
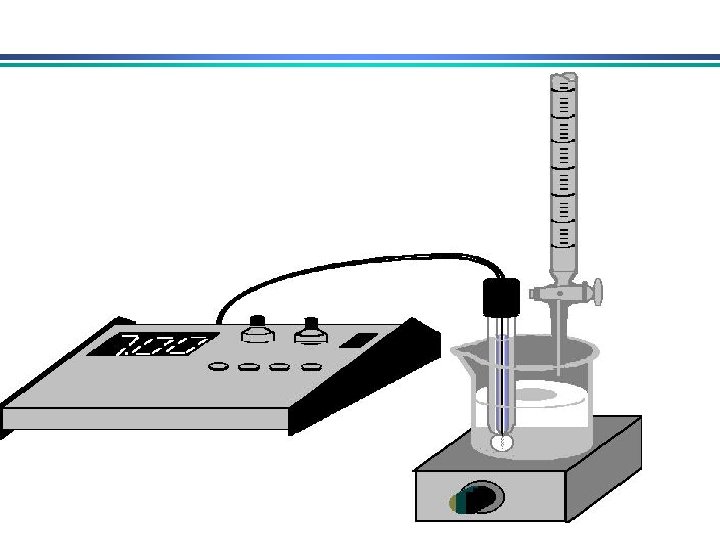
Eletrodo de vidro para medida de p. H • medida de p. H – medida da diferença de potencial através de uma membrana de vidro que separa a solução desconhecida de uma solução de referencia cuja [H+] é conhecida p. H-metro ESC eletrodo de vidro fio de prata solução de p. H desconhecido agitador magnético HCl O, 1 M saturado c/ Ag. Cl Fina membrana de vidro (responsável pela resposta ao p. H)

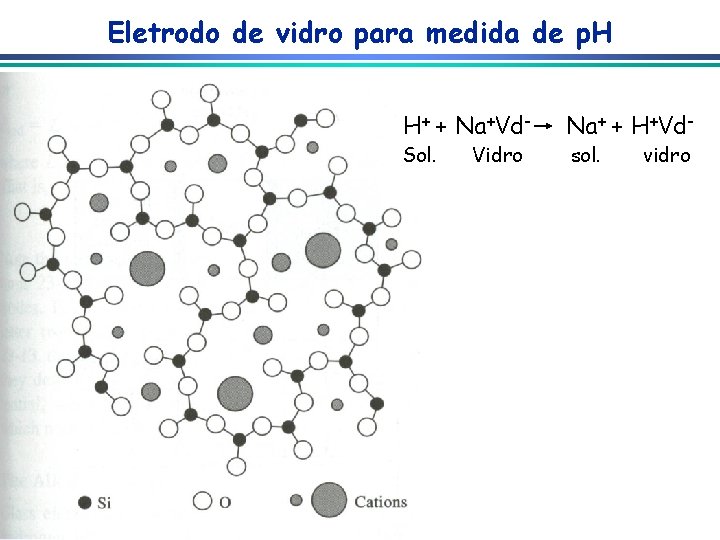
Eletrodo de vidro para medida de p. H H+ + Na+Vd- Sol. Vidro Na+ + H+Vdsol. vidro


















Titulação Potenciométrica Utilização da medida do potencial de um eletrodo indicador para determinar-se o ponto de equivalência de uma titulação Método muito mais exato e preciso que a utilização de indicadores visuais



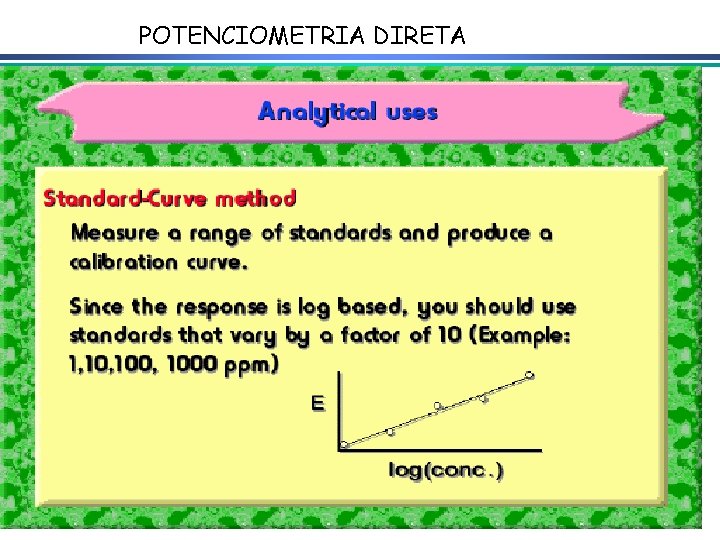
Cálculos quantitativos em potenciometria POTENCIOMETRIA DIRETA MÉTODO ADIÇÃO PADRÃO

POTENCIOMETRIA DIRETA

A equação linear do método OLS Y = bo + b 1 x X Fica: E(V ou m. V) = bo + b 1 x Log [analito] Onde o coeficiente de correlação de Pearson (r) será negativo

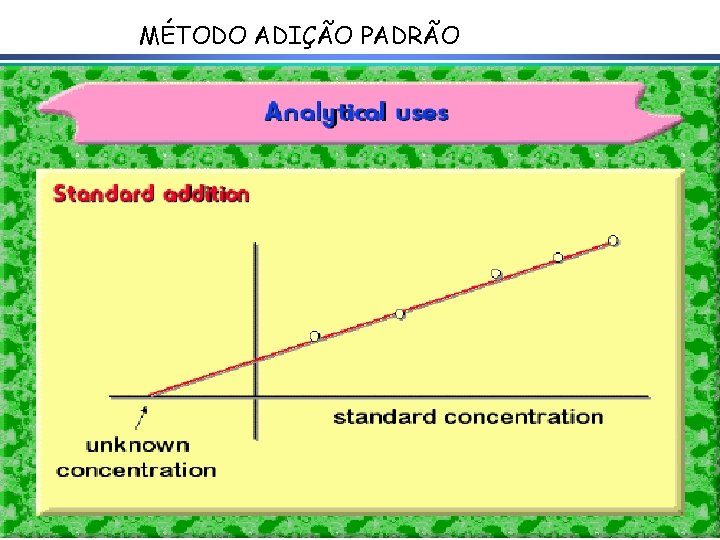
MÉTODO ADIÇÃO PADRÃO
![EA const 59 2 m V x Log analitoA EAP const EA = const. – 59, 2 m. V x Log [analito]A EA+P = const.](https://slidetodoc.com/presentation_image_h/c93612c28fb04e1e6d2cbf2fcedcdcb3/image-55.jpg)
EA = const. – 59, 2 m. V x Log [analito]A EA+P = const. – 59, 2 m. V x Log [analito]A+P Equação:
 Predicado
Predicado Grupo nominal e grupo verbal
Grupo nominal e grupo verbal Grupo nominal e grupo verbal
Grupo nominal e grupo verbal Transversalidad lourau
Transversalidad lourau Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Condón femenino
Condón femenino Mtodos
Mtodos Funda de plastico latex que evita el paso de espermatozoide
Funda de plastico latex que evita el paso de espermatozoide Mtodos
Mtodos Mtodos
Mtodos Grupo geslogic
Grupo geslogic Ldh
Ldh Grupo niche cali pachanguero
Grupo niche cali pachanguero Grupo tri a e i o u
Grupo tri a e i o u Nuestro grupo esta conformado por
Nuestro grupo esta conformado por Grupo d fonasa
Grupo d fonasa J donald phillips
J donald phillips Classificação de pronomes
Classificação de pronomes Grupo proteo
Grupo proteo Genero y numero de grupos nominales
Genero y numero de grupos nominales Grupo oracion
Grupo oracion Etapas de vida de un grupo
Etapas de vida de un grupo Strepto grupo b
Strepto grupo b Um retrocruzamento sempre significa
Um retrocruzamento sempre significa Somos un grupo de profesionales
Somos un grupo de profesionales Grupo nitro
Grupo nitro Grupo carbonilo
Grupo carbonilo Grupo 1
Grupo 1 Diferencia entre aprendizaje cooperativo y trabajo en grupo
Diferencia entre aprendizaje cooperativo y trabajo en grupo Grupo financiero pichincha
Grupo financiero pichincha Grupo aranha guedes
Grupo aranha guedes Tabela periodica familia e grupo
Tabela periodica familia e grupo Funcion de enzimas
Funcion de enzimas Sioc imss
Sioc imss Carbonilo estructura
Carbonilo estructura Imagen personal
Imagen personal Grupo focal
Grupo focal Isopropilmetilcetona
Isopropilmetilcetona Grupo lanit
Grupo lanit Ideias para grupo de oração
Ideias para grupo de oração Um fazendeiro comprou vacas de duas raças diferentes
Um fazendeiro comprou vacas de duas raças diferentes Hidrocarburos oxigenados y nitrogenados
Hidrocarburos oxigenados y nitrogenados Que es un grupo primario
Que es un grupo primario Yodo de que color es
Yodo de que color es Grupo educativo oro y bronce
Grupo educativo oro y bronce Metina_4
Metina_4 Classificação dos sais
Classificação dos sais Ocampo grupo aduanal
Ocampo grupo aduanal Disciplina mercado financeiro
Disciplina mercado financeiro Tabla peridodica
Tabla peridodica Ejemplos de grupos adjetivales
Ejemplos de grupos adjetivales Grupo interactuante
Grupo interactuante