Mengenal Sifat Material Konfigurasi Elektron dalam Atom Persamaan



![Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum](https://slidetodoc.com/presentation_image_h/1786701691368fe3b5e349f8d3725592/image-7.jpg)







![Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5 Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5](https://slidetodoc.com/presentation_image_h/1786701691368fe3b5e349f8d3725592/image-21.jpg)


- Slides: 24

Mengenal Sifat Material Konfigurasi Elektron dalam Atom


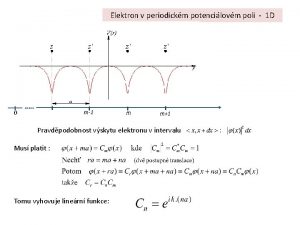
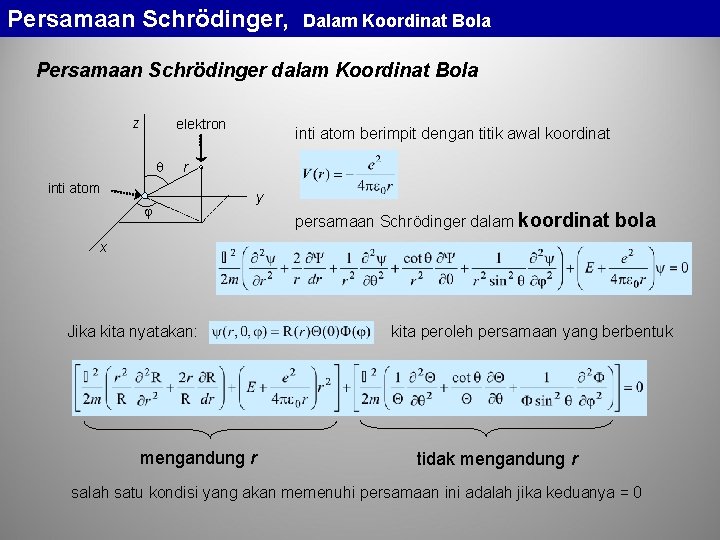
Persamaan Schrödinger dalam Koordinat Bola

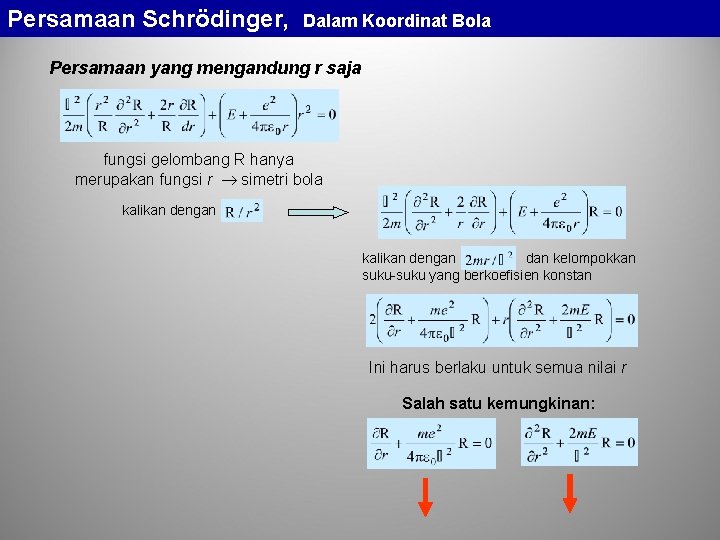
Persamaan Schrödinger, Dalam Koordinat Bola Persamaan Schrödinger dalam Koordinat Bola z elektron inti atom berimpit dengan titik awal koordinat r inti atom y persamaan Schrödinger dalam koordinat bola x Jika kita nyatakan: mengandung r kita peroleh persamaan yang berbentuk tidak mengandung r salah satu kondisi yang akan memenuhi persamaan ini adalah jika keduanya = 0

Persamaan Schrödinger, Dalam Koordinat Bola Persamaan yang mengandung r saja fungsi gelombang R hanya merupakan fungsi r simetri bola kalikan dengan dan kelompokkan suku-suku yang berkoefisien konstan Ini harus berlaku untuk semua nilai r Salah satu kemungkinan:

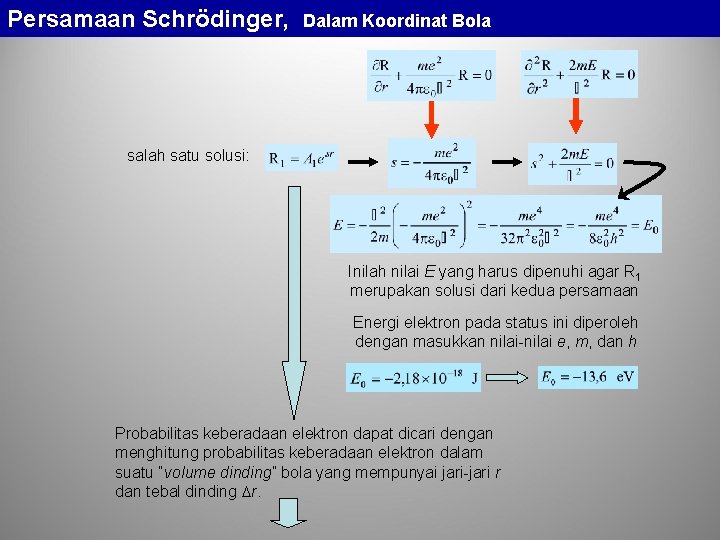
Persamaan Schrödinger, Dalam Koordinat Bola salah satu solusi: Inilah nilai E yang harus dipenuhi agar R 1 merupakan solusi dari kedua persamaan Energi elektron pada status ini diperoleh dengan masukkan nilai-nilai e, m, dan h Probabilitas keberadaan elektron dapat dicari dengan menghitung probabilitas keberadaan elektron dalam suatu “volume dinding” bola yang mempunyai jari-jari r dan tebal dinding r.
![Persamaan Schrödinger Dalam Koordinat Bola Pe Pe 1 r 0 r Å probabilitas maksimum Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum](https://slidetodoc.com/presentation_image_h/1786701691368fe3b5e349f8d3725592/image-7.jpg)
Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum ada di sekitar suatu nilai r 0 sedangkan di luar r 0 probabilitas ditemukannya elektron dengan cepat menurun keberadaan elektron terkonsentrasi di sekitar jari-jari r 0 saja Inilah struktur atom hidrogen yang memiliki hanya satu elektron di sekitar inti atomnya dan inilah yang disebut status dasar atau ground state

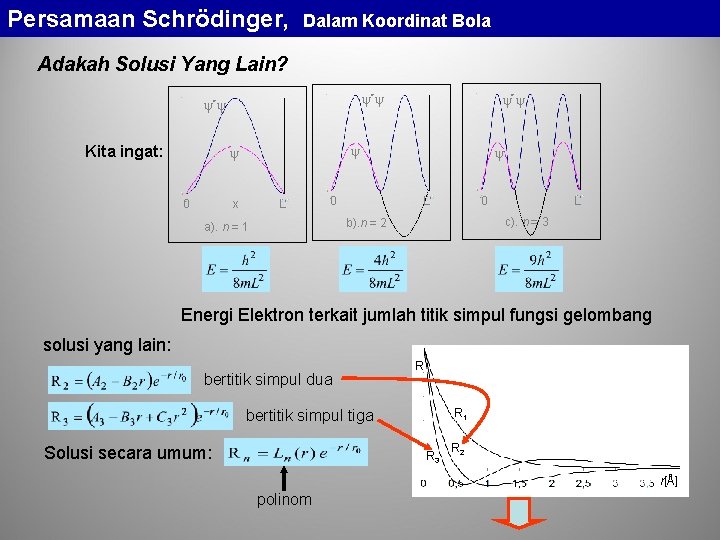
Persamaan Schrödinger, Dalam Koordinat Bola Adakah Solusi Yang Lain? * * Kita ingat: 0 * x L 0 0 L c). n = 3 b). n = 2 a). n = 1 L Energi Elektron terkait jumlah titik simpul fungsi gelombang solusi yang lain: bertitik simpul dua R R 1 bertitik simpul tiga Solusi secara umum: R 3 R 2 r[Å] polinom

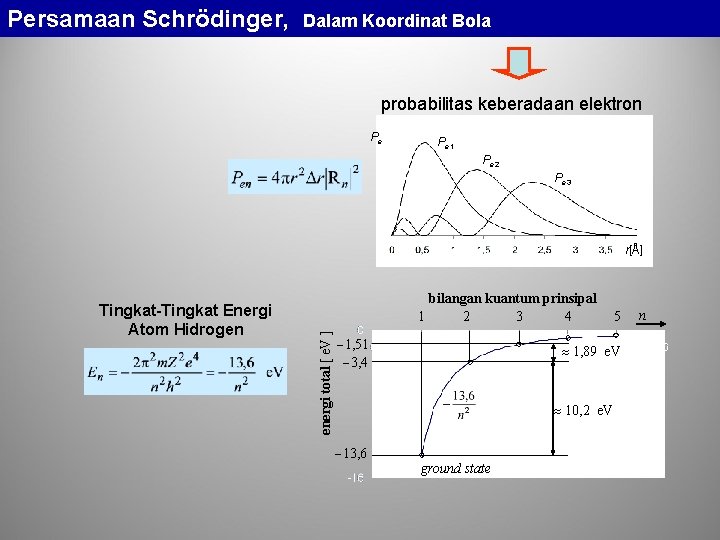
Persamaan Schrödinger, Dalam Koordinat Bola probabilitas keberadaan elektron Pe Pe 1 Pe 2 Pe 3 r[Å] bilangan kuantum prinsipal 1 2 3 4 energi total [ e. V ] Tingkat-Tingkat Energi Atom Hidrogen 1, 51 3, 4 1, 89 e. V 10, 2 e. V 13, 6 5 ground state n

Persamaan Schrödinger, Dalam Koordinat Bola Momentum Sudut Momentum sudut juga terkuantisasi bilangan bulat positif Momentum sudut ditentukan oleh dua macam bilangan bulat: l : menentukan besar momentum sudut, dan ml : menentukan komponen z atau arah momentum sudut Nilai l dan ml yang mungkin : dst.

Persamaan Schrödinger, Dalam Koordinat Bola l disebut bilangan kuantum momentum sudut, atau bilangan kuantum azimuthal bilangan kuantum l 0 1 2 3 4 5 simbol s p d f g h degenerasi 1 3 5 7 9 11 ml adalah bilangan kuantum magnetik

Persamaan Schrödinger, Dalam Koordinat Bola Bilangan Kuantum Ada tiga bilangan kuantum yang sudah kita kenal, yaitu: (1) bilangan kuantum utama, n, yang menentukan tingkat energi; (2) bilangan kuantum momentum sudut, atau bilangan kuantum azimuthal, l; (3) bilangan kuantum magnetik, ml. kuantum utama bilangan n: 1 2 3 4 5 3 s, 3 p, 3 d 1, 5 0 1 energi 3, 4 2 s, 2 p total [ e. V ] 13, 6 1 s Bohr lebih cermat (4) Spin Elektron: ½ dikemukakan oleh Uhlenbeck

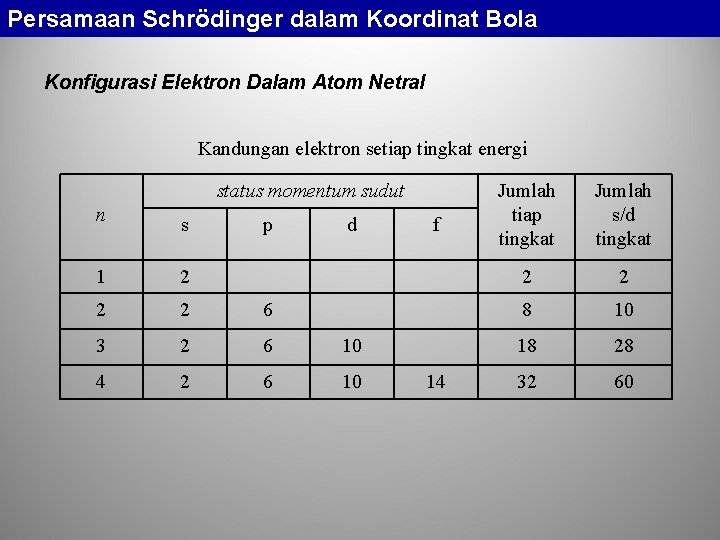
Persamaan Schrödinger dalam Koordinat Bola Konfigurasi Elektron Dalam Atom Netral Kandungan elektron setiap tingkat energi status momentum sudut n s 1 2 2 2 6 3 2 6 10 4 2 6 10 p d f 14 Jumlah tiap tingkat Jumlah s/d tingkat 2 2 8 10 18 28 32 60

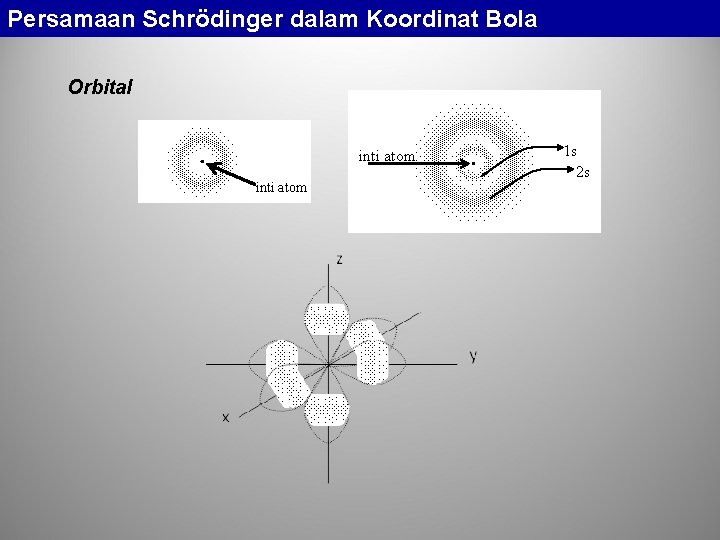
Persamaan Schrödinger dalam Koordinat Bola Orbital inti atom 1 s 2 s

Persamaan Schrödinger dalam Koordinat Bola Penulisan konfigurasi elektron unsur-unsur H: 1 s 1; He: 1 s 2 Li: 1 s 2 2 s 1; Be: 1 s 2 2 s 2; B: 1 s 2 2 p 1; C: 1 s 2 2 p 2; N: 1 s 2 2 p 3; O: 1 s 2 2 p 4; F: 1 s 2 2 p 5; Ne: 1 s 2 2 p 6. . dst

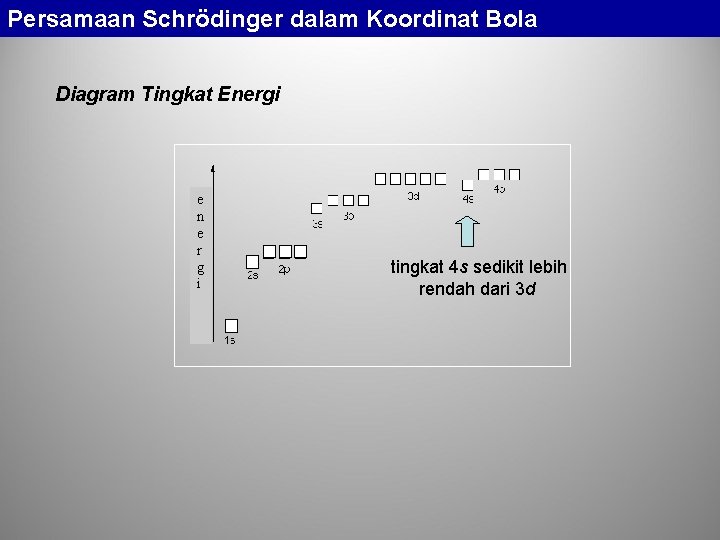
Persamaan Schrödinger dalam Koordinat Bola Diagram Tingkat Energi e n e r g i tingkat 4 s sedikit lebih rendah dari 3 d

Persamaan Schrödinger dalam Koordinat Bola Pengisian Elektron Pada Orbital H: pengisian 1 s; He: Li: Be: pemenuhan 1 s; pengisian 2 s; pemenuhan 2 s; B: pengisian 2 px dengan 1 elektron; C: N: O: F: Ne: pengisian 2 py dengan 1 elektron; pengisian 2 pz dengan 1 elektron; pemenuhan 2 px; pemenuhan 2 py; pemenuhan 2 pz.

Konfigurasi Elektron Dalam Atom Tingkat energi 4 s lebih rendah dari 3 d. Hal ini terlihat pada perubahan konfigurasi dari Ar (argon) ke K (kalium). Ar: 1 s 2 2 p 6 3 s 2 3 p 6 K: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 (bukan 3 d 1) Ca: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 (bukan 3 d 2) Sc: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 1 4 s 2 (orbital 3 d baru mulai terisi setelah 4 s penuh) Y: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 2 4 s 2 (dan unsur selanjutnya pengisian 3 d sampai penuh)

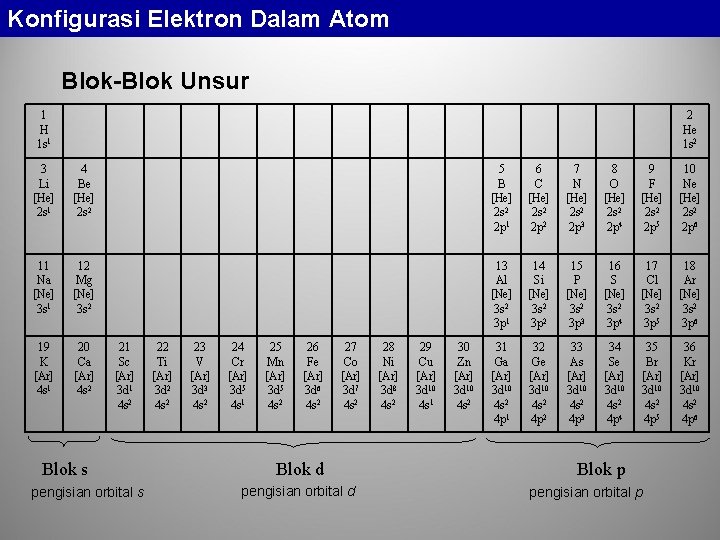
Konfigurasi Elektron Dalam Atom Blok-Blok Unsur 1 H 1 s 1 2 He 1 s 2 3 Li [He] 2 s 1 4 Be [He] 2 s 2 5 B [He] 2 s 2 2 p 1 6 C [He] 2 s 2 2 p 2 7 N [He] 2 s 2 2 p 3 8 O [He] 2 s 2 2 p 4 9 F [He] 2 s 2 2 p 5 10 Ne [He] 2 s 2 2 p 6 11 Na [Ne] 3 s 1 12 Mg [Ne] 3 s 2 13 Al [Ne] 3 s 2 3 p 1 14 Si [Ne] 3 s 2 3 p 2 15 P [Ne] 3 s 2 3 p 3 16 S [Ne] 3 s 2 3 p 4 17 Cl [Ne] 3 s 2 3 p 5 18 Ar [Ne] 3 s 2 3 p 6 19 K [Ar] 4 s 1 20 Ca [Ar] 4 s 2 31 Ga [Ar] 3 d 10 4 s 2 4 p 1 32 Ge [Ar] 3 d 10 4 s 2 4 p 2 33 As [Ar] 3 d 10 4 s 2 4 p 3 34 Se [Ar] 3 d 10 4 s 2 4 p 4 35 Br [Ar] 3 d 10 4 s 2 4 p 5 36 Kr [Ar] 3 d 10 4 s 2 4 p 6 21 Sc [Ar] 3 d 1 4 s 2 Blok s pengisian orbital s 22 Ti [Ar] 3 d 2 4 s 2 23 V [Ar] 3 d 3 4 s 2 24 Cr [Ar] 3 d 5 4 s 1 25 Mn [Ar] 3 d 5 4 s 2 26 Fe [Ar] 3 d 6 4 s 2 27 Co [Ar] 3 d 7 4 s 2 Blok d pengisian orbital d 28 Ni [Ar] 3 d 8 4 s 2 29 Cu [Ar] 3 d 10 4 s 1 30 Zn [Ar] 3 d 10 4 s 2 Blok p pengisian orbital p

Ionisasi dan Energi Ionisasi: Energi ionisasi adalah jumlah energi yang diperlukan untuk melepaskan elektron terluar suatu unsur guna membentuk ion positif bermuatan +1. Energi ionisasi dalam satuan e. V disebut juga potensial ionisasi. Potensial ionisasi didefinisikan sebagai energi yang diperlukan untuk melepaskan elektron yang paling lemah terikat pada atom. Pada atom dengan banyak elektron, pengertian ini sering disebut sebagai potensial ionisasi yang pertama, karena sesudah ionisasi yang pertama ini bisa terjadi ionisasi lebih lanjut dengan terlepasnya elektron yang lebih dekat ke inti atom.
![Ionisasi dan Energi Ionisasi e V 1 H 13 6 2 He 24 5 Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5](https://slidetodoc.com/presentation_image_h/1786701691368fe3b5e349f8d3725592/image-21.jpg)
Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5 3 Li 5, 39 4 Be 9, 32 5 B 8, 29 6 C 11, 2 7 N 14, 6 8 O 13, 6 9 F 17, 4 10 Ne 21, 6 11 Na 5, 14 12 Mg 7, 64 13 Al 5, 98 14 Si 8, 15 15 P 10, 4 16 S 10, 4 17 Cl 13, 0 18 Ar 15, 8 19 K 4, 34 20 Ca 6, 11 31 Ga 6, 00 32 Ge 7, 88 33 As 9, 81 34 Se 9, 75 35 Br 11, 8 36 Kr 14 21 Sc 6, 54 22 Ti 6, 83 23 V 6, 74 24 Cr 6, 76 25 Mn 7, 43 26 Fe 7, 87 27 Co 7, 86 28 Ni 7, 63 29 Cu 7, 72 30 Zn 9, 39

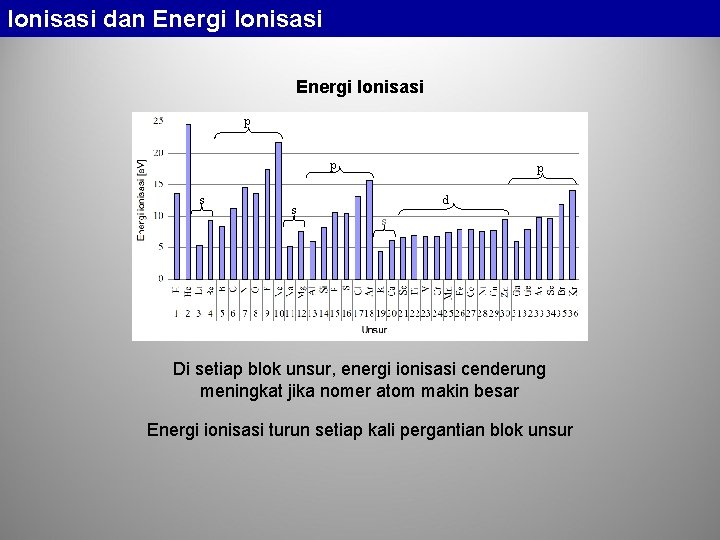
Ionisasi dan Energi Ionisasi p p s s p d s Di setiap blok unsur, energi ionisasi cenderung meningkat jika nomer atom makin besar Energi ionisasi turun setiap kali pergantian blok unsur

Afinitas Elektron Afinitas elektron adalah energi yang dilepaskan jika atom netral menerima satu elektron membentuk ion negatif bermuatan 1. Afinitas elektron dinyatakan dengan bilangan negatif, yang berarti pelepasan energi. Afinitas elektron merupakan ukuran kemampuan suatu unsur untuk menarik elektron, bergabung dengan unsur untuk membentuk ion negatif. Makin kuat gaya tarik ini, berarti makin besar energi yang dilepaskan. Gaya tarik ini dipengaruhi oleh jumlah muatan inti atom, jarak orbital ke inti, dan screening (tabir elektron).

Course Ware Mengenal Sifat Material Konfigurasi Elektron dalam Atom Sudaryatno Sudirham
 Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Barang siapa mengenal dirinya maka dia mengenal tuhannya
Barang siapa mengenal dirinya maka dia mengenal tuhannya Konfigurasi elektron yang cocok untuk transisi
Konfigurasi elektron yang cocok untuk transisi Pengertian konfigurasi elektron
Pengertian konfigurasi elektron Cara menyingkat konfigurasi elektron
Cara menyingkat konfigurasi elektron Elektron be
Elektron be Konfigurasi elektron
Konfigurasi elektron Lambang atom no 31
Lambang atom no 31 Konfigurasi elektron
Konfigurasi elektron Kedudukan elektron dalam atom
Kedudukan elektron dalam atom Konfigurasi elektron v
Konfigurasi elektron v Koordinat umum
Koordinat umum Peta konsep sifat mustahil allah
Peta konsep sifat mustahil allah Sifat - sifat -sifat pemerintah reformasi di indonesia
Sifat - sifat -sifat pemerintah reformasi di indonesia Sifat sifat persamaan garis lurus
Sifat sifat persamaan garis lurus Konfigurasi yg tepat untuk unsur bernomor atom 38 yaitu
Konfigurasi yg tepat untuk unsur bernomor atom 38 yaitu Susunan bola billiard
Susunan bola billiard Sifat-sifat koloid dan penerapannya
Sifat-sifat koloid dan penerapannya Cara mengenal pasti masalah reka bentuk
Cara mengenal pasti masalah reka bentuk Ilmu pengenalan diri
Ilmu pengenalan diri Mengecam jenis bunyi
Mengecam jenis bunyi The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Gambar teori atom
Gambar teori atom Sifat atom
Sifat atom Sifat atom
Sifat atom