SELAMAT DATANG DI KELAS DARING MAPEL KIMIA Kelas




















- Slides: 25

SELAMAT DATANG DI KELAS DARING MAPEL KIMIA Kelas X IPA

KOMPETENSI DASAR � 3. 3 Menjelaskan konfigurasi elektron dan pola konfigurasi elektron terluar untuk setiap golongan dalam tabel periodik � 4. 3 Menentukan letak suatu unsur dalam tabel periodik berdasarkan konfigurasi elektron

INDIKATOR 3. 3. 1. Menentukan pola konfigurasi elektron untuk golongan dalam sistem periodik unsur. 3. 3. 2. Menentukan elektron valensi dan jumlah kulit suatu atom 3. 3. 3. Menghubungkan elektron valensi dengan letak unsur dalam tabel periodik (pertemuan selanjutnya) 3. 3. 4. Menguraikan sejarah perkembangan sistem periodik unsur (pertemuan selanjutnya) 4. 3. 1. Menentukan letak unsur dalam tabel periodik berdasarkan konfigurasi elektron (pertemuan selanjutnya) 4. 3. 2 Menyajikan sejarah perkembangan sistem periodik unsur (pertemuan selanjutnya)

Apa yang akan dipelajari? � Konfigurasi elektron berdasarkan kulit � Konfigurasi elektron berdasarkan sub kulit bentuk orbital ü prinsip Aufbau ü aturan Hund ü larangan Pauli ü Bilangan kuantum � Sistem Periodik Unsur � Penentuan letak unsur dalam Sistem Periodik Unsur ü

Konfigurasi Elektron � Menurut Bohr, elektron berada dalam lintasan/orbit yang disebut kulit elektron. � Setiap kulit memiliki tingkat energi tertentu. � Semakin dekat dengan inti atom maka semakin kecil tingkat energinya, semakin jauh dengan inti atom maka semakin besar tingkat energinya. Kulit n hanya dapat menempati Elektron maksimal � Tiap kulit elektron K 1 2 (1)2 = 2 2 n 2 elektron, n=kulit. L 2 2 (2)2 = 8 M 3 2 (3)2 = 18 N 4 2 (4)2 = 32 O 5 2 (5)2 = 50 P 6 2 (6)2 = 72 Q 7 2 (7)2 = 98

Konfigurasi Elektron Kulit K : - isi 2 (jika elektron ≥ 2) - isi 1 (hanya untuk H) Kulit L : - isi 8 (jika elektron ≥ 8) - isi jumlah elektron sisa (jika < 8) Kulit M : - isi 18 (jika elektron >18) - isi 8 (jika 8≤elektron <18) - isi jumlah elektron sisa (jika < 8) Kulit N: - isi 32 (jika elektron >32) - isi 18 (jika 18≤elektron <32) - isi 8 (jika 8≤elektron <18) - isi jumlah elektron sisa (jika < 8) contoh : K L M N O P Q 18 Ar: 2 8 8 (elektron valensi/terakhir = 8) 7 N : 2 5 (elektron valensi= 5) 19 K : 2 8 8 1 (elektron valensi = 1) 56 Ba : 2 8 18 8 2 (elektron valensi = 2) 88 Ra : 2 8 18 32 18 8 2 (elektron valensi = 2)

Konfigurasi elektron �Susunan elektron dalam atom �Kulit terdiri dari subkulit-subkulit �Subkulit terdiri dari orbital-orbital (tempat elektron beredar) �Orbital : maksimal 2 elektron untuk 1 orbital Subkulit s p d f Orbital 1 3 5 7 Jumlah 2 6 10 14 maks. elektron

Bentuk Orbital � Orbital s Semakin besar nilai bilangan kuantum utama, ukuran orbitalnya juga semakin besar. � Orbital p Seperti balon terpilin

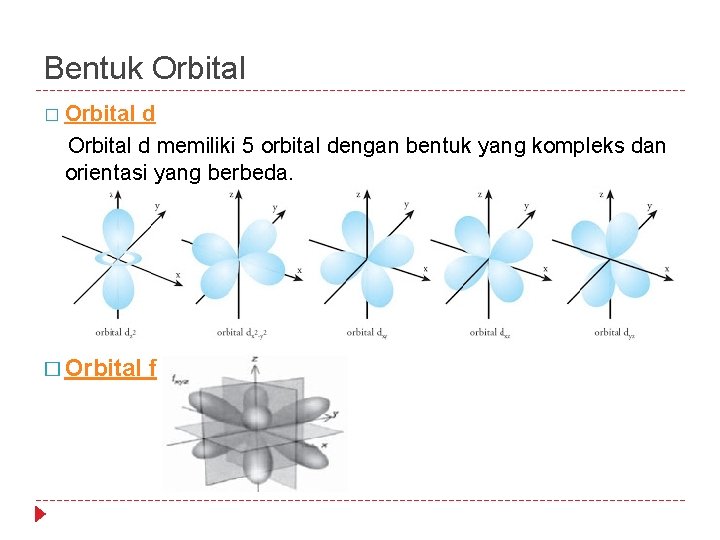
Bentuk Orbital � Orbital d memiliki 5 orbital dengan bentuk yang kompleks dan orientasi yang berbeda. � Orbital f

Konfigurasi elektron Prinsip Aufbau : Elektron menempati orbital dimulai dari yang berenergi rendah, setelah penuh, kemudia menempati orbital yang satu tingkat lebih tinggi, dan seterusnya sampai semua terisi. 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 sp 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 6 Contoh : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 18 Ar 17 X 1 s 2 2 p 6 3 s 2 3 p 5 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 20 Ca 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 4 24 Cr (tidak stabil) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 5 setengah penuh (stabil) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 9 29 Cu (tidak stabil) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 10 keadaan penuh(stabil)

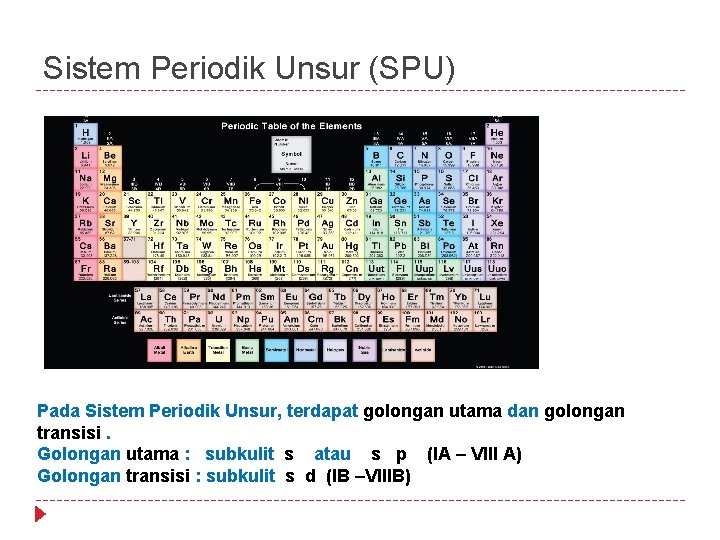
Sistem Periodik Unsur (SPU) Pada Sistem Periodik Unsur, terdapat golongan utama dan golongan transisi. Golongan utama : subkulit s atau s p (IA – VIII A) Golongan transisi : subkulit s d (IB –VIIIB)

Penentuan elektron valensi Tentukan elektron valensi dari 18 Ar 20 Ca 24 Cr 29 Cu ! 18 Ar 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 elektron valensi ; 8 : 3 s 2 3 p 6 20 Ca 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 elektron valensi ; 2 : 4 s 2 24 Cr 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 5 elektron valensi ; 6 : 4 s 1 3 d 5 29 Cu 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 10 elektron valensi ; 1 : 4 s 1 3 d 10

Konfigurasi Elektron Aturan Hund Pengisian elektron dalam orbital-orbital dengan tingkat energi yang sama (orbital-orbital dalam satu subkulit) tidak boleh berpasangan terlebih dahulu sebelum masing-masing orbital terisi oleh satu elektron dengan arah/spin yang sama. Misal : 2 p 3 � 2 � 1 � 3 d 6

BILANGAN KUANTUM Bilangan Kuantum Utama (n) : letak elektron pada kulit terluar � Bilangan Kuantum Azimut (l) : subkulit berdasarkan bilangan kuantum utama l s(sharp)=0 p (principal) = 1 d (diffuse) = 2 f (fundamental) =3 � Bilangan Kuantum Magnetik (m) : pengisian elektron terakhir pada orbital s m = 0 � p m = -1, 0, +1 d m = -2, -1, 0, +1 , +2 f m = -3, -2, -1, 0, +1 , +2, +3 � Bilangan Kuantum Spin (s) : arah rotasi elektron

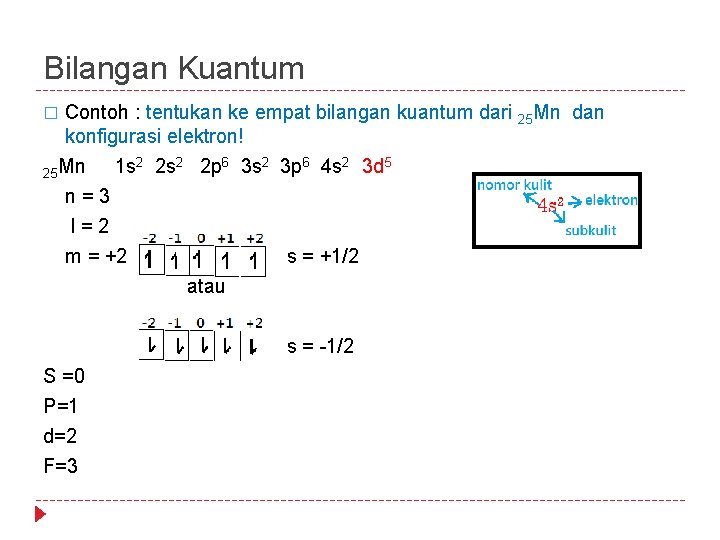
Bilangan Kuantum � Contoh : tentukan ke empat bilangan kuantum dari 25 Mn dan konfigurasi elektron! 25 Mn 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 5 n = 3 l = 2 m = +2 s = +1/2 atau S =0 P=1 d=2 F=3 s = -1/2

Konfigurasi Elektron � Larangan Pauli Dalam suatu orbital yang sama tidak boleh ada dua elektron yang mempunyai harga empat bilangan kuantum yang sama. Orbital yang sama akan memiliki bil. kuantum n, l, dan m 1 yg sama, tapi yg membedakan hanya bil. kuantum spin. Setiap orbital hanya dapat berisi 2 elektron dgn spin yg berlawanan Misal : 3 p 4 n = 3, l = 1, m = -1 dan s = - ½ n = 3, l = 1, m = -1 dan s = +½

� 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 8 benar � 3 � 2 � 0 � -1/2

Sejarah Perkembangan Sistem Periodik Unsur (SPU) � Triade Dobereiner (Hukum Triade) � Oktaf Newlands (Hukum Oktaf) � Mandeleev dan Meyer (susunan berkala) � Moseley (Sistem Periodik Modern)

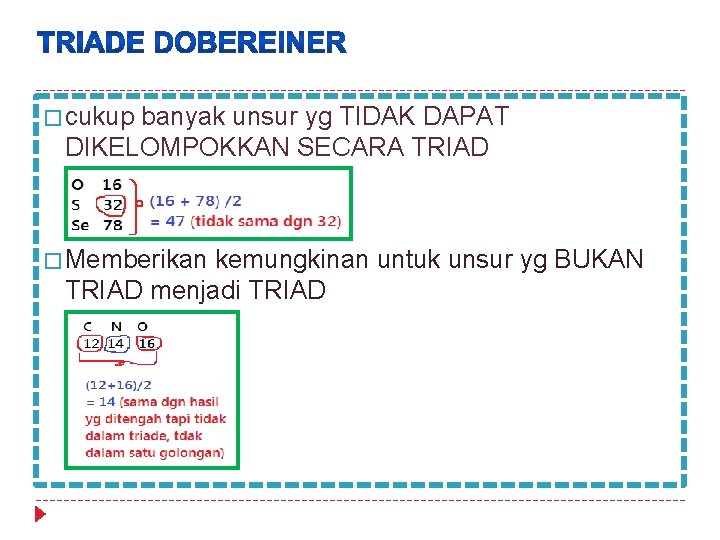
� Unsur yg sifat kimianya sama berdasar kenaikan massa atom dalam TRIADE (terdiri dari 3 unsur) � Unsur yg ditengah ialah massa atom rata 2 dari kedua unsur � cukup banyak unsur yg TIDAK DAPAT DIKELOMPOKKAN SECARA TRIAD � Memberikan kemungkinan untuk unsur yg BUKAN TRIAD menjadi TRIAD

� cukup banyak unsur yg TIDAK DAPAT DIKELOMPOKKAN SECARA TRIAD � Memberikan kemungkinan untuk unsur yg BUKAN TRIAD menjadi TRIAD

OKTAF NEWLANDS � Pengelompokkan berdasar massa atom � Sifat unsur berulang pada unsur ke-8 (unsur ke-8 punya sifat yg sama dgn unsur ke-1) � Pengulangan sifat unsur sbg landasan unsur 2 diket. Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe � Tdk berlaku untuk unsur 2 yg nomor massa ny besar � Tdk mengenal unsur transisi � Tdk memberikan tempat khusus untuk H � Tdk menyediakan tempat untuku unsur yg belum diketahui

Mandeleev dan meyer � Unsur 2 disusun dalam tabel (buku paket hal 59) � Unsur yg sifat nya sama diletakkan dlm satu kolom (atas ke bawah) � Meyer berdasarkan sifat 2 fisika, dan mandeleev berdasarkan sifat 2 kimia � Ada 8 golongan (vertikal), dan 7 periode (horizontal) � Mandeleev yakin ada unsur lain pd ruang kosong dan hal itu terbukti � Posisi H tidak pasti � Posisi transisi belum tepat � Jika berdasarkan kenaikan massa atom, tp unsur Co (58, 9) dan Ni (58, 6) justru mengalami penurunan

Moseley � Berdasarkan kenaikan atom � Periode (nomor kulit) � Golongan (elektron valensi) � Utama ( IA – VIII A) : subkulit s dan p � Transisi (IB –VIII B) : subkulit s dan d, ada aturan penuh dan setengah penuh (materi sebelumnya) � Transisi Dalam : lantanida (terakhir di 4 f), aktinida (terakhir di 5 f)

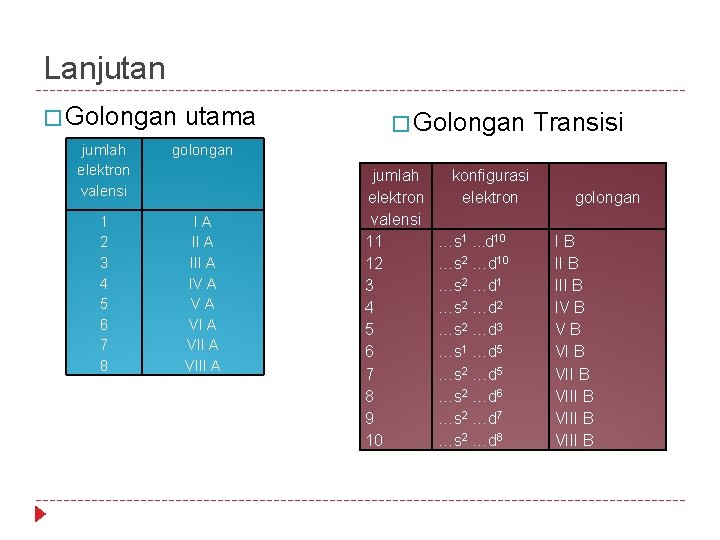
Lanjutan � Golongan utama jumlah elektron valensi golongan 1 2 3 4 5 6 7 8 I A III A IV A VIII A � Golongan Transisi jumlah elektron valensi 11 12 3 4 5 6 7 8 9 10 konfigurasi elektron …s 1. . . d 10 …s 2 …d 1 …s 2 …d 2 …s 2 …d 3 …s 1 …d 5 …s 2 …d 6 …s 2 …d 7 …s 2 …d 8 golongan I B III B IV B VIII B VIII B

Contoh soal � Tentukan golongan dan periode berapa dari 25 Mn ?
 Selamat datang dan selamat beribadah
Selamat datang dan selamat beribadah Cara menjawab selamat datang
Cara menjawab selamat datang Selamat datang peserta ujian
Selamat datang peserta ujian Welcome to 2nd semester
Welcome to 2nd semester Slide selamat datang powerpoint
Slide selamat datang powerpoint Selamat datang peserta ujian
Selamat datang peserta ujian Selamat datang peserta ujian sekolah
Selamat datang peserta ujian sekolah Sambutan selamat datang gubernur
Sambutan selamat datang gubernur Selamat datang di penerbangan
Selamat datang di penerbangan Cover amplop soal ujian sekolah doc
Cover amplop soal ujian sekolah doc Selamat datang peserta ujian sekolah
Selamat datang peserta ujian sekolah Pantun cinta negara
Pantun cinta negara Selamat datang peserta ujian
Selamat datang peserta ujian Selamat datang ppt
Selamat datang ppt Selamat datang peserta ujian
Selamat datang peserta ujian Tugas tik kelas 9 semester 2
Tugas tik kelas 9 semester 2 Pekerjaan plumbing dan sanitasi
Pekerjaan plumbing dan sanitasi Korosi kelas 12
Korosi kelas 12 Materi kimia kelas 12 senyawa turunan alkana
Materi kimia kelas 12 senyawa turunan alkana 9 kelas bahan kimia berbahaya
9 kelas bahan kimia berbahaya Fraksi mol
Fraksi mol Materi penyepuhan kelas 12
Materi penyepuhan kelas 12 Peta konsep hukum dasar kimia kelas 10
Peta konsep hukum dasar kimia kelas 10 Katakan tidak kepada amang seksual
Katakan tidak kepada amang seksual Selamat pagi termasuk kalimat
Selamat pagi termasuk kalimat Assalamualaikum wr wb selamat pagi
Assalamualaikum wr wb selamat pagi
















































