STRUKTUR ATOM DAN KONFIGURASI ELEKTRON PERTEMUAN 2 Harizal










![Konfigurasi Elektron Na: 1 s 2 2 p 6 3 s 1 Na: [Ne] Konfigurasi Elektron Na: 1 s 2 2 p 6 3 s 1 Na: [Ne]](https://slidetodoc.com/presentation_image_h2/253337a224f5ce78d10081ea314edef7/image-15.jpg)




- Slides: 22

STRUKTUR ATOM DAN KONFIGURASI ELEKTRON PERTEMUAN 2 Harizal, S. Pd. , M, Sc Program Studi Gizi Universitas Esa Unggul

KEMAMPUAN AKHIR YANG DIHARAPKAN

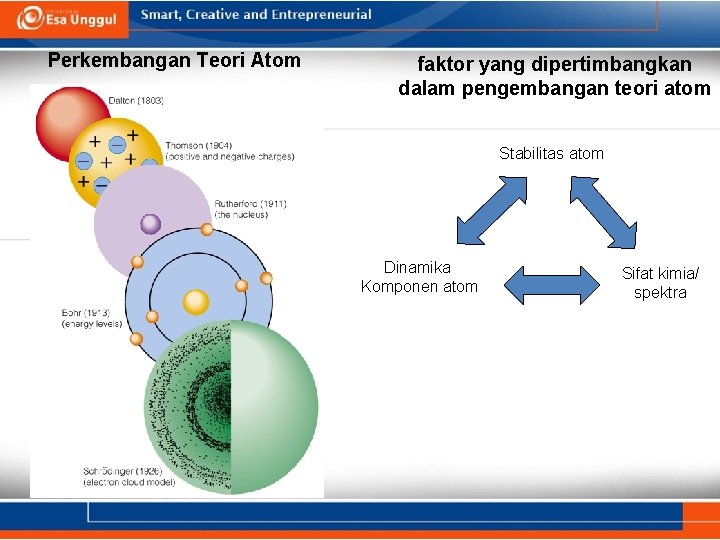
Perkembangan Teori Atom faktor yang dipertimbangkan dalam pengembangan teori atom Stabilitas atom Dinamika Komponen atom Sifat kimia/ spektra

Teori Atom Kuantum Poin penting dalam teori atom kuantum 1. Elektron tidak bergerak mengelilingi inti atom pada jalur tertentu. 2. Elektron bergerak secara acak pada daerah probabilitas tertentu (orbital) 3. Elektron menempati keadaan energi tertentu dalam tiap orbital 4. Keadaan energi ini digambarkan dalam empat bilangan kuantum yaitu bilangan kuantum utama (n), bilangan kuantum momentum angular, bilsngsn kusntum magnetik, dan bilangan kuantum spin

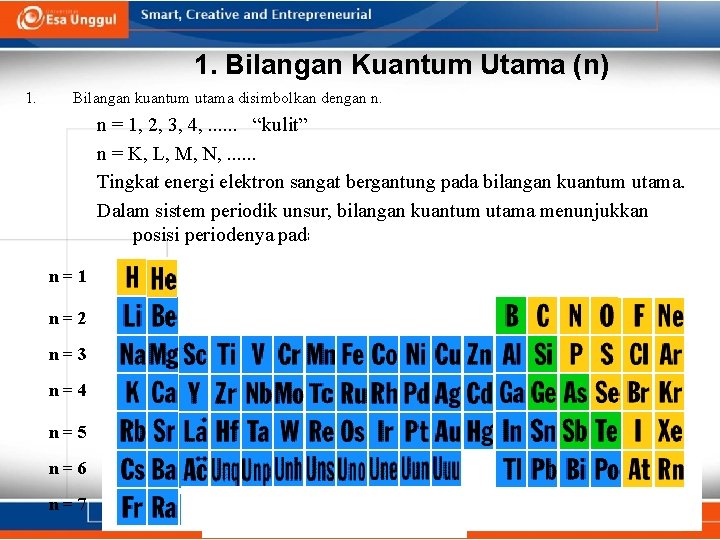
1. Bilangan Kuantum Utama (n) 1. Bilangan kuantum utama disimbolkan dengan n. n = 1, 2, 3, 4, . . . “kulit” n = K, L, M, N, . . . Tingkat energi elektron sangat bergantung pada bilangan kuantum utama. Dalam sistem periodik unsur, bilangan kuantum utama menunjukkan posisi periodenya pada SPU n=1 n=2 n=3 n=4 n=5 n=6 n=7

n=1 2. Bilangan kuantum azimut ( ) Bilangan kuantum azimut memiliki simbol . Bilangan kuantum ini menunjukkan momentum angular dan bentuk orbital yang dimiliki suatu elektron dan ketika dihubungkan dengan n, bilangan kuantum ini akan tingkat energi elektron =menunjukkan 0 = 1 = s = 0, 1, 2, 3, 4, 5, . . (n-1) =p = s, p, d, f, g, h, . . . . (n-1) n=2 =2 =d n=3 n=4 n=5 n=6 n=7 =3 =f

3. Bilangan Kuantum Magnetik (m ) Bilangan kuantum magnetik disimbolkan dengan m. Bilangan kuantum ini menunjukkan banyaknya orbital yang tersedia dalam tiap subkulit dan orientasi orbital dalam ruang. Secara umum, nilai bilangan kuantum magnetik terdiri atas - hingga + digambarkan sebagai berikut: m = - , (- + 1), (- +2), . . . 0, . . . . , ( -2), ( -1), • Jika = 0 (orbital s), maka m = 0. – Sebagaimana diketahui hanya terdapat 1 nilai m untuk orbital s – Hal ini menunjukkan bahwa hanya terdapat satu orbital s per nilai n dimana n 1 • Jika = 1 (orbital p), maka m = -1, 0, +1. – Sebagaimana diketahui, terdapat 3 nilai m untuk orbital p. – Hal ini menunjukkan bahwa terdapat 3 orbital p untuk tiap nilai n dimana n 2 • Jika = 2 (orbital d), maka m = -2, -1, 0, +1, +2. – Sebagaimana diketahui, terdapat 5 nilai m untuk orbital d. – Hal ini menunjukkan bahwa terdapat lima orbital d per nilai n dimana n 3 • Jika = 3 (orbital f), maka m = -3, -2, -1, 0, +1, +2, +3. – Sebagaimana diketahui, terdapat 7 nilai m untuk orbital f. – Hal ini menunjukkan bahwa terdapat tujuh orbital d per nilai n dimana n 3 Secara teoritis, deret ini akan terus berlanjut hingga orbital g, h, i, dst. – Namun pada prakteknya, atom yang ditemukan hingga saat ini hanya memiliki konfigurasi elektron pada orbital s, p, d, atau f pada keadaan dasarnya. •

• • Orbital atom merupakan daerah dalam ruang yang memiliki probabilitas tertinggi ditemukannya elektron. Sifat orbital s: • Terdapat satu orbital s pada tiap bilangan kuantum utama. • =0 • Memiliki 1 nilai m = 0 =s n=1 n=2 n=3 n=4 n=5 n=6 n=7

Orbital atom • • Orbital p memiliki 3 orbital berbentuk seperti kacang atau balon terpilin. Tiap orbital mengarah di sepanjang sumbu sistem koordinasi Cartesian. Orbital p pertama muncul pada kulit n=2. Terdapat tiga orbital p per bilangan kuantum utama. – Ketiga orbital dinamakan orbital px, py, pz. – Memiliki nilai = 1. – Memiliki tiga nilai m = -1, 0, +1

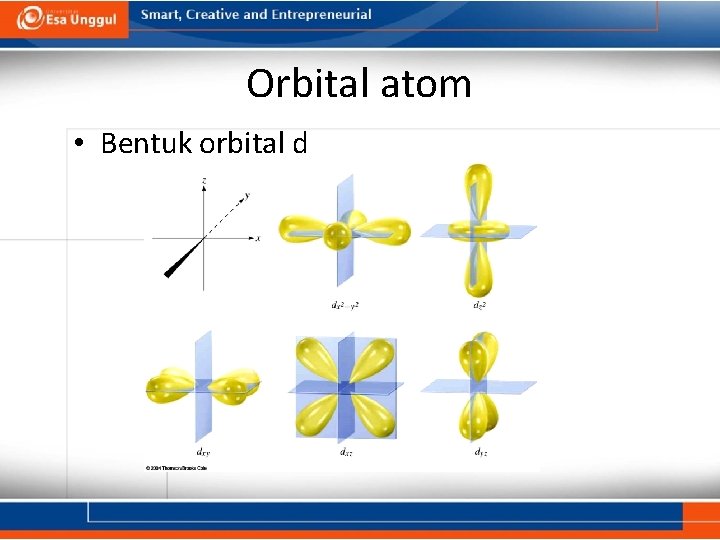
Orbital Atom • Sifat orbital d: – Orbital d pertama muncul pada kulit n=3. • Kelima orbital d memiliki dua bentuk yang berbeda: – Empat orbital memiliki dua balon terpilin. – Satu orbital berbentuk seperti satu balon terpilin yang dikelilingi dengan donat. – Orbital-orbital ini terletak disepanjang atau diantara sumbu Cartesian. terdapat 5 orbital d di tiap kulit. –Lima orbital tsb dilambangkan dengan –Tiap orbital memiliki = 2. –Orbital d memiliki 5 nilai m = -2, -1, 0, +1, +2

Orbital atom • Bentuk orbital d

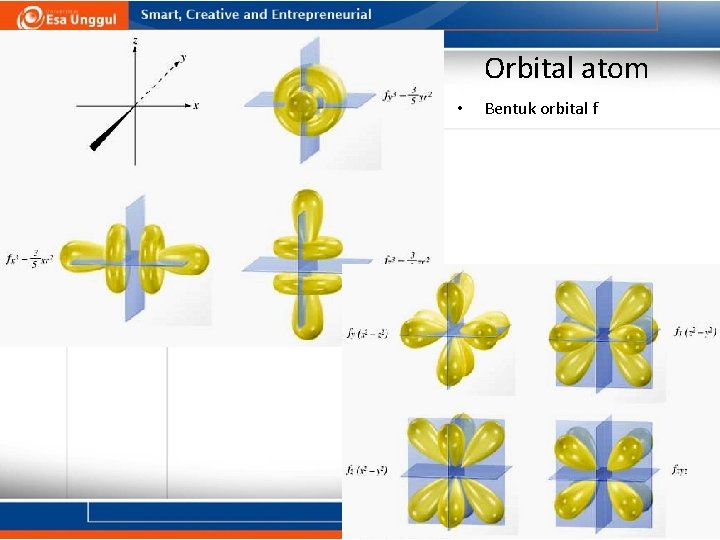
Orbital atom • Sifat orbital f: – Orbital f pertama kali muncul pada kulit n=4. • Orbital f memiliki bentuk yang paling kompleks. • Terdapat 7 orbital f tiap kulit. – Orbital f memiliki nama yang rumit. – Orbital f memiliki = 3 – Orbital f meiliki 7 nilai m = -3, -2, -1, 0, +1, +2, +3 – Orbital f memiliki efek yang penting terhadap unsur lantanida dan aktinida.

Orbital atom • Bentuk orbital f

4. Bilangan kuantum spin dilambangkan dengan simbol m s. – Bilangan kuantum spin hanya memiliki dua nilai yang mungkin. • • – – – ms = +1/2 or -1/2 ms = ± 1/2 Bilangan kuantum ini menunjukkan spin dan orientasi medan magnet elektron. Wolfgang Pauli pada tahun 1925 menemukan prinsip pengecualian yang mengemukakan bahwa tidak ada dua elektron yang memiliki satu set bilangan kuantum yang sama. Adanya bilangan kuantum spin berimplikasi pada kapasitas orbital dimana setiap orbital hanya dapat ditempati oleh dua elektron yang dilambangkan sebagai spin atas ↑ dan spin bawah ↓.
![Konfigurasi Elektron Na 1 s 2 2 p 6 3 s 1 Na Ne Konfigurasi Elektron Na: 1 s 2 2 p 6 3 s 1 Na: [Ne]](https://slidetodoc.com/presentation_image_h2/253337a224f5ce78d10081ea314edef7/image-15.jpg)
Konfigurasi Elektron Na: 1 s 2 2 p 6 3 s 1 Na: [Ne] 3 s 1

Konfigurasi elektron • Konfigurasi elektron metode singkat untuk menunjukkan posisi orbital yang ditempati oleh elektron 2 dalam suatu unsur. • Lambang yang ditunjukkan dalam suatu konfigurasi elektron terdiri atas jenis kulit, subkulit, dan jumlah elektron yang menempati subkulit tersebut sebagaimana ditunjukkan pada gambar berikut Jumlah elektron yang mendiami subkulit Jenis subkulit

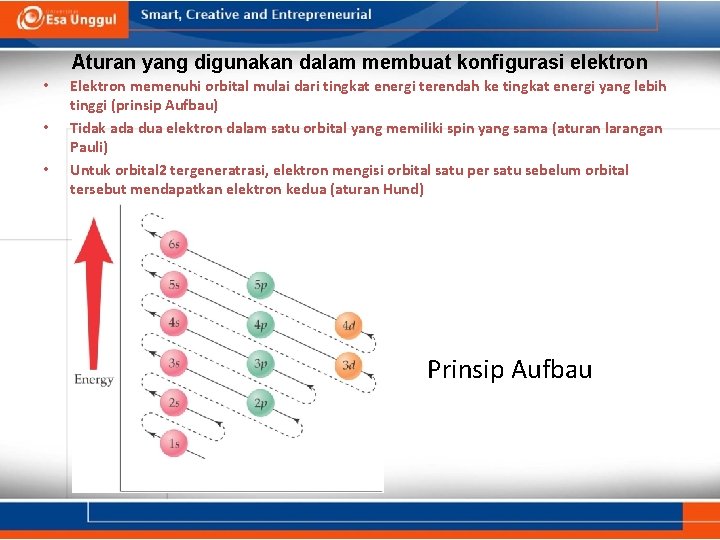
Aturan yang digunakan dalam membuat konfigurasi elektron • • • Elektron memenuhi orbital mulai dari tingkat energi terendah ke tingkat energi yang lebih tinggi (prinsip Aufbau) Tidak ada dua elektron dalam satu orbital yang memiliki spin yang sama (aturan larangan Pauli) Untuk orbital 2 tergeneratrasi, elektron mengisi orbital satu per satu sebelum orbital tersebut mendapatkan elektron kedua (aturan Hund) Prinsip Aufbau

Penulisan konfigurasi elektron • Tentukan berapa jumlah elektron dalam suatu atom. Misalnya: Fe memiliki 26 elektron. • Susun energi subkulit secara berurutan berdasarkan tingkat energinya dari yang terendah hingga yang lebih tinggi: – 1 s 2 s 2 p 3 s 3 p 4 s 3 d … • Isi tiap subkulit dengan elektron hingga semua elektron terisi pada tiap subkulit dalam atom. – Fe: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 6 • Jumlah angka pada superskrip sama dengan nomor atom Fe = 26.

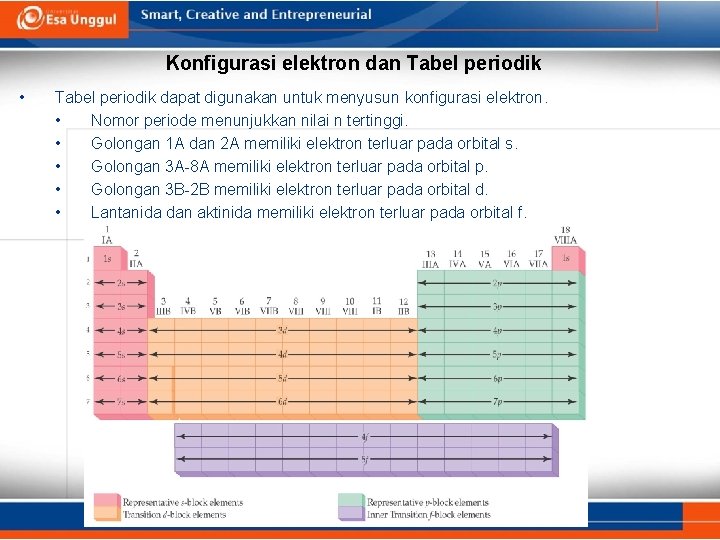
Konfigurasi elektron dan Tabel periodik • Tabel periodik dapat digunakan untuk menyusun konfigurasi elektron. • Nomor periode menunjukkan nilai n tertinggi. • Golongan 1 A dan 2 A memiliki elektron terluar pada orbital s. • Golongan 3 A-8 A memiliki elektron terluar pada orbital p. • Golongan 3 B-2 B memiliki elektron terluar pada orbital d. • Lantanida dan aktinida memiliki elektron terluar pada orbital f.

Penulisan singkat konfigurasi elektron • Misal, konfigurasi elektron untuk atom Na adalah: Na: 1 s 2 2 p 6 3 s 1 • Penulisan konfigurasi elektron tersebut dapat dipersingkat dengan mengganti elektron bagian dalam dengan simbol gas mulia. • Unsur gas mulia dengan nomor atom yang lebih kecil dari Na adalah Neon, sehingga konfigurasi elektron Na dapat ditulis sebagai berikut: Na: [Ne] 3 s 1 • Jumlah elektron yang berada setelah lambang gas mulia tersebut merupakan jumlah elektron valensi dalam suatu unsur sehingga atom Na memiliki 1 elektron valensi pada subkulit 3 s.

Konfigurasi elektron untuk ion • Suatu atom dapat memperoleh atau kehilangan elektron menghasilkan suatu ion (anion atau kation) • Untuk menulis konfigurasi elektronnya diperlukan pemahaman mengenai tingkat energi tiap subkulit sebelum dan sesudah kehilangan elektron. • (contoh? ? )

Sekian
 Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Konfigurasi elektron unsur transisi periode 4
Konfigurasi elektron unsur transisi periode 4 Penempatan elektron
Penempatan elektron 54xe konfigurasi elektron
54xe konfigurasi elektron He2 electron configuration
He2 electron configuration Konfigurasi elektron
Konfigurasi elektron Lambang atom nomor 31
Lambang atom nomor 31 Konfigurasi bilangan
Konfigurasi bilangan Kedudukan elektron dalam atom
Kedudukan elektron dalam atom Konfigurasi elektron v
Konfigurasi elektron v Konfigurasi elektron
Konfigurasi elektron Unsur yang memiliki elektron valensi terbanyak adalah
Unsur yang memiliki elektron valensi terbanyak adalah E miring
E miring Array yang sangat banyak elemen nol-nya
Array yang sangat banyak elemen nol-nya Jelaskan struktur data array
Jelaskan struktur data array Contoh desain struktur
Contoh desain struktur Pertemuan antara sumbu datar dan sumbu tegak dinamakan
Pertemuan antara sumbu datar dan sumbu tegak dinamakan Sel adalah pertemuan antara titik-titik dan titik-titik
Sel adalah pertemuan antara titik-titik dan titik-titik Penawaran elastis uniter terjadi jika
Penawaran elastis uniter terjadi jika Susunan zarah cecair
Susunan zarah cecair Arigato goisamas
Arigato goisamas The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Teori atom modern
Teori atom modern