ATOM DAN STRUKTUR ATOM Mengapa struktur atom dipelajari

















- Slides: 24

ATOM DAN STRUKTUR ATOM

Mengapa struktur atom dipelajari? 1. Penyusunan bagian-bagian atom akan menentukan sifat materi 2. Mengetahui bgm atom bergabung, & bgm mengubah bhn sesuai dgn yg dibthkan 3. Berguna utk kesehatan

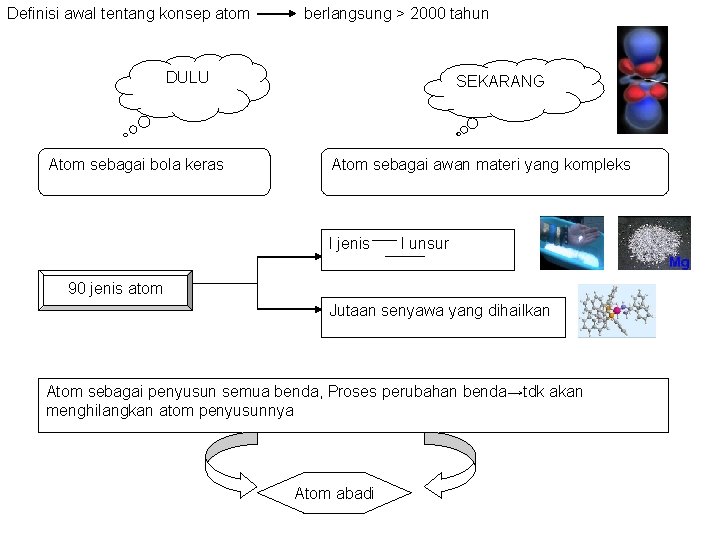
Definisi awal tentang konsep atom berlangsung > 2000 tahun DULU Atom sebagai bola keras SEKARANG Atom sebagai awan materi yang kompleks I jenis I unsur 90 jenis atom Jutaan senyawa yang dihailkan Atom sebagai penyusun semua benda, Proses perubahan benda→tdk akan menghilangkan atom penyusunnya Atom abadi

KONSEP YUNANI TTG ATOM Pandangan filosof Yunani Konsep kemampuan utk di pecah yg tiada berakhir Leucippus (Abad ke-5 SM) Ada batas kemampuan utk dibagi, shg hrs ada bgn yg tdk dpt dibagi lagi Democritus (380 -470 SM) Atomos: partikel yg tdk dpt dibagi lg. Atom stp unsure berbeda bentuk & ukurannya Bhn adl campuran atom-atom berbagai unsure dgn proporsi yg berbeda Bhn satu diubah mjd bhn yg lain dgn mengubah proporsinya Lucretius Sifat atom suatu bhn dlm “On the Nature of Things”

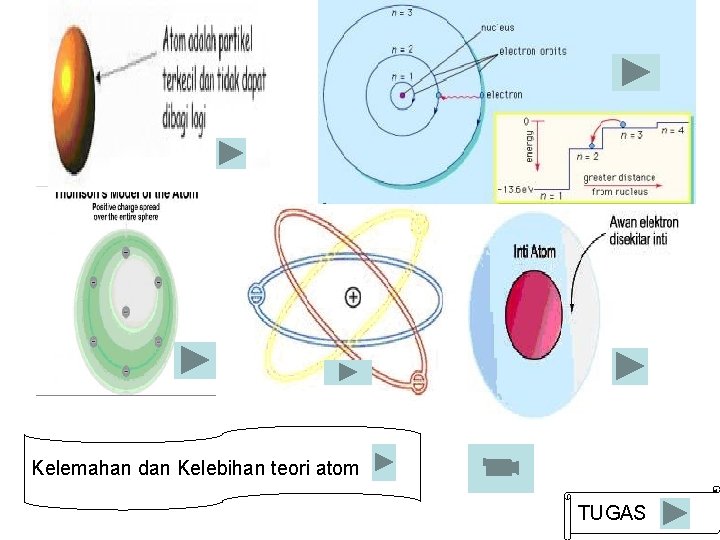
STRUKTUR ATOM Atom sgt kecil & tdk dpt dilihat Rekaman bayangan atom: 1. Prof. Albert Crewe (Univ. Chicago, 1970) Bayangan atom U & Th 2. Gert Erlich & W. R. Graham (Univ. Illinois, 1974)Bayangan atom pd permukaan kristal 3. G. W. Stroke (Univ. New York, 1976)Lokasi & ukuran relatif atom C, Mg, & O dlm satu bagiankristal

Kelemahan dan Kelebihan teori atom TUGAS

HUKUM LAVOISIER Antonie Laurent Lavoisier (1743 -1794) Jk reaksi kimia berlangsung dlm system tertutup, mk total bobot sistem tdk berubah : v. Reaksi dekomposisi merkuri oksida: Hg. O→Hg + 1/2 O 2 v. Reaksi pembakaran batubara: C + O 2 →CO 2 v. Respirasi: O 2 (konsumsi) →CO 2 Definisi Pemikiran: v. Definisi Kerja Robert Boyle dlm The Sceptical Chemist (1661) v. Unsur: zat yg tdk dpt dipecah lbh sederhana lg v. Senyawa: 2 atau lebih unsure yg bergabung membentuk zat yg kompleks BAPAK ILMU KIMIA (Elementary Treatise on Chemistry)

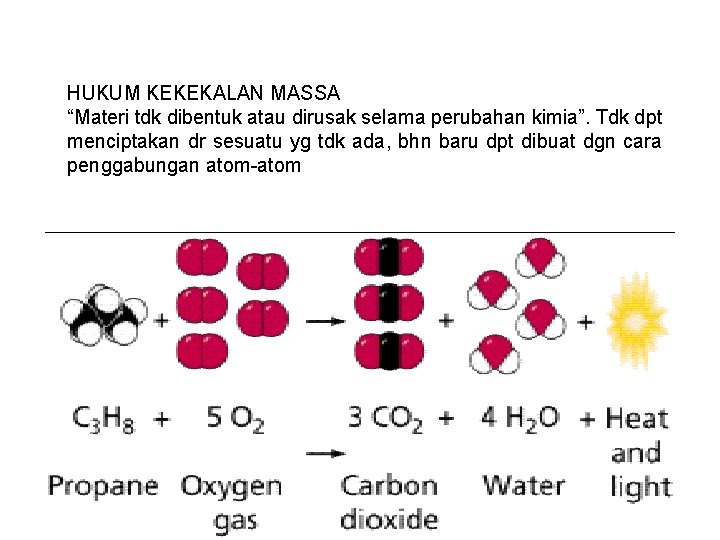
HUKUM KEKEKALAN MASSA “Materi tdk dibentuk atau dirusak selama perubahan kimia”. Tdk dpt menciptakan dr sesuatu yg tdk ada, bhn baru dpt dibuat dgn cara penggabungan atom-atom

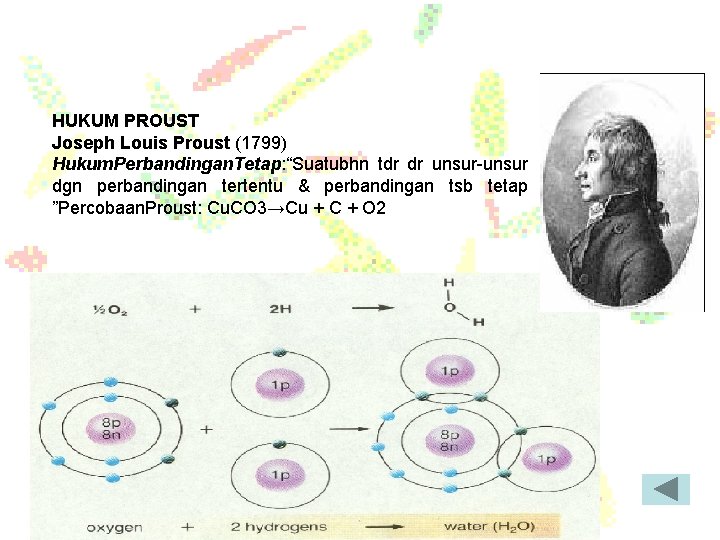
HUKUM PROUST Joseph Louis Proust (1799) Hukum. Perbandingan. Tetap: “Suatubhn tdr dr unsur-unsur dgn perbandingan tertentu & perbandingan tsb tetap ”Percobaan. Proust: Cu. CO 3→Cu + C + O 2

Hukum. Proust Hukum. Lavoiser Teori Atom Dalton Asumsi – asumsi. Dalton 1. Semua unsure terbebtuk dr partikel kecil yg tdk dpt dirusak & tdk dpt dibagi, yg disebut atom 2. Semua atom suatu unsure tertentu, sama, tetapi atom dr unsur-unsur yg berbeda tdk sama 3. Atom-atom dr unsure yg berbeda bergabung membentuk suatu senyawa 4. Reaksi kimia mengubah cara atom-atom bergabung membentuk sen ttp tidak mengubah atom-atomnya

Model Atom Dalton 1. Kelebihan Mulai membangkitkan minat terhadap penelitian mengenai model atom 2. Kelemahan Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menghantarkan arus listrik.

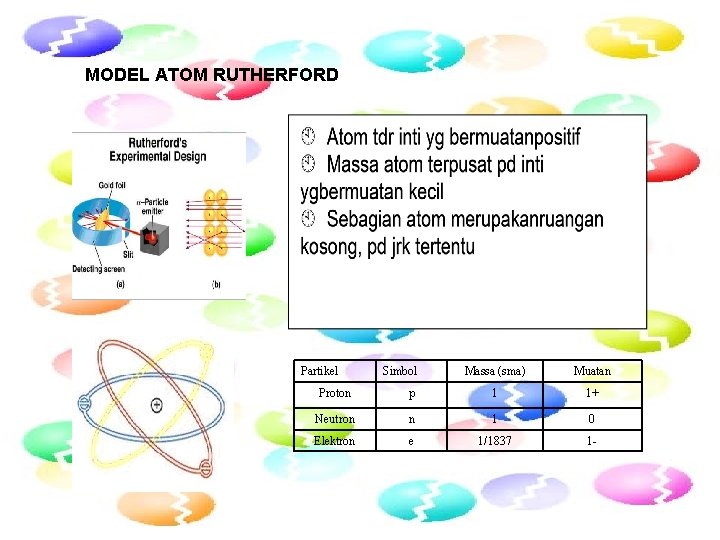
MODEL ATOM RUTHERFORD Partikel Simbol Massa (sma) Muatan Proton p 1 1+ Neutron n 1 0 Elektron e 1/1837 1 -

Model Atom Rutherford ØRutherford menemukan bukti bahwa dalam atom terdapat inti atom yang bermuatan positif, berukuran lebih kecil daripada ukuran atom tetapi massa atom hampir seluruhnya berasal dari massa intinya. ØAtom terdiri dari inti atom yang bermuatan positif dan berada pusat atom serta elektron bergerak melintasi inti (seperti planet dalam tata surya). ØAtom bersifat netral. ØJari-jari inti atom dan jari-jari atom sudah dapat ditentukan.

Kelemahan Model Atom Rutherford 1. Kelebihan Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti 2. Kelemahan Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti Ambilah seutas tali dan salah satu ujungnya Anda ikatkan sepotong kayu sedangkan ujung yang lain Anda pegang. Putarkan tali tersebut di atas kepala Anda. Apa yang terjadi? Benar. Lama kelamaan putarannya akan pelan dan akan mengenai kepala Anda karena putarannya lemah dan Anda pegal memegang tali tersebut. Karena Rutherford adalah telah dikenalkan lintasan/kedudukan elektron yang nanti disebut dengan kulit.

SUSUNAN ELEKTRON : MODEL ATOM BOHR Spekrum Cahaya: Kontinu/berkesinambungan Sinar dgn berbagai λ Spektrum Atom: Diskontinu/diskrit Spektrum garis/pita �� e-mengorbit sekeliling inti pd lintasan yg berbeda, dgn Ek tertentu & Ep tertentu �� Gerakan e-mencegah jatuhnya e-ke dlm inti atom �� e-dpt berpindah dr lintasan dgn tkt E dasar →E yg lebih tinggi jk menyerap E & sebaliknya �� Stp level lintasan tkt E diisi oleh sjml e-ttt

Kelebihan dan Kelemahan Model Atom Bohr 1. Kelebihan atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron. 2. Kelemahan model atom ini adalah tidak dapat menjelaskan efek Zeeman dan efek Strack

TEORI ATOM MODERN �� Teori Kuantum: e-dianggap sbg gel Lokasinya tdk dpt dipastikan Louis de Broglie(1924): �� E bersifat sbg gelombang Erwin schrodinger(1927): fungsi gelombang atau orbital

Kelemahan Model Atom Modern : Persamaan gelombang Schrodinger hanya dapat diterapkan secara eksak untuk partikel dalam kotak dan atom dengan elektron tunggal

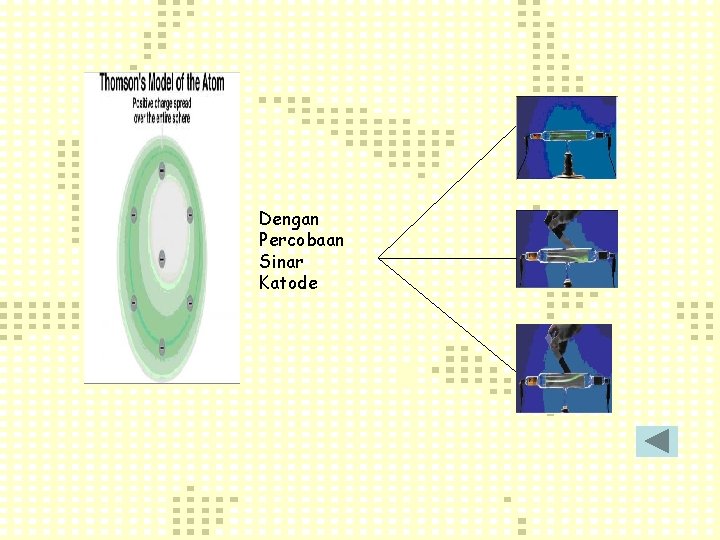
Menurut Thomson : @ Atom terdiri dari materi bermuatan positif dan di dalamnya tersebar elektron (bagaikan kismis dalam roti kismis) @ Atom bersifat netral, yaitu muatan positif dan muatan negatif jumlahnya sama

Kelebihan dan Kelemahan Model Atom Thomson 1. Kelebihan Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur. 2. Kelemahan Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.

Dengan Percobaan Sinar Katode

Kelemahan Model Atom Modern : Persamaan gelombang Schrodinger hanya dapat diterapkan secara eksak untuk partikel dalam kotak dan atom dengan elektron tunggal


TERIMA KASIH …………. . !!!!!