LIRADS v 2017 CTMRI Core Diagnostic Algorithm CTMRI





















- Slides: 34

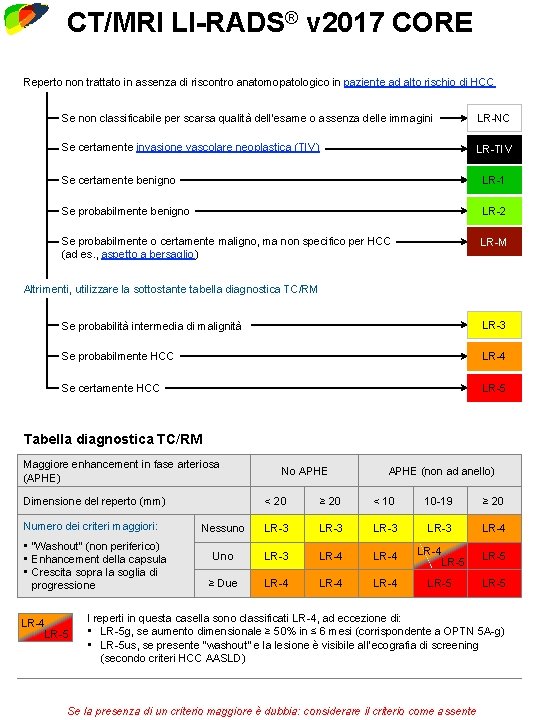
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm CT/MRI Treatment Response LI-RADS® Last Viewed v 2017 CORE Reperto non trattato in assenza di riscontro anatomopatologico in paziente ad alto rischio di HCC Se non classificabile per scarsa qualità dell’esame o assenza delle immagini LR-NC Se certamente invasione vascolare neoplastica (TIV) LR-TIV Se certamente benigno LR-1 Se probabilmente benigno LR-2 Se probabilmente o certamente maligno, ma non specifico per HCC (ad es. , aspetto a bersaglio) LR-M Altrimenti, utilizzare la sottostante tabella diagnostica TC/RM Se probabilità intermedia di malignità LR-3 Se probabilmente HCC LR-4 Se certamente HCC LR-5 Tabella diagnostica TC/RM Maggiore enhancement in fase arteriosa (APHE) Dimensione del reperto (mm) Numero dei criteri maggiori: • “Washout” (non periferico) • Enhancement della capsula • Crescita sopra la soglia di progressione LR-4 LR-5 No APHE (non ad anello) < 20 ≥ 20 < 10 10 -19 ≥ 20 Nessuno LR-3 LR-4 Uno LR-3 LR-4 LR-5 ≥ Due LR-4 LR-5 I reperti in questa casella sono classificati LR-4, ad eccezione di: • LR-5 g, se aumento dimensionale ≥ 50% in ≤ 6 mesi (corrispondente a OPTN 5 A-g) • LR-5 us, se presente “washout” e la lesione è visibile all’ecografia di screening (secondo criteri HCC AASLD) Se la presenza di un criterio maggiore è dubbia: considerare il criterio come assente

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Indice Pagine Introduzione Cosa è il LI-RADS® 2 Algoritmi LI-RADS® v 2017 3 Novità 4 Per iniziare 5 Categorie 6 Diagnosi Risposta al Trattamento Tecnica Gestione Refertazione Definizioni Domande Frequenti Passo 1. Applicare l’algoritmo diagnostico LI-RADS 7 Passo 2. Considerare l’applicazione dei criteri ancillari 8 Passo 3. Applicare i Criteri discriminanti se necessario 9 Passo 4. Controllo finale 9 Passo 1. Applicare l’algoritmo LI-RADS di risposta al trattamento 10 Passo 2. Misurare la dimensione del tumore vitale se applicabile 11 Passo 3. Applicare i criteri discriminanti se necessario 11 Passo 4. Controllo finale 11 Raccomandazioni tecniche LI-RADS 12 Alternative consigliate per l’Iter diagnostico radiologico & Intervalli di tempo 13 OPTN e LI-RADS 14 Considerazioni preliminari alla stesura di un referto LI-RADS 15 Refertazione: requisiti e contenuto 16 Fasi di acqusizione 17 Principali caratteristiche radiologiche 18 Invasione vascolare neoplastica 19 Criteri LR-M 20 Criteri ancillari suggestivi di malignità 21 Criteri ancillari suggestivi di benignità 22 Caratteristiche LI-RADS di risposta al trattamento 23 Esempi di reperti LR-1 e LR-2 24 Reperti con aspetto infiltrante 25 Per iniziare 26 Diagnosi 27 Risposta al trattamento 28 Tecnica 29 Gestione 30 Refertazione 31 Caratteristiche radiologiche 32 Abbreviazioni 33 Manuele TC/RM (Con Bibliografia) (in attesa di pubblicazione) Altri documenti LI-RADS (in attesa di pubblicazione): US LI-RADS, CEUS LI-RADS, LI-RADS

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Introduzione Cosa è il LI-RADS®? Il Liver Imaging Reporting And Data System (LI-RADS) è: • Un sistema completo per standardizzare l’acquisizione, l’interpretazione, la refertazione e la raccolta di dati nell’ambito della diagnostica per immagini epatica • Un documento dinamico, destinato ad essere ampliato e perfezionato con lo sviluppo delle conoscenze ed in risposta alle opinioni degli utilizzatori • Concepito per migliorare la comunicazione, la cura del paziente, la formazione e la ricerca • Supportato e promosso dall’American College of Radiology (ACR) • Sviluppato da un consorzio internazionale multidisciplinare composto da radiologi che si occupano di diagnostica e di interventistica, chirurghi epatobiliari, epatologi ed epatoanatomopatologi. • Include medici universitari e ospedalieri, e anche medici in formazione Il LI-RADS può essere usato da: • Radiologi universitari e ospedalieri • Radiologi in formazione • Altri professionisti sanitari che si occupano della cura di pazienti con malattie epatiche • Ricercatori 2

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Introduzione Algoritmi LI-RADS® v 2017 Ecografia LI-RADS® v 2017 Per lo screening e la sorveglianza dell’HCC Utilizzando l’ecografia senza mezzo di contrasto In pazienti cirrotici o ad alto rischio Vedi US LI-RADS Core (in attesa di essere pubblicato). CEUS LI-RADS® v 2017 Per la diagnosi dell’HCC Utilizzando l’ecografia con mezzo di contrasto (CEUS) In pazienti cirrotici o ad alto rischio Vedi CEUS LI-RADS Core (in attesa di essere pubblicato). Per la diagnosi e la stadiazione dell’HCC TC/RM LI-RADS® v 2017 Vedi pagina 7. Per la valutazione della risposta al trattamento Vedi pagina 10. Utilizzando TC o RM con mezzi di contrasto extracellulari (ECA) o RM con mezzi di contrasto epatospecifici (HBA) In pazienti cirrotici o ad alto rischio, inclusi i pazienti con HCC candidati al trapianto epatico Note: • La TC multifasica e la RM sono spesso utilizzate per la sorveglianza dell’HCC, tenendo conto delle linee guida locali, delle preferenze della struttura e di altri fattori. Il LI-RADS non raccomanda né sconsiglia l’utilizzo della TC o della RM per questo scopo, ma può essere applicato per interpretare e refertare questi esami. • Sebbene la CEUS possa essere utilizzata per valutare la risposta al trattamento, il LI-RADS v 2017 non raccomanda l’utilizzo della CEUS per questo scopo. Questo punto verrà discusso nella prossima versione del LI-RADS. 3

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Novità del LI-RADS® v 2017 Nuovi algoritmi: • Screening e sorveglianza ecografica. Vedi US LI-RADS Core (in attesa di essere pubblicato). • Diagnosi tramite CEUS. Vedi CEUS LI-RADS Core (in attesa di essere pubblicato). • Valutazione della risposta al trattamento tramite TC/RM. Vedi pagina 10. Categorie nuove o revisionate per il LI-RADS TC/RM: • LR-NC (nuova). Vedi pagina 6. • LR-TIV (precedentemente LR-5 V). Vedi pagina 6. Modifica della definizione di “crescita sopra la soglia di progressione” Vedi pagina 18. Nuovi criteri per la categoria LR-M. Vedi pagina 20. Aggiornamento dell’algoritmo diagnostico per il LI-RADS TC/RM. Vedi pagina 7. Nuove tabelle per integrare gli algoritmi diagnostici. Vedi Manuale (in attesa). I criteri ancillari sono adesso opzionali, ed il loro uso è stato chiarito. Vedi pagina 8. Nuovi criteri ancillari suggestivi di malignità: visibilità all’ecografia. Vedi pagina 21. Cambiamento del nome di un criterio ancillare: orletto periferico capsula non dotata di enhancement. Vedi pagina 21. Diagrammi migliorati, nuove curve intensità-tempo. Vedi Manuale (in attesa di essere pubblicato). Nuove Domande Frequenti. Vedi pagine 26 (Per iniziare), 27 (Diagnosi), 28 (Risposta al trattamento), 29 (Tecnica), 30 (Gestione), 31 (Refertazione), 32 (Caratteristiche radiologiche). Chiarimenti: • Distinzione tra enhancement in fase arteriosa non ad anello (criterio maggiore per HCC) vs. enhancement in fase arteriosa ad anello (caratteristico del LR-M). Vedi pagina 18. • Distinzione tra “washout” non periferico (criterio maggiore per HCC) vs. “washout” periferico (caratteristico del LR-M). Vedi pagina 18. • Distinzione tra capsula dotata di enhancement (criterio maggiore per HCC) vs. capsula non dotata di enhancement (criterio ancillare suggestivo di HCC). Vedi pagina 18. • I criteri ancillari suggestivi di malignità includono alcuni suggestivi di malignità in generale e alcuni suggestivi di HCC in particolare. Vedi pagina 21. • Il LI-RADS TC/RM può essere utilizzato in pazienti con HCC candidati al trapianto epatico. Vedi pagina 5. • Categorie “Invasione vascolare neoplastica” e “malignità con aspetto infiltrante”. Vedi pagine 19 & 25. Perché è necessario questo aggiornamento? Con l’emergere di nuove evidenze ed in base alle opinioni degli utilizzatori, il LI-RADS si evolve per rispondere al 4

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Per iniziare LI-RADS® v 2017 TC/RM Applicare in pazienti ad alto rischio di HCC, cioè quelli con: ✔ • Cirrosi OPPURE • Epatite B cronica OPPURE • Presenza di HCC o precedente HCC Inclusi gli adulti candidati al trapianto epatico o che hanno ricevuto un trapianto epatico Non applicare in pazienti: ✘ ✔ • • Senza i fattori di rischio sopracitati < 18 anni Con cirrosi dovuta a fibrosi epatica congenita Con cirrosi dovuta a patologie vascolari, quali teleangectasia emorragica ereditaria, sindrome di Budd-Chiari, occlusione cronica della vena porta, scompenso cardiaco, iperplasia nodulare rigenerativa diffusa Applicare per esami multifasici eseguiti tramite: • TC o RM con mezzo di contrasto extracellulare (ECA) OPPURE • RM con mezzo di contrasto epatospecifico (HBA) Non assegnare categorie LI-RADS per reperti: ✘ • Con riscontro anatomopatologico di malignità OPPURE • Con riscontro anatomopatologico di lesioni benigne ad origine non epatocellulare, come gli angiomi Vedi pagina 31 per una guida sulla refertazione di lesioni con riscontro anatomopatologico. 5

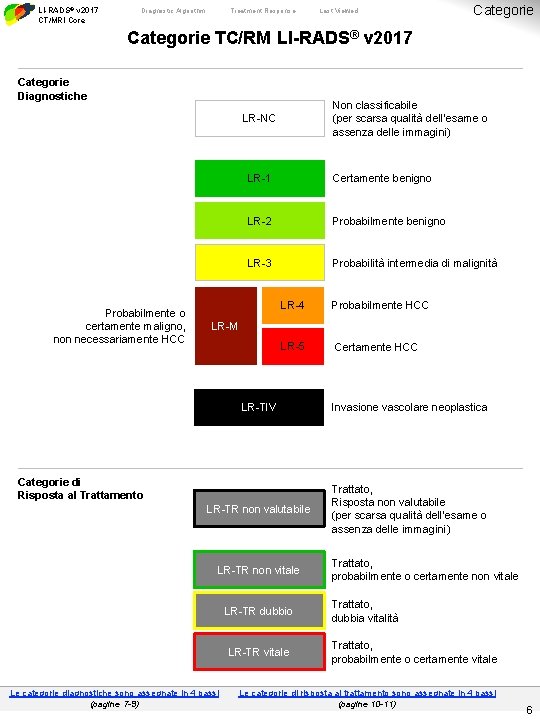
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Categorie TC/RM LI-RADS® v 2017 Categorie Diagnostiche Non classificabile (per scarsa qualità dell’esame o assenza delle immagini) LR-NC Probabilmente o certamente maligno, non necessariamente HCC LR-1 Certamente benigno LR-2 Probabilmente benigno LR-3 Probabilità intermedia di malignità LR-4 Probabilmente HCC LR-5 Certamente HCC LR-M LR-TIV Invasione vascolare neoplastica LR-TR non valutabile Trattato, Risposta non valutabile (per scarsa qualità dell’esame o assenza delle immagini) Categorie di Risposta al Trattamento LR-TR non vitale LR-TR dubbio LR-TR vitale Le categorie diagnostiche sono assegnate in 4 passi (pagine 7 -9) Trattato, probabilmente o certamente non vitale Trattato, dubbia vitalità Trattato, probabilmente o certamente vitale Le categorie di risposta al trattamento sono assegnate in 4 passi (pagine 10 -11) 6

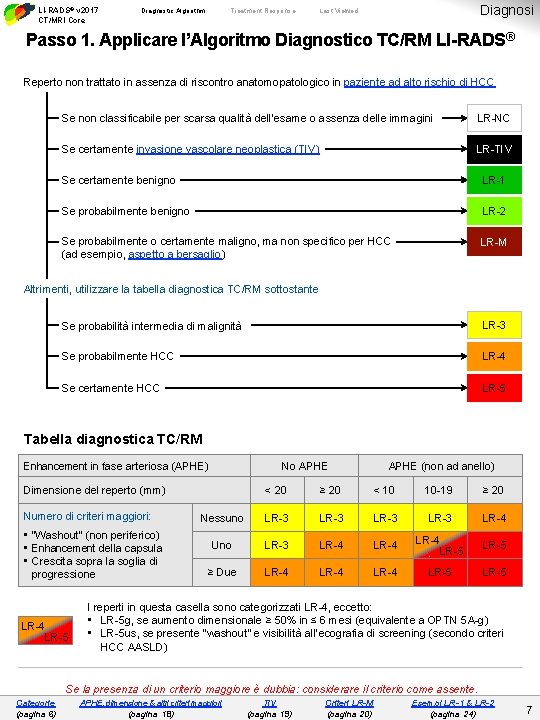
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Diagnosi Last Viewed Passo 1. Applicare l’Algoritmo Diagnostico TC/RM LI-RADS® Reperto non trattato in assenza di riscontro anatomopatologico in paziente ad alto rischio di HCC Se non classificabile per scarsa qualità dell’esame o assenza delle immagini LR-NC Se certamente invasione vascolare neoplastica (TIV) LR-TIV Se certamente benigno LR-1 Se probabilmente benigno LR-2 Se probabilmente o certamente maligno, ma non specifico per HCC (ad esempio, aspetto a bersaglio) LR-M Altrimenti, utilizzare la tabella diagnostica TC/RM sottostante Se probabilità intermedia di malignità LR-3 Se probabilmente HCC LR-4 Se certamente HCC LR-5 Tabella diagnostica TC/RM Enhancement in fase arteriosa (APHE) No APHE Dimensione del reperto (mm) Numero di criteri maggiori: • “Washout” (non periferico) • Enhancement della capsula • Crescita sopra la soglia di progressione LR-4 LR-5 APHE (non ad anello) < 20 ≥ 20 < 10 10 -19 ≥ 20 Nessuno LR-3 LR-4 Uno LR-3 LR-4 LR-5 ≥ Due LR-4 LR-5 I reperti in questa casella sono categorizzati LR-4, eccetto: • LR-5 g, se aumento dimensionale ≥ 50% in ≤ 6 mesi (equivalente a OPTN 5 A-g) • LR-5 us, se presente “washout” e visibilità all’ecografia di screening (secondo criteri HCC AASLD) Se la presenza di un criterio maggiore è dubbia: considerare il criterio come assente. Categorie (pagina 6) APHE, dimensione & altri criteri maggiori (pagina 18) TIV (pagina 19) Criteri LR-M (pagina 20) Esempi LR-1 & LR-2 (pagina 24) 7

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Diagnosi Last Viewed Passo 2. Facoltativo: Applicare Criteri Ancillari (AFs) I criteri ancillari possono essere utilizzati a discrezione del radiologo per: Incrementare la sensibilità, aumentare la confidenza diagnostica, o adattare la categoria Per adattare la categoria (aumentare o ridurre il grado), applicare i criteri ancillari come segue: Uno o più criteri ancillari suggestivi di malignità: aumentare di 1 la categoria, fino a LR-4 (L’assenza di questi criteri ancillari non dovrebbe essere utilizzata per ridurre il grado) LR-1 LR-2 LR-3 LR-4 LR-5 Uno o più criteri ancillari suggestivi di benignità: ridurre di 1 la categoria (L’assenza di questi criteri ancillari non dovrebbe essere utilizzata per aumentare il grado) Se ci sono criteri ancillari in conflitto (ad es, uno o più suggestivi di malignità e uno o più suggestivi di benignità): Non adattare la categoria! I criteri ancillari non possono essere utilizzati per aumentare il grado a LR-5 Criteri ancillari suggestivi di malignità Suggestivi di malignità generica, non specifici per HCC • Visibilità del nodulo all’ecografia • Crescita inferiore alla soglia di progressione • Restrizione della diffusione • Iperintensità in T 2 lieve-moderata • Enhancement con aspetto a corona • Lesione solida senza contenuto adiposo • Lesione solida senza accumulo di ferro • Ipointensità in fase transizionale • Ipointensità in fase epatospecifica Criteri ancillari suggestivi di benignità • • Stabilità dimensionale > 2 anni Riduzione dimensionale Enhancement equivalente ai vasi Vasi non distorti Ferro intralesionale, maggiore che nel fegato Marcata iperintensità in T 2 Isointensità in fase epatospecifica Specifici per HCC • Capsula non dotata di enhancement • Nodulo in nodulo • Aspetto a mosaico • Cataboliti intralesionali dell'emoglobina • Grasso intralesionale, maggiore che nel parenchima epatico adiacente Se la presenza di un criterio ancillare è dubbia: considerare il criterio come assente Definizione di fasi di acquisizione (pagina 17) Definizione di criteri ancillari suggestivi di malignità (pagina 21) Definizione di criteri ancillari suggestivi di benignità (pagina 22) 8

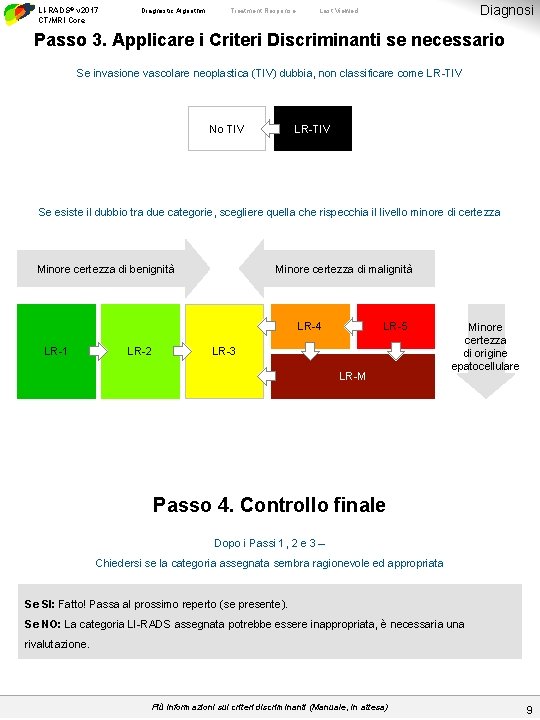
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Diagnosi Last Viewed Passo 3. Applicare i Criteri Discriminanti se necessario Se invasione vascolare neoplastica (TIV) dubbia, non classificare come LR-TIV No TIV LR-TIV Se esiste il dubbio tra due categorie, scegliere quella che rispecchia il livello minore di certezza Minore certezza di benignità Minore certezza di malignità LR-4 LR-1 LR-2 LR-5 LR-3 LR-M Minore certezza di origine epatocellulare Passo 4. Controllo finale Dopo i Passi 1, 2 e 3 – Chiedersi se la categoria assegnata sembra ragionevole ed appropriata Se SI: Fatto! Passa al prossimo reperto (se presente). Se NO: La categoria LI-RADS assegnata potrebbe essere inappropriata, è necessaria una rivalutazione. Più informazioni sui criteri discriminanti (Manuale, in attesa) 9

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Risposta al trattamento Passo 1. Applicare l’Algoritmo di Risposta al Trattamento TC/RM LI-RADS® Reperto trattato Se la risposta al trattamento non può essere valutata per la scarsa qualità o assenza delle immagini LR-TR Non valutabile Altrimenti, utilizzare la tabella TC/RM di risposta al trattamento Se probabilmente o certamente non vitale LR-TR non vitale Se vitalità dubbia LR-TR dubbio Se probabilmente o certamente vitale LR-TR vitale Tabella TC/RM di Risposta al Trattamento Categoria di Risposta Criteri LR-TR non vitale • Nessun enhancement della lesione OPPURE • Tipologia di enhancement atteso per il tipo di trattamento effettuato LR-TR dubbio Enhancement atipico rispetto a quello atteso per il tipo di trattamento effettuato e che non rispetta i criteri per “probabilmente o certamente vitale” LR-TR vitale Tessuto nodulare, formante massa, o tessuto irregolarmente ispessito all’interno o lungo la lesione trattata con uno dei seguenti elementi: • Maggiore enhancement in fase arteriosa OPPURE • Presenza di washout OPPURE • Enhancement simile a quello presente prima del trattamento Definizione dei criteri di risposta al trattamento (pagina 23) 10

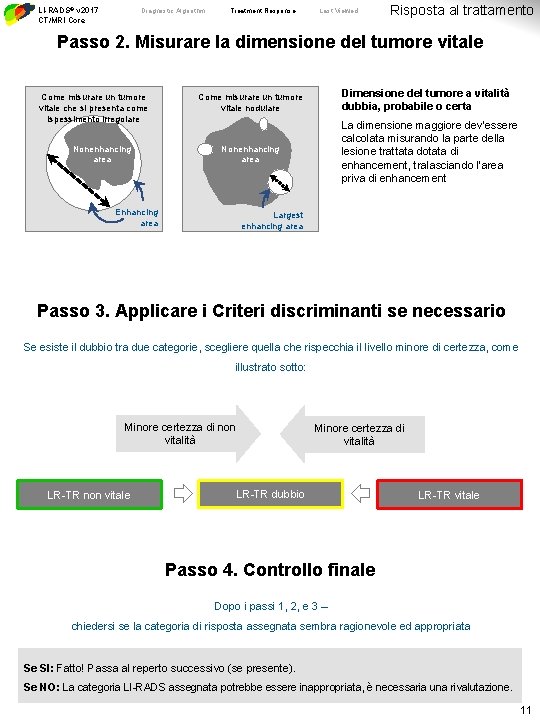
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Risposta al trattamento Passo 2. Misurare la dimensione del tumore vitale Come misurare un tumore vitale che si presenta come ispessimento irregolare Nonenhancing area Dimensione del tumore a vitalità dubbia, probabile o certa Come misurare un tumore vitale nodulare La dimensione maggiore dev’essere calcolata misurando la parte della lesione trattata dotata di enhancement, tralasciando l’area priva di enhancement Nonenhancing area Enhancing area Largest enhancing area Passo 3. Applicare i Criteri discriminanti se necessario Se esiste il dubbio tra due categorie, scegliere quella che rispecchia il livello minore di certezza, come illustrato sotto: Minore certezza di non vitalità LR-TR non vitale Minore certezza di vitalità LR-TR dubbio LR-TR vitale Passo 4. Controllo finale Dopo i passi 1, 2, e 3 – chiedersi se la categoria di risposta assegnata sembra ragionevole ed appropriata Se SI: Fatto! Passa al reperto successivo (se presente). Se NO: La categoria LI-RADS assegnata potrebbe essere inappropriata, è necessaria una rivalutazione. 11

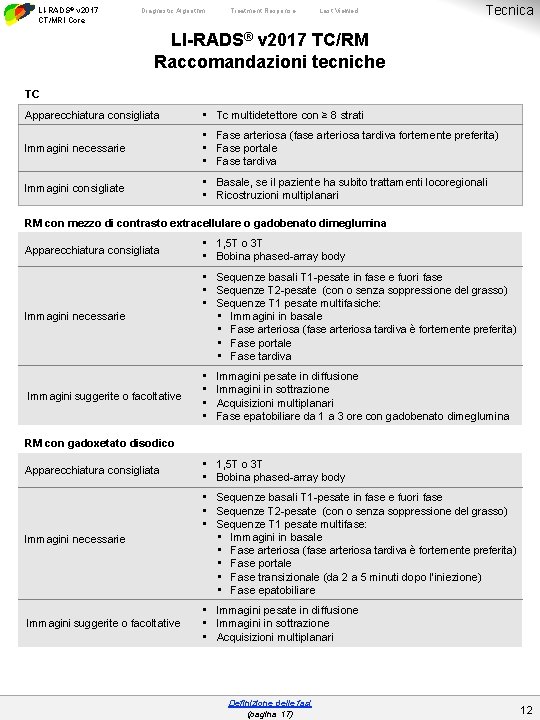
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Tecnica LI-RADS® v 2017 TC/RM Raccomandazioni tecniche TC Apparecchiatura consigliata • Tc multidetettore con ≥ 8 strati Immagini necessarie • Fase arteriosa (fase arteriosa tardiva fortemente preferita) • Fase portale • Fase tardiva Immagini consigliate • Basale, se il paziente ha subito trattamenti locoregionali • Ricostruzioni multiplanari RM con mezzo di contrasto extracellulare o gadobenato dimeglumina Apparecchiatura consigliata • 1, 5 T o 3 T • Bobina phased-array body Immagini necessarie • Sequenze basali T 1 -pesate in fase e fuori fase • Sequenze T 2 -pesate (con o senza soppressione del grasso) • Sequenze T 1 pesate multifasiche: • Immagini in basale • Fase arteriosa (fase arteriosa tardiva è fortemente preferita) • Fase portale • Fase tardiva Immagini suggerite o facoltative • • Immagini pesate in diffusione Immagini in sottrazione Acquisizioni multiplanari Fase epatobiliare da 1 a 3 ore con gadobenato dimeglumina RM con gadoxetato disodico Apparecchiatura consigliata • 1, 5 T o 3 T • Bobina phased-array body Immagini necessarie • Sequenze basali T 1 -pesate in fase e fuori fase • Sequenze T 2 -pesate (con o senza soppressione del grasso) • Sequenze T 1 pesate multifase: • Immagini in basale • Fase arteriosa (fase arteriosa tardiva è fortemente preferita) • Fase portale • Fase transizionale (da 2 a 5 minuti dopo l’iniezione) • Fase epatobiliare Immagini suggerite o facoltative • Immagini pesate in diffusione • Immagini in sottrazione • Acquisizioni multiplanari Definizione delle fasi (pagina 17) 12

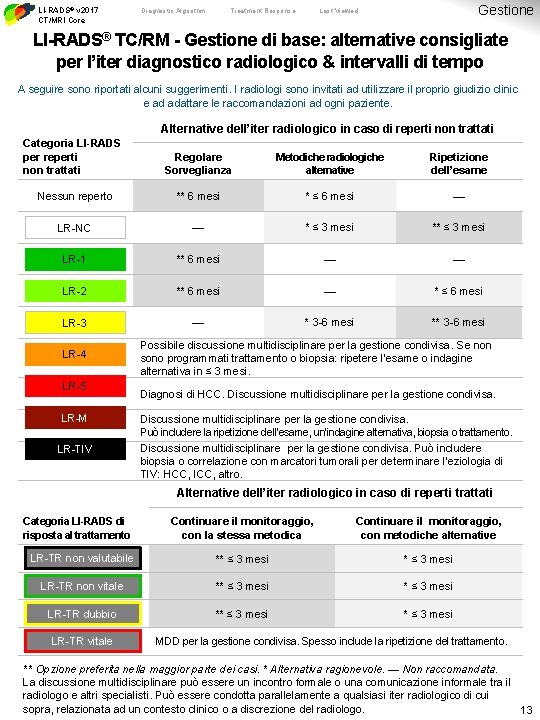
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Gestione Last Viewed LI-RADS® TC/RM - Gestione di base: alternative consigliate per l’iter diagnostico radiologico & intervalli di tempo A seguire sono riportati alcuni suggerimenti. I radiologi sono invitati ad utilizzare il proprio giudizio clinic e ad adattare le raccomandazioni ad ogni paziente. Alternative dell’iter radiologico in caso di reperti non trattati Categoria LI-RADS per reperti non trattati Regolare Sorveglianza Metodiche radiologiche alternative Ripetizione dell’esame Nessun reperto ** 6 mesi * ≤ 6 mesi — LR-NC — * ≤ 3 mesi ** ≤ 3 mesi LR-1 ** 6 mesi — — LR-2 ** 6 mesi — * ≤ 6 mesi LR-3 — * 3 -6 mesi ** 3 -6 mesi LR-4 LR-5 LR-M LR-TIV Possibile discussione multidisciplinare per la gestione condivisa. Se non sono programmati trattamento o biopsia: ripetere l’esame o indagine alternativa in ≤ 3 mesi. Diagnosi di HCC. Discussione multidisciplinare per la gestione condivisa. Può includere la ripetizione dell’esame, un’indagine alternativa, biopsia o trattamento. Discussione multidisciplinare per la gestione condivisa. Può includere biopsia o correlazione con marcatori tumorali per determinare l’eziologia di TIV: HCC, ICC, altro. Alternative dell’iter radiologico in caso di reperti trattati Categoria LI-RADS di risposta al trattamento Continuare il monitoraggio, con la stessa metodica Continuare il monitoraggio, con metodiche alternative LR-TR non valutabile ** ≤ 3 mesi LR-TR non vitale ** ≤ 3 mesi LR-TR dubbio ** ≤ 3 mesi LR-TR vitale MDD per la gestione condivisa. Spesso include la ripetizione del trattamento. ** Opzione preferita nella maggior parte dei casi. * Alternativa ragionevole. — Non raccomandata. La discussione multidisciplinare può essere un incontro formale o una comunicazione informale tra il radiologo e altri specialisti. Può essere condotta parallelamente a qualsiasi iter radiologico di cui sopra, relazionata ad un contesto clinico o a discrezione del radiologo. 13

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Gestione Last Viewed OPTN e LI-RADS® • Il sistema OPTN stabilisce i principi di esclusione per i canditati al trapianto di fegato portatori di HCC. • Il LI-RADS TC/RM può essere applicato ai candidati al trapianto di fegato se rispettano i criteri di idoneità LI-RADS (Vedi pag 5). • Le informazioni di base riguardanti LI-RADS e OPTN sono fornite a seguire: Tecnica radiologica I requisiti tecnici dell’OPTN sono pressocché identici a quelli del LI-RADS, ad eccezione del fatto che il LI-RADS fornisce una guida per l’uso del gadoxetato disodico. Referto I reperti che contribuiscono alla stadiazione OPTN (ad es. , LR-5 g, HCC con riscontro anatomopatologico) dovrebbero essere descritti fornendo le seguenti informazioni: • Dimensione del reperto o dimensione del tumore vitale se trattato • Criteri maggiori usati per l’attribuzione della categoria Sebbene non rispettino criteri OPTN 5 A o 5 B: • LR-M e LR-TIV dovrebbero essere descritti, poiché possono inficiare la gestione pretrapianto e/o l’idoneità al trapianto • I reperti LR-4 e LR-5 us dovrebbero essere descritti, poiché c’è un’alta probabilità che possa trattarsi di un HCC, e la loro presenza può essere indicativa di HCC multifocale. Avvertenze OPTN e LI-RADS differiscono per la crescita sopra la soglia di progressione: OPTN • aumento dimensionale > 50% in < 6 mesi LI-RADS Aumento dimensionale di una massa di minimo 5 mm E uno dei seguenti: • crescita dimensionale > 50% in < 6 mesi O • crescita dimensionale ≥ 100% in > 6 mesi O • Lesione in precedenza non visualizzata in TC o RM, in atto ≥ 10 mm, in ≤ 24 mesi N. B. : Alcuni reperti LR-5 non sono classificabili come OPTN 5. In particolare, per i reperti la cui categoria LR-5 dipende dalla crescita sopra la soglia di progressione, soltanto quelli con crescita dimensionale ≥ 50% in ≤ 6 mesi sono considerati OPTN 5. Differenza tra le popolazioni OPTN e LI-RADS: OPTN Criteri applicati a tutti i candidati al trapianto LI-RADS Applicati solo ai candidati al trapianto che rispondono ai criteri di idoneità: (Vedi pagina 5) N. B. : OPTN può essere applicato ad alcuni candidati al trapianto per i quali il LI-RADS non è raccomandato a causa dell’insufficiente appropriatezza delle immagini per la diagnosi non invasiva di HCC, come nel caso di pazienti pediatrici e patologie vascolari in fegato cirrotico. Informazioni più dettagliate sulla stadiazione dei tumori OPTN e LI-RADS (Manuale, in attesa) 14

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Refertazione LI-RADS® v 2017 TC/RM - Refertazione: Considerazioni preliminari alla stesura di un referto LI-RADS ® Usare il proprio giudizio clinico e il buon senso: Se un paziente ha multipli reperti: • Decidere se descrivere i reperti singolarmente, complessivamente, o con entrambe queste opzioni, con l’obiettivo di comunicare osservazioni e conclusioni nel modo più chiaro possibile. Adattare le proprie raccomandazioni al paziente: • Pagina 13 fornisce una guida generale per l’iter diagnostico radiologico, ma va ricordato che la gestione ottimale può dipendere dai reperti o dal paziente. Si è a conoscenza del riscontro anatomo-patologico di qualche reperto? Se un reperto è stato bioptizzato e non c’è incertezza sulla diagnosi istologica (ad es. si tratta di una lesione maligna come l’HCC oppure un’entità benigna non epatocellulare come un angioma), meglio riportare la diagnosi istologica anzichè la categoria LI-RADS. Se un reperto è stato bioptizzato ma c’è incertezza sulla diagnosi istologica, o si tratta di un potenziale precursore di HCC (ad es. un nodulo displastico o di rigenerazione), descrivere sia la categoria LI-RADS che la diagnosi istologica. Razionale: descrivere entrambi può mettere in guardia da un possibile falso negativo bioptico e/o sollecitare uno stretto follow-up per individuare un’eventuale progressione. Vedi pagina 31 per un’ulteriore guida. C’è invasione vascolare neoplastica? Se presente, descrivere l’eziologia più probabile. La maggior parte dei reperti LR-TIV sono HCC, ma alcuni possono essere ICC, H-Ch. C, o altre lesioni maligne non HCC. Vedi pagina 19 per la guida sulla refertazione del reperto LR-TIV. Il paziente è un candidato al trapianto di fegato? Se si, la categoria LI-RADS deve essere convertita nella classe OPTN dal radiologo o dall’equipe del trapianto. La conversione è semplice se sono descritte le seguenti caratteristiche: dimensioni, criteri maggiori, numero di reperti LR-5 e LR-5 g, HCC con riscontro anatomopatologico – o la dimensione del tumore vitale se trattato. In caso di malattia più avanzata, riportare la presenza di metastasi linfonodali o a distanza ed i reperti LR-TIV. Inoltre, descrivere i reperti LR-M poiché potrebbero influenzare l’idoneità al trapianto. Vedi Manuale (in attesa di pubblicazione) per istruzione dettagliate sulla conversione da LI-RADS a OPTN. Evitare un linguaggio che indichi la biopsia o altre procedure invasive come assolutamente necessarie • Se l’esecuzione della biopsia epatica è appropriata, potrebbero essere utilizzate le seguenti frasi: • “Le possibilità per il proseguimento dell’iter diagnostico includono ____ ed eventuale biopsia. ” • “La distinzione tra HCC e ___ in questo paziente non può essere determinata radiologicamente. Se tale distinzione può essere utile per la gestione del paziente, considerare approfondimento bioptico. ” • “ La biopsia può essere necessaria per distinguere tra HCC e ___. ” 15

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Refertazione LI-RADS® v 2017 TC/RM - Refertazione Reperto non trattato Nessun reperto LR-NC LR-1 LR-2 LR-3 LR-4 LR-5 LR-M Requisiti del referto Contenuto consigliato nel referto Dovrebbe essere riportato nelle conclusioni. “Non ci sono reperti LI-RADS degni di nota. ” Deve essere riportato nelle conclusioni. Fornire le limitazioni tecniche o gli artefatti responsabili, e suggerire il proseguimento dell’iter diagnostico. Riassumere le lesioni nell’insieme OPPURE Riportare nelle conclusioni se: si trattava di un nodulo sospetto nella precedente ecografia o era precedentemente considerato LR-4, -5, o -M. Fornire l’intervallo di categoria e il numero approssimativo di reperti. Se si riduce il grado rispetto ad un precedente esame, fornire una spiegazione. Riportare nelle conclusioni se: non ci sono reperti di categoria superiore o LR 4, LR-5, o LR-M al precedente esame Fornire i criteri maggiori, la crescita, e i criteri ancillari. Indicare i cambiamenti rilevanti rispetto ai precedenti. Devono essere riportati in descrizione e conclusioni. Fornire i criteri maggiori, la crescita, i criteri ancillari e altre caratteristiche. Indicare i cambiamenti rilevanti rispetto ai precedenti. Per LR-5: Indicare se LR-5 g o LR-5 us. Possono essere riassunti nel complesso per chiarezza. LR-TIV Devono essere riportati in descrizione e conclusioni. Indicare l’eziologia più probabile (HCC, non-HCC, dubbia); descrivere eventuale coinvolgimento vascolare. Reperto trattato Requisiti del Referto Contenuto consigliato nel referto LR-TR non valutabile Devono essere riportati in descrizione e conclusioni. LR-TR non vitale Devono essere riportati in descrizione e conclusioni. LR-TR dubbio LR-TR vitale Possono essere riassunti nel complesso per chiarezza. Fornire limitazioni tecniche o artefatti responsabili, e suggerimenti per il proseguimento dell’iter diagnostico. Fornire categoria e dimensioni prima del trattamento, e l’attuale categoria di risposta al trattamento. Per TR vitale o dubbio: Riportare le dimensioni del tumore vitale (o l’intervallo – da. . – se considerate nell’insieme), criteri per la vitalità, e i cambiamenti rispetto ai precedenti. Tutti i reperti descritti dovrebbero includere: • Identificatore: numero sequenziale o altro identificatore unico, fisso e univoco per tutti gli esami. • Dati per la localizzazione: serie e numero di immagine su cui si effettuano le misurazioni. Se possibile, 16 salvare anche le immagini chiave sul PACS.

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Definizioni LI-RADS® TC/RM - Fasi Fase Arteriosa (AP) Precoce AP Tardiva AP Nel LI-RADS, con fase arteriosa si intende la fase arteriosa parenchimale, a meno che non sia altrimenti specificato. La fase arteriosa è un intervallo di tempo dopo la somministrazione di mezzo di contrasto con le seguenti caratteristiche: • L’arteria epatica e i suoi rami mostrano completo potenziamento contrastrografico. • Le vene sovraepatiche non hanno ancora enhancement dal flusso anterogrado. Due sottotipi: • AP precoce: sottotipo di AP in cui la vena porta non mostra ancora enhancement. • AP tardiva: sottotipo di AP in cui la vena porta mostra enhancement. La fase arteriosa tardiva è fortemente preferita per la diagnosi e la stadiazione dell’HCC, poiché il grado di enhancement dell’HCC è di solito più importante nella fase arteriosa tardiva rispetto alla fase arteriosa precoce. Alcuni HCC possono mostrare enhancement soltanto nella fase arteriosa tardiva. Fase extra-cellulare (ECP) Fase dopo contrasto in cui l’enhancement del fegato dipende principalmente dalla distribuzione interstiziale del mezzo di contrasto. Nella pratica, si fa riferimento a: • Fase portale (PVP) e fase tardiva (DP), se viene somministrato un mezzo di contrasto extracellulare o il gadobenato. • Fase portale (PVP) soltanto, se è somministrato il gadoxetato. Fase portale (PVP) Intervallo di tempo dopo la somministrazione di mezzo di contrasto con le seguenti caratteristiche: • La vena porta mostra completo enhancement. • Le vene sovraepatiche mostrano enhancement dal flusso anterogrado. • Il parenchima epatico raggiunge di solito il suo picco di enhancement. Fase tardiva (DP) Fase dopo contrasto acquisita con mezzo di contrasto extracellulare o gadobenato dopo la fase portale e con le seguenti caratteristiche: • La vena porta e le vene sovraepatiche mostrano enhancement, minore rispetto alla fase portale. • Il parenchima epatico mostra enhancement minore rispetto alla fase portale. Di solito è acquisita da 2 a 5 minuti dopo somministrazione di contrasto. Fase transizionale (TP) Fase dopo contrasto acquisita con mezzo di contrasto epatospecifico dopo la fase interstiziale, prima della fase epatobiliare e con le seguenti caratteristiche: • Vasi epatici e parenchima epatico hanno simile intensità di segnale. • Sia il compartimento intracellulare che quello extracellulare del mezzo di contrasto contribuiscono all’enhancement del parenchima. Tipicamente acquisita da 2 a 5 minuti dopo somministrazione di gadoxetato. Non viene ottenuta con il gadobenato. Fase epatobiliare (HBP) Fase dopo contrasto acquisita con un mezzo di contrasto epatospecifico dove: • Il parenchima epatico è iperintenso rispetto ai vasi del fegato. • C’è escrezione di contrasto nel sistema biliare. Tipicamente acquisita 20 minuti dopo somministrazione di gadoxetato. Tipicamente non si ottiene con il gadobenato. Se ottenuta, acquisita dopo 1 - 3 ore dopo la sua somministrazione. HBP è subottimale se il fegato ha minore intensità di segnale dei vasi epatici. 17

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Definizioni LI-RADS® Criteri Discriminanti Maggiori APHE (non ad anello) Enhancement in fase arteriosa non ad anello inequivocabilmente maggiore del fegato in tutta o in parte del reperto. La porzione con enhancement deve avere attenuazione o intensità maggiore del fegato in fase arteriosa. Da differenziare da APHE ad anello (criterio di inclusione per LR-M, pagina 20). “Washout” (non periferico) Riduzione progressiva dell’enhancement in tutta o in parte del reperto, valutata visivamente rispetto al restante parenchima epatico, dalla fase precoce a quella più tardiva, conseguente riduzione dell’enhancement in fase extra-cellulare: • fase portale o fase tardiva se si utilizza mdc ECA o gadobenato • fase portale se si utilizza gadoxetate Si applica a qualsiasi reperto, anche se non ha APHE. Da differenziare da “washout” periferico (criterio di inclusione per LR-M, pagina 20) e da ipointensità in fase transizionale (TP) o epatobiliare (HBP) (Criteri ancillari suggestivi di malignità, pagina 21). “Capsula” dotata di enhancement Regolare, uniforme, con margini definiti, circonda la maggior parte o tutto il reperto, inequivocabilmente più spessa e cospicua del tessuto fibrotico che tipicamente circonda i noduli cirrotici, e visibile come un anello con enhancement in PVP, DP, or TP. Da differenziare da capsula non dotata di enhancement (criterio ancillare suggestivo di HCC, pagina 21) o da enhancement con aspetto a corona (criterio ancillare suggestivo di malignità, pagina 21). Dimensioni Misura maggiore calcolata dal bordo esterno di un reperto: • Includere la capsula nella misura. • Scegliere la fase, la sequenza e il piano in cui imargini sono più definiti. • Non misurare in fase arteriosa o in DWI se i margini sono chiaramente visibili in una fase diversa (le dimensioni possono essere sovrastimate in fase arteriosa a causa del sovrapporsi di potenziamento del tessuto perilesionale e la misura non è affidabile in DWI a causa di possibili distorsioni anatomiche). Crescita sopra la soglia di progressione Aumento dimensionale superiore a 5 mm di una massa E inoltre: • ≥ 50% aumento dimensionale in ≤ 6 mesi O • ≥ 100% aumento dimensionale in > 6 mesi O • Precedentemente non visibile in TC o RM, attualmente ≥ 10 mm, in ≤ 24 mesi Misurare nella stessa fase, sequenza e piano in esami successivi. Nota: Applicare I criteri di crescita solo se è disponibile una TC o RM di qualità sufficiente e con tecnica adeguata a riconoscere se il reperto è di nuova comparsa o se è cresciuto. Non utilizzare I criteri di crescita con precedenti esami US o CEUS. 18

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definizioni Last Viewed LI-RADS® Invasione Vascolare Neoplastica Invasione vascolare neoplastica Presenza inequivocabile di tessuto dotato di enhancement nel lume venoso, indipendentemente dalla visualizzazione di massa parenchimale Reperti aggiuntivi per diagnosticare l’invasione vascolare neoplastica: I reperti che suggeriscono invasione vascolare neoplastica ma NON ne consentono una diagnosi di certezza sono i seguenti: • • Occlusione venosa can pareti mal definite Occlusione venosa con restrizione della diffusione Occlusione venosa o vena mal identificabile in contiguità ad una massa parenchimale maligna Enhancement eterogeneo della vena, non attribuibile ad artefatto Se si identificano le caratteristiche soprariportate, si deve valutare accuratamente la vena per la presenza di tessuto dotato di enhancement. Classificazione: Classificare come LR-TIV. Refertazione: Indicare nel referto la eziologia più probabile. Vedi sotto come guida: LR-TIV Se adiacente a LR-5 “Sicuramente dovuto a HCC” Se adiacente a LR-4 “Probabilmente dovuto a HCC” Se associata a massa infiltrativa “Probabilmente dovuto a HCC” Se adiacente a massa “a bersaglio” Altrimenti “Potrebbe essere dovuta a lesione maligna non-HCC” “Eziologia incerta” 19

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definitioni Last Viewed LI-RADS® Criterio LR-M Massa a bersaglio (vedi sotto per la definizione e per gli aspetti radiologici) O Massa non a bersaglio, con uno o più dei seguenti aspetti: • • Aspetto infiltrativo. Vedi pagina 25. Netta restrizione della diffusività. Vedi il manuale (non completato). Necrosi o marcata ischemia. Vedi il manuale (non completato). Altri aspetti che a giudizio del radiologo suggeriscono lesione maligna non-HCC (descrivere nel referto). Vedi il manuale (non completato). Assenza di invasione vascolare neoplastica Non soddisfa i criteri LR-5 Aspetto a bersaglio, definizione Aspetto morfologico a bersaglio. Distribuzione concentrica delle componenti intralesionali. Verosimilmente dovuto a ipercellularità periferica e a fibrosi o ischemia dello stroma centrale. Caratteristico di • Colangiocarcinoma • Epatocolangiocarcinoma • Altre lesioni maligne non-HCC Può essere presente in HCC con aspetto atipico. Per questo l’aspetto a bersaglio suggerisce una lesione maligna non-HCC ma non esclude HCC. Massa a bersaglio, aspetti imaging nelle diverse fasi e sequenze Enhancement a bersaglio APHE ad anello Particolare APHE caratterizzato da enhancement in fase arteriosa a localizzazione prevalente in corrispondenza della periferia del reperto. “washout” periferico Particolare “washout” caratterizzato da localizzazione prevalente in corrispondenza della periferia del reperto. Enhancement centrale tardivo Area centrale con progressivo enhancement nelle fasi successive alla fase arteriosa Aspetto a bersaglio in DWI o TP/HBP: Restrizione a bersaglio Aspetto concentrico in DWI caratterizzato da diffusione maggiormente ristretta alla periferia e da minor restrizione al centro Aspetto concentrico in TP o HBP caratterizzato da dicreta/marcata Aspetto a bersaglio ipointensità alla periferia del reperto e da una ipointensità meno accentuata al in TP o HBP centro 20

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definizioni Last Viewed LI-RADS® Criteri ancillari indicatori di malignità e modalità di imaging in cui questi sono visibili Criteri ancillari indicatori di malignità, non necessariamente di HCC Criterio Ecograficamente visibile come nodulo distinto Incremento dimensionale al di sotto della soglia di crescita Definizione TC RM RM ECA HBA Ecograficamente visibile come nodulo distinto + + + Incremento inequivocabile di una massa, al di sotto della soglia di crescita. Vedi pagina 18 per la definizione di soglia di crescita + + + + — + Enhancement perilesionale nella fase arteriosa tardiva o nella fase venosa portale precoce attribuibile al drenaggio venoso + del tumore Scarsa presenza di contenuto adiposo all’interno di una Lesione solida senza massa solida nel contesto di un fegato steatosico O in un + / – contenuto adiposo nodulo interno ad un nodulo ad elevato contenuto adiposo Intensità in DWI non attribuibile unicamente all’effetto di Restrizione della trascinamento dell’iperintensità in T 2, inequivocabilmente Diffusione — superiore all’intensità di segnale del fegato e/o con valori di ADC più bassi del parenchima epatico Intensità nelle sequenze T 2 pesate lievemente o Lieve-moderatamente più elevata rispetto al parenchima epatico e — iperintensità in T 2 simile o inferiore rispetto a quella della milza senza sovraccarico di ferro Scarso contenuto di ferro intralesionale nel contesto di un Lesione solida senza fegato con sovraccarico di ferro O in un nodulo interno ad un — accumulo di ferro nodulo siderotico Ipointensità in fase Intensità in fase transizionale inequivocabilmente inferiore, — transizionale globalmente o in parte, rispetto al fegato Ipointensità in fase Intensità in fase epatobiliare inequivocabilmente inferiore, — epatobiliare globalmente o in parte, rispetto al fegato Enhancement con aspetto a corona Criteri ancillari specifici per HCC Criterio Definizione Aspetto della capsula non apprezzabile come un anello di Capsula che non enhancement. Vedi pagina 18 per la definizione di capsula presenta enhancement con enhancement Nodulo più piccolo all’interno di un nodulo, con Aspetto del nodulo in caratteristiche imaging differenti dal nodulo esterno più nodulo grande Presenza di noduli interni o aree con distribuzione casuale, Aspetto a mosaico che presentano caratteristiche imaging differenti Grasso intralesionale, Eccesso di grasso all’interno di una massa rispetto al maggiore che nel parenchima epatico, globalmente o in parte di essa parenchima epatico Emorragia intra o peri-lesionale in assenza di biopsia, Cataboliti intralesionali trauma o intervento dell’emoglobina + generalmente valutabile – non valutabile TC RM RM ECA HBA + + + + + / – potrebbere essere o non essere valutabile ADC = coefficiente di diffusione apparente, DWI = immagini pesante in diffusione, ECA = mezzo di contrasto extracellulare, HBA = mezzo di contrasto epatobiliare, PVP = fase portale, T 2 WI = immagini pesate in T 2 21

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definizioni Last Viewed LI-RADS® Criteri ancillari indicatori di benignità e modalità di imaging in cui questi risultano visibili Criteri ancillari indicatori di benignità TC RM RM ECA HBA Criterio Definizione Stabilità dimensionale ≥ 2 anni Assenza di cambiamenti significativi della dimensione del reperto misurato nella precedente indagine ≥ 2 anni prima in assenza di trattamenti + + + Riduzione di dimensione Inequivocabile spontanea riduzione della dimensione nel tempo non attribuibile ad artefatti, errori di misurazione, tecniche d’esame differenti, o a riassorbimento di cataboliti dell’emoglobina + + + Enhancement equivalente ai vasi Caratteristica temporanea per la quale l’enhancement del reperto raggiunge ed eguaglia quello dei vasi + + + Vasi non distorti Vasi che attraversano un reperto senza essere dislocati, nè deformati, e senza altre alterazioni + + + Ferro intralesionale maggiore che nel fegato Eccesso di ferro all’interno della massa rispetto al fegato circostante + / – + + Marcata Iperintensità Intensità nelle sequenze T 2 pesate marcatamente più alta nelle sequenze T 2 rispetto a quella del fegato e simile a quella dei dotti biliari pesate o di altre strutture a contenuto liquido — + + Isointensità in fase epatobiliare Intensità in fase epatobiliare pressochè identica a quella del parenchima epatico — — + + generalmente valutabile – non valutabile + / – potrebbe essere o non essere valutabile ECA = mezzo di contrasto extracellulare, HBA = mezzo di contrasto epatobiliare, T 2 WI = immagini pesate in T 2 22

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Definitions LI-RADS® Criteri di risposta al trattamento Vitalità Presenza di cellule tumorali vitali all’interno o intorno al margine della lesione trattata. Vitalità radiologica non è sinonimo di vitalità patologica poichè le tecniche di imaging non sono sensibili a piccoli o microscopici foci di residuo tumorale. Enhancement atteso dopo trattamenti specifici Aspetto atteso, nel tempo e nello spazio, di enhancement posttrattamento attribuibile ai cambiamenti della perfusione parenchimale dopo il trattamento. In alcuni tipi di trattamento, il precoce enhancement posttrattamento può non rendere affidabile la differenziazione tra tumore vitale e non vitale. Nel primo periodo post-trattamento di queste tipologie di trattamenti, la categoria di risposta più appropriata potrebbe essere LR-TR Equivoco. Assenza di enhancement della Assenza di enhancement all’interno o lungo il margine della lesione trattata. Enhancement in fase arteriosa di aspetto nodulare, tipo massa, o post-trattamento ispessito e irregolare all’interno o lungo il margine della lesione trattata suggestivo di vitalità tumorale post-trattamento. “Washout” di mezzo di contrasto di aspetto nodulare, tipo massa, o post-trattamento ispessito e irregolare, contenuto all’interno o lungo il margine della lesione trattata suggestivo di vitalità tumorale post-trattamento. . Enhancement post-trattamento Enhancement simile in tutte le fasi post-contrastografiche a quello simile al pre-trattamento di aspetto nodulare, tipo massa, o ispessito e irregolare, contenuto all’interno o lungo il margine della lesione trattata suggestivo di vitalità tumorale post-trattamento, anche in assenza di enhancement in fase arteriosa o di “washout”. 23

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed LR-1 e LR-2 Esempi di reperti LR-1 e LR-2 LR-1 LR-2 Certo: • Cisti • Emangioma • Alterazione della perfusione (es. , shunt artero-portale) • Area di steatosi epatica/area di risparmio • Ipertrofia rigenerativa con effetto pseudomassa • Fibrosi confluente o cicatrice focale Scomparsa spontanea L’elenco soprariportato non intende essere esaustivo Probabile: • Cisti • Emangioma • Alterazione della perfusione (es. , shunt artero-portale) • Area di steatosi epatica/area di risparmio • Ipertrofia rigenerativa con effetto pseudomassa • Fibrosi confluente o cicatrice focale Nodulo distinto senza criteri imaging di malignità (vedi sotto) L’elenco soprariportato non intende essere esaustivo Nodulo solido con diametro < 20 mm che si distingue per caratteristiche imaging dai noduli di fondo E non presenta criteri maggiori indicativi di HCC, nè caratteristiche tipo LR-M, nè criteri ancillari indicativi di malignità. Esempi comuni: Nodulo definito senza caratteristiche di malignità • • Iperintensità in T 1 Ipointensità in T 2 Siderotico Iperintensità in fase epatobiliare • Qualsiasi combinazione delle caratteristiche suddette Assenza di enhancement in fase arteriosa, di “washout”, di capsula, o di crescita Assenza di caratteristiche tipo LRM (vedi pagina 20) Assenza di criteri ancillari indicativi di malignità (vedi pagina 21) Se di diametro ≥ 20 mm, inserire nella categoria LR-3 Attenzione: I noduli con caratteristiche compatibili con iperplasia nodulare focale (FNH) o con adenoma epatocellulare (HCA) dovrebbero essere generalmente inclusi nella categoria LR-3. Con particolari avvertenze, potrebbero essere inclusi nella categoria LR-2. Non dovrebbero essere inclusi nella categoria LR-1. Razionale: queste sono diagnosi di esclusione in pazienti ad alto rischio. 24

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Reperto con aspetto infiltrante Definizioni Reperto che presenta margini mal definibili (in assenza di una zona di transizione ben distinta) che potrebbe essere indicativo di tumore maligno con pattern di crescita infiltrante. Terminologia: • I tumori maligni con pattern di crescita infiltrante sono spesso definiti come “infiltranti”. • LI-RADS preferisce il termine aspetto infiltrante. Razionale: potrebbe rappresentare una vera infiltrazione di cellule tumorali nel parenchima epatico o la confluenza di multipli piccoli noduli o entrambi. La diagnosi differenziale è difficile. Diagnosi Differenziale per tumori maligni con aspetto infiltrante in TC e RM: • Comuni: HCC • Non comuni: ICC, H-Ch. C, metastasi epatiche da primitivo extra-epatico, linfoma Tumori maligni con aspetto infiltrante in TC e RM: • Può manifestarsi come una massa a margini mal definibili, spesso coinvolgente più di un segmento • Nonostante le grandi dimensioni, potrebbe essere difficile da diagnosticare • Potrebbero aiutare le immagini pre-contrastografiche. • E’ spesso necessaria un’attenta analisi di tutte le immagini disponibili. • Caratteristiche suggestive (lista parziale): • Invasione vascolare neoplastica (spesso primo e più utile indizio diagnostico) • Vene non opacizzate o non ben visualizzabili non attribuibili ad occlusione benigna cronica • Attenuazione/intensità di segnale disomogenea • Da lieve a moderata ipointensità in T 1, iperintensità in T 2, e restrizione della diffusione • Enhancement eterogeneo in una o più fasi • Presenza di multipli noduli indistinti o con margini non ben definiti • Distorsione dell’architettura epatica Insidie: Alcuni processi benigni possono avere aspetto infiltrante ed essere mal interpretati come maligni. Esempi: alterazione della perfusione focale o regionale, depositi di grasso, depositi di ferro. Suggerimenti per effettuare una diagnosi corretta: queste entità non infiltrano i vasi, non sono presenti vasi non opacizzati e non distorcono l’architettura del parenchima epatico Assegnazione dei criteri LI-RADS nei reperti a margini mal-definibili: Reperti a margini mal definibili senza prova patologica di malignità in pazienti ad alto rischio di HCC Se Invasione vascolare neoplastica LR-TIV Se si pensa sia un reperto benigno o un’alterazione locale della perfusione, grasso, ferro, o altri processi produttivi parenchimali benigni LR-2 Se presenta i criteri per LR-5 (es. , enhancement in fase arteriosa + “washout”) LR-5 Altrimenti LR-M 25

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Per iniziare Che cos’è un reperto LI-RADS? Un reperto è un’area ben definita del fegato rispetto al parenchima circostante rilevabile alle metodiche di imaging. Può essere una lesione (una massa o un nodulo) o una pseudolesione (es. : alterazione della perfusione, una pseudomassa o un artefatto). Perchè i LI-RADS non possono essere utilizzati in pazienti senza fattori di rischio, pazienti di età <18 anni o pazienti con cirrosi da fibrosi epatica congenita? In questi pazienti il valore predittivo positivo della diagnostica per immagini per HCC non è abbastanza elevato. Perchè i LI-RADS non possono essere applicati in pazienti con cirrosi da patologie vascolari come la teleangectasia emorragica ereditaria, la sindrome di Budd-Chiari, la trombosi portale cronica, la congestione cardiaca o l’iperplasia nodulare rigenerativa diffusa? Queste condizioni sono associate alla formazione di noduli iperplastici benigni che possono simulare l’HCC alle tecniche d’immagine dando luogo a falsi positivi. Non sono sicuro che il paziente abbia la cirrosi. Posso applicare i criteri LI-RADS TC/RM? Puoi applicare i LI-RADS e fornire una categoria “condizionale”. Per esempio: “nodulo di 25 mm con APHE e washout. Se il paziente ha cirrosi o epatite B cronica, il nodulo rientra nella classe LR-5 (sicuramente HCC)”. Il mio istituto è un centro trapianti e utilizza il sistema OPTN. Posso utilizzare i criteri LI-RADS al posto o in aggiunta all’OPTN? Sì, i LI-RADS si possono utilizzare in qualsiasi paziente candidato e/o ricevente trapianto con cirrosi, epatite B cronica, HCC pregresso o attivo. Il mio paziente ha un tumore primitivo extraepatico. Posso utilizzare i criteri LI-RADS? Sì. I criteri LI-RADS si possono utilizzare, ma la categoria LR-5 deve essere assegnata con cautela perchè i criteri LI-RADS e le varie categorie non sono stati fatti e validati in questo contesto. La presenza di concomitante malignità extraepatica riduce il valore predittivo positivo di LR-5 per HCC, specialmente se il tumore primitivo è ipervascolare. Se ci sono dubbi, classificare la lesione come LR-M piuttosto che LR-5, considerare ulteriore tecnica d’immagine e discussione multidisciplinare. Perchè i criteri LI-RADS non possono essere applicati alla TC o RM monofasiche? La caratterizzazione di tutti i principali criteri radiologici è possibile solo attraverso l’esecuzione di indagini radiologiche multifasiche. Vedi pag. 12 per le raccomandazioni tecniche LI-RADS. Come devo interpretare e refertare i reperti alla TC o RM monofasiche nei pazienti a rischio? Fornisci la migliore diagnosi o diagnosi differenziali. Consiglia la TC o RM multifasica se la classificazione LI-RADS può aiutare la gestione del paziente. Perchè non posso assegnare una categoria LI-RADS ad una lesione maligna conferma istologica e ad una lesione benigna non epatocellulare conferma istologica? I LI-RADS sono stati concepiti per rendere più chiaro il messaggio. Assegnando una categoria LIRADS ad una lesione con diagnosi istologica (per la quale c’è certezza diagnostica) si può causare confusione, specialmente per le categorie LI-RADS che pongono qualche incertezza (es. : LR-2, LR 3, LR-4 o LR-M). Posso assegnare una categoria LI-RADS ad una lesione benigna di origine epatocellulare conferma istologica (es. : nodulo rigenerativo o displastico)? Queste sono eccezioni alla regola precedente Per noduli rigenerativi o displastici conferma 26

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Diagnosi Come determino un reperto non caratterizzabile (LR-NC)? Un reperto è considerato non classificabile se non può essere correttamente valutato a causa della mancanza o della scarsa qualità di una o più fasi, impedendo così la valutazione di una o più caratteristiche. Di conseguenza, le categorie possibili variano da quelle in cui il cancro è improbabile (LR-1 or LR-2) a quelle in cui il cancro è probabile (LR-4, LR-5, LR-M). Non assegnare la classe LRNC se le caratteristiche radiologiche sono inusuali o in caso di difficoltà a riconoscere dei criteri ancillari. Come categorizzo un reperto LR-1 o LR-2? Uutilizza la tua conoscenze ed esperienza per classificare un reperto come sicuramente benigno (100% di certezza di benignità) o probabilmente benigno (verosimilmente, ma non certo al 100%). Vedi pag. 24 e il manuale (in sospeso). Qual è la differenza tra LR-5 e LR-M? LR-M esclude la probabilità di HCC? LR-5 è indicativo di HCC al 100%. LR-M è indicativo con elevata certezza di malignità ma non è specifico di HCC. LR-M non esclude la probabilità di HCC. LR-M include la diagnosi differenziale tra HCC con caratteristiche radiologjche non specifiche, il colangiocarcinoma ed altri tumori maligni. Come posso classificare un’invasione vascolare? LR-TIV, indipendentemente dall’eziologia. Vedi pag. 19 per la guida alla refertazione. Come devo classificare una massa con aspetto infiltrante che non soddisfa i criteri per LRTIV o LR-5? LR-M. Questi criteri suggeriscono malignità ma non sono diagnostici per HCC: Vedi pag. 20. Perchè i LI-RADS non hanno una categoria per gli HCC conferma istologica come i BIRADS 6? La biopsia gioca un ruolo meno importante nel workup e management dell’HCC nei pazienti a rischio rispetto a quello che fa nei pazienti con tumore della mammella. Comunque, questa categoria potrebbe essere utile in alcune situazioni e una categoria istologica è prevista per i prossimi LIRADS ceh verranno aggiornati nel 2020 o 2021. Perchè non possono essere utilizzati criteri ancillari per passare alla classe LR-5? I criteri ancillari aumentano la confidenza diagnostica e modificano la probabilità di malignità. I criteri ancillari non hanno però sufficiente specificità per HCC da permettere di passare alla classe LR-5. Perchè i LI-RADS hanno reso opzionali i criteri ancillari nella v 2017? Questa modifica è stata apportata per incoraggiare più radiologi ad adottare i LI-RADS riducendo la loro complessità. Appena si acquisirà sufficiente esperienza con i criteri LI-RADS si potranno utilizzare anche i criteri ancillari per migliorarne le prestazioni. Perchè i LI-RADS sostituiscono LR-5 V con LR-TIV? Dal momento che i tumori maligni non HCC (es. : ICC, H-Ch. C) possono anch’essi produrre invasione vascolare, classificare come LR-5 V (sicuramente HCC con invasione vascolare) tutti i reperti con invasione vascolare non è corretto. Perchè le regole di spareggio fanno scegliere la categoria con minore certezza? Queste regole fanno sì che le categorie LR-5 e LR-1 mantengano il 100% di certezza. Per esempio, se c’è il dubbio che un reperto sia certamente o probabilmente benigno, allora non può essere considerato sicuramente benigno. La regola permette anche di raggiungere il 100% di valore predittivo positivo per HCC. Se c’è incertezza tra LR-5 e LR-4 o LR-5 e LR-M, le regole dello 27

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Risposta al trattamento Che cos’è un reperto trattato? E’ un reperto corrispondente ad una lesione trattata mediante terapia locoregionale come radiofrequenza, alcolizzazione, crioablazione, ablazione con microonde, embolizzazione, chemioembolizzazione e chemioembolizzazione con DC-beads, radioembolizzazione, radioterapia esterna. Vedi Manuale (in sospeso). Che cosa dire dei reperti trattati mediante terapia sistemica? La v 2017 dei LI-RADS non si occupa della risposta alla terapia sistemica. Come determino non valutabile un reperto trattato? Se la risposta al trattamento non può essere valutata a causa di una diagnostica per immagini inappropriata o una qualità delle immagini inadeguata deve essere assegnata una categoria LR-TR non valutabile. Non assegnare una categoria di risposta non valutabile se la qualità delle immagini è adeguata, anche se le immagini sono difficili da caratterizzare o da interpretare. Vedi manuale (in sospeso). Cosa fare se la fase arteriosa non è adeguata ma la fase portale-venosa mostra un enhancement equivoco? Si tratta di categoria non valutabile o equivoca? Assegnare una categoria di risposta LR-TR Equivoca. Prendere in considerazione di ripetere una tecnica di immagine e, se necessario per assicurare una fase arteriosa adeguata, prendere in considerazione una tecnica d’immagine diversa. Qual è l’intervallo di follow-up ottimale per valutare la risposta al trattamento? L’intervallo di follow-up ottimale dipende dal tipo di trattamento e dalle linee guida deli singloli centri. . In generale, il follow-up mediante TC o RM è raccomandato ogni 3 mesi, anche se un esame ad 1 mese può essere utile dopo alcuni tipi di trattamento. Vedi pag. 13. Ci sono dei rischi nel valutare la risposta troppo precocemente dopo il trattamento? Le modifiche della perfusione tissutale correlate al trattamento possono simulare o oscurare un enhancement tumorale causando potenzialmente falsi positivi o falsi negativi nella valutazione della persistenza di attività del tumore. Cosa devo fare se sono in dubbio tra persistenza di attività del tumore vs fisiologiche variazioni post-trattamento? Categorizza il reperto come LR-TR equivoco se la qualità dell’immagine è adeguata. Vedi pag. 10. LR-TR senza persistenza di malattia esclude una persistenza microscopica? No. LR-TR senza persistenza di malattia corrisponde ad assenza di grossolana attività tumorale, piccoli foci di tumore attivo però non possono essere esclusi mediante una diagnostica non invasiva. Come posso distinguere un residuo tumorale da un nuovo tumore vicino ad un reperto trattato? Il residuo tumorale si localizza all’interno o in prossimità del margine di un reperto trattato, a differenza di un nuovo tumore adiacente ad esso. Non esiste una distanza soglia dal margine tumorale in grado di distinguere affidabilmente una nuova lesione da una recidiva. Bisogna utilizzare il proprio giudizio per distinguerle ed applicare l’algoritmo LI-RADS corrispondente (TC/RM risposta al trattamento o diagnostico). Per esempio: un nuovo reperto che abbia caratteristiche di origine de novo (es. : nodulo in nodulo) e/o che escluda metastasi dalla lesione trattata (es. : differenze nella presenza di grasso. Ferro o di intensità in fase epatobiliare) deve essere considerato un nuovo tumore. Come valuto la risposta al trattamento di un’invasione vascolare? 28

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Tecnica Quale modalità di mezzo di contrasto raccomandano i LI-RADS per la diagnosi o la stadiazione? I LI-RADS forniscono la guida tecnica per ciascun esame (TC, RM) e mezzo di contrasto (extracellulari, epatobiliari) ma non raccomandano nessun esame diagnostico o mezzo di contrasto particolare. La scelta dell’esame diagnostico e del mezzo di contrasto dipende dalle preferenze del paziente, dalla tolleranze e sicurezza; da numerosi fattori che possono influenzare la qualità dell’immagine o la fattibilità dell’esame; dai precedenti esami diagnostici e mezzi di contrasto; dalla competenza della struttura e dei radiologi. I radiologi devono selezionare l’esame diagnostico e il mezzo di contrasto più adatto per ogni singolo paziente. Che cosa dire del monitoraggio della risposta al trattamento? Sebbene la risposta al trattamento possa essere monitorata con TC o con RM e con qualsiasi mezzo di contrasto: • La RM è preferibile rispetto alla TC dopo TACE con Lipiodol (LUF) perchè l’elevata densità del LUF all’interno dell’area embolizzata può oscurare l’enhancement causato da residuo tumorale o recidiva di malattia • La RM con agenti extracellulari è preferibile rispetto alla RM con gadoxetato che può dare artefatti da movimento nella fase arteriosa. La RM con gadoxetato può essere appropriata nei pazienti in cui la ricerca di nuove lesioni è più importante rispetto alla valutazione della risposta al trattamento. I radiologi dovrebbero personalizzare l’esame diagnostico e il mezzo di contrasto a seconda del paziente e del tipo di trattamento. Posso utilizzare i LI-RADS per la caratterizzazione e refertazione anche in assenza di alcune fasi? Sì. Si può assegnare una categoria LI-RADS specifica anche se l’esame risulta incompleto. Per esempio, un esame con solo una fase arteriosa e tardiva permette la caratterizzazione in LR-5 se queste immagini riportano una massa con APHE, “washout” e “capsula”. Le raccomandazioni LI-RADS sono coerenti con OPTN? Sì. Vedi pag. 14 per una breve rassegna di OPTN e LI-RADS. Vedi il Manuale (in sospeso) per una rassegna in dettaglio. Perchè i LI-RADS utilizzano la “fase transizionale” piuttosto che la “fase tardiva” per il gadoxetato? Per la RM con gadoxetato, nei 2 -5 minuti dopo l’iniezione c’è una transizione del mezzo di contrasto dallo spazio extracellulare (es. : fase portale-venosa) a quello intracellulare (es. : fase epatobiliare), definita per questo “fase transizionale”. In questa fase, sia la componente intracellulare che quella extracellulare contribuiscono all’enhancement del parenchima. Nella fase tardiva con mezzi di contrasto convenzionali l’enhancement dipende invece dalla loro distribuzione extracellulare. Perchè si preferisce la fase arteriosa tardiva? E qual è il ritardo ottimale nell’acquisizione? La fase arteriosa tardiva è nettamente preferita perchè generalmente l’enhancement dell’HCC è maggiore in questa fase piuttosto che in quella precoce ed alcuni HCC mostrano enhancement solo in questa fase. Il ritardo ottimale nell’acquisizione dipende dall’esame diagnostico (TC/RM); dal tipo, volume e concentrazione del mezzo di contrasto; dal tasso di iniezione del contrasto; dalla modalità di iniezione (fisso/in bolo/con il timer); dal numero e dal tempo della costante di distribuzione spaziale della fase arteriosa (per RM). Vedi il manuale (in sospeso). Come posso giudicare adeguato l’enhancement del fegato durante la fase epatobiliare (HBP)? L’enhancement del fegato durante la fase epatobiliare è adeguato se il parenchima è 29 inequivocabilmente iperintenso rispetto ai vasi epatici. Altrimenti è subottimale. I meccanismi alla

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Gestione del Paziente LI-RADS indica che può essere appropriato consigliare una metodica di imaging alternativa a distanza ≤ 6 mesi in assenza di riscontri patologici. Qual è il razionale di tale raccomandazione? Nella maggior parte dei casi in cui non emergano riscontri patologici alla TC/RM multifasica è sufficiente riproporre il protocollo di sorveglianza routinario a 6 mesi. Possono comunque esserci casi in cui il test di screening precedente è fortemente positivo (ad esempio un nodulo solido all’ecografia o valori molto elevati di AFP) e può essere necessario ricorrere ad una metodica di imaging alternativa, al fine di escludere un falso negative della TC/RM iniziale. In tali casi è corretto indicare, secondo il proprio giudizio, l’esame di imaging alternativo più appropriato e/o l’intervallo temporale adeguato. Se disponibile, la CEUS può essere molto utile in casi in cui l’ecografia di screening abbia identificato un nodulo solido non visualizzato al follow-up diagnostico con TC/RM multifasica. La gestione ottimale del paziente deriva direttamente dalla categoria LI-RADS? No, la gestione ottimale è determinata dalla combinazione della categoria LI-RADS e dalla valutazione clinica, che integri le preferenze del paziente, eventuali comorbidità, l’entità della disfunzione epatica, la possibile immissione in lista trapianto, la condizione socio-economica, la copertura assicurativa sanitaria e la disponibilità di un appuntamento. Poichè non sempre i radiologi possono essere a conoscenza di tutti gli aspetti rilevanti, in casi difficili è utile ricorrere a valutazioni multidisciplinari per un gestione ottimale, basata su dati di consenso. Se ritengo che sia necessario un approfondimento bioptico per una definitiva diagnosi di natura dovrei raccomandarlo? E’ ragionevole affermare che potrebbe essere necessaria una biopsia per definire la diagnosi, ma esistono aspetti diversi dall’imaging che possono condizionare la scelta di eseguire una biopsia, come già detto sopra. Oltre alla conferma diagnostica potrebbe essere preferibile non costringere il clinico ad intraprendere procedure invasive, poichè possono esserci motivi non noti al radiologo che rendano sconsigliabile l’approccio bioptico in alcuni pazienti. Io temo che I miei colleghi clinici non gradiscano che consigli nei miei referti l’intervallo temporale per successivi follow-up diagnostici. E’ necessario che io includa tale indicazione nei miei referti? No, gli intervalli di follow-up elencati a pag 13 sono standardizzati, ma il radiologo può consigliare o meno nel referto intervalli di follow-up specifici. Perchè la gestione delle lesioni definite LR-3 è diversa negli algoritmi CEUS e TC/RM? Come dimostrato in due recenti studi 1, 2, la maggior parte delle osservazioni TC/RM di lesioni LR-3 sono alterazioni perfusionali di natura benigna o lesioni “indolenti”, che possono essere tenute tranquillamente sotto controllo senza la necessità di una consulenza mutlidisciplinare (ved. Il manuale in corso di pubblicazione). E’ meno chiara la storia naturale delle lesioni LR-3 identificate con CEUS, sebbene le evidenze indirette suggeriscano che tali osservazioni meritino attenta sorveglianza. Per definizione tutte le osservazioni CEUS sono visibili nelle immagini B-mode pre contrasto. In un fegato cirrotico i noduli identificabili all’esame ecografico hanno alta probabilità di essere HCC, a meno che le caratteristiche di enhancement siano diagnostiche di emangioma o altre lesioni benigne. A tale riguardo, in caso di elevata probabilità di HCC, un recente studio retrospettivo 3 ha dimostrato che il 60% (45/75) delle osservazioni CEUS LR-3 sono noduli di HCC (ved. Il Manuale CEUS). References 30

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Refertazione Quanti reperti dovrei refertare singolarmente? Usa le tue capacità di giudizio nel decidere quante lesioni refertare singolarmente, quante accorparne o quante descriverne utilizzando entrambi i sistemi di giudizio. Usa il metodo che definisca i reperti per te clinicamente più rilevanti e le tue impressioni nella modalità più chiara possibile. Cosa devo refertare se non riscontro alterazioni sospette? I reperti categorizzati LR-1 e LR-2 possono essere riportati insieme nella descrizione. Le conclusioni dovrebbero consistere in una semplice frase riassuntiva, quale “Nessuna osservazione LI-RADS sospetta per malignità”. Come dovrei refertare una lesione trattata? Referta l’attuale categoria di risposta e le attuali dimensioni del tessuto vitale, se fattibile. Inoltre, quando possibile, riporta tra parentesi la categoria LI-RADS pretrattamento (o la diagnosi patologica) e le dimensioni pre-trattamento. Ad esempio: • LR-TR non-vitale (pre-trattamento LR-5, 22 mm) • LR-TR Vitale 20 mm, (pre-trattamento LR-5, 32 mm) • LR-TR Equivoco 15 mm, (diagnosi patologica pretrattamento di HCC, 21 mm) Vi sono particolari considerazioni nella refertazione di pazienti con HCC candidati al trapianto? Un referto TC/RM standard secondo LI-RADS contiente le informazioni necessarie alla valutazione di pazienti con HCC candidati a trapianto: numero e dimensioni delle osservazioni LR-5, osservazioni LR-5 g e HCC definiti patologicamente, o le dimensioni del tessuto neoplastico vitale se sottoposti a trattamenti loco-regionali. Descrivi i criteri maggiori per ogni osservazione LR-5. Referta inoltre le osservazioni definite come LR-M e LR-TIV, poichè possono condizionare la valutazione pre-trapianto e l’immissione in lista trapianto. Le osservazioni LR-5 us dovrebbero essere comunque riportate, ma non contribuiscono allo staging secondo i criteri americani OPTN (Organ Procurement and Transplantation Network). Cosa dovrei refertare se una lesione è stata bioptizzata e definita patologicamente? Dipende dalla diagnosi anatomo-patologica: • Se maligna o benigna di origine non-epatocellulare (ad es. angioma): riporta la diagnosi patologica, gli aspetti di imaging clinicamente rilevanti e le variazioni rispetto ai precedenti: ad es. ”angioma dimostrato patologicamente, stabile nelle dimensioni e nelle caratteristiche di imaging rispetto ai precedenti”. • Se benigna di origine epatocellulare (ad es. nodulo rigenerativo o displastico): riporta la categoria LI-RADS della lesione e la diagnosi patologica, le caratteristiche all’imaging e le variazioni rispetto ai precedenti: ad es. “LR-4 con diagnosi istologica di nodulo displastico, presenta attualmente enhancement arterioso (APHE) ed aumento delle dimensioni da 12 a 16 mm. ” Se la diagnosi patologica è diversa dalla categoria LI-RADS? Indica nel referto che esiste una discordanza, fornendo la categoria LI-RADS e la diagnosi patologica. Spiega brevemente perchè c’è discordanza. Considera una valutazione multidisciplinare con una consensus review dell’stologia, dell’imaging e dei dati clinici per chiarire la discordanza Se non devo assegnare una categoria LI-RADS ai reperti definiti patologicamente perchè devo refertare le loro caratterstiche all’imaging e le variazioni rispetto ai precedenti? I radiologi dovrebbero continuare a caratterizzare secondo i criteri maggiori e criteri ancillari anche per le osservazioni bioptizzate, poichè le variazioni di tali reperti potrebbero essere clinicamente rilevanti. Ad esempio: “colangiocarcinoma definito patologicamente, con aumento delle dimensioni all’imaging, da 22 mm a 28 mm” oppure “HCC definito patologicamente, con riscontro all’imaging di 31

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Caratteristiche all’Imaging Esiste una soglia dimensionale minima per applicare iil concetto dell’enhancement arterioso (APHE), di “washout” e la presenza di una “capsula”? No. E’ sufficiente che la presenza di questi aspetti sia definita dal giudizio del Radiologo. Su che piano dovrei misurare le dimensioni della lesione? Al fine di ottenere la massima standardizzazione possibile, è meglio utilizzare il piano assiale. E’ possibile comunque misurare su piani diversi, laddove i margini siano meglio definiti e visualizzati. Tale piano sarà utilizzato anche nei successivi esami per la valutazione delle variazioni dimensionali e dell’eventuale crescita. La presenza di “washout” è applicabile solo in caso di lesioni con enhancement arterioso (APHE)? No, il washout può essere riscontrabile anche in assenza di enhancement arterioso (APHE), purchè vi sia un qualche tipo di enhancement. Il washout e l’enhancement arterioso (APHE) devono essere presenti in ogni parte della lesione? No, l’enhancement arterioso (APHE) ed il washout non devono per forza coincidere nella stessa sede della lesione. Ad esempio: una lesione di 25 mm con enhancement arterioso (APHE) in una sua porzione e “washout” in un’altra porzione può essere categorizzata come LR-5. Perchè il “washout” deve essere confrontato con le caratteristiche del parenchima epatico piuttosto che con la lesione stessa? Storicamente in letteratura il criterio "washout" è stato riferito all’enhancement del parenchima epatico di base piuttosto che alle caratteristiche particolari del nodulo. Finchè non si dimostrerà la superiorità di un altro genere di riferimento verrà conservato tale criterio. Perchè non posso valutare il “washout” nella fase transizionale in esami RM con Acido Gadoxetico? In RM con acido gadoxetico il washout in fase portale è piuttosto specifico per HCC. Di contro, l’ipointensità in fase transizionale manca di specificità, poichè la captazione di mdc da parte del parenchima epatico di base rende ipointensi anche i colangiocarcinomi ed altre lesioni maligne non. HCC. Si veda il manuale (in corso di pubblicazione). Perchè la versione 2017 (v 2017) fa differenza tra caratteristiche depongono, in generale, per la malignità e caratteristiche depongono in particolare per HCC? La maggior parte delle caratteristiche depongono per la natura maligna sono aspecifiche, potendosi riscontrare sia nei noduli di HCC che in lesioni non-HCC. Ciononostante, altre caratteristiche sono specifiche per HCC e possono essere di aiuto nella diagnosi differenziale tra HCC e non-HCC. Se l’enhancement epatico nella fase epatobiliare (HBP) è sub-ottimale, come posso caratterizzare le lesioni che appaiono ipointense, isointense, o iperintense rispetto al parenchima epatico? Se una lesione appare ipointensa in fase epatobiliare può essere comunque caratterizzata come tale, nonostante l’enhancement parenchimale sub-ottimale. Di contro, se un reperto appare isointenso o iperintenso in tale fase, la caratterizzazione dell’intensità di segnale in fase epatobiliare può essere inaffidabile. I criteri LR-M sembrano in gran parte applicabili al colangiocarcinoma intraepatico (ICC). Come caratterizzare altre lesioni maligne diverse dall’HCC? 32

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Abbreviations Abbreviazioni AASLD American Association for the Study of Liver Diseases ACR American College of Radiology ADC Coefficiente di Diffusione Apparente (Apparent diffusion coefficient) AF Caratteristiche Ancillari (Ancillary features) AFP Alfa-fetoproteina AP Fase arteriosa (Arterial phase) APHE Iper-enhancement arterioso (Arterial phase hyperenhancement) CEUS Ecografia con mdc (Contrast-enhanced ultrasound) DP Fase tardiva (Delayed phase) DWI Diffusion-weighted imaging ECA Mezzi di contrasto (Mdc) extracellulari ECP Fase extracellulare (Extracellular phase) FNH Iperplasia nodulare focale (Focal nodular hyperplasia) HBA Mezzi di contrasto (Mdc) epatobiliari (Hepatobiliary agent) HBP Fase epatobiliare (Hepatobiliary phase) HCA Adenoma epatico (Hepatocellular adenoma) HCC Epatocarcinoma (Hepatocellular carcinoma) H-Ch. C Epato-colangiocarcinoma (Hepatocholangiocarcinoma) ICC Colangiocarcinoma intraepatico (Intrahepatic cholangiocarcinoma) MDD Discussione multidisciplinare (Multidisciplinary discussion) OPTN Rete trapiantologica americana (Organ Procurement and Transplantation Network) PVP Fase venosa portale (Portal venous phase) T 2 WI Imaging T 2 w (T 2 -weighted imaging) TACE Chemioembolizzazione arteriosa (Transcatheter arterial chemoembolization) TIV Estensione neoplastica intravascolare (Tumor in vein) TP Fase transizionale (Transitional phase) WO “Washout” o aspetto di washout 33