LIRADS v 2017 CTMRI Core Diagnostic Algorithm Treatment





















- Slides: 34

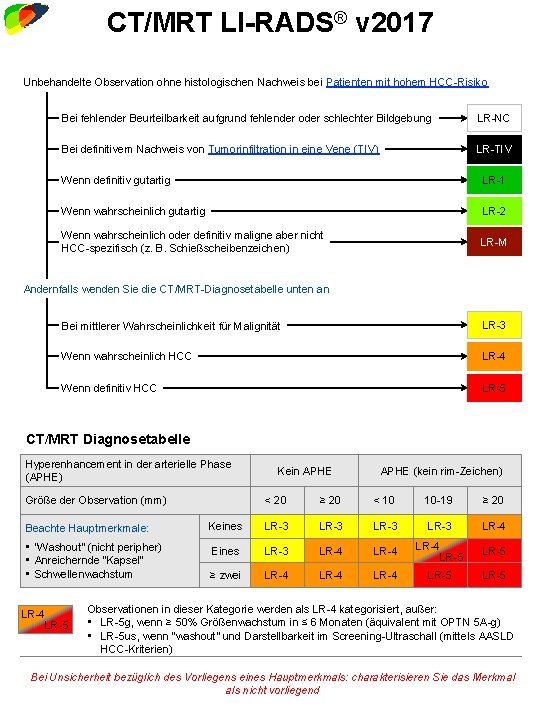
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed CT/MRT LI-RADS® v 2017 Unbehandelte Observation ohne histologischen Nachweis bei Patienten mit hohem HCC-Risiko Bei fehlender Beurteilbarkeit aufgrund fehlender oder schlechter Bildgebung LR-NC Bei definitivem Nachweis von Tumorinfiltration in eine Vene (TIV) LR-TIV Wenn definitiv gutartig LR-1 Wenn wahrscheinlich gutartig LR-2 Wenn wahrscheinlich oder definitiv maligne aber nicht HCC-spezifisch (z. B. Schießscheibenzeichen) LR-M Andernfalls wenden Sie die CT/MRT-Diagnosetabelle unten an Bei mittlerer Wahrscheinlichkeit für Malignität LR-3 Wenn wahrscheinlich HCC LR-4 Wenn definitiv HCC LR-5 CT/MRT Diagnosetabelle Hyperenhancement in der arterielle Phase (APHE) Größe der Observation (mm) Kein APHE (kein rim-Zeichen) < 20 ≥ 20 < 10 10 -19 ≥ 20 Beachte Hauptmerkmale: Keines LR-3 LR-4 • “Washout” (nicht peripher) • Anreichernde “Kapsel” • Schwellenwachstum Eines LR-3 LR-4 LR-5 ≥ zwei LR-4 LR-5 LR-4 LR-5 Observationen in dieser Kategorie werden als LR-4 kategorisiert, außer: • LR-5 g, wenn ≥ 50% Größenwachstum in ≤ 6 Monaten (äquivalent mit OPTN 5 A-g) • LR-5 us, wenn “washout” und Darstellbarkeit im Screening-Ultraschall (mittels AASLD HCC-Kriterien) Bei Unsicherheit bezüglich des Vorliegens eines Hauptmerkmals: charakterisieren Sie das Merkmal als nicht vorliegend

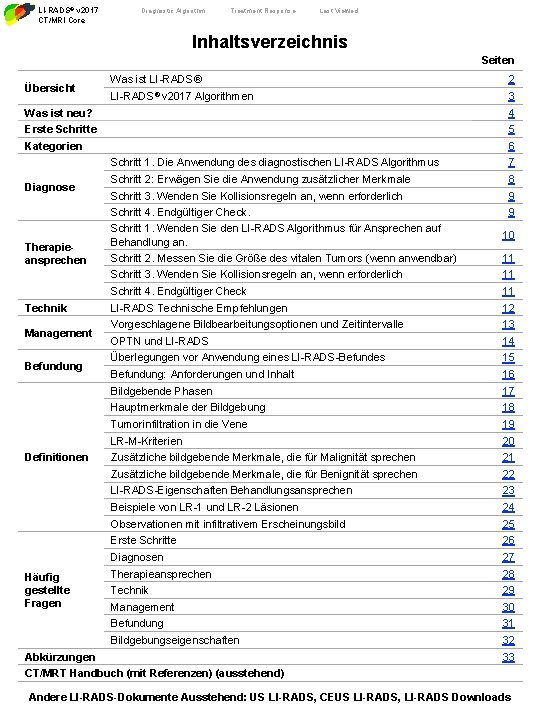
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Inhaltsverzeichnis Seiten Übersicht Was ist LI-RADS® 2 LI-RADS® v 2017 Algorithmen 3 Was ist neu? 4 Erste Schritte 5 Kategorien 6 Diagnose Therapieansprechen Technik Management Befundung Definitionen Häufig gestellte Fragen Schritt 1. Die Anwendung des diagnostischen LI-RADS Algorithmus 7 Schritt 2: Erwägen Sie die Anwendung zusätzlicher Merkmale 8 Schritt 3. Wenden Sie Kollisionsregeln an, wenn erforderlich 9 Schritt 4. Endgültiger Check. Schritt 1. Wenden Sie den LI-RADS Algorithmus für Ansprechen auf Behandlung an. Schritt 2. Messen Sie die Größe des vitalen Tumors (wenn anwendbar) 9 10 Schritt 3. Wenden Sie Kollisionsregeln an, wenn erforderlich 11 Schritt 4. Endgültiger Check 11 LI-RADS Technische Empfehlungen 12 Vorgeschlagene Bildbearbeitungsoptionen und Zeitintervalle 13 OPTN und LI-RADS 14 Überlegungen vor Anwendung eines LI-RADS-Befundes 15 Befundung: Anforderungen und Inhalt 16 Bildgebende Phasen 17 Hauptmerkmale der Bildgebung 18 Tumorinfiltration in die Vene 19 LR-M-Kriterien 20 Zusätzliche bildgebende Merkmale, die für Malignität sprechen 21 Zusätzliche bildgebende Merkmale, die für Benignität sprechen 22 LI-RADS-Eigenschaften Behandlungsansprechen 23 Beispiele von LR-1 und LR-2 Läsionen 24 Observationen mit infiltrativem Erscheinungsbild 25 Erste Schritte 26 Diagnosen 27 Therapieansprechen 28 Technik 29 Management 30 Befundung 31 Bildgebungseigenschaften 32 Abkürzungen 11 33 CT/MRT Handbuch (mit Referenzen) (ausstehend) Andere LI-RADS-Dokumente Ausstehend: US LI-RADS, CEUS LI-RADS, LI-RADS Downloads

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Überblick Was ist LI-RADS®? Das Liver Imaging Reporting And Data System (LI-RADS) ist: • Ein verständliches System zur Standardisierung der Erhebung, der Interpretation, der Befundung und der Datensammlung bei der Bildgebung der Leber • Ein dynamisches Dokument mit dem Ziel der Erweiterung und Verfeinerung bei Auftreten von neuen Fakten und Feedback von Anwendern • Erstellt zur Verbesserung der Kommunikation, Behandlung, Ausbildung und Forschung • Unterstützt und befürwortet vom American College of Radiology (ACR) • Entwickelt von einem multidisziplinären und internationalen Konsortium von diagnostischen und therapeutischen Radiologen, hepatobiliären Chirurgen, Hepatologen und Hepatopathologen • Einschließlich Wissenschaftlichern und Allgemeininternisten sowie Mitgliedern in Ausbildung LI-RADS kann angewendet werden von: • Radiologen in Ausbildung • Anderen medizinischen Berufsgruppen mit Bezug zu Patienten mit Leberkrankheiten • Wissenschaftlern 2

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Übersicht LI-RADS® v 2017 Algorithmen Ultraschall LI-RADS® v 2017 Zum HCC-Screening und zur Überwachung Mittels konventioneller Sonographie Bei Patienten mit Leberzirrhose und anderen Hochrisikopatienten US LI-RADS Core (ausstehend). CEUS LI-RADS® v 2017 Zur HCC-Diagnostik Mittels Kontrastmittel-Ultraschall (KMUS, contrast-enhanced ultrasound, CEUS) Bei Patienten mit Leberzirrhose und anderen Hochrisikopatienten CEUS LI-RADS Core (ausstehend). Zur HCC-Diagnostik und zum Staging CT/MRI LI-RADS® v 2017 Seite 7. Zur Beurteilung des Therapieansprechens Seite 10. Mittels CT, MRT mit extrazellulären Kontrastmittteln (extracellular agents, ECA), oder MRT mit hepatobiliären Kontrastmitteln (hepatobiliary agents, HBA) Bei Patienten mit Leberzirrhose und anderen Hochrisikopatienten einschließlich Transplantationskandidaten mit HCC Anmerkungen: • Multiphasen-CT oder MRT werden gelegentlich zur HCC-Überwachung angewendet, abhängig von regionalen Leitlinien, Institutsgepflogenheiten und anderen Faktoren. Weder verlangt LI-RADS nach diesen Anwendungen noch spricht sich LI-RADS dagegen aus, aber das System kann zur Interpretation und Befundung einer solchen Fragestellung angewendet werden. • Obwohl CEUS zur Beurteilung des Behandlungsansprechens geeignet ist, behandelt LI-RADS v 2017 diese Anwendung nicht. In der nächsten LI-RADS-Version wird darauf Bezug genommen werden. 3

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Was ist neu? Was ist neu bei LI-RADS® v 2017? Neue Algorithmen: • US Screening und Überwachung: US LI-RADS Core (ausstehend). • CEUS-Diagnose: CEUS LI-RADS Core (ausstehend). • Beurteilung des Behandlungsansprechens mittels CT/MRT. Seite 10. Neue oder revidierte Kategorien für CT/MRT LI-RADS: • LR-NC (neu). Seite 6. • LR-TIV (ehemals LR-5 V). Seite 6. Modifizierte Definition des Schwellenwachstums. Seite 18. Neue explizite Kriterien für LR-M. Seite 20. Update Algorithmus für CT/MRT LI-RADS. Seite 7. Neue Listenansicht (Weiterentwicklung). (ausstehend). Zusätzliche Merkmale sind nun optional und ihre Anwendung ist geklärt. Seite 8. Zusätzliche Merkmale die für Malignität sprechen: Darstellbarkeit im Ultraschall. Seite 21. Namensänderung eines zusätzlichen Merkmals: erkennbares rim-Zeichen nichtanreichernde Kapsel. Seite 21. Verbesserte schematische Diagramme, neue Zeit-Intensitäts-Kurven. Handbuch (ausstehend). Neue häufig gestellte Fragen (FAQs). Seiten 26 (Beginn), 27 (Diagnose), 28 (Behandlungsansprechen), 29 (Technik), 30 (Management), 31 (Befundung), 32 (Bildgebungseigenschaften). Konkretisiert: • Unterscheidung zwischen Hyperenhancement in der arteriellen Phase ohne rim-Zeichen (Hauptmerkmal eines HCC) und arterieller Mehranreicherung mit rim-Zeichen (Eigenschaft von LR-M). Seite 18. • Unterscheidung zwischen nicht-peripherem “washout” (Hauptmerkmal eines HCC) und peripherem “washout” (Merkmal von LR-M). Seite 18. • Unterscheidung zwischen anreichernder Kapsel (Hauptmerkmal eines HCC) und nichtanreichernder “Kapsel” (Zusatzmerkmal eines HCC). Seite 18. • Konkretisiert, dass Zusatzmerkmale für Malignität in einigen Fällen für Malignität im Allgemeinen und in anderen Fällen für HCC im Speziellen sprechen. Seite 21. • Konkretisiert, dass CT/MRT LI-RADS bei Transplantationskandidaten mit HCC angewendet werden kann. Seite 5. • Kategorisierung von Tumorinfiltration in die Vene und Malignität mit infiltrativem Erscheinungsbild. Seiten 19 & 25. Warum ist dieses Update notwendig? ? 4

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Erste Schritte CT/MRT LI-RADS® v 2017 Wenden Sie LI-RADS an bei Patienten mit hohem HCC-Risiko, nämlich: ✔ • Leberzirrhose ODER • Chronische Hepatitis B Virusinfektion ODER • Bekanntes HCC oder vormals HCCErkrankung Einschließlich erwachsener Lebertransplantationskandidaten und –empfänger Wenden Sie LI-RADS nicht an bei Patienten: ✘ • • Ohne o. g. Risikofaktoren < 18 Jahre Mit Zirrhose aufgrund kongenitaler hepatischer Fibrose Mit Zirrhose aufgrund von Gefäßerkrankungen wie Hereditäre Hämorrhagische Teleangiektasie, Budd-Chiari-Syndrom, chronischem Pfortaderverschluss, kardialer Stauung oder Nodulär Regenerativer Hyperplasie Wenden Sie Multiphasentechniken an: ✔ • CT oder MRT mit extrazellulären Kontrastmitteln (extracellular contrast agents, ECA) ODER • MRT mit hepatobiliären Kontrastmitteln (hepatobiliary contrast agents, HBA) Wenden Sie LI-RADS-Kategorien nicht für Observationen an: ✘ • welche histologisch nachgewiesen maligne sind ODER • welche histologisch nachgewiesen benigne sind, beispielsweise Hämangiome Beachten Sie Seite 31 für Hinweise zur Befundung histologisch gesicherter Läsionen. 5

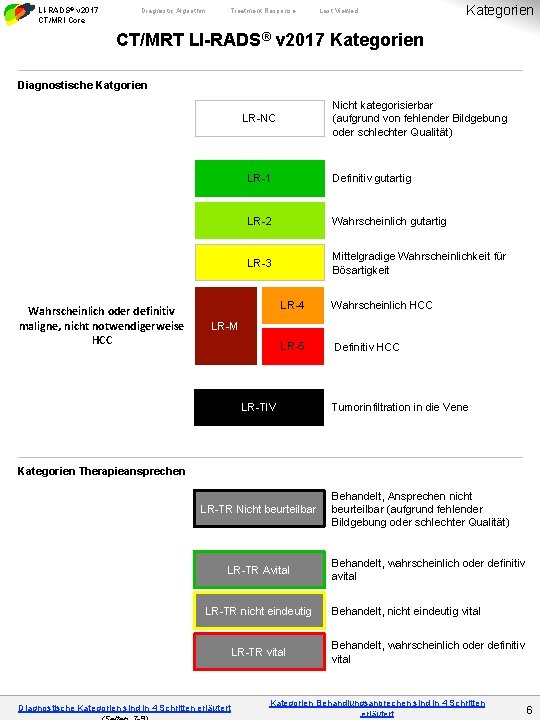
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Kategorien CT/MRT LI-RADS® v 2017 Kategorien Diagnostische Katgorien Nicht kategorisierbar (aufgrund von fehlender Bildgebung oder schlechter Qualität) LR-NC Wahrscheinlich oder definitiv maligne, nicht notwendigerweise HCC LR-1 Definitiv gutartig LR-2 Wahrscheinlich gutartig LR-3 Mittelgradige Wahrscheinlichkeit für Bösartigkeit LR-4 Wahrscheinlich HCC LR-5 Definitiv HCC LR-M LR-TIV Tumorinfiltration in die Vene Kategorien Therapieansprechen LR-TR Nicht beurteilbar LR-TR Avital LR-TR nicht eindeutig LR-TR vital Diagnostische Kategorien sind in 4 Schritten erläutert Behandelt, Ansprechen nicht beurteilbar (aufgrund fehlender Bildgebung oder schlechter Qualität) Behandelt, wahrscheinlich oder definitiv avital Behandelt, nicht eindeutig vital Behandelt, wahrscheinlich oder definitiv vital Kategorien Behandlungsanprechen sind in 4 Schritten erläutert 6

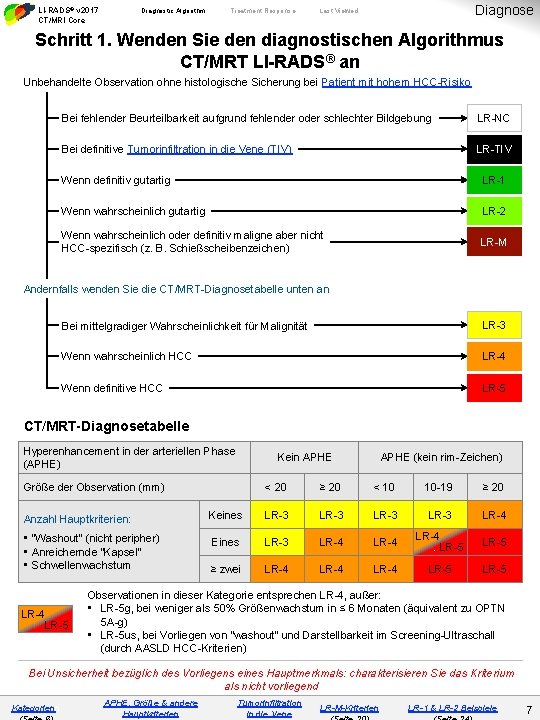
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Diagnose Last Viewed Schritt 1. Wenden Sie den diagnostischen Algorithmus CT/MRT LI-RADS® an Unbehandelte Observation ohne histologische Sicherung bei Patient mit hohem HCC-Risiko Bei fehlender Beurteilbarkeit aufgrund fehlender oder schlechter Bildgebung LR-NC Bei definitive Tumorinfiltration in die Vene (TIV) LR-TIV Wenn definitiv gutartig LR-1 Wenn wahrscheinlich gutartig LR-2 Wenn wahrscheinlich oder definitiv maligne aber nicht HCC-spezifisch (z. B. Schießscheibenzeichen) LR-M Andernfalls wenden Sie die CT/MRT-Diagnosetabelle unten an Bei mittelgradiger Wahrscheinlichkeit für Malignität LR-3 Wenn wahrscheinlich HCC LR-4 Wenn definitive HCC LR-5 CT/MRT-Diagnosetabelle Hyperenhancement in der arteriellen Phase (APHE) Kein APHE Größe der Observation (mm) APHE (kein rim-Zeichen) < 20 ≥ 20 < 10 10 -19 ≥ 20 Anzahl Hauptkriterien: Keines LR-3 LR-4 • “Washout” (nicht peripher) • Anreichernde “Kapsel” • Schwellenwachstum Eines LR-3 LR-4 LR-5 ≥ zwei LR-4 LR-5 LR-4 LR-5 Observationen in dieser Kategorie entsprechen LR-4, außer: • LR-5 g, bei weniger als 50% Größenwachstum in ≤ 6 Monaten (äquivalent zu OPTN 5 A-g) • LR-5 us, bei Vorliegen von “washout” und Darstellbarkeit im Screening-Ultraschall (durch AASLD HCC-Kriterien) Bei Unsicherheit bezüglich des Vorliegens eines Hauptmerkmals: charakterisieren Sie das Kriterium als nicht vorliegend Kategorienn APHE, Größe & andere Hauptkriterien Tumorinfiltration in die Vene LR-M-Kriterien LR-1 & LR-2 Beispiele 7

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Diagnose Last Viewed Schritt 2. Optional: Anwendung zusätzlicher Merkmale (ancilliary features, AFs) Zusätzliche Merkmale können von Radiologen angewendet werden zur: Verbesserten Detektion, Erhöhung der Zuverlässigkeit oder Kategorienanpassung. Wenden Sie zusätzliche Merkmale zur Kategorienanpassung (upgrading, downgrading wie folgt an): Ein oder mehrere zusätzliche Merkmale, die für Malignität sprechen: upgrading von 1 Kategorie bis LR-4 (die Abwesenheit dieser zusätzlichen Merkmale soll nicht zum Downgrading führen) LR-1 LR-2 LR-3 LR-4 LR-5 Ein oder mehrere zusätzliche Merkmale, die für Benignität sprechen: downgrading um eine Kategorie (die Abwesenheit dieser zusätzlichen Merkmale soll nicht zum Upgrading führen). Bei Vorliegen widersprüchlicher Zusatzmerkmale (z. B. ein oder mehrere Merkmale, die für Bösartigkeit sprechen und ein oder mehrere Merkmale, die für Gutartigkeit sprechen): Keine Anpassung der Kategorie Zusätzliche Merkmale können nicht zum Upgrading nach LR-5 genutzt werden. Zusatzmerkmale, die für Bösartigkeit sprechen Für Bösartigkeit im Allgemeinen, nicht HCC im Besonderen • Darstellbarkeit im Ultraschall als begrenzter Knoten • Signifikantes Wachstum • Begrenzte Diffusion • Leichte bis mittelmäßige Hyperintensität • Corona-Anreicherung • Fettarmut in solidem Knoten • Fehlender Eisennachweis in solidem Knoten • Hypointensität in Transitionalphase • Hypointensität in hepatobiliärer Phase Zusatzmerkmale, die für Gutartigkeit sprechen • • • Größenstabilität > 2 Jahre Größenreduktion Simultane Anreicherung zu den Blutgefäßen Nicht gestörte Blutgefäße Höheres Eisensignal in der Läsion als in der Leber • Betonte Hyperintensität in T 2 • Isointensität in der hepatobiliären Phase Für HCC im Besonderen • Nichtanreichernde “Kapsel” • Knoten im Knoten • Mosaik-Architektur • Blutprodukte im Knoten • Vermehrter Fettnachweis im Knoten hinausgehende Definition der Bildgebungsphasen Bei (Seite 17) Definition zusätzlicher Merkmale die für Unklarheit gelten AF-Merkmale präsent. sprechen (Seite 22) für Bösartigkeit sprechen (Seite 21) als nicht Gutartigkeit 8

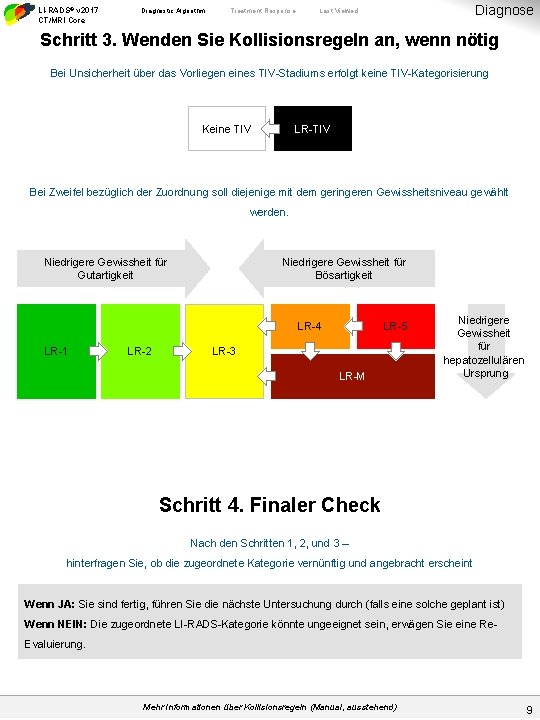
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Diagnose Last Viewed Schritt 3. Wenden Sie Kollisionsregeln an, wenn nötig Bei Unsicherheit über das Vorliegen eines TIV-Stadiums erfolgt keine TIV-Kategorisierung Keine TIV LR-TIV Bei Zweifel bezüglich der Zuordnung soll diejenige mit dem geringeren Gewissheitsniveau gewählt werden. Niedrigere Gewissheit für Gutartigkeit Niedrigere Gewissheit für Bösartigkeit LR-4 LR-1 LR-2 LR-5 LR-3 LR-M Niedrigere Gewissheit für hepatozellulären Ursprung Schritt 4. Finaler Check Nach den Schritten 1, 2, und 3 – hinterfragen Sie, ob die zugeordnete Kategorie vernünftig und angebracht erscheint Wenn JA: Sie sind fertig, führen Sie die nächste Untersuchung durch (falls eine solche geplant ist) Wenn NEIN: Die zugeordnete LI-RADS-Kategorie könnte ungeeignet sein, erwägen Sie eine Re. Evaluierung. Mehr Informationen über Kollisionsregeln (Manual, ausstehend) 9

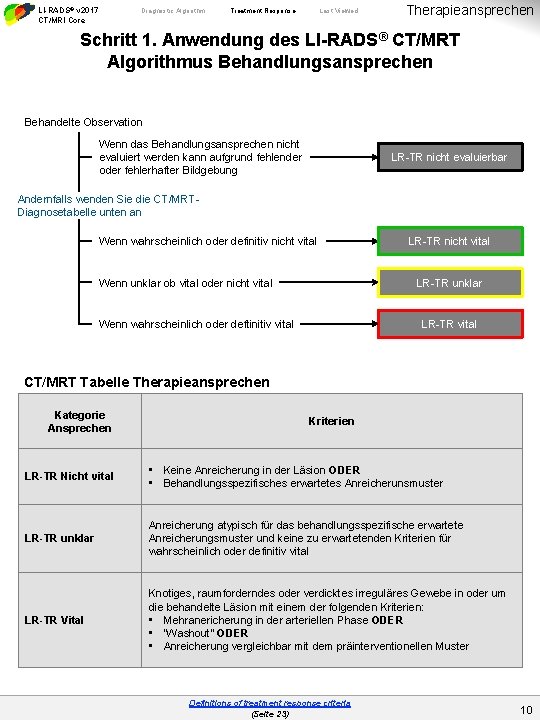
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Therapieansprechen Schritt 1. Anwendung des LI-RADS® CT/MRT Algorithmus Behandlungsansprechen Behandelte Observation Wenn das Behandlungsansprechen nicht evaluiert werden kann aufgrund fehlender oder fehlerhafter Bildgebung LR-TR nicht evaluierbar Andernfalls wenden Sie die CT/MRTDiagnosetabelle unten an Wenn wahrscheinlich oder definitiv nicht vital Wenn unklar ob vital oder nicht vital LR-TR unklar Wenn wahrscheinlich oder deftinitiv vital LR-TR vital CT/MRT Tabelle Therapieansprechen Kategorie Ansprechen Kriterien LR-TR Nicht vital • Keine Anreicherung in der Läsion ODER • Behandlungsspezifisches erwartetes Anreicherunsmuster LR-TR unklar Anreicherung atypisch für das behandlungsspezifische erwartete Anreicherungsmuster und keine zu erwartetenden Kriterien für wahrscheinlich oder definitiv vital LR-TR Vital Knotiges, raumforderndes oder verdicktes irreguläres Gewebe in oder um die behandelte Läsion mit einem der folgenden Kriterien: • Mehranericherung in der arteriellen Phase ODER • “Washout” ODER • Anreicherung vergleichbar mit dem präinterventionellen Muster Definitions of treatment response criteria (Seite 23) 10

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Therapieansprechen Schritt 2. Messbare vitale Tumorgröße Wie dicker irregulärer vitaler Tumor gemessen wird Nichtanreichern de Region Anreichernde Region Wie nodulärer vitaler Tumor gemessen wird Nichtanreichernd e Region Größe des unklar, wahrscheinlich oder definitiv vitalen Tumors Längste kontinuierliche Dimension durch die anreichernde Region der behandelten Läsion. Größte anreichernde Region Schritt 3. Anwendung der Kollisionsregeln wenn nötig Bei Unsicherheit zwischen zwei Kategorien wählen Sie diejenige, welche die geringere Gewissheit beinhaltet, wie unten dargestellt. Niedrigere Gewissheit für Avitalität LR-TR Avitalität Niedrigere Gewissheit für Vitalität LR-TR unklar LR-TR Vital Schritt 4. Finaler Check Nach den Schritten 1, 2, und 3 Hinterfragen Sie, ob die zugeordnete Kategorie vernünftig und angebracht erscheint Wenn JA: Sie sind fertig, führen Sie die nächste Untersuchung durch (falls eine solche geplant ist) Wenn NEIN: Die zugeordnete LI-RADS-Kategorie könnte ungeeignet sein, erwägen Sie eine Re. Evaluierung. 11

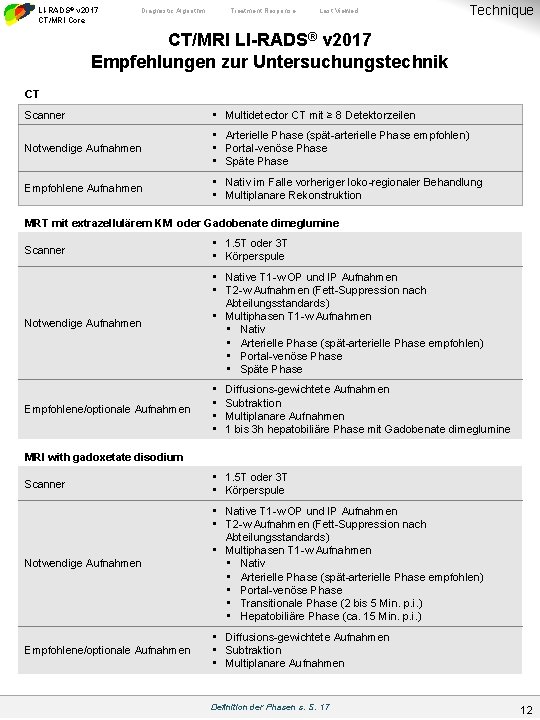
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Technique CT/MRI LI-RADS® v 2017 Empfehlungen zur Untersuchungstechnik CT Scanner • Multidetector CT mit ≥ 8 Detektorzeilen Notwendige Aufnahmen • Arterielle Phase (spät-arterielle Phase empfohlen) • Portal-venöse Phase • Späte Phase Empfohlene Aufnahmen • Nativ im Falle vorheriger loko-regionaler Behandlung • Multiplanare Rekonstruktion MRT mit extrazellulärem KM oder Gadobenate dimeglumine Scanner • 1. 5 T oder 3 T • Körperspule Notwendige Aufnahmen • Native T 1 -w OP und IP Aufnahmen • T 2 -w Aufnahmen (Fett-Suppression nach Abteilungsstandards) • Multiphasen T 1 -w Aufnahmen • Nativ • Arterielle Phase (spät-arterielle Phase empfohlen) • Portal-venöse Phase • Späte Phase Empfohlene/optionale Aufnahmen • • Diffusions-gewichtete Aufnahmen Subtraktion Multiplanare Aufnahmen 1 bis 3 h hepatobiliäre Phase mit Gadobenate dimeglumine MRI with gadoxetate disodium Scanner • 1. 5 T oder 3 T • Körperspule Notwendige Aufnahmen • Native T 1 -w OP und IP Aufnahmen • T 2 -w Aufnahmen (Fett-Suppression nach Abteilungsstandards) • Multiphasen T 1 -w Aufnahmen • Nativ • Arterielle Phase (spät-arterielle Phase empfohlen) • Portal-venöse Phase • Transitionale Phase (2 bis 5 Min. p. i. ) • Hepatobiliäre Phase (ca. 15 Min. p. i. ) Empfohlene/optionale Aufnahmen • Diffusions-gewichtete Aufnahmen • Subtraktion • Multiplanare Aufnahmen Definition der Phasen s. S. 17 12

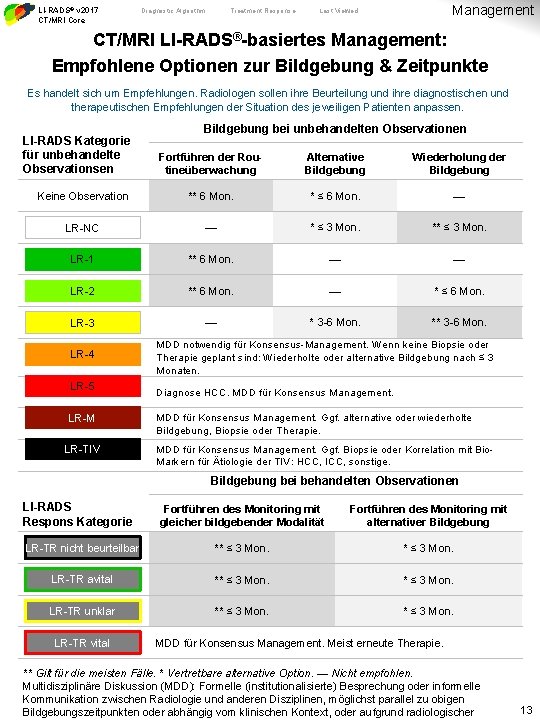
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Management Last Viewed CT/MRI LI-RADS®-basiertes Management: Empfohlene Optionen zur Bildgebung & Zeitpunkte Es handelt sich um Empfehlungen. Radiologen sollen ihre Beurteilung und ihre diagnostischen und therapeutischen Empfehlungen der Situation des jeweiligen Patienten anpassen. LI-RADS Kategorie für unbehandelte Observationsen Bildgebung bei unbehandelten Observationen Fortführen der Routineüberwachung Alternative Bildgebung Wiederholung der Bildgebung Keine Observation ** 6 Mon. * ≤ 6 Mon. — LR-NC — * ≤ 3 Mon. ** ≤ 3 Mon. LR-1 ** 6 Mon. — — LR-2 ** 6 Mon. — * ≤ 6 Mon. LR-3 — * 3 -6 Mon. ** 3 -6 Mon. LR-4 LR-5 LR-M LR-TIV MDD notwendig für Konsensus-Management. Wenn keine Biopsie oder Therapie geplant sind: Wiederholte oder alternative Bildgebung nach ≤ 3 Monaten. Diagnose HCC. MDD für Konsensus Management. Ggf. alternative oder wiederholte Bildgebung, Biopsie oder Therapie. MDD für Konsensus Management. Ggf. Biopsie oder Korrelation mit Bio. Markern für Ätiologie der TIV: HCC, ICC, sonstige. Bildgebung bei behandelten Observationen LI-RADS Respons Kategorie Fortführen des Monitoring mit gleicher bildgebender Modalität Fortführen des Monitoring mit alternativer Bildgebung LR-TR nicht beurteilbar ** ≤ 3 Mon. LR-TR avital ** ≤ 3 Mon. LR-TR unklar ** ≤ 3 Mon. LR-TR vital MDD für Konsensus Management. Meist erneute Therapie. ** Gilt für die meisten Fälle. * Vertretbare alternative Option. — Nicht empfohlen. Multidisziplinäre Diskussion (MDD): Formelle (institutionalisierte) Besprechung oder informelle Kommunikation zwischen Radiologie und anderen Disziplinen, möglichst parallel zu obigen Bildgebungszeitpunkten oder abhängig vom klinischen Kontext, oder aufgrund radiologischer 13

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Management Last Viewed OPTN und LI-RADS® • Das OPTN (Organ procurement and transplantation network) System legt für Kandidaten mit HCC zur Lebertransplantation Ausnahmeregeln fest. • CT/MRI LI-RADS kann für Lebertransplantationskandidaten angewendet werden, die LI-RADS Kriterien erfüllen (s. S. 5). • Grundlegende Informationen bzgl. LI-RADS und OPTN sind im Folgenden dargestellt: Bildgebung Die technischen Erfordernisse für OPTN sind nahezu identisch zu LI-RADS, wobei LIRADS zusätzlich Empfehlung zur Verwendung von Gadoxetate disodium gibt. Befundung Observationen bezogen auf OPTN staging (z. B. LR-5, LR-5 g, Histologisch gesichtertes HCC) sollten mit folgenden Angaben berichtet werden: • Größe oder Größe des vitalen Tumors im Behandlungsfall. • Hauptkriterien die für die Kategorisierung verwendet wurden. Auch wenn nicht den OPTN 5 A oder 5 B Kriterien entsprechend: • LR-M und LR-TIV sollten angegeben werden, da u. U. das Workup vor Transplantation und/oder die Transplantationseignung beeinflusst wird. • LR-4 und LR-5 us Observationen sollten angegeben werden, da sie mit hoher Wahrscheinlichkeit das Vorhandensein eines HCC darstellen und das Vorliegen eines multifokalen HCC nahelegen. Caveats Unterschied zwischen OPTN und LI-RADS Definitionen für Schwellenwachstum OPTN • > 50% Größenzunahme in < 6 Mon. LI-RADS Größenzunahme einer Raumforderung um minimal 5 mm UND: • > 50% Größenzunahme in < 6 Mon. ODER • ≥ 100% Größenzunahme in > 6 Mon. ODER • Bisher unerkannt in CT oder MRT, aktuell ≥ 10 mm, in ≤ 24 Mon. Implikation: Manche LR-5 Observationen entsprechen nicht OPTN 5. Dies gilt insbesondere für die LR-5 Observationen mit ≥ 50% Größenzunahme in ≤ 6 Mon. , die als OPTN 5 betrachtet werden. OPTN und LI-RADS Populationen unterscheiden sich: OPTN Bezieht sich auf alle Transplantationskandidaten. LI-RADS Bezieht sich nur auf Transplantationskandidaten, die Eignungskriterien erfüllen. ( s. S. 5) Implikation: OPTN geeignet für einzelne Transplantationskandidaten, bei denen LI-RADS nicht empfohlen wird wegen invollständiger Validierung der nicht-invasiven HCC Diagnostik (z. B. pädiatrische Patienten und vaskulär bedingte Zirrhosen). Weiter detaillierter Informationen zu OPTN Tumor Staging und LI-RADS in OPTN (Manual, in Arbeit) 14

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Report CT/MRT LI-RADS® v 2017 Befundung: Zu berücksichtigen bei der LI-RADS® Befunderstellung Beurteilen Sie mit “gesundem Menschenverstand”. Hat ein Patient mehrere Observationen: • Entscheiden Sie ob die Observationen einzeln, zusammengefasst oder kombiniert dargestellt werden, mit dem Ziel, den Befund möglichst klar und eindeutig darzustellen. Stimmen Sie Ihren Befund individuell auf den Patienen ab: • Seite 13 liefert Anweisungen für die bildgebende Diagnostik, dennoch mag das optimale Management für einzelne Patietenn variieren. Liegt für eine Observation schon eine bioptisch histopathologische Sicherung vor? Wurde eine Observation schon biopsiert und die pathologische Diagnose ist eindeutig (z. B. bestätigt die Pathologie ein HCC oder ein Hämangiom), dann muss die pathologische Diagnose anstatt der LI -RADS Kategorie angegeben warden. Wurde eine Observation schon biopsiert und die pathologische Diagnose ist nicht eindeutig oder legt eine potentielle HCC Präkanzerose (z. B. regenerativer oder dysplastischer Knoten), geben Sie die LI-RADS Kategorie und die pathologische Diagnose an. Die Rationale hierfür ist, dass beide Befunde auf eine mögliche falsch-negative Biopsie und/oder auf eine kurzfristige Follow-up Untersuchung aufmerksam machen. S. Seite 31 für weitere Informationen. Liegt ein venöser Tumoreinbruch vor? Wenn ja, geben Sie die wahrscheinlichste Ätiologie an. Die meisten LR-TIV Observation sind HCC, dennoch können ICC, H-Ch. C oder andere nicht-HCC Malignome vorkommen. S. Seite 19 zur Befundanleitung für LR-TIV. Ist der Patient Kandidat für eine Lebertransplanation? Wen ja, muss der Radiologe oder das Transplantationsteam die LI-RADS Kategorie in die OPTN Klasse überführen. Die Übertragung ist vollständig und unkompliziert wenn Folgendes angegeben wird: Größe, Haupteigenschaften, Anzahl der LR-5 und LR-5 g Observationen, Pathologie gesicherte HCC – oder vitale Tumorgröße im Behandlungsfall. Bei fortgeschritteneren Erkrankungen, geben Sie das Vorhandensein von Lymphknoten oder Fernmetastasen sowie LR-TIV Observationen an. Geben Sie ebenfalls LR-M Observationen an, da die Transplanationseignung hiervon beeinflusst werden kann. S. Manual (in Arbeit) für detailierte LI-RADS zu OPTN Konvertierungsanleitung. Vermeiden Sie Formulierungen, die eine Biopsie oder anderweitig invasive Abklärung erzwingen • Falls eine Leberbiopsie angezeigt erscheint, verwenden Sie folgende Formulierungen: • “Optionen für die diagnostische Ausarbeitung beinhalten ____ und ggf. eine Biopsie. ” • “die Unterscheidung eines HCC und ___ kann bei diesem Patieten nicht durch die Bildgebung 15

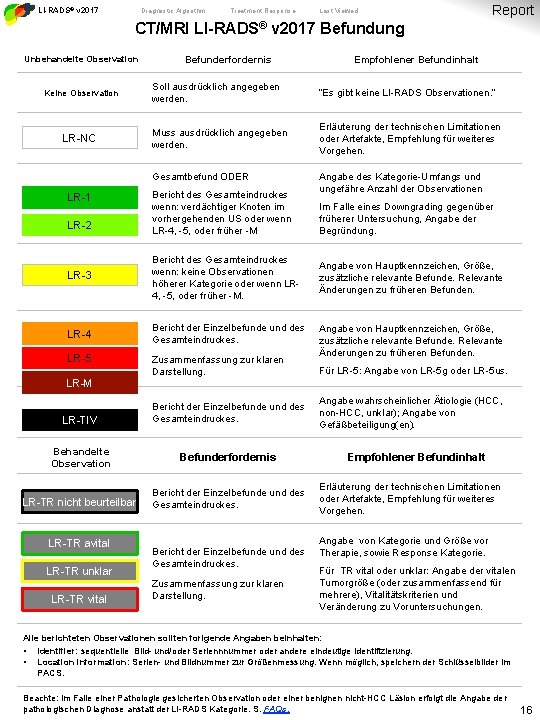
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Report CT/MRI LI-RADS® v 2017 Befundung Unbehandelte Observation Keine Observation LR-NC Befunderfordernis Soll ausdrücklich angegeben werden. “Es gibt keine LI-RADS Observationen. ” Muss ausdrücklich angegeben werden. Erläuterung der technischen Limitationen oder Artefakte, Empfehlung für weiteres Vorgehen. Gesamtbefund ODER LR-1 LR-2 Bericht des Gesamteindruckes wenn: verdächtiger Knoten im vorhergehenden US oder wenn LR-4, -5, oder früher -M LR-3 Bericht des Gesamteindruckes wenn: keine Observationen höherer Kategorie oder wenn LR 4, -5, oder früher -M. LR-4 Bericht der Einzelbefunde und des Gesamteindruckes. LR-5 Empfohlener Befundinhalt Zusammenfassung zur klaren Darstellung. Angabe des Kategorie-Umfangs und ungefähre Anzahl der Observationen Im Falle eines Downgrading gegenüber früherer Untersuchung, Angabe der Begründung. Angabe von Hauptkennzeichen, Größe, zusätzliche relevante Befunde. Relevante Änderungen zu früheren Befunden. Für LR-5: Angabe von LR-5 g oder LR-5 us. LR-M LR-TIV Bericht der Einzelbefunde und des Gesamteindruckes. Behandelte Observation Befunderfordernis LR-TR nicht beurteilbar Bericht der Einzelbefunde und des Gesamteindruckes. LR-TR avital LR-TR unklar LR-TR vital Bericht der Einzelbefunde und des Gesamteindruckes. Zusammenfassung zur klaren Darstellung. Angabe wahrscheinlicher Ätiologie (HCC, non-HCC, unklar); Angabe von Gefäßbeteiligung(en). Empfohlener Befundinhalt Erläuterung der technischen Limitationen oder Artefakte, Empfehlung für weiteres Vorgehen. Angabe von Kategorie und Größe vor Therapie, sowie Response Kategorie. Für TR vital oder unklar: Angabe der vitalen Tumorgröße (oder zusammenfassend für mehrere), Vitalitätskriterien und Veränderung zu Voruntersuchungen. Alle berichteten Observationen sollten forlgende Angaben beinhalten: • • Identifier: sequentielle Bild- und/oder Seriennnummer oder andere eindeutige Identifizierung. Location information: Serien- und Bildnummer zur Größenmessung. Wenn möglich, speichern der Schlüsselbilder im PACS. Beachte: im Falle einer Pathologie gesicherten Observation oder einer benignen nicht-HCC Läsion erfolgt die Angabe der pathologischen Diagnose anstatt der LI-RADS Kategorie. S. FAQs. 16

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Definitionen LI-RADS® CT/MRT Phasen Arterielle phase (AP) Frühe AP Späte AP Bei LI-RADS bezieht sich arterielle Phase (AP) auf die hepatische arterielle Phase, solange nicht anders angegeben. Die AP umfasst nach Kontrastmittelinjektion folgenden Zeitraum: • Leberarterien und Seitäste sind vollständig kontrastiert. • Die Lebervenen sind über antegraden Fluss noch nicht kontrastiert. 2 Subtypen: • Frühe AP: Die Pfortader ist nicht kontrastiert. • Späte AP: Die Pfortader ist schon kontrastiert. Die späte AP ist zur Diagnose und Staging des HCC eindeutig zu bevorzugen, da der Grad der Kontrastierung eines HCC in der späten Phase meist deutlich höher ist als in der frühen. Einige HCC zeigen sogar nur in der späten Phase ein Hyperenhancement. Extrazelluläre Phase (ECP) Diejenige Phase nach Kontrastmittelgabe, in der die Leberkontrastierung im Wesentlichen durch die Verteilung des Kontrastmittels im Extrazellulärraum bestimmt ist. Dies entspricht: • PVP und DP bei Verwendung von Röntgen-KM oder Gadobenate • PVP bei Verwendung von Gadoxetate. Portal-venöse Phase (PVP) Nach Kontrastmittelinjektion Zeitraum mit folgenden Charakteristika: • Pfortaderäste sind vollständig kontrastiert. • Lebervenen sind durch antegraden Fluss kontrastiert. • Das Leberparenchym zeigt in der Regel die höchste Kontrastierung. Verzögerte Phase (DP) Postkontrastmittel-Phase bei extrazellulären Röntgenkontrastmitteln oder Gadobenate nach der PVP mit folgenden Charakteristika: • Portal- und Lebervenen sind weniger kontrastiert als in der PVP. • Das Leberparenchym ist geringer kontrastiert als in der PVP. Typischer Aufnahmezeitpunkt ist 2 bis 5 Minuten p. i. . Transitional Phase (TP) Postkontrastmittel-Phase für hepatobiliäre KM nach der extrazellulären Phase aber vor der hepatobiliären Phase mit folgenden Charakteristika: • Lebergefäße und –parenchym in gleicher Dichte bzw. Signalintensität. • Intra- und extrazelluläre KM-Pools tragen zur Kontrastierung bei. Typischer Aufnahmezeitpunkt ist 2 bis 5 Minuten p. i. von Gadoxetate. Üblicherweise nicht angewendet bei extrazellulären KM. Hepatobiliäre Phase (HBP) Postkontrastmittel-Phase für hepatobiliäre KM: • Leberparenchym hyperkontrastiert gegenüber Lebergefäßen. • KM-Elimination über das biliäre System. Typischer Aufnahmezeitpunkt ist ca. 15 bis 20 Minuten p. i. von Gadoxetat und 1 -3 Stunden nach Gadobenate. Nicht angewendet bei extrazellulären KM. Suboptimale HBP falls Parenchymkontrastierung nicht hyperintens im Vergleich zu den Lebergefäßen. 17

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Definitionen LI-RADS® Wesentliche bildgebende Charakteristika APHE (kein Rand) Nicht-randartige Mehranreicherung einer Läsion im Vergleich zum Leberparnchym. Die Kontrastmittelaufnahme muss höher sein als die der Leber in der AP. Kontrastierung mit Rand APHE (Einschlußkriterium für LR-M, S. 20). “Washout” (nicht peripher) Nicht-periphere zeitliche Abnahme der Kontrastierung der gesamten Läsion oder von Teilbereichen relativ zum Leberparenchym von früherer zu späterer Phase mit relativer Hypokontrastierung in der extrazellulären Phase: • PVP oder DP im Falle von EC-KM oder Gadobenate • PVP im Falle von Gadoxetate Kann auf jede KM-aufnehmende Observation auch ohne APHE angewendet werden. Kontrastierung mit peripherem “washout” (Einschlusskriterium für LR-M, S. 20) oder TP oder HBP Hypointensität (Ergänzende Befunde können für Malignität sprechen, S. 21). Kontrastierte “Kapsel” Glatte, gleichförmige und scharfe, vollständige oder teilweise Berandung einer Observation, deutlich dicker oder deutlicher als die den Tumor umgebende Fibrose, während PVP, DP oder TP als ringartige Kontrastierung erkennbar. Kontrastierung ohne Kapselkontrastierung (Ergänzende Befunde können für HCC sprechen, S. 21) oder Corona-Kontrastierung (Ergänzende Befunde können für Malignität sprechen, S. 21). Größe Größter äußerer Durchmesser eine Observation: • Messung schließt “Kapsel” ein. • Messung in der Phase, in der die Grenzen am besten beurteilt werden können. • Wenn möglich keine Messung in AP oder in DWI Aufnahmen, sofern die Grenzen in anderen Untersuchungsphasen gut erkennbar sind (Überschätzung der Größe in der AP wegen Summation mit Umgebungskontrastierung und methodenbedingt unzuverlässiger Messung in der DWI). Schwellenwachstum Größenzunahme eines Herdes von mindestens 5 mm UND : • ≥ 50% Größenzunahme in ≤ 6 Mon. ODER • ≥ 100% Größenzunahme in > 6 Mon. ODER • Bisher unerkannt in CT oder MRT, aktuell ≥ 10 mm, in ≤ 24 Mon. Messungen in identischer Phase, Aufnahmesequenz und Schicht bei seriellen Untersuchungen (verwende wenn mgl. die gleiche Modalität) Beachte: Verwendung des Schwellenwachstums nur, wenn eine frühere CT oder MRT in ausreichender Qualität und Technik vorliegt, die Beurteilung einer neuen oder im Verlauf gewachsenen Observation zulässt. Ein Vergleich von CT/MRT zu früherem US oder CEUS lässt keine Beurteilung von Schwellenwachstum zu. 18

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definitionen Last Viewed LI-RADS® Tumorinfiltration in die Vene Eindeutige Anreicherung von Weichteilgewebe in einer Vene, unabhängig von der Darstellbarkeit einer parenchymatösen fokalen Läsion. Zusätzliche Hinweise für die Diagnose einer Tumorinfiltration in die Vene: Bildgebende Merkmale, die auf eine Tumorinfiltration in die Vene hindeuten, aber nicht beweisen, sind unten aufgelistet: • Verschlossene Vene mit unscharfer Gefäßwand. • Verschlossene Vene mit eingeschränkter Diffusion. • Verschlossene oder unscharfe Abgrenzbarkeit einer Vene in Nachbarschaft zu einer malignen parenchymatösen fokalen Läsion. • Heterogene Anreicherung in der Vene, die keinem Artefakt entspricht. Bei Nachweis dieser Merkmale untersuchen Sie die Vene auf anreicherndes Weichteilgewebe. Kategorisierung: Kategorisieren Sie als LR-TIV. Dokumentation: Geben Sie im Bericht die wahrscheinlichste ätiologische Zuordnung an. Anleitung siehe unten: LR-TIV Wenn benachbart zu LR-5 “Definitiv HCC” Wenn benachbart zu LR-4 “Wahrscheinlich HCC” Wenn mit infiltrativ wachsender fokaler Läsion assoziiert “Wahrscheinlich HCC” Wenn benachbart zu zielscheibenartiger fokaler Läsion “Möglicherweise Nicht-HCC-Malignom” Andernfalls “Ursache unsicher” 19

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definitionen Last Viewed LI-RADS® LR-M Kriterien Zielscheibenartige fokale Läsion (Definition und bildgebendes Erscheinungsbild siehe unten) ODER Nicht-zielscheibenartige fokale Läsion mit einem oder mehreren der folgenden Zeichen: • • Infiltratives Erscheinungsbild. Siehe Seite 25. Deutliche “Diffusionseinschränkung”. Siehe Anleitung (ausstehend). Nekrose oder ausgeprägte Ischämie. Siehe Anleitung (ausstehend). Anderes Merkmal, welches in der radiologischen Bewertung ein Non. HCC Malignom nahe legt. (im Bericht zu spezifizieren). Siehe Anleitung (ausstehend). Keine Tumorinfiltration in die Vene. Keine LR-5 Kriterien. Zielscheibenartig, Definition Zielscheibenartige Bildmorphologie. Konzentrische Anordnung der inneren Komponenten, was wahrscheinlich eine periphere Hyperzellularität und eine zentrale Stromafibrose oder Ischämie darstellt. Typisch für • • • Cholangiozelluläres Karzinom Hepatocholangiokarzinom Anderes Non-HCC-Malignom Kann bei einem HCC mit atypischem Erscheinungsbild auftreten. Daher ist ein zielscheibenartiges Erscheinungsbild verdächtig für ein Non-HCC-Malignom, schließt aber ein HCC nicht aus. Zielscheibenartige fokale Läsion, Erscheinungsbild in der Bildgebung in verschiedenen Phasen und Sequenzen Zielscheibenartige dynamische Anreicherung: Arterielle Ringmehranreicherung Räumlich definierter Subtyp einer „APHE“, bei der die Anreicherung in der arteriellen Phase in der Peripherie der Observation am ausgeprägtesten ist. Peripheres Räumlich definierter Subtyp einer "Auswaschung", bei der die offensichtliche Auswaschung in der Peripherie der Observation am ausgeprägtesten ist. “Auswaschen” Verspätete zentrale Anreicherung Zentrales Areal, in dem es in der postarteriellen Phase zu einer zunehmenden Anreicherung kommt Zielscheibenartige Darstellung in der DWI oder TP/HBP: Zielscheibenartige “Begrenzung” Konzentrisches Muster in der DWI, charakterisiert durch eine eingeschränkte Diffusion in der Peripherie und einer weniger eingeschränkten Diffusion im Zentrum der Observation. Zielscheibenartige Darstellung in der TP/HBP Konzentrisches Muster in der TP oder HBP, charakterisiert durch eine mäßige bis ausgeprägte Hypointensität in der Peripherie und geringer Hypointensität im Zentrum der Observation. 20

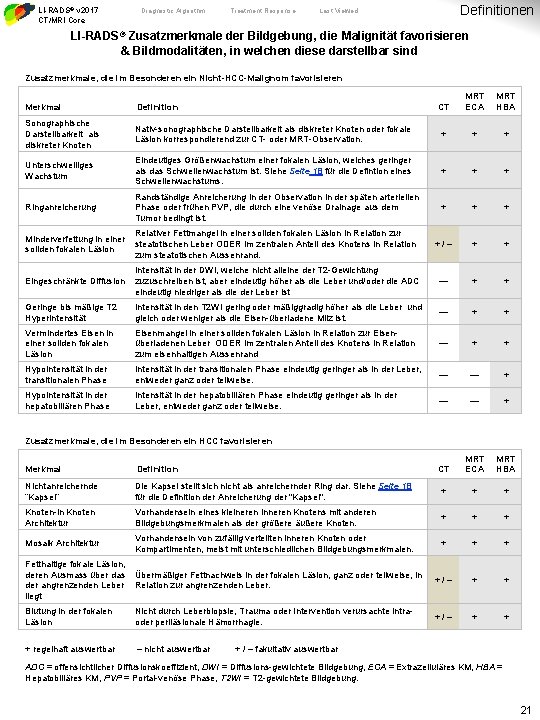
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definitionen Last Viewed LI-RADS® Zusatzmerkmale der Bildgebung, die Malignität favorisieren & Bildmodalitäten, in welchen diese darstellbar sind Zusatzmerkmale, die im Besonderen ein Nicht-HCC-Malignom favorisieren CT MRT ECA MRT HBA Nativ-sonographische Darstellbarkeit als diskreter Knoten oder fokale Läsion korrespondierend zur CT- oder MRT-Observation. + + + Unterschwelliges Wachstum Eindeutiges Größenwachstum einer fokalen Läsion, welches geringer als das Schwellenwachstum ist. Siehe Seite 18 für die Defintion eines Schwellenwachstums. + + + Ringanreicherung Randständige Anreicherung in der Observation in der späten arteriellen Phase oder frühen PVP, die durch eine venöse Drainage aus dem Tumor bedingt ist. + + + Minderverfettung in einer soliden fokalen Läsion Relativer Fettmangel in einer soliden fokalen Läsion in Relation zur steatotischen Leber ODER im zentralen Anteil des Knotens in Relation zum steatotischen Aussenrand. +/– + + Eingeschränkte Diffusion Intensität in der DWI, welche nicht alleine der T 2 -Gewichtung zuzuschreiben ist, aber eindeutig höher als die Leber und/oder die ADC eindeutig niedriger als die der Leber ist — + + Geringe bis mäßige T 2 Hyperintensität Intensität in den T 2 WI gering oder mäßiggradig höher als die Leber und gleich oder weniger als die Eisen-überladene Milz ist. — + + Vermindertes Eisen in einer soliden fokalen Läsion Eisenmangel in einer soliden fokalen Läsion in Relation zur Eisenüberladenen Leber ODER im zentralen Anteil des Knotens in Relation zum eisenhaltigen Aussenrand — + + Hypointensität in der transitionalen Phase Intensität in der transitionalen Phase eindeutig geringer als in der Leber, entweder ganz oder teilweise. — — + Hypointensität in der hepatobiliären Phase Intensität in der hepatobiliären Phase eindeutig geringer als in der Leber, entweder ganz oder teilweise. — — + CT MRT ECA MRT HBA Merkmal Definition Sonographische Darstellbarkeit als diskreter Knoten Zusatzmerkmale, die im Besonderen ein HCC favorisieren Merkmal Definition Nichtanreichernde “Kapsel” Die Kapsel stellt sich nicht als anreichernder Ring dar. Siehe Seite 18 für die Definition der Anreicherung der "Kapsel". + + + Knoten-in Knoten Architektur Vorhandensein eines kleineren inneren Knotens mit anderen Bildgebungsmerkmalen als der größere äußere Knoten. + + + Mosaik Architektur Vorhandensein von zufällig verteilten inneren Knoten oder Kompartimenten, meist mit unterschiedlichen Bildgebungsmerkmalen. + + + Fetthaltige fokale Läsion, deren Ausmass über das der angrenzenden Leber liegt Übermäßiger Fettnachweis in der fokalen Läsion, ganz oder teilweise, in Relation zur angrenzenden Leber. +/– + + Blutung in der fokalen Läsion Nicht durch Leberbiopsie, Trauma oder Intervention verursachte intraoder periläsionale Hämorrhagie. +/– + + + regelhaft auswertbar – nicht auswertbar + / – fakultativ auswertbar ADC = offensichtlicher Diffusionskoeffizient, DWI = Diffusions-gewichtete Bildgebung, ECA = Extrazelluläres KM, HBA = Hepatobiliäres KM, PVP = Portal-venöse Phase, T 2 WI = T 2 -gewichtete Bildgebung. 21

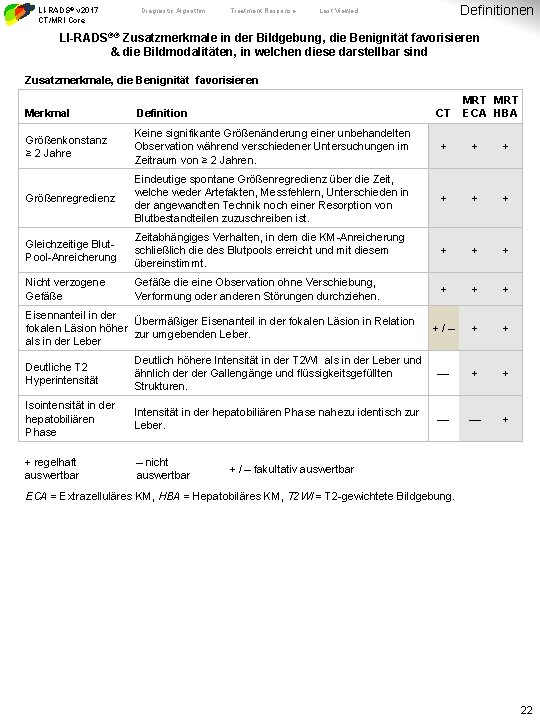
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Definitionen Last Viewed LI-RADS®® Zusatzmerkmale in der Bildgebung, die Benignität favorisieren & die Bildmodalitäten, in welchen diese darstellbar sind Zusatzmerkmale, die Benignität favorisieren CT MRT ECA HBA Merkmal Definition Größenkonstanz ≥ 2 Jahre Keine signifikante Größenänderung einer unbehandelten Observation während verschiedener Untersuchungen im Zeitraum von ≥ 2 Jahren. + + + Größenregredienz Eindeutige spontane Größenregredienz über die Zeit, welche weder Artefakten, Messfehlern, Unterschieden in der angewandten Technik noch einer Resorption von Blutbestandteilen zuzuschreiben ist. + + + Gleichzeitige Blut. Pool-Anreicherung Zeitabhängiges Verhalten, in dem die KM-Anreicherung schließlich die des Blutpools erreicht und mit diesem übereinstimmt. + + + Nicht verzogene Gefäße die eine Observation ohne Verschiebung, Verformung oder anderen Störungen durchziehen. + +/– + + Eisennanteil in der Übermäßiger Eisenanteil in der fokalen Läsion in Relation fokalen Läsion höher zur umgebenden Leber. als in der Leber Deutliche T 2 Hyperintensität Deutlich höhere Intensität in der T 2 WI als in der Leber und ähnlich der Gallengänge und flüssigkeitsgefüllten Strukturen. — + + Isointensität in der hepatobiliären Phase Intensität in der hepatobiliären Phase nahezu identisch zur Leber. — — + + regelhaft auswertbar – nicht auswertbar + / – fakultativ auswertbar ECA = Extrazelluläres KM, HBA = Hepatobiläres KM, T 2 WI = T 2 -gewichtete Bildgebung. 22

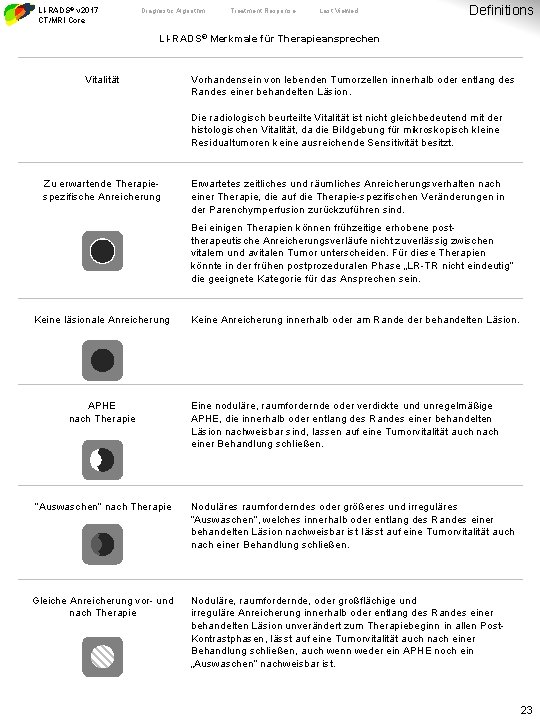
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Definitions LI-RADS® Merkmale für Therapieansprechen Vitalität Vorhandensein von lebenden Tumorzellen innerhalb oder entlang des Randes einer behandelten Läsion. Die radiologisch beurteilte Vitalität ist nicht gleichbedeutend mit der histologischen Vitalität, da die Bildgebung für mikroskopisch kleine Residualtumoren keine ausreichende Sensitivität besitzt. Zu erwartende Therapiespezifische Anreicherung Erwartetes zeitliches und räumliches Anreicherungsverhalten nach einer Therapie, die auf die Therapie-spezifischen Veränderungen in der Parenchymperfusion zurückzuführen sind. Bei einigen Therapien können frühzeitige erhobene posttherapeutische Anreicherungsverläufe nicht zuverlässig zwischen vitalem und avitalen Tumor unterscheiden. Für diese Therapien könnte in der frühen postprozeduralen Phase „LR-TR nicht eindeutig“ die geeignete Kategorie für das Ansprechen sein. Keine läsionale Anreicherung APHE nach Therapie “Auswaschen” nach Therapie Gleiche Anreicherung vor- und nach Therapie Keine Anreicherung innerhalb oder am Rande der behandelten Läsion. Eine noduläre, raumfordernde oder verdickte und unregelmäßige APHE, die innerhalb oder entlang des Randes einer behandelten Läsion nachweisbar sind, lassen auf eine Tumorvitalität auch nach einer Behandlung schließen. Noduläres raumforderndes oder größeres und irreguläres “Auswaschen”, welches innerhalb oder entlang des Randes einer behandelten Läsion nachweisbar ist lässt auf eine Tumorvitalität auch nach einer Behandlung schließen. Noduläre, raumfordernde, oder großflächige und irreguläre Anreicherung innerhalb oder entlang des Randes einer behandelten Läsion unverändert zum Therapiebeginn in allen Post. Kontrastphasen, lässt auf eine Tumorvitalität auch nach einer Behandlung schließen, auch wenn weder ein APHE noch ein „Auswaschen“ nachweisbar ist. 23

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed LR-1 and LR-2 Beispiele für LR-1 und LR-2 Entitäten Definitiv: LR-1 • • • Zyste. Hämangiom. Perfusionsänderung (z. B. arterio-portaler Shunt). Mehr- oder Minderverfettungzone. Hypertrophe Pseudoläsion. Konfluierende Fibrose oder Narbe. Spontanes Verschwinden. Die obige Liste erhebt keinen Anspruch auf Vollständigkeit. Wahrscheinlich : LR-2 • • • Zyste. Hämangiom. Perfusionsänderung (z. B. , arterio-portaler Shunt). Mehr- oder Minderverfettungzone. Hypertrophe Pseudoläsion. Konfluierente Fibrose oder fokale Narbe. Auffälliger Knoten ohne bildgebende Malignitätszeichen (siehe unten). Die obige Liste erhebt keinen Anspruch auf Vollständigkeit. Solider Knoten < 20 mm auffällig im bildgebenden Erscheinnungsbild im Vergleich zu umgebenden Knoten UND ohne ein Hauptmerkmal für ein HCC, kein Merkmal für LR-M, und keine Zusatzmerkmale für Malignität. Auffälliger Knoten ohne Malignitätszeichen Typische Beispiele : • • • T 1 hyperintens T 2 hypointens Siderotisch HBP hyperintens Eine Kombination der oben genannten Beispiele Keine APHE, WO, keine Kapsel, kein Wachstum Kein Merkmal für LR-M (siehe Seite 20) Keine Zusatzmerkmale für Malignität (siehe Seite 21) wenn ≥ 20 mm, kategorisieren Sie als LR-3 Achtung: Knoten mit Merkmalen, die für eine fokal-noduläre Hyperplasie (FNH) oder ein hepatozelluläres Adenom (HCA) sprechen, sollten als LR-3 kategorisiert werden. Sie können mit Vorsicht als LR-2 und sollten nie als LR-1 kategorisiert werden. Hintergrund: Es handelt sich um Ausschlussdiagnosen bei Hochrisiko-Patienten 24

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Definitionen Observation mit infiltrativem Erscheinungsbild Observation mit nicht umschriebenem Rand (unscharfer Übergang) vermutlich einer Malignität mit durchwanderndem Wachstumsmuster entsprechend. Terminologie: • • Malignitäten mit durchwanderndem Wachstumsmuster werden gewöhnlich als “infiltrativ” bezeichnet. LI-RADS bevorzugt den Begriff “infiltratives Erscheinungsbild”. Hintergrund: Diese Wortwahl erläutert deutlicher die Infiltration von Tumorzellen in das Leberparenchym oder das Auftreten von konfluierenden winzigen Knoten (oder Beides). Die Unterscheidung ist schwierig. Differentialdiagnose für Malignitäten mit infiltrativem Erscheinungsbild im CT und MRT • • Häufig: HCC. Selten: ICC, H-Ch. C, Metastasierung in die Leber durch einen extrahepatischen Primärtumor, Lymphom. CT- und MRT-Detektion von Malignitäten mit infiltrativem Erscheinungsbild: • • • Kann sich als diffuse unscharf-definierte fokale Läsion manifestieren, häufig mehr als ein Segment einnehmend. Trotz der Größe kann es schwierig sein, sie zu detektieren: • Native Bildgebung vor Kontrastgabe kann hilfreich sein. • Nötig ist eine regelmäßige sorgfältige Befundung aller verfügbarer Bilder. Verdächtige Merkmale können sein (inkomplette Liste): • Tumorinfiltration in die Vene (oft der erste und hilfreiche Hinweis). • Verdrängte oder nicht darstellbare Venen, die nicht einem chronisch bedingten Verschluss zugeordnet werden können. • Heterogene Abschwächung/Signalintensität. • Milde bis moderate T 1 Hypointensität, T 2 Hyperintensität, eingeschränkte Diffusion. • Heterogene Anreicherung in einer oder mehreren Phasen. • Nachweis von multiplen schlecht abgrenzbaren und unscharf-definierten Knoten. • Architektonische Verziehung. Pitfall: Einige gutartige Prozesse können ein infiltratives Aussehen haben und als maligne fehlnterpretiert werden. Beispiele: Fokale oder regionale Perfusionsstörung, Areale zonaler Mehr-/Minderverfettung, Eisenablagerung. Hinweis: Diese Prozesse infiltrieren weder die Vene, noch verdrängen sie Gefäße oder verformen die normale Parenchymarchitektur. LI-RADS Kategorisierung von unscharf definierten Observationen: Unscharf definierte Observation ohne bioptische Sicherung bei Patienten mit hohem HCC-Risiko Bei Tumorinfiltration in die Vene LR-TIV Wenn der Verdacht auf eine benigne fokal oder regionale Perfusionsstörung, Fett, Eisen oder eine anderer nicht-neoplastischer parenchymatöser Prozess besteht. LR-2 Wenn die Kriterien für LR-5 erfüllt sind (z. B. APHE + “Auswaschen”) LR-5 Andernfalls LR-M 25

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Erste Schritte Was ist eine LI-RADS-Observation (Beobachtung)? Eine Observation ist ein markanter Bereich im Vergleich zur Hintergrundleber bei der Bildgebung. Es kann eine Läsion (Masse oder Knoten) oder Pseudoläsion (z. B. Perfusionsveränderung, hypertrophe. Pseudoläsion oder Artefakt) sein. Warum gilt LI-RADS nicht für Patienten ohne Risikofaktoren, für Patienten <18 Jahre oder für Patienten mit Leberzirrhose aufgrund einer kongenitalen Leberfibrose? Der positiv prädiktive Wert der Bildgebung für HCC ist bei solchen Patienten möglicherweise nicht ausreichend hoch. Warum gilt LI-RADS nicht für Patienten mit Zirrhose aufgrund einer vaskulären Störung wie erblicher hämorrhagischer Teleangiektasie, Budd-Chiari-Syndrom, chronischem Pfortaderverschluss, Herzinsuffizienz oder nodulärer regenerativer Hyperplasie? Solche Zustände sind mit der Bildung von benignen hyperplastischen Knötchen verbunden, die dem HCC bei der Bildgebung ähneln und möglicherweise falsch positive Diagnosen verursachen können. Ich bin mir nicht sicher, ob mein Patient eine Zirrhose hat. Kann ich CT / MRI LI-RADS anwenden? Sie können LI-RADS anwenden und eine bedingte Kategorie bereitstellen. Zum Beispiel: "25 mm. Läsion mit APHE und Washout. Wenn der Patient eine Zirrhose oder eine chronische Hepatitis B hat, erfüllt dies Kriteriem LR-5 (definitiv HCC). Meine Einrichtung ist ein Transplantationszentrum und benötigt das OPTN-System. Kann ich LI-RADS anstelle von oder zusätzlich zu OPTN verwenden? Ja, Sie dürfen LI-RADS bei Patienten mit Zirrhose, chronischer Hepatitis B oder aktuellem oder Zustand nach HCC anwenden. Dies schließt Lebertransplantationskandidaten und/oder Empfänger mit einem dieser Risikofaktoren ein. Mein Patient hat ein extrahepatisches primäres Malignom. Kann ich LI-RADS verwenden? Ja. LI-RADS kann angewendet werden, aber die Zuordnung von LR-5 sollte mit Vorsicht erfolgen, da LI-RADS -Bildgebungskriterien und Beobachtungskategorien für diese Situation nicht entwickelt oder validiert wurden. Das Bestehen eines extrahepatischen Malignoms reduziert den positive prädiktiven Wert von LR-5 für HCC, insbesondere wenn der Primärtumor hypervaskularisiert ist. Im Zweifelsfall als LR-M und nicht als LR-5 kategorisieren. Berücksichtigen Sie zusätzliche Bildgebung und eine multidisziplinäre Diskussion. Warum gilt LI-RADS nicht für einphasige CT- oder MRT-Untersuchungen? Die Charakterisierung aller wichtigen Bildgebungsmerkmale von LI-RADS ist nur möglich, wenn mehrere Bildgebungsphasen erfasst werden. Technische Empfehlungen zu LI-RADS siehe Seite 12. Wie interpretiere und berichte ich Beobachtungen bei einphasiger CT oder MRT bei Risikopatienten? Stellen Sie Ihre beste Diagnose oder Differenzialdiagnose zur Verfügung. Sie sollten ein Multiphasen-CT oder MRT vorschlagen, wenn eine formelle LI-RADS-Kategorisierung bei der Patientenbehandlung helfen würde. Warum sollte ich keine LI-RADS-Kategorie für histologisch gesicherte Malignome und für histologisch gesicherte gutartige Läsionen nicht-hepatozellulären Ursprungs zuordnen? LI-RADS soll die Kommunikation verbessern. Das Zuweisen einer LI-RADS-Kategorie zu einer histologisch gesicherten Läsion (bei der Gewissheit über die Diagnose besteht) kann insbesondere bei LI-RADSKategorien, die eine gewisse Unsicherheit vermitteln (z. B. LR-2, LR-3, LR-4 oder LR-M), zu Verwirrung führen. Sollte ich histologisch gesicherte gutartige Läsionen hepatozellulären Ursprungs (z. B. regenerative oder dysplastische Knoten) eine LI-RADS-Kategorie zuweisen? Dies sind Ausnahmen von der vorherigen Regel. Bei pathologisch nachgewiesenen regenerativen oder dysplastischen Knoten ordnen Sie zusätzlich zur histologisch gesicherten Diagnose eine LI-RADS-Kategorie zu. Die Zuweisung von LI-RADS-Kategorien mindert möglichen Schaden durch falsch-negative histologische Diagnosen, erleichtert die Überwachung von Knoten hinsichtlich einer möglichen Progression und ermöglicht Therapieentscheidungen. 26

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Diagnose Wie kann ich feststellen, ob eine Beobachtung nicht kategorisierbar ist (LR-NC)? Eine Beobachtung wird als nicht kategorisierbar angesehen, wenn sie nicht sinnvoll kategorisiert werden kann, da wichtige Phasen weggelassen wurden, was die Bewertung eines oder mehrerer Hauptmerkmale verhindert. Weisen Sie die Kategorie LR-NC nicht zu, wenn die Kategorisierung nur durch ungewöhnliche Bildgebungsmerkmale oder durch die Unfähigkeit zur Charakterisierung von Hilfsmerkmalen in Frage gestellt wird. Wie kategorisiere ich Beobachtungen als LR-1 oder LR-2? Verwenden Sie Ihr Wissen und Ihre Erfahrung, um Beobachtungen als eindeutig benigne (100 % Sicherheit der Benignität) oder wahrscheinlich benigne (überzeugt, aber nicht zu 100 % sicher) einzustufen. Siehe Seite 24 und Handbuch (ausstehend). Was ist der Unterschied zwischen LR-5 und LR-M? Schließt LR-M HCC aus? LR-5 zeigt 100 %ige Sicherheit für das Vorliegen eines HCC an. LR-M weist auf eine hohe Malignitätssicherheit hin, aber die Merkmale sind nicht spezifisch für ein HCC. LR-M schließt ein HCC nicht aus. Die Differentialdiagnose für LR-M umfasst das HCC mit unspezifischen Bildgebungsmerkmalen, das cholangiozelluläre Karzinom und andere Malignome. Wie kategorisiere ich einen Tumor in einer Vene? LR-TIV, unabhängig von der Ätiologie. Hinweise zur Befundung finden Sie auf Seite 19. Wie kategorisiere ich eine infiltrative Läsion, die nicht den Kriterien LR-TIV oder LR-5 entspricht? LR-M. Die Merkmale deuten auf Malignität hin, sind jedoch nicht diagnostisch für ein HCC. Siehe Seite 20. Warum hat LI-RADS nicht analog zu BI-RADS 6 eine Kategorie für ein gesichertes HCC? Die Biopsie spielt eine weniger wichtige Rolle bei der Aufarbeitung und Behandlung eines HCC bei Risikopatienten als bei Brustkrebs. Dennoch kann eine solche Kategorie in einigen Situationen nützlich sein, und eine Kategorie für histologisch gesicherte HCCs ist für das nächste große Update von LI-RADS in 2020 oder 2021 geplant. Warum können Zusatzmerkmale nicht für ein Upgrade auf LR-5 verwendet werden? Zusätzliche Merkmale erhöhen die diagnostische Sicherheit und beeinflussen die Wahrscheinlichkeit von Malignität. Die Merkmale haben jedoch keine ausreichende Spezifität für ein HCC, um ein Upgrade auf LR-5 zu ermöglichen. Warum sind die LI-RADS Zusatzmerkmale in v 2017 neuerdings optional? Zusatzmerkmale sind in v 2017 optional, um mehr Radiologen zu ermutigen, das dadurch weniger komplexe LIRADS anzuwenden. Wenn sich neue Anwender mit LI-RADS vertraut machen, können sie Zusatzmerkmale nutzen, um ihre Diagnosen weiter zu verbessern. Warum hat LI-RADS LR-5 V in LR-TIV geändert? Da nicht-HCC-Malignome (z. B. ICC, H-Ch. C) einen Tumor in der Vene verursachen können, ist die Kategorisierung aller Beobachtungen mit Tumor in Vene als LR-5 V (d. h. definitiv HCC mit Tumor in der Vene) falsch. Warum wählt die Tie-Break-Regel die Kategorie mit geringerer Sicherheit? Dies hält 100 % Sicherheit für LR-5 und LR-1 aufrecht. Wenn zum Beispiel Zweifel darüber bestehen, ob eine Beobachtung definitiv oder wahrscheinlich gutartig ist, kann sie nicht als definitiv gutartig angesehen werden. Die Regel hilft auch 100 % positiven Vorhersagewert von LR-5 für HCC zu erreichen. Wenn zwischen LR-5 und LR-4 oder zwischen LR-5 und LR-M Unsicherheit besteht, wählt die Tie-Break-Regel LR-4 bzw. LR-M. Was sollte ich tun, wenn einige Zusatzmerkmale für Benignität und andere für Malignität sprechen? Ändern Sie nicht die Kategorie (siehe Seite 8). Beinhaltet eine Kategorie von LR-3 oder LR-4 ein nicht-HCC-Malignom? Die Kriterien für LR-3 und LR-4 sind nicht spezifisch für einen hepatozellulären Ursprung und schließen daher ein nicht-HCC-Malignom nicht aus. Daher kann eine kleine Minderheit von LR-3 - oder LR-4 -Beobachtungen ein nicht-HCC-Malignom sein. 27

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Therapieansprechen Was ist eine behandelte Beobachtung? Eine Beobachtung, die durch lokoregionäre Therapien wie Radiofrequenzablation, perkutaneÄthanolablation, Kryoablation, Mikrowellenablation, transarterielle Embolisation oder Chemoembolisation, Doxorubicinfreisetzende Chemoembolisation, transarterielle Radioembolisation und externe Strahlentherapie behandelt wurde. Siehe Handbuch (ausstehend). Was ist mit Beobachtungen, die mit systemischer Therapie behandelt werden? LI-RADS v 2017 befasst sich nicht mit dem Therapieansprechen nach systemischer Therapie. Wie kann ich feststellen, ob eine behandelte Beobachtung nicht kategorisierbar ist? Eine Kategorie von LR-TR „nicht kategorisierbar“ sollte zugewiesen werden, wenn das Therapieansprechen aufgrund einer ungeeigneten Bildgebungstechnik oder einer unzureichenden Bildqualität nicht sinnvoll bewertet werden kann. Weisen Sie bei einer ausreichenden Bildqualität nicht die Kategorie "nicht kategorisierbar" zu, selbst wenn die Bildgebungsmerkmale schwer zu charakterisieren oder zu interpretieren sind. Siehe Handbuch (ausstehend). Was ist, wenn die arterielle Phase unzureichend ist, aber die portalvenöse Phase eindeutige KMAnreicherung zeigt? Ist das nicht kategorisierbar oder zweifelhaft (unklar)? Ordnen Sie die Kategorie LR-TR „unklar“ zu. Ziehen Sie eine zeitnahe Wiederholung der Bildgebung oder alternative Bildgebungsmethoden in Erwägung, um eine adäquate arterielle Phase zu gewährleisten. Was ist das optimale Follow-up-Intervall zur Beurteilung der Behandlung? Die optimalen Follow-up-Intervalle hängen von der Behandlung, den institutionellen Richtlinien und der Kostenerstattung ab. Im Allgemeinen wird eine Follow-up-CT oder MRT alle 3 Monate empfohlen, obwohl eine anfängliche Bildgebung nach 1 Monat nach bestimmten Behandlungen hilfreich sein kann. Siehe Seite 13. Gibt es Fallgruben bei der Beurteilung des Therapieansprechens, wenn die Bildgebung zu früh nach der Behandlung durchgeführt wird? Behandlungsbedingte Veränderungen der Parenchymperfusion können der Tumorperfusion ähneln oder diese verschleiern, was möglicherweise zu einer falsch positiven oder falsch negativen Beurteilung führt. Was sollte ich tun, wenn ich unsicher bin, ob die Tumoren vital sind oder nicht? Kategorisieren Sie als LR-TR „unklar“, wenn die Bildqualität ausreichend ist. Siehe Seite 10. Schließt LR-TR „nicht vital“ mikroskopisch vitale Anteile aus? Nein. LR-TR „nicht vital“ bedeutet, dass es keinen Hinweis auf einen vitalen Tumor gibt. Kleine Herde von vitalen Tumorzellen können durch nichtinvasive Bildgebung nicht ausgeschlossen werden. Wie kann ich den Resttumor von einem neuen Tumor neben einer behandelten Beobachtung unterscheiden? Im Gegensatz zu einem neuen Tumor in der angrenzenden Leber tritt ein Resttumor gewöhnlich innerhalb oder am Rand der behandelten Beobachtung auf. Das Vorhandensein von gesundem Leberparenchym zwischen der Läsion und dem Parenchymdefekt erlaubt die Differenzierung zwischen einer neuen Läsion und einem Rezidiv. Treffen Sie eine Entscheidung und wenden Sie den entsprechenden LI-RADS-Algorithmus an (CT / MRT Therapieansprechen oder Diagnose). Beispiel: Eine neue Beobachtung weist Merkmale auf, die für einen de novo Ursprung sprechen (z. B. Knoten im Knoten) und/oder eine Metastase aus der behandelten Läsion ausschließen (z. B. Unterschiede in Fett, Eisen, HBP-Gehalt). Dann sollte die Läsion als neuer Tumor betrachtet werden. Wie bewerte ich die Reaktion des Tumors in der Vene auf die Behandlung? Dies kann eine Herausforderung sein. Wenden Sie die LI-RADS-Therapieansprechen-Kriterien so gut wie möglich an. Muss ich die Reaktion jeder Beobachtung beurteilen, wenn die Anzahl der Beobachtungen groß ist? Wenn es eine große Anzahl von behandelten Beobachtungen mit ähnlichen Bildgebungsmerkmalen gibt, die wahrscheinlich eine ähnliche Reaktion zeigen, können Sie die Behandlungsreaktion insgesamt bewerten. 28

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Technik Welche Modalität und welchen Kontrastmitteltyp empfiehlt LI-RADS zur Diagnose oder zum Staging? LI-RADS liefert eine Anleitung zur korrekten Anwendung der Bildgebungstechnik für die Modalität (CT, MRT) und der Kontrastmittel (ECA, HBA), empfiehlt jedoch keine bestimmte Modalität und kein bestimmtes Kontrastmittel. Die Wahl der Modalität und des Kontrastmittels hängt von der Präferenz, Toleranz und der Sicherheit des Patienten ab, von zahlreichen Faktoren, die Bildqualität oder die Durchführbarkeit der Untersuchung beeinflussen können, von bisher angewandter Bildgebungsmodalität und bisher angewandtem Kontrastmittel und von der Expertise der Institution und des Radiologen sollen die Modalität und das Kontrastmittel individuell auf den Patienten abstimmen. Besonderheiten bei der Beurteilung des Therapieansprechens? Obwohl das Therapieansprechen mit CT oder MRT und mit jedem Kontrastmittel beurteilt werden kann: • Die MRT kann der CT nach einer jodierten Öl-TACE vorgezogen werden, da dichtes Öl innerhalb eines embolisierten Tumors eine Tumorresiduum oder ein Tumorrezidiv maskieren kann. • Eine MRT mit extrazellulärem Kontrastmittel kann gegenüber einer MRT mit Gadoxetat bevorzugt werden, da es bei diesem zu Bewegungsartefakten in der arteriellen Phase kommen kann. Bei Patienten, bei denen der Nachweis neuer Läsionen als wichtiger angesehen wird als die Beurteilung des Therapieansprechens der behandelten Läsionen, kann eine Gadoxetat-MRT geeigneter sein. Radiologen sollten die Modalität und das Kontrastmittel individuell an den Patienten und die durchgeführte Therapie anpassen. Kann ich LI-RADS zur Interpretation und zur Berichterstellung verwenden, wenn empfohlene Bilder/Sequenzen weggelassen werden? Ja. Eine bestimmte LI-RADS-Kategorie kann oft zugewiesen werden, selbst wenn empfohlene Bilder/Sequenzen weggelassen werden. Zum Beispiel würde eine Untersuchung mit Bilder arteriellen und späten Kontrastmittelphase eine sichere LR-5 -Kategorisierung ermöglichen, wenn diese Bilder eine Observation mit APHE, „Wash-out" und "Kapsel" zeigen. Sind die technischen Empfehlungen von LI-RADS für CT und MRT konsistent mit OPTN? Ja. Eine kurze Übersicht über OPTN & LI-RADS finden Sie auf Seite 14. Siehe Handbuch (ausstehend) für eine detaillierte Überprüfung. Warum verwendet LI-RADS "Übergangsphase" anstatt „Spätphase" für Gadoxetat? Für eine Gadoxetat-verstärkte MRT stellt der Zeitraum von 2 -5 Minuten nach der Kontrastmittel-Injektion einen Übergang von extrazellulär-dominanter (d. h. portalvenöser Phase) zu intrazellulär-dominanter (d. h. hepatobiliärer Phase) dar und wird daher als "Übergangsphase" bezeichnet. Während dieses Zeitraums tragen sowohl die intrazellulären als auch die extrazellulären Anteile von Gadoxetat wesentlich zur Parenchymanreicherung bei. Dies unterscheidet sich grundlegend von der herkömmlichen Spätphase unter Verwendung anderer. KM, bei denen die Kontrastmittelanreicherung die extrazelluläre Verteilung des Kontrastmittels widerspiegelt. Warum wird die spätarterielle Phase ausdrücklich bevorzugt? Und was ist der optimale Scan-Zeitpunkt? Die spätarterielle Phase wird ausdrücklich bevorzugt, da das HCC-Enhancement in der spätarteriellen gewöhnlich höher ist als in der früharteriellen Phase und einige HCCs nur in der spätarteriellen Phase anreichern. Der optimale Scan-Zeitpunkt hängt von der Modalität (CT / MRT), der Art, des Volumens und der Konzentration des Kontrastmittels, der Flussrate der Kontrastmittelinjektion, der Timing-Methode (Fix, Bolus-Tracking, Testbolus) und der Zeit bis zur K-Raum-Zentrum-Füllung (für MRI) ab. Siehe Handbuch (ausstehend). Wie kann ich beurteilen, ob die Leberanreicherung während der hepatobiliären Phase (HBP) ausreichend ist? Das Leber-Enhancement während des HBP ist ausreichend, wenn das Parenchym im Vergleich zu den hepatischen Blutgefäßen eindeutig hyperintens ist. Ansonsten ist es suboptimal. Der Mechanismus für ein suboptimales. HBPEnhancement ist nicht gut verstanden, spiegelt jedoch wahrscheinlich eine verringerte Anzahl funktionstüchtiger Hepatozyten oder eine Dysfunktion der zellulären Transportmechanismen wider. Fallstrick: Die sichtbare Ausscheidung von Gadoxetat in die Gallengänge deutet nicht auf ein ausreichendes Leber-Enhancement hin. Siehe Handbuch (ausstehend). Sollte ich den Scan-Zeitpunkt verzögern oder den Flip-Winkel erhöhen wenn die HBP suboptimal ist? Das Verzögern des Scan-Zeitpunkts der HBP kann die Bildqualität bei einer zirrhotischen Leber mit verminderter Funktion verbessern, die Auswirkungen auf die diagnostische Genauigkeit sind jedoch nicht bekannt. Die Erhöhung 29

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Management LI-RADS weist darauf hin, dass es angemessen sein kann eine alternative Bildgebung innerhalb von weniger als sechs Monaten zu empfehlen, wenn keine Observation gemacht worden ist. Was ist hierzu die Rationale? In den meisten Fällen ohne nachweisbare Observation im Multiphasen-CT oder MRT, erfolgt eine Routineüberwachung in 6 Monaten. Bei anderweitig positivem Screening-Test (z. B. ein definitiver solider Knoten im Ultraschall oder ein hochpositives AFP) kann eine alternative Bildgebung nützlich sein, um ein falsch negatives Resultat im initialen CT oder MRT auszuschließen. In solchen Fällen benutzen Sie Ihre eigene Einschätzung um das angemessene alternative Verfahren und Zeitintervall zu empfehlen. CEUS kann insbesondere hilfreich sein, falls in einem Screening-Ultraschall ein für CT oder MRT nicht darstellbare Läsion detektiert wurde. Lässt sich das optimale Patientenmanagement direkt von der LI-RADS-Kategorie ableiten? Nein, das optimale Patientenmanagement wird bestimmt durch die LI-RADS-Kategorie und durch die klinische Einschätzung, welche die Vorstellungen und Komorbiditäten des Patienten, die Tumorlast, die Verfügbarkeit der Lebertransplantation, den sozioökonomischen und Versicherungsstatus, und die Zuweisungsmöglichkeiten integriert. Da Radiologen möglicherweise nicht alle relevanten Faktoren zur Verfügung stehen kann eine multidisziplinäre Diskussion mit einem konsensusbasierten Management in schwierigen Fällen hilfreich sein. Wenn man der Ansicht ist, dass eine Biopsie nötig ist, sollte dies dann auch empfohlen werden? Es ist vernünftig anzugeben das seine Biopsie zur Bestätigung der Diagnose nötig ist, aber es existierenauch Faktoren neben dem bildgebenden Befund selbst, die Entscheidung zur Biopsie beeinflussen könnten. Es ist empfehlenswert den Kliniker nicht zur Biopsie zu zwingen, da unbekannte Gründe vorliegen könnten, warum dies für den speziellen Patienten kein angemessenes Vorgehen ist. Ich bin besorgt, dass meine klinischen Kollegen nicht wünschen, dass für die Bildgebung Follow-up. Intervalle in meinen Befunden angegeben werden. Bin ich gezwungen diese Informationen in meine Befunde zu integrieren? Nein, die Follow-up-Intervalle auf Seite 13 sind typische Zeiträume, aber benutzen Sie Ihre persönliche Einschätzung ob spezifische Zeitintervalle in Ihren Befunden eingeschlossen werden sollen. Das Management für LR-3 ist im CEUS- und CT/MRT-Algorithmus unterschiedlich. Was ist die Begründung? Wie von zwei kürzlichen Studien 1, 2 gezeigt sind LR-3 -Observationen im CT oder MRT gutartige Perfusionsänderungen oder indolente Läsionen, welche sicher ohne multidisziplinäre Diskussion nachverfolgt werden können (Anhang, ausstehend). Weniger ist über den natürlichen Verlauf von LR-3 -Observationen im CEUS bekannt, aber indirekte Hinweise deuten an, dass solche Observationen engmaschige Kontrollen verlangen. Per Definition sind alle CEUS-Observationen bereits im B-Bild nachweisbar. In der zirrhotischen Leber haben sonographisch sichtbare Läsionen eine hohe Vortestwahrscheinlichkeit für ein HCC, außerdie CEUS-Kriterien sind typisch für ein Hämangiom oder eine andere benigne Entität. Eine kürzlich publizierte retrospektive Studie³ zeigte, dass 60% (45/75) aller CEUS-LR-3 -Observationen HCCs sind (siehe CEUSManual, ausstehend). Referenzen 1. J-Y Choi et al. Indeterminate observations (Liver Imaging Reporting and Data System Category 3) on MRI in the cirrhotic liver: fate and clinical implications. AJR 2013. PMID 24147469 2. M Tanabe et al. Imaging outcomes of Liver Imaging Reporting and Data System Version 2014 Category 2, 3, and 4 observations detected at CT and MR Imaging. Radiology 2016. PMID 27115054 3. E Terzi, L. De Bonis, S. Leoni, et al. Dig Liv Dis, 2017; 49, Suppl 1, e 22 30

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Befundung Wieviele “Observations” (Beobachtungen) soll ich beschreiben? Entscheiden Sie aufgrund Ihrer Erfahrung wieviele der Beobachtungen Sie als individuelle Beobachtung (Läsion), als Cluster von Befunden oder kombiniert beschreiben. Drücken Sie sich entsprechend der klinisch relvanten Befunde und Ihrer Eindrücke möglichst präzise aus. Was soll ich beschreiben, wenn keine auffälligen Observationen vorliegen? LR-1 und LR-2 Observationen können im Befund zusammengefasst werden. Die Beurteilung sollte einfache Zusammenfassung , wie “keine malignitätsverdächtigen LI-RADS Observationen” enhalten. Wie soll ich eine schon behandelte Observation beschreiben? Geben Sie die aktuelle Respons-Kategorie und, sofern möglich die Größe des vitalen Tumors an. Geben Sie möglichst auch die LI-RADS Kategorie und Größe vor Therapie an. Beispiel: • • • LR-TR avital, (vor Therapie LR-5, 22 mm) LR-TR vital 20 mm, (vor Therapie, LR-5, 32 mm) LR-TR unklar 15 mm, (vor Therapie, histol. ogisch gesichertes HCC, 21 mm) Was muss bei HCC Transplantationskandidaten berücksichtigt werden? Der standardisierte CT/MRT LI-RADS Befund beschreibt die notwendigen Informationen für Transplantationskandidaten mit HCC: Anzahl und Größe der LR-5 Observationen, LR-5 g Observationen und histopathologisch gesicherte HCC, sowie die Größe deren vitalen Anteils im Falle einer stattgehabten lokoregionären Therapie. Nennen Sie die Hauptmerkmale für jede LR-5 Observation. Geben Sie auch LR-MU und LR-TIV Observationen an, da diese Einfluss auf die Vorbereitung vor Transplantation und die grundsätzliche Transplantationseignung haben können. LR-5 us Observationen sollen angegeben werden, tragen jedoch nicht zum OPTN Staging bei. Was muss bei biopsierten, histo-pathologisch gesicherten Observationen befundet werden? Dies ist abhängig von der pathologischen Diagnose: • • Maligne oder benigne ohne hepatozellulären Ursprung (z. B. Hämangiom): Geben Sie die pathologische Diagnose, klinisch relevante, bildmorphologische Eigenschaften und die evtl. Größenänderung im Vergleich zu Voruntersuchungen an: z. B. , ”histologisch gesichertes Hämangiom, unverändert bzgl. Größe und übriger Bildgebungseigenschaften zu Voraufnahmen”. Benigne oder hepatozellulären Ursprungs (z. B. regenerativer oder dysplastischer Knoten): Geben Sie die LI -RADS Kategorie, pathologische Diagnose, bildmorphologische Eigenschaften und die evtl. Größenänderung im Vergleich zu Voruntersuchungen an: z. B. , “histologisch dysplastischer LR-4 Knoten mit neu aufgetretenem APHE und Intervallwachstum von 12 auf 16 mm”. Was muss berichtet werden im Fall einer Diskrepanz von pathologischer Diagnose und LI-RADS Kategorie? Beschreiben Sie die Diskrepanz unter Angabe der LI-RADS Kategorie und der pathologischen Diagnose. Erklären Sie knapp warum die Diskrepanz vorliegt. Berücksichtigen Sie dabei eine multidisziplinäre Diskussion (“Tumorboard”) mit konsensueller Begutachtung von Histologie, Bildgebung und übriger Befunde, um die Diskrepanz zu rechtfertigen. Wenn pathologisch gesicherte Observationen keiner LI-RADS Kategorie zugeordnet werden sollen, warum soll ich dann deren Bildgebungseingeschaften und Verlaufsänderung beschreiben? Radiologen sollen weiterhin typische und kritische zusätzliche Befunde von pathologisch gesicherten Observationen beschreiben, da eine Verlaufsveränderung dieser Befunde klinisch relevant sein kann: z. B. , “Pathologisch gesichertes Cholangiokarzinom mit bildgebend Intervallwachstum von 22 mm auf 28 mm” oder “Pathologisch gesichertes HCC mit bildgebend venösem Tumoreinbruch im Intervall”. Was muss man angeben, wenn die LI-RADS Kategorie nach den LI-RADS Kriterien nicht meiner aktuellen Malignitätseinschätzung entspricht? Geben Sie die LI-RADS Kategorie und Ihre Einschätzung an: z. B. , “LR-4, höchstwahrscheinlich HCC”. Wo finde ich Befundvorlagen und Beispiele für LI-RADS Befunde? Diese können hier (in Vorbereitung) heruntergeladen werden. 31

LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed FAQs Befundungskriterien Gibt es eine minimale Größe für die Anwendung der Begriffe “Mehranreicherung in der arteriellen Phase”, “washout” oder “Kapsel”? Nein. Es ist ausreichend, wenn der Untersucher die Begriiffe für anwendbar hält. In welcher Ebene sollte die Messung der Läsion durchgeführt werden? Aus Standardiserungsgründen sollte die axiale Ebene vorgezogen werden. Wie auch immer, man kann auch in einer anderen Ebene mit guter Darstellbarkeit und Abgrenzbarkeit der Läsion messen. Es sollte dann bei zukünftigen Untersuchungen die gleiche Ebene zur Verlaufsbeurteilung eingesetzt werden. Kann “Washout” nur bei Läsionen mit “Mehranreicherung in der arteriellen Phase” auftreten? Nein, “Washout” kann auch ohne Mehranreicherung in der arteriellen Phase auftreten, solange überhaupt Anreicherung nachgewiesen werden kann. Müssen “Washout” und “Mehranreicherung in der arteriellen Phase” notwendigerweise im gleichen Anteil der Läsion auftreten? Nein, Mehranreicherung in der arteriellen Phase und Washout müssen nicht notwendigerweise im gleichen Teil der Läsion auftreten. Beispielsweise kann eine 25 mm Läsion eine Mehraneicherung in der arteriellen Phase in einem Abschnitt und Washout in einem anderen Abschnitt als LR-5 kategorisiert werden. Warum erfordert Washout ein Vergleich mit dem umgegenden Lebergewebe und nicht mit Knoten? Historisch wurde in der diesbezüglichen Literatur das Washout einer Observation mit dem Hintergrundlebergewebe verglichen. Dies interpretieren wir als umgebendes Lebergewebe. Bis sich ein alternativer Vergleichsort nachweislich als vorteilhafter erweist hat, behalten wir das aktuelle Vorgehen bei. Warum kann ich das “Washout” nicht in der Übergangsphase beim Gadoxetate-MRT anwenden? Mit dem Gadoxetate-MRT ist die portalvenöse Phase relativ spezifisch für ein HCC. Allerdings weist eine Hypointensität in der Übergangsphase eine unzureichende Spezifität auf, da die KM-Aufnahme des Hintergrundlebergewebes ausreichend hoch ist, dass cholangiozelluläre Karzinome und andere Nicht-HCCMalignome hypointens erscheinen können. Manual (ausstehend) Warum wird in der v 2017 eine Unterscheidung gemacht zwischen für Malignität im Generellen und für HCC im Speziellen? Die meisten für Malignität sprechenden Kriterien sind unspezifisch und tauchen sowohl bei HCCs als auch bei anderen Malignomen auf. Einige für Malignität sprechende Kriterien sind HCC-spezifisch und können helfen zwischen HCC und Nicht-HCC zu unterscheiden. Wenn die Anreicherung des Lebergewebes in der hepatobiliären Phase suboptimal ist, wie kann ich hypointense, isointense oder hyperintense Observationen im Vergleich zum umgebenden Lebergewebe charakterisieren? Wenn eine Observation hypointens in der hepatobiliären Phase ist, kann sie auch bei suboptimalem Enhancement des Parenchyms so charakterisiert werden. Wenn die Läsion iso- oder hyperintens ist, kann die Charakterisierung der hepatobiliären Phase unzuverlässig sein. LR-M-Kriterien scheinen gut anwendbar bei intrahepatischen cholangiozellulären Karzinom zu sein. Wie ist die Situation bei anderen Nicht-HCC-Malignitäten? LR-M-Kriterien wurden auf der Basis von begrenzter verfügbarer Evidenz formulliert, die meisten wurden im Rahmen der Charakterisierung von HCC gegen CCC erfasst. Eine solche Evidenz liegt nicht für andere Nicht. HCC-Läsionen vor. Glücklicherweise sind solche Läsionen selten. Wie werden HCC, CCC und Hepatocholangiokarzinom differenziert? Einige bildgebende Kriterien weisen auf hepatozellulären Ursprung hin (siehe unten). Das Vorliegen solcher Kriterien schließt maligne Läsionen nicht hepatozellulären Ursprungs aus, wie das intrahepatische cholangiozelluläre Karzinom, aber nicht Hepatocholangiokarzinome (H-CHCs), welche beide Elemente enthalten. Implikation: Für maligne Läsionen mit hepatozelulären Eigenschaften kommen die Differenzialdiagnosen HCC und H-CHC in Frage. Eine Differenzierung zwischen HCC und H-CHC ist bildgebend nicht möglich. 32

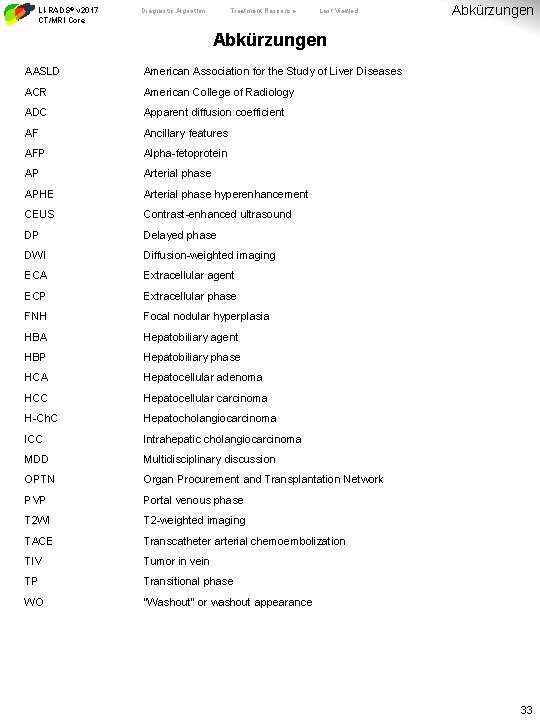
LI-RADS® v 2017 CT/MRI Core Diagnostic Algorithm Treatment Response Last Viewed Abkürzungen AASLD American Association for the Study of Liver Diseases ACR American College of Radiology ADC Apparent diffusion coefficient AF Ancillary features AFP Alpha-fetoprotein AP Arterial phase APHE Arterial phase hyperenhancement CEUS Contrast-enhanced ultrasound DP Delayed phase DWI Diffusion-weighted imaging ECA Extracellular agent ECP Extracellular phase FNH Focal nodular hyperplasia HBA Hepatobiliary agent HBP Hepatobiliary phase HCA Hepatocellular adenoma HCC Hepatocellular carcinoma H-Ch. C Hepatocholangiocarcinoma ICC Intrahepatic cholangiocarcinoma MDD Multidisciplinary discussion OPTN Organ Procurement and Transplantation Network PVP Portal venous phase T 2 WI T 2 -weighted imaging TACE Transcatheter arterial chemoembolization TIV Tumor in vein TP Transitional phase WO “Washout” or washout appearance 33