KEEMILINE SIDE JA AINE EHITUS Martin Saar 2007





















- Slides: 34

KEEMILINE SIDE JA AINE EHITUS Martin Saar 2007

Keemiline side l “Keemilise sideme probleem on kesksel kohal kogu keemias. ” L. Pauling l Üksikud aatomid on ebapüsivad neil on kõrge energia. . . l Seepärast liituvad nad teiste aineosakestega, minnes üle püsivamasse olekusse ehk madalama energiaga olekusse. . . Üksikute aatomite moodustumisel sideme katkemisel aga minnakse üle ebapüsivamasse kõrgema energiaga olekusse. . .

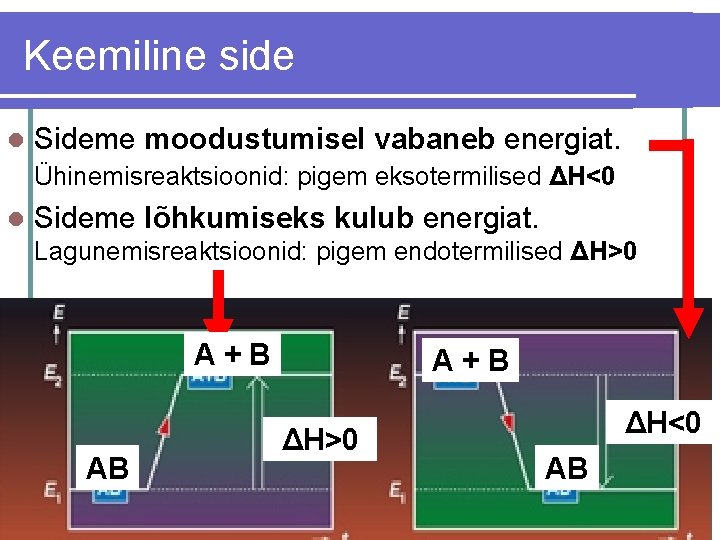
Keemiline side l Sideme moodustumisel vabaneb energiat. Ühinemisreaktsioonid: pigem eksotermilised ΔH<0 l Sideme lõhkumiseks kulub energiat. Lagunemisreaktsioonid: pigem endotermilised ΔH>0 A+B AB A+B ΔH>0 ΔH<0 AB

Keemilise sideme süsteemsus l Aatomite või ioonide vahel molekulis või kristallis Kovalentne – üldiselt 2 või enam mittemetalli l Iooniline – ühendis metall ja mittemetall(id) l Metalliline – metallides l l Molekulide vahel - vesinikside

Keemilise sideme liigid: KOVALENTNE SIDE l Levinuim side. l Moodustub ühise elektronpaari abil. l kumbki aatom annab ühe elektroni elektronpaari, mis jääb tiirlema mõlema aatomi tuuma ümber.

Keemilise sideme liigid: KOVALENTNE SIDE l Peamiselt mittemetalliliste elementide korral: l l Kaks sama mittemetalli (nt H-H ehk H 2) – kovalentne mittepolaarne side. Kaks erineva elektronegatiivsusega mittemetalli (nt H-Cl ehk HCl) – polaarne side. Üks aatom tõmbab ühist elektronpaari tugevamini enda poole. Kokkuleppeliselt on C-H side sisuliselt mittepol. (. . . või ka nõrk metall + nõrk mittemetall (Al 2 S 3), kus elektronide üleminekut ei toimu, sest kumbki pole piisavalt vägev. )

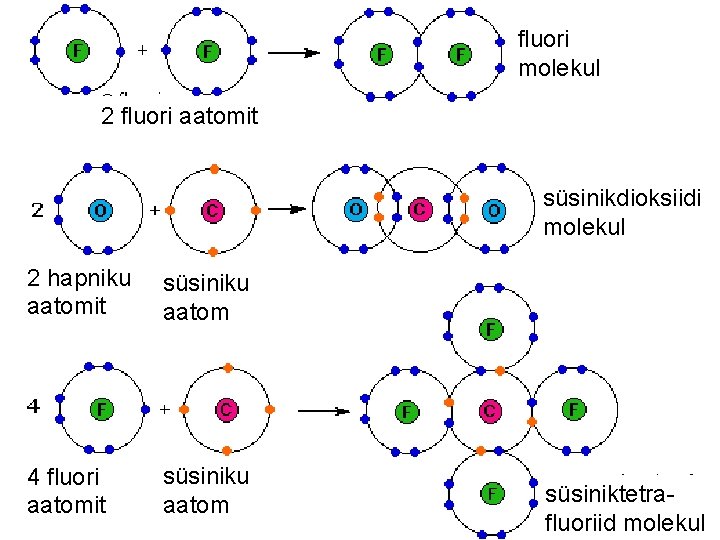
fluori molekul 2 fluori aatomit süsinikdioksiidi molekul 2 hapniku aatomit süsiniku aatom 4 fluori aatomit süsiniku aatom süsiniktetrafluoriid molekul

Keemilise sideme liigid: IOONILINE SIDE Justkui kovalentse sideme piirjuht – puhast ioonilist sidet tegelikult pole. . . l Kui aatomite elektronegatiivsused on väga erinevad (tegemist on tugeva metalli ja tugeva mittemetalliga), l toimub elektronide üleminek ja tekivad ioonid. l Nende ioonide vahel mõjuvad elektrilised tõmbejõud, mis ongi ioonilise sideme alus.

Keemilise sideme liigid: IOONILINE SIDE l Aktiivne metall + aktiivne mittemetall (nt Na. Cl, KF) l l Elektronegatiivsus on elemendi aatomite võime tõmmata enda poole ühist elektronpaari. Kui on tegemist nõrga metall ja/või nõrga mittemetalliga (nt Ca. C 2, Al 2 S 3), siis elektronide üleminekut ei toimu, sest kumbki pole piisavalt vägev. Vaadeldav side on ikkagi valdavalt kovalentne.

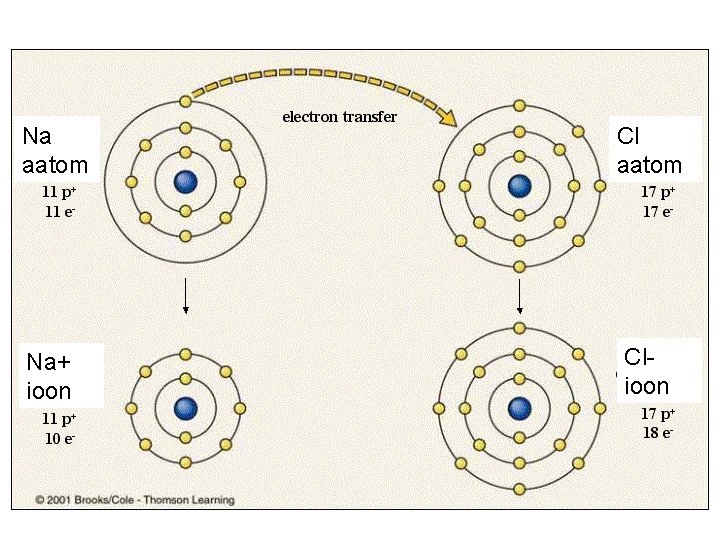
Na aatom Cl aatom Na+ ioon Clioon

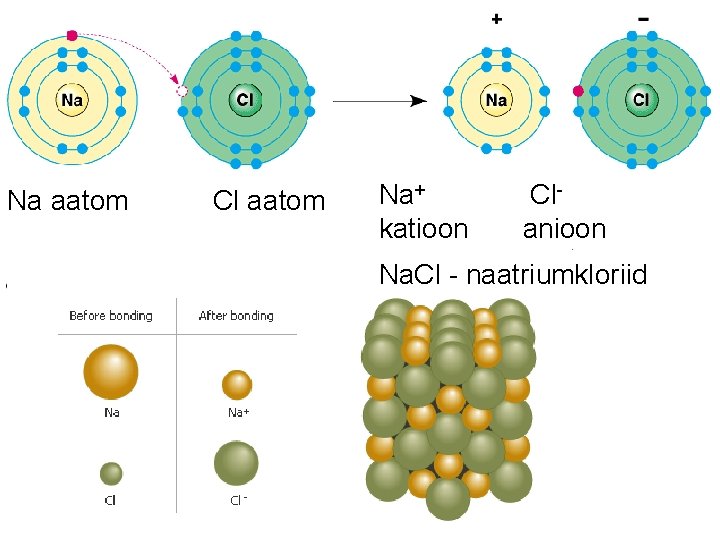
Na aatom Cl aatom Na+ katioon Clanioon Na. Cl - naatriumkloriid

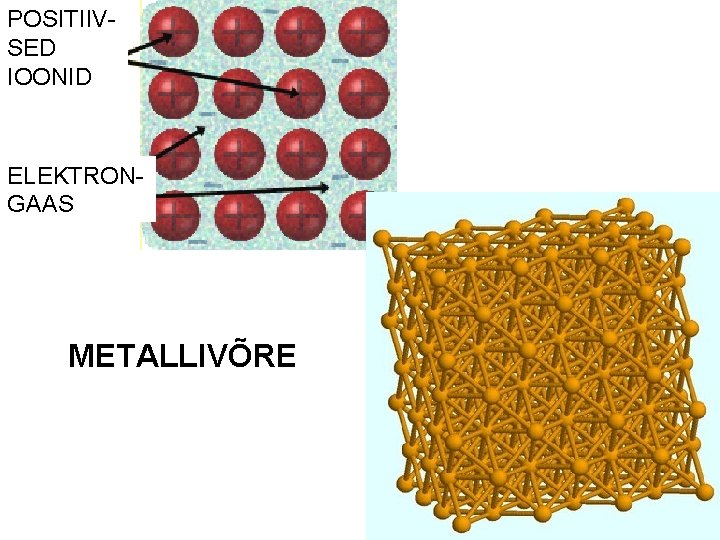
Keemiline side: METALLILINE SIDE l Metalli aatomid paiknevad üksteisele nii lähedal, et väliskihtide orbitaalid osaliselt kattuvad. l Seega hakkavad väliskihi elektronid liikuma kiiresti ühe tuuma mõjualast teise juurde ja nii üle kogu kristalli – elektrongaas.

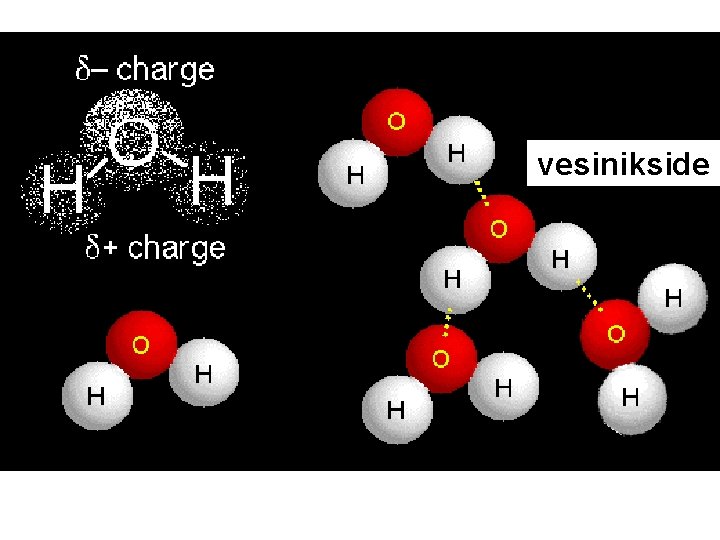
Keemiline side: VESINIKSIDE Esineb vesinikku sisaldavate molekulide vahel, kus vesinik on ühendis fluori, hapniku või lämmastikuga (nt HF, H 2 O, NH 3) ning tal on seetõttu positiivne osalaeng. l Positiivse osalaenguga vesiniku aatom seotakse elektrostaatiliselt järgmise molekuli elektronegatiivsema (F, O, N) aatomiga, millel on negatiivne osalaeng ja põhimõtteliselt vaba elektronpaar l

vesinikside

KEEMILINE SIDE JA AINE EHITUS l metall (lihtaine) metalliline side metallivõre l akt. metall + akt. mittemetall iooniline side ioonvõre l peamiselt üks või enam mittemetalli kovalentne side aatomvõre (hiigelstruktuur) või molekulvõre (molekulaarsed ained)

Kristallivõre tüübid: metallvõre l Sõlmpunktides asuvad metalli katioonid, mida hoiavad koos vabalt ja korrapäratult liikuvad elektronid ehk elektrongaas metalliline side. l Sideme iseloomu (elektrongaas) tõttu juhivad elektrit ja soojust, on plastilised ja läikivad. l Lihtained: Na, Zn, Fe, Al

POSITIIVSED IOONID ELEKTRONGAAS METALLIVÕRE

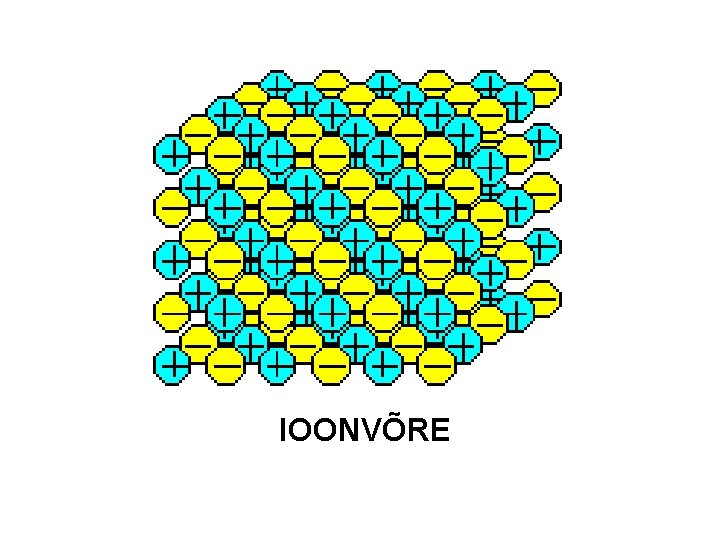
Kristallivõre tüübid: ioonvõre l Kristallivõre sõlmpunktides on laenguga osakesed ioonid, nende vahel mõjub iooniline side. l Ainetel suhteliselt kõrge sulamistemperatuur, ained haprad, lahustuvad sageli vees ja teistes polaarsetes lahustes l Liitained metallist ja mittemetalli(de)st: Cs. Cl, KF, Ba. O, Na. OH

IOONVÕRE

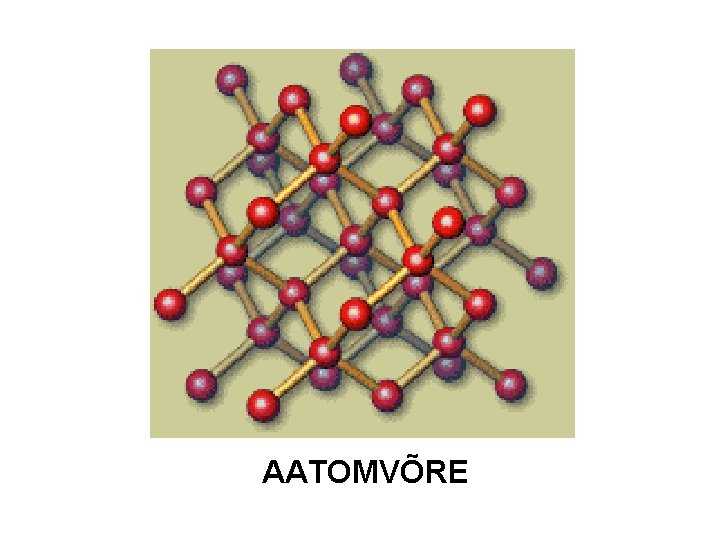
Kristallivõre tüübid: aatomvõre Kristallivõre sõlmpunktides aatomid, mida seob kovalentne side (molekule pole!) l Kõrge sulamistemperatuur, suur kõvadus, vees praktiliselt lahustumatud ja elektrit ei juhi. l l l Lihtained: C (teemant), Si, B – indeksita mittemetallid! Mõningad kovalentse sidemega liitained mittemetallidest: Si. O 2, Si. C, BC + Kovalentse sidemega liitained metall + mittemetall: Zn. S, Mg. O)

AATOMVÕRE

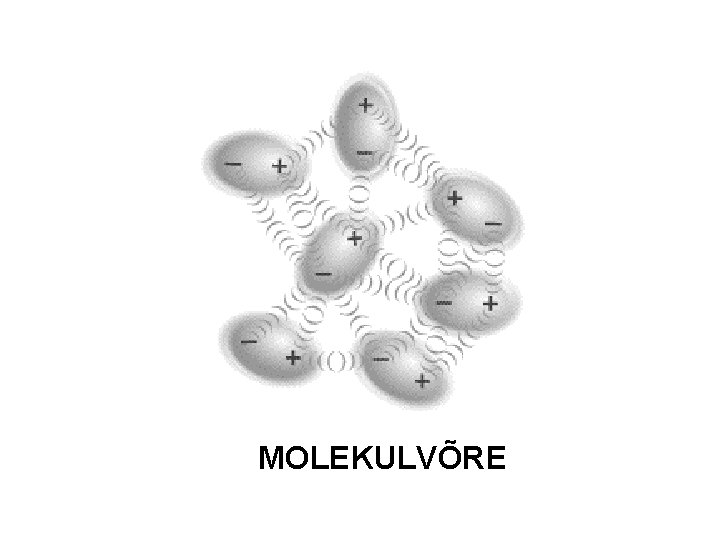
Kristallivõre tüübid: molekulvõre l Kristallivõre sõlmpunktides molekulid, mille vahel mõjuvad suhteliselt nõrgad molekulidevahelised tõmbejõud. (Molekulide sees aatomite vahel on kovalentsed sidemed. ) l Madal või mõõdukas sulamistemperatuur, aurustuvad kergest (iseloomulik lõhn), pehmed. Vees lahustuvad vähe või praktiliselt mitte. l l Lihtained: H 2, O 2, N 2, VIIA, S 8 - indeksiga mittemetallid Enamik liitaineid kovalentsete sidemetega seotud mittemetallide aatomitest: CO 2, NH 3, H 2 O, enamik orgaanilisi ühendeid

MOLEKULVÕRE

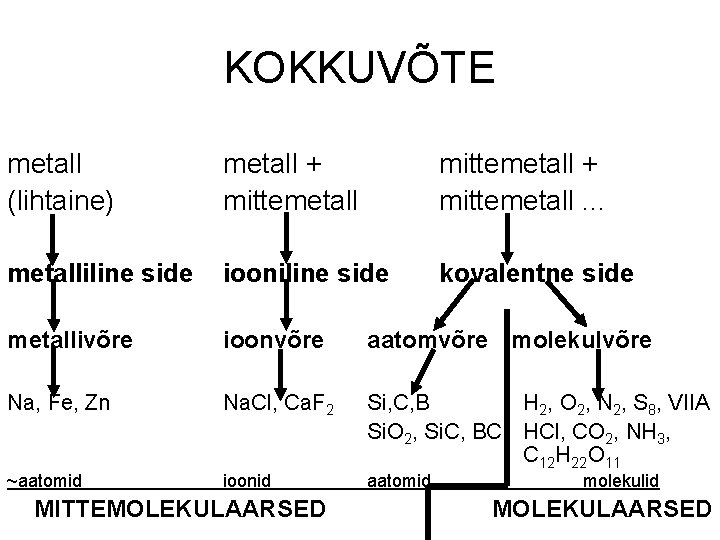
KOKKUVÕTE metall (lihtaine) metall + mittemetall. . . metalliline side iooniline side kovalentne side metallivõre ioonvõre aatomvõre molekulvõre Na, Fe, Zn Na. Cl, Ca. F 2 ~aatomid ioonid Si, C, B H 2, O 2, N 2, S 8, VIIA Si. O 2, Si. C, BC HCl, CO 2, NH 3, C 12 H 22 O 11 MITTEMOLEKULAARSED aatomid molekulid MOLEKULAARSED

KORDAVALT LIHTAINED l metallid (Fe. . . ) – metalliline side – metallvõre - mittemolekulaarne l mittemetallid – kovalentne mittepolaarne side Molekulaarsed (H 2. . . ) – molekulvõre l Mittemolekulaarsed (Si. . . ) – aatomvõre l

KORDAVALT LIITAINED l aktiivne metall + aktiivne mittemetall (Na. Cl) – iooniline side – ioonvõre - mittemolekulaarne l l (vähemaktiivne) metall + mittemetall (Al 2 O 3) – kovalentne side – aatomvõre - mittemolekulaarne mitu mittemetalli – kovalentne side l l tavaliselt molekulaarsed ained (CO 2, suhkur) – molekulvõre mõnel puhul ka aatomvõre, näiteks Si. C, BC, Si. O 2 (mittemolekulaarne)

Õige variant! Reaktsioon 2 H 2 + O 2 2 H 2 O on eksotermiline/endotermiline. Järelikult on sideme H-H ja O=O lõhkumisel eralduv/neelduv energiahulk suurem/väiksem kui sidemete H-O tekkel eralduv/neelduv energiahulk. ΔH on seega >0/<0. Ioonvõrega ained on kõrge/madala sulamistemperatuuriga, mistõttu nad on tavatingimustes gaasilises/vedelas/tahkes olekus.

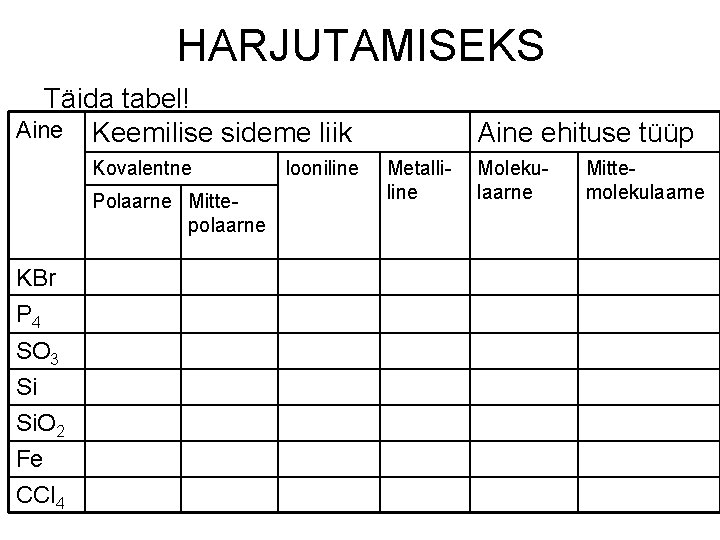
HARJUTAMISEKS Täida tabel! Aine Keemilise sideme liik Kovalentne Polaarne Mittepolaarne KBr P 4 SO 3 Si Si. O 2 Fe CCl 4 Iooniline Aine ehituse tüüp Metalliline Molekulaarne Mittemolekulaarne

Ülesanne l Valige alltoodud ainete hulgas. . . a) kolm ainet, milles esineb polaarne kovalentne side b) kolm ainet, milles (tahkes või vedelas olekus) on osakeste vahel molekulidevahelised tõmbejõud KBr, S 8, Fe, C (teemant), CCl 4, Ca, C 12 H 22 O 11, Ba. Cl 2, Si. O 2 (kvarts)

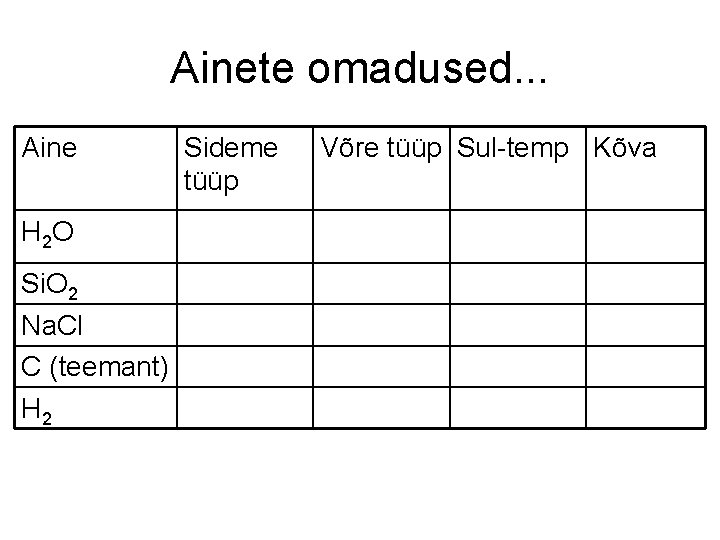
Ainete omadused. . . Aine H 2 O Si. O 2 Na. Cl C (teemant) H 2 Sideme tüüp Võre tüüp Sul-temp Kõva

Sulamistemperatuur l Kummal on madalam sulamistemperatuur. . . Na. Cl või PCl 5? l H 2 O või Ca. O? l Cl 2 või I 2? l

Aine ehitusest veel. . . l Võtame elemendid Na, C, Si, N, S, Cl l Kirjutage nende kõrgeima o. -a. -ga oksiidide valemid. l Milline on sideme tüüp ja kristallivõre tüüp (ning aine ehitus: molekulaarne või mittemolekulaarne) neis ainetes?

MÕTLEMISEKS l Millised keemilised sidemed katkevad. . . Vee elektrolüüsil? l Vee destilleerimisel? l Lume sulamisel? l Naatriumitüki lõikamisel? l Tahke joodi aurustamisel? l Suhkru peenestamisel? l Keedusoola sulatamisel? l

Vesinikside l Kas vesinikside saab tekkida: l Vesinikfluoriidhappes HF? l Kaaliumkloriidis KCl? l Metaanhappes HCOOH? l Ammoniaagis NH 3? l Etaanis C 2 H 6
 Keemiline evolutsioon
Keemiline evolutsioon Organismide keemiline koostis
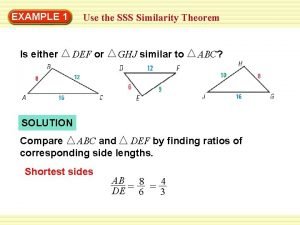
Organismide keemiline koostis Sss similarity theorem
Sss similarity theorem Side side side similarity
Side side side similarity Sss similarity theorem examples
Sss similarity theorem examples Angle angle similarity
Angle angle similarity Martin saar õpetaja
Martin saar õpetaja Reaktsioonivõrrandite tasakaalustamine ülesanded
Reaktsioonivõrrandite tasakaalustamine ülesanded Griechische mythologie gaia
Griechische mythologie gaia Ukr aine
Ukr aine Tiheduse mõõtühik
Tiheduse mõõtühik Triangle de jean-louis petit et quadrilatère de grynfelt
Triangle de jean-louis petit et quadrilatère de grynfelt Aatomvõre
Aatomvõre Pihustuskeskkond
Pihustuskeskkond Happelisele mullale lisatav aine happesuse vähendamiseks
Happelisele mullale lisatav aine happesuse vähendamiseks Liht ja liitained
Liht ja liitained Nielty myrkyllinen aine
Nielty myrkyllinen aine Aine hulga mõõtühik
Aine hulga mõõtühik Karboksyylihapot
Karboksyylihapot Millainen aine on lämmönjohde
Millainen aine on lämmönjohde Vks ruokalista
Vks ruokalista Jose schutt-aine
Jose schutt-aine Aine agregaatolek
Aine agregaatolek Lms gmit.tj
Lms gmit.tj Aine menos gastrolesivo
Aine menos gastrolesivo Horizontal plane border movement
Horizontal plane border movement Soda lime uses
Soda lime uses Plug or slot weld symbol
Plug or slot weld symbol Side by side stuff
Side by side stuff Perfect competition side by side graphs
Perfect competition side by side graphs Videocon refrigerator temperature settings
Videocon refrigerator temperature settings Side angle side theorem
Side angle side theorem Regular hexagonal lamina has
Regular hexagonal lamina has Sin inverse -1
Sin inverse -1 Uil side by side
Uil side by side