KEEMILINE SIDE II KEEMILISED REAKTSIOONID Loeng 7 Keskkonnakeemia






















- Slides: 23

KEEMILINE SIDE (II) KEEMILISED REAKTSIOONID Loeng 7 Keskkonnakeemia alused 30. märts 2007

Molekulidevahelised jõud on tingitud molekulide polaarsusest või polariseeritavusest ja neil on elektriline iseloom. Eristatakse 3 tüüpi molekulide vastasmõju: 1) 2) 3) Orientatsiooniline (2 polaarset molekuli, ka ioonset) Induktsioonne (polaarne ja mittepolaarne molekul) Dispersioonne (kaks mittepolaarset molekuli)

Orientatsioonijõud … on jõud püsiva dipoolmomendiga polaarsete molekulide vahel või ioon-dipool vastastoime (näiteks, HCl ja HCl) Eor = - 2μ 2/r 3 kus μ - dipoolmoment r - kaugus ioonide-dipoolide tsentrite vahel

Induktsioonijõud …jõud polaarsete ja mittepolaarsete molekulide vahel (polaarne molekul tekitab teises samuti dipoolmomendi; näiteks, HCl ja Ar) Eind = - 2αμ 2/r 6 kus α - polariseeritavus (näitab kui kergesti on elektronpilv deformeeritav) Reeglina - mida suurem on elektronide arv, seda kaugemal on nad tuumast, seda suurem polariseeritavus

Dispersioonijõud … elektronide liikumisel tekkivate hetkdipoolide nõrk vastastikune mõju (näiteks, He ja He vahel) Edisp = - 3/4 Iα 2/r 6 kus I - ionisatsioonienergia (suureneb molaarmassi kasvuga) Van der Waalsi jõud kahanevad kaugusega väga kiiresti, eriti olulised on nad tugevasti kokkusurutud gaasides, vedelikes, aga ka molekulvõrega kristallides

Erinevate vastasmõju energiate võrdlus Vastasmõju tüüp Energia, k. J/mol Keemiline side ~200 -600 Vesinikside ~20 -40 Orientatsioonijõud ~1 -5 Induktsioonijõud ~0. 05 -2 Dispersioonijõud ~0. 05 -2

Keemilised reaktsioonid (I) Keemiline reaktsioon on aine muutus, millega kaasneb aatomitevaheliste keemiliste sidemete teke või katkemine Näiteks: 1) nitraadid nitoosamiinideks metabolismi käigus fermentide abil. Meie organism toodab nn toksiini. 2 NO 3– + X → RR’N-N=O, mis mürgine 2) tsüaniidist, mis vähem mürgine tekib organismis tsüaanhape, mis väga mürgine RCN → HCN + RH 3) Vihmavee happesuse tekkimine CO 2 + H 2 O → H 2 CO 3 4) Äikese ajal reaktsioon õhus N 2 + O 2 → NO 2

Keemilised reaktsioonid (II) Keemilised reaktsioonid alluvad teatud seadustele - massi, energia, elektrilaengu, aatomite hulga jäävuste seadustele. Keemiline reaktsiooni toimumiseks peavad molekulid põrkuma, olema kindlal viisil orienteeritud ja omama kindlat reaktsiooniks vajalikku energiat (kile). Valguskvandi neeldumisel võib muutuda molekuli pöörlemis-, võnkumisenergia, elektronide jaotus energiate kaupa, tuumaenergia. Molekuli energia suureneb ja molekul muutub reaktsioonivõimelisemaks. Reaktsiooniks vajalik lisaenergia väheneb (kile).

Keemilised reaktsioonid (III) 1) Termilised - molekulid (aatomid) põhiolekus - vajalik teatud temperatuur 2) Fotokeemilised - molekulid (aatomid) ergastatud olekus teatud kvantseisundis, etteantud energiaga

Keemiline termodünaamika … käsitleb erinevate energiavormide vastastikust üleminekut keemilises protsessis. Termodünaamika (t-d) üldisemas mõistes uurib soojuse ja töö, kahe energialiigi seost. Keemiline termodünaamika (t-d) vaatleb protsesse nende võimalikkuse, kulgemise suuna ja lõpptulemuste seisukohalt… … uurib süsteeme (paljudest molekulidest, aatomitest, ioonidest radikaalidest koosnevaid); uurib üldomadusi, laskumata süsteemi sisemise ehituse üksikasjadesse. Reaktsiooni keskkond kui süsteem on kas a) avatud, b) suletud või c) isoleeritud vastavalt energia või/ja massi vahetuse olemasolule ümbritseva keskkonnaga. Kõigis neis süsteemides võib muutuda rõhk(p), ruumala(V) ja temperatuur(T).

Olekuparameetrid (OP) ja olekufunktsioonid (OF) OP on tavaliselt mõõdetavad suurused: temperatuur T, rõhk P, ruumala V, ainehulk n OF on funktsioon, mis sõltub ainult süsteemi olekust, olekuparameetritest, mitte aga selle oleku saavutamise teedest (Hessi seadus - reaktsiooni soojusefekt ei sõltu reaktsiooni teest) ΔU = ΣUprod – ΣUreag U - siseenergia, isokooriline reaktsiooni soojusefekt (V=const) H – entalpia, isobaariline soojusefekt (P=const) S – entroopia Sgaas > Svedel > Stahke G - Gibbsi energia ΔG = ΔH -TΔS

Gibbsi energia Süsteemi vabaenergia muutus 1 mooli aine tekkel elementidest standardtingimustel on tekke vabaenergia ΔG 0298. standardväärtus (teatmikest leida) Keemilise reaktsiooni kulgemisel G väheneb, kuni saavutab minimaalse väärtuse Gmin. Püsivat tasakaalu konstantse T ja P korral iseloomustab Gibbsi energia miinimum ΔG = 0 Iseeneslikud protsessid suletud süsteemis viivad paratamatult tasakaaluolekusse, energia miinimumi suunas , st Gibbsi energia süsteemis väheneb ΔG < 0 μ - keemiline potentsiaal - so Gibbsi energia osatuletis üht liiki molekulide järgi μi = (ðG/ðni)P, T, n

Gibbsi vaba energia ΔG < 0 ΔG = ΔH –TΔS on reaktsiooni spontaansuse (iseenesest toimumise) mõõduks Neli (4) võimalust ΔH ja –TΔS kombinatsioonil ΔH ΔS T ΔG 1) – + mis iganes 2) – – – – madal kõrge – spontaanne +mittespontaanne 3) + – mis iganes +mittespontaanne 4) + + madal kõrge + mittespontaanne – spontaanne

Molekulide tekke-entalpia ΔH 0298. - soojushulk, mis vabaneb või neeldub liitaine tekkimisel lihtainetest konstantsel rõhul p = 1 atm ja temperatuuril 298 K (standardtingimustel) on standardne molekuli tekkeentalpia Püsivate lihtainete ΔH 0298. = 0 C + 2 O 2 = CO 2 -393, 5 k. J/mool (eksotermiline r-n) ΔH 298 = ΔHCO 2 - 2ΔHO 2 -ΔHc = - 393, 5 – 0 = - 393, 5 k. J/mol C + 2 H 2 = C 2 H 4 + 52, 3 k. J/mool (endotermiline r-n)

Endotermilised ja eksotermilised protsessid ΔH = ΣHprod - ΣHreag Kui entalpia muut on negatiivne -ΔH, siis eksotermiline protsess, reaktsiooni käigus eraldub energia Eksotermiline reaktsioon Kui entalpia muut on positiivne +ΔH, siis endotermiline protsess, reaktsiooni käigus neelatakse energiat

TERMOKEEMIA - KÜLMAPAKENDID Esmaabis sportlastele, meditsiinis üldse Pakend: kuiv kemikaal NH 4 NO 3 + tasku veega H 2 O. Löögiga tasku katki ja reaktsioonil veega neeldub soojus. NH 4 NO 3 (t) + H 2 O NH 4+n. H 2 O + NO 3–m. H 2 O (+ ΔH) ΔH = +26, 2 k. J/mol ΔH > 0, so endotermiline reaktsioon, soojus neeldub Tavaliselt pakendis 30 g NH 4 NO 3 + 100 ml H 2 O temperatuur langeb 20º 0 ºC

KUUMAPAKEND (Ca. Cl 2 või Mg. SO 4 ) + H 2 O on aluseks Vee ampulli katkitegemisel toimub reaktsioon Ca. Cl 2 + n. H 2 O = Ca 2+aq + 2 Cl–aq ΔH = - 82, 8 k. J/mol ΔH < 0, eksotermiline reaktsioon, eraldub soojus Tavaliselt pakendis 40 g Ca. Cl 2 + 100 ml H 2 O temperatuur tõuseb 20° 90 °C

KEEMILINE KINEETIKA Gaasilises olekus molekuli kineetiline energia sõltub temperatuurist Ekin. = 3/2 k. T kus k on Boltzmanni konstant Gaasikonstant arvestab 1 mooli ainega, milles 6, 02. 1023 molekuli R = k NA = 8, 13 J/mol Reaktsioon toimumiseks peavad molekulid: 1) omama kindlat reaktsiooni barjääri ületavat energiat, 2) olema orienteeritud sobivalt Reaktsiooni barjäär on kõrge endotermiliste reaktsioonide puhul, madalam (aga olemas) eksotermiliste reaktsioonide puhul.

Reaktsiooni kiirus 2 NO + O 2 V↔V 2 NO 2 V 1 = k 1[NO]2[O 2] V 2 = k 2[NO 2]2 Arrheniuse võrrand k = Aexp(-Ea/RT) ln k = A – Ea/RT Kiiruskonstant k on funktsioon reaktsiooni aktiveerimisenergiast Ea ja temperatuurist T (A on konstant) Termodünaamiline tingimus reaktsiooni toimumiseks peab olema täidetud Gibbsi vabaenergia muut ΔG = ΔH – TΔS (peab olema negatiivne) ΔG <0

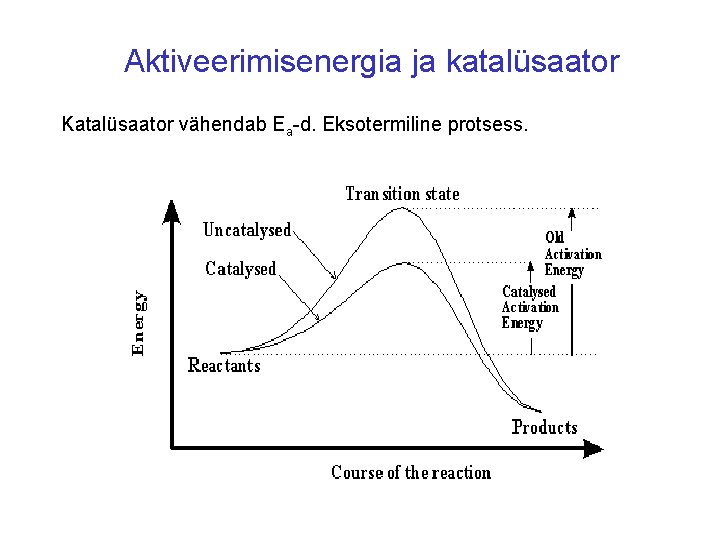
Katalüsaatorid ja inhibiitorid Katalüsaator vähendab aktiveerimisenergiat, reaktsiooni kiirus kasvab. Katalüsaator muudab reaktsiooni kulgemise teed ja lõpuks taastub esialgses hulgas ja esialgsete keemiliste omadustega. Inhibiitor aeglustab reaktsiooni kulgu, tõstab aktiveerimisenergiat EA.

Aktiveerimisenergia ja katalüsaator Katalüsaator vähendab Ea-d. Eksotermiline protsess.

Homogeenne ja heterogeenne katalüüs Homogeenne katalüüs – kõik ained, nii reagendid kui ka katalüsaator, on samas faasis (kas gaasilises, vedelas või tahkes) 2 SO 2 + (NOx )-> 2 SO 3 2 SO 2 + 2 NO 2 = 2 SO 3 + 2 NO + O 2= 2 NO 2 Heterogeenne katalüüs – reagendid ja katalüsaator on erifaasides C 2 H 4 + H 2 + (Ni) = C 2 H 6 eteeni C 2 H 4 ja vesiniku H 2 reaktsioon metalse Ni pinnal toimub mitmes järgus (kile!!! järgmine slaid) Gibbsi vabaenergia muut ΔG = ΔH -TΔS peab olema negatiivne (ΔG<0), et reaktsioon toimuks

Eteeni reaktsioon nikli pinnal 1) difusioon pinnale, ained orienteeruvad pinnal 2) adsorptsioon (metalli pinnaomadused ja reagentide struktuuromadused Ni. C 2 H 4* ja Ni. H 2*) , mille tulemusena algab 3) reaktsioon, katkeb kaksikside kahe C vahel eteenis ja nõrgeneb keemiline side kahe H aatomi vahel vesiniku molekulis ning tekib reaktsiooni produkt - etaan C 2 H 6 4) desorptsioon, so etaani eraldumine pinnalt. adsorptsiooni-jõud on nõrgemad kui eteenil 5) difusioon Tekkinud Kokku see oli hüdreerimis-reaktsioon C 2 H 4 + H 2 = C 2 H 6 etaani
 Keemilised elemendid jagunevad
Keemilised elemendid jagunevad Maaamet
Maaamet Organismide keemiline koostis
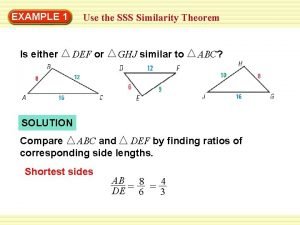
Organismide keemiline koostis Sss similarity theorem examples
Sss similarity theorem examples Similar picture
Similar picture Sss similarity theorem examples
Sss similarity theorem examples Sss similarity theorem
Sss similarity theorem Glass will break first on the weaker side, the side:
Glass will break first on the weaker side, the side: Red side blue side
Red side blue side Monoplane teeth
Monoplane teeth A circular plate of negligible thickness
A circular plate of negligible thickness Perfect competition side by side graphs
Perfect competition side by side graphs Client side and server side
Client side and server side Side angle side theorem
Side angle side theorem Platzbedarf side by side melkstand
Platzbedarf side by side melkstand Tea side by side
Tea side by side Immediate side shift and progressive side shift
Immediate side shift and progressive side shift Two wheels roll side by side
Two wheels roll side by side Side by side stuff
Side by side stuff M&a process timeline
M&a process timeline Videocon refrigerator temperature settings
Videocon refrigerator temperature settings Root gap
Root gap Trigonometry
Trigonometry What is the other side of the prime meridian called
What is the other side of the prime meridian called