Molekulide teke KEEMILINE SIDE FOTOKEEMILISED PROTSESSID Loeng 5

































- Slides: 46

Molekulide teke KEEMILINE SIDE FOTOKEEMILISED PROTSESSID Loeng 5 - 6 Keskkonnakeemia alused 16. 03. 07, 23. 07

Lihtained ja keemilised elemendid Lihtaine koosneb ühe ja ainult ühe keemilise elemendi aatomitest (liitaine koosneb mitme erineva keemilise elemendi aatomitest). Teemant, seatina… Lihtainet iseloomustavad makro-omadused: tihedus, lahustuvus, sulamistemperatuur, keemistemperatuur jne. Keemilist elementi iseloomustavad mikro-omadused: tema aatomi ehitus, so tuumalaeng, isotoopkoosseis, oksüdatsiooniaste, elektronegatiivsus, ionisatsioonipotentsiaal, raadius jne.

Keemiliste elementide olekud (gaas, vedel, tahke) ~ 116 teadaolevast keemilisest elemendist normaaltingimustes (25 C ja 1 atm) gaasilises olekus 11 elementi: 8 -nda rühma elemendid, väärisgaasid (He, Ne, Ar, Kr, Xe, Rn) ja molekulaarsed gaasid H 2, N 2, O 2, F 2, Cl 2. 2 elementi on vedelas olekus: Hg ja Br 2. Ülejäänud on tahkes olekus, kui üldse esinevad ehedalt looduses (Au, Ag, Pd, Cu, S).

MOLEKULIDE TEKE …. aatomitest viib süsteemi energia vähenemisele. Molekulid on normaaltingimustel (toatemperatuuril ja rõhul ~1 atm = 105 k. Pa) reeglina stabiilsemad kui aatomid. Õpetus aatomite ehitusest on aluseks molekulide tekke mehanismidele ja selgitab keemilise sideme olemust. Aatomite väliselektronkihis on 1 kuni 8 elektroni. Maksimaalse (8) elektronide arvuga kiht on täitunud. Täitunud kihti (8 e) iseloomustab väga suur stabiilsus, tugevus – OKTETI REEGEL. Väärisgaasidel Ar, Kr, Xe, Rn on väliskihis 8 elektroni (ns 2 np 6), He erandina 2 elektroni (s 2). Teistel keemiliste elementide aatomitel on väliskihid täitumata (1 -7) ja keemilisel vastasmõjul nad täituvad.

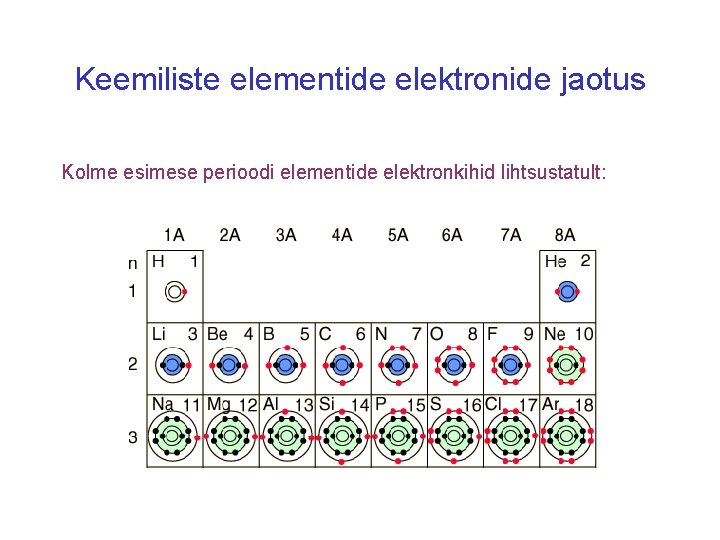
Keemiliste elementide elektronide jaotus Kolme esimese perioodi elementide elektronkihid lihtsustatult:

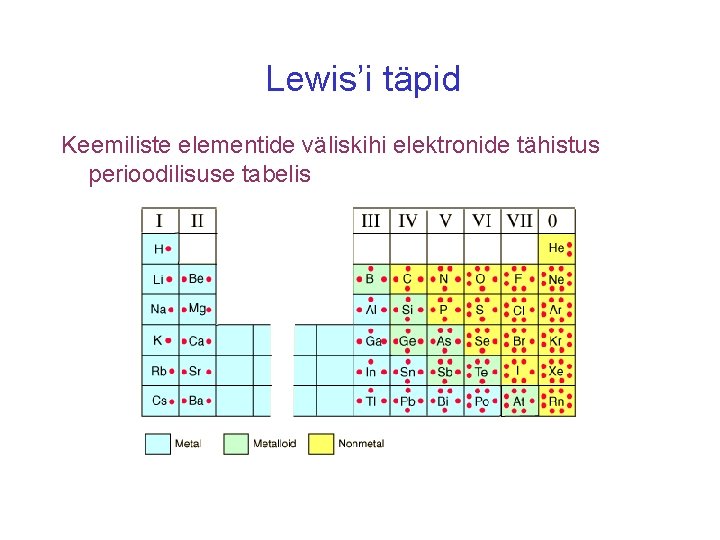
Lewis’i täpid Keemiliste elementide väliskihi elektronide tähistus perioodilisuse tabelis

H 2 molekuli teke aatomitest Miks tekivad molekulid? Miks ei esine looduses H, O, N, F, Cl, Br, J atomaarsetena? Kilel: molekuli teke

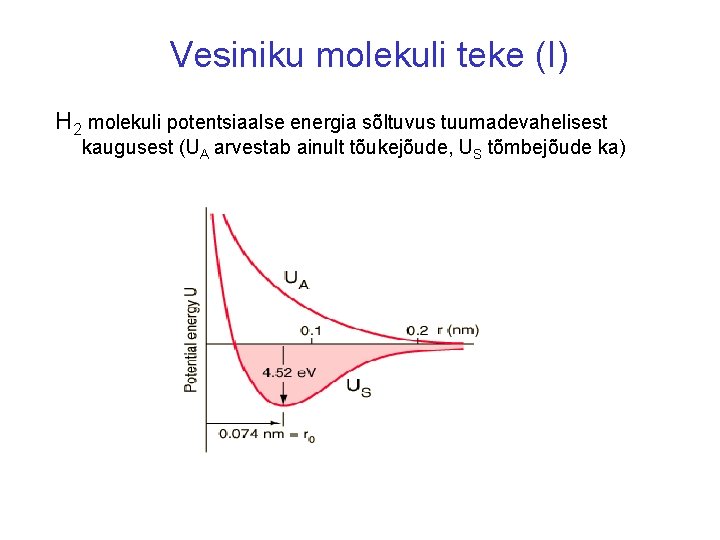
Vesiniku molekuli teke (I) H 2 molekuli potentsiaalse energia sõltuvus tuumadevahelisest kaugusest (UA arvestab ainult tõukejõude, US tõmbejõude ka)

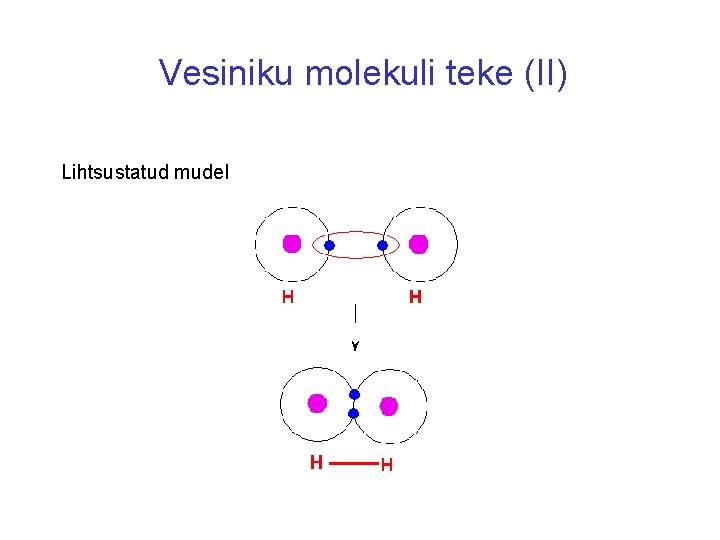
Vesiniku molekuli teke (II) Lihtsustatud mudel

F 2, N 2 ja O 2 molekulide teke aatomitest Kilel molekulide teke (okteti - 8 elektroni väliskihis - reegel aluseks) • : N • • lämmastikul on puudu 3 elektroni • : O • '' hapnikul on puudu 2 elektroni : F • '' flooril on puudu 1 elektron Keemiline side teostub ühiste elektronpaaride kaudu F 2 O 2 N 2 ühekordne side, üks ühine paar elektrone kahekordne side, kaks ühist elektronpaari kolmekordne side, kolm ühist elektronpaari (tugevaim side reas N 2 - O 2 - F 2)

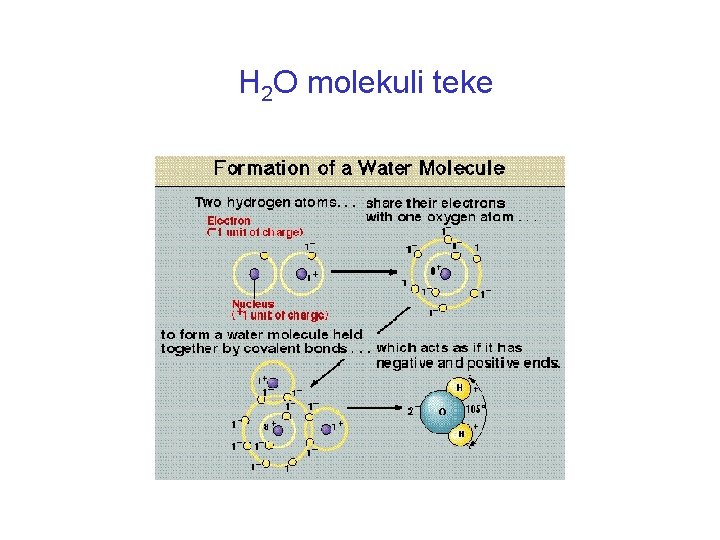
H 2 O molekuli teke

Keemiline side - keemia ‘võti’ Õpetus keemilisest sidemest on kaasaegse keemia tugisambaks, keskseks õpetuseks. Molekulide teke aatomitest viib süsteemi energia vähenemisele. Molekulid on reeglina stabiilsemad kui aatomid. Keemiliste elementide aatomite täitumata (1 -7) väliskihid täituvad keemilisel vastasmõjul. Keemilise sideme tekke füüsikaliseks põhjuseks on ühinevate aatomite valentselektonide kollektiviseerumine (ühistumine) molekulis.

Keemiline side (II) Keemiline side (KS) on jõud, mis hoiab kokku aatomeid molekulis. KS teostub valentselektronide arvel erineval viisil (Lewis’ sümbolid täppidena keemilise elemendi ümber näitavad valentselektronide arvu) Tuntakse kovalentset, ioonset ja metallilist sidet KS tugevuse mõõduks on tema energia KS energia - energia, mis on vajalik sideme katkemiseks Keemilise sidema energiat mõõdetakse kilodžaulides ühe mooli aine kohta (k. J/mol). Tavaliselt 200 -650 k. J/mol 50 -150 kkal/mol (umbes 2 -6 e. V)

Kovalentne keemiline side teostub ühiste elektronpaaride kaudu (kas mõlema aatomi valentselektronidest või ainult üks aatom annab vajaliku elektronpaari ühisorbitaalile; doonor-aktseptor side, kui ainult üks aatom annab elektronpaari). Kovalentset KS iseloomustab tema pikkus, energia, küllastatus ja suunatus. Keemiliselt on side seda tugevam, mida lühem on ta pikkus (so 2 aatomi tuumade vaheline kaugus , tavaliselt 1 -2 Å ). KS küllastatus on aatomite võime moodustada piiratud arv kovalentseid sidemeid. KS suunatus määrab molekuli ruumilise struktuuri, st tema geomeetria.

Kovalentne side Mittepolaarne kovalentne side teostub alati homeopolaarsetes, ühesugustest aatomitest koosnevates molekulides Cl 2 F 2 N 2 O 2 (ka CO 2, CH 4, Polaarne kovalentne side on iseloomulik hetero-nukleaarsetele molekulidele (koosnevad erinevate elementide aatomitest) HF, H 2 O, NH 3 Eripära – keemilist sidet moodustavate elektronide nihkumine molekuli elektronegatiivsema aatomi poole.

Elektronegatiivsused ja sideme tüübid EN-st sõltuvalt: Ühend F 2 EN erinevus 4, 0 - 4, 0 = 0 Sideme tüüp Mittepolaarne kovalentne HF Li. F 4, 0 - 2, 1 = 1, 9 4, 0 - 1, 0 = 3, 0 Polaarne kovalentne Ioonne

Polaarne kovalentne side Näide: fluorvesinikhape

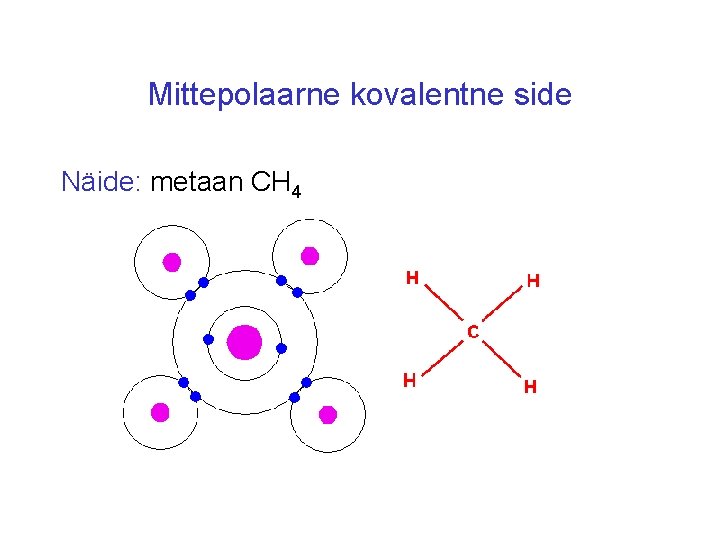
Mittepolaarne kovalentne side Näide: metaan CH 4

Keemilise sideme energia suurus hüdriidide molekulides Mõnede VII-IV rühmade elementide (Z) hüdriidid Rühma number VII Hüdriidi keemiline valem ja Z-H sidemeenergia, k. J/mol HF 560 HCl 426 HBr 364 HI 293 VI H 2 O 463 H 2 S 347 H 2 Se 276 H 2 Te 238 V NH 3 380 PH 3 323 As. H 3 281 Sb. H 3 256 IV CH 4 414 Si. H 4 320 Ge. H 4 291 Sn. H 4 258

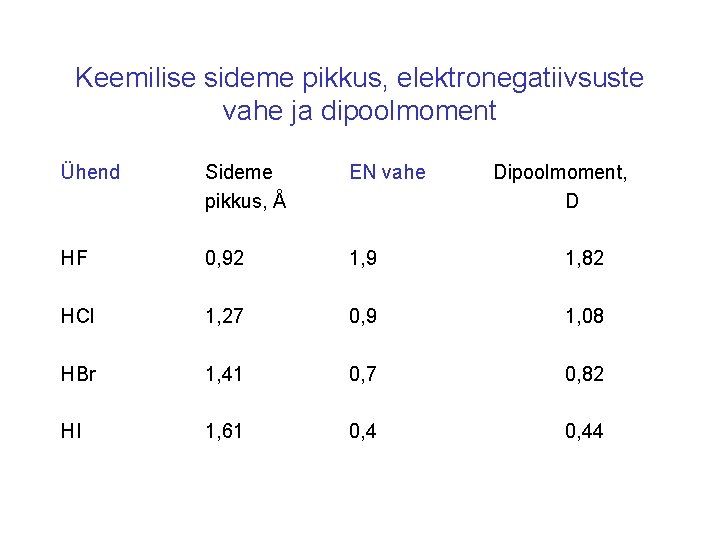
Keemilise sideme pikkus, elektronegatiivsuste vahe ja dipoolmoment Ühend Sideme pikkus, Å EN vahe Dipoolmoment, D HF 0, 92 1, 9 1, 82 HCl 1, 27 0, 9 1, 08 HBr 1, 41 0, 7 0, 82 HI 1, 61 0, 44

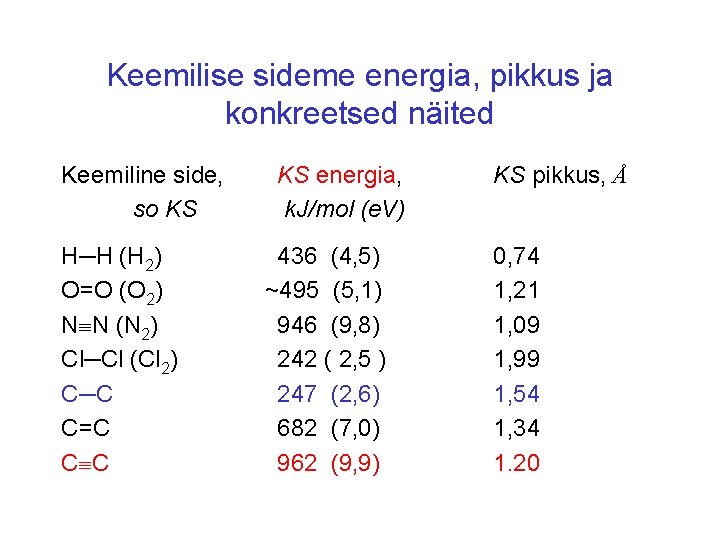
Keemilise sideme energia, pikkus ja konkreetsed näited Keemiline side, so KS H─H (H 2) O=O (O 2) N N (N 2) Cl─Cl (Cl 2) C─C C=C C C KS energia, k. J/mol (e. V) 436 (4, 5) ~495 (5, 1) 946 (9, 8) 242 ( 2, 5 ) 247 (2, 6) 682 (7, 0) 962 (9, 9) KS pikkus, Å 0, 74 1, 21 1, 09 1, 99 1, 54 1, 34 1. 20

Ioonne side tekib, kui väikese ionisatsioonipotentsiaaliga keemilise elemendi valentselektronid (väliskihi elektronid) lähevad üle elemendile, millel on suur elektronafiinsus. Seejuures ioonid omandavad inertse gaasi (1 s 2 või ns 2 np 6) või pseudoinertse gaasi (ns 2 np 6 nd 10) elektronkonfiguratsiooni. ns 2 np 6 elektronkonfiguratsiooni stabiilsust defineeritakse kui okteti reeglit (eelviimasel kihil reeglina 8 elektroni) Leelishalogeniidid (Na. Cl, KCl, Na. Br, KI jne) on tüüpilised ioonse sidemega ühendid. Lewis’i punktid valentselektronide tähisteks.

Keemilise sideme tekke näiteid H 2, Cl 2 ja HCl molekulide teke ja keemilise sideme märgistus Lewis’ täppide või kriipsuna

Ioonse sideme teke Näide:

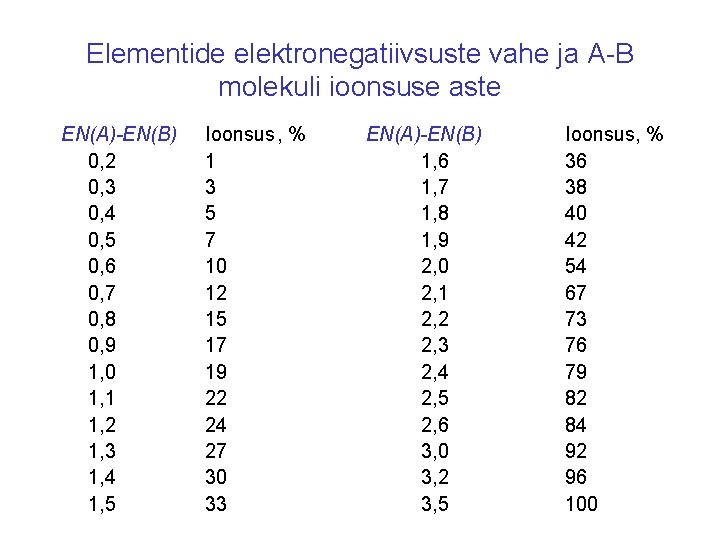
Elementide elektronegatiivsuste vahe ja A-B molekuli ioonsuse aste EN(A)-EN(B) 0, 2 0, 3 0, 4 0, 5 0, 6 0, 7 0, 8 0, 9 1, 0 1, 1 1, 2 1, 3 1, 4 1, 5 Ioonsus, % 1 3 5 7 10 12 15 17 19 22 24 27 30 33 EN(A)-EN(B) 1, 6 1, 7 1, 8 1, 9 2, 0 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 3, 0 3, 2 3, 5 Ioonsus, % 36 38 40 42 54 67 73 76 79 82 84 92 96 100

Metalliline side …selgitab metallide füüsikalisi omadusi. Metallidel on väliselektronkihis vähe elektrone – kuueteistkümnel ainult 1, viiekümne kaheksal 2, neljal 3, pallaadiumil (Pd) mitte ühtegi. Ge, Sn, Pb, Sb, Bi, Po ei ole tüüpilised metallid. Element metall moodustab lihtaine metalli, millel on kristalne struktuur. Na aatomil (nagu teistel metallidelgi) on valentsorbitaalide ülejääk ja elektronide puudujääk. Valents elektron 3 s 1 võib asustada ühe 9 -st vabast orbitaalist 3 s (1), 3 p (3) ja 3 d (5). Kristallvõre tekkimisel aatomid lähenevad ja nende valentsorbitaalid kattuvad tänu millele on elektronid vabalt liikuvad ühelt orbitaalilt teisele. . . Tekib ‘elektrongaas’, keemiline side metallilistes kristallides on delokaliseeritud

Vesinikside on omapärane keemiline side. Ta võib olla molekulidevaheline ja molekulisisene. 20 -40 k. J/mol, 120 -130 pm. Molekulidevaheline vesinikside tekib molekulide vahel, mis koosnevad vesinikust ja suure elektronegatiivsusega keemilisest elemendist (fluor, hapnik, lämmastik, harvem kloor ja väävel). Molekulisisene vesinikside tekib suurtes orgaanilistes molekulides, kui on erinevaid funktsionaalseid rühmi, milledes hapnik, lämmastik, väävel.

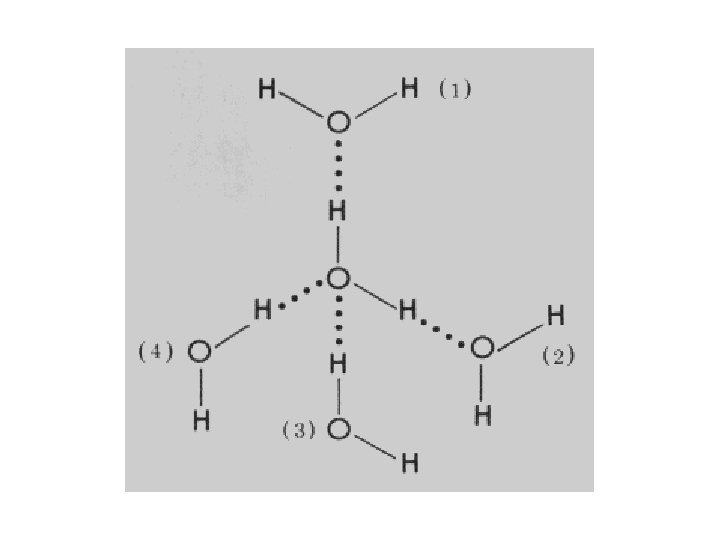
Vesinikside vees


VESINIKSIDE (II) Vesiniksideme tugevus 1 -2 k. J/mool kuni 40 k. J/mool, mis lähedane kovalentsele, nagu HF 2− ioonil. Tüüpilised sidemeenergia väärtused on: O—H. . . : N (7 kcal/mol) O—H. . . : O (5 kcal/mol) N—H. . . : N (3 kcal/mol) N—H. . . : O (2 kcal/mol) Tüüpiline vesiniksideme pikkus vees on 197 pm (1. 97 Å).

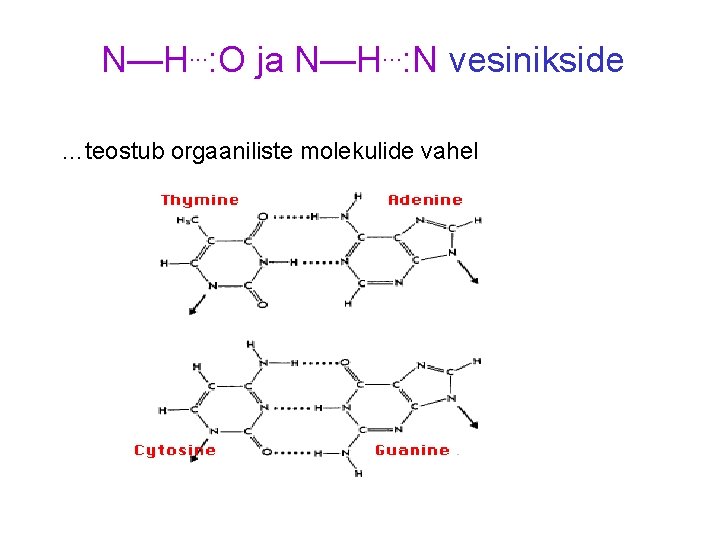
N—H. . . : O ja N—H. . . : N vesinikside …teostub orgaaniliste molekulide vahel

Molekulid gaasilise olekus toatemperatuuril (RT) Peavad vastama teatud tingimustele: 1) Mittemetallide kovalentsed ühendid H 2, N 2, O 2, CO, N 2 O, NO 2 jne CH 4, NH 3, HCN 2) Väikese molekulmassiga reeglina (erandiks SF 6, CF 2 Cl 2 jne)

Fotokeemilised protsessid (I) Fotokeemia on teadus keemilistest protsessidest, ilmnevad pärast molekulide elektronergastust elektromagneetilise kiirgusega, so ergastatud osakeste keemia Elektromagnetiline kiirgus koosneb footonitest, milledel on teatud sagedus v ja energia E E = hv h – Plancki konstant = 6, 6262. 10 -34 J. s/footon c- valguse kiirus = 3 x 108 m/s c = /T = v v = c/ E = hc/ (1/T = v)

Fotokeemilised protsessid (II) Keemias käsitletakse aineid moolidena 1 mool sisaldab Avogadro arv NA molekule NA = 6, 02. 1023 molekuli E = NAhv = NAhc/ E = 119625/ E = 1239, 8/ (v = c/ ) c- valguse kiirus (E - k. J/mool; -nm) (E - e. V; -nm) Fotokeemikud kasutavad osakeste elektronseisundite kirjeldamiseks spektroskoopia keelt

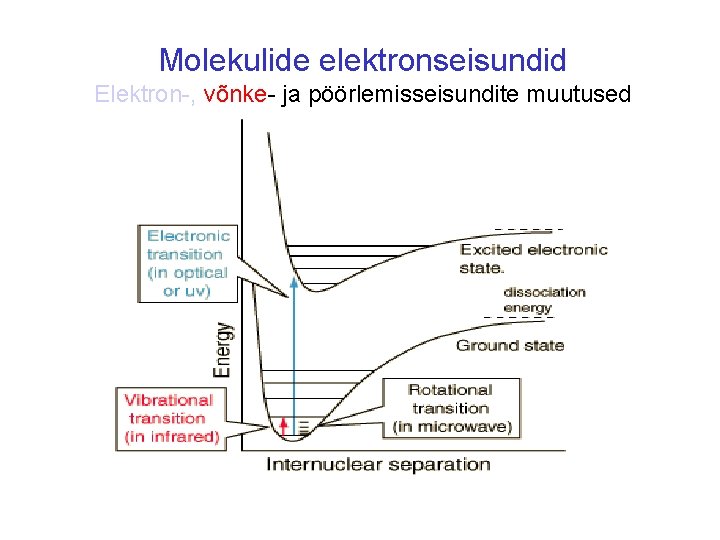
Molekulide elektronseisundid Elektron-, võnke- ja pöörlemisseisundite muutused

Elektromagnetkiirguse (EMK) spekter

EMK olulised piirkonnad fotokeemias Ultravioletne kiirgus lainepikkusega 100– 400 nm Nähtav valgus lainepikkusega 400– 700 nm Lähis-infrapunane lainepikkusega 700– 1000 nm EMK - elektromagnetkiirgus

Päikese spekter Infrapunane (IP) kiirgus sagedusega 1012 ja 1014 Hz sunnib molekule kiiremini võnkuma, mis omakorda tõstab temperatuuri ( > 800 nm) Nähtav valgus on suurema energiaga (sagedus ~1014 Hz) ja võib ergastada mõnede keemiliste sidemete elektrone. Nähtav valgus annab energiat taimede lehtede klorofüllisse fotosünteesiks UV kiirguse footonid on veel suurema energiaga (sagedus 1014 kuni 1016 Hz) ja nad võivad lõhkuda lihtsamaid kovalentseid sidemeid ( < 400 nm). Tulemuseks võib olla elusrakkude häving. Lähi-UV = 400 -200 nm; Vaakum-UV = 200 -100 nm Kauge-UV = 100 – 10 nm X-, gammakiired, galaktikast kosmilised kiired < 10 nm (ioniseeriv kiirgus)

Päikese-energia neelajad Atmosfäär neelab lühilainelist (suure energiaga) kiirgust O 2 < 200 nm H 2 O < 180 nm CO 2 < 165 nm N 2, H 2 < 100 nm Fotokeemilist aktiivne on pikemalainelisem kiirgus. Troposfääri fotokeemias domineerivad O 3, NO 2, SO 2 ja HCHO (metanaal e formaldehüüd) neelavad lähis-UV (200 -400 nm) kiirgust Maapinna lähedale jõuab kiirgus > 300 nm (~400 k. J/mool), ~ 500 nm (~240 k. J/mool) maksimumis (klorofülli süntees) (osoon neelab < 290 nm)

UV kiirguse jaotus ja (mõju) Kauge UV 100< <200 nm (O 2 diss-n) Keskmine UV ehk UV-C 200< <280 nm (O 3 diss-n) UV-B 280< <320 nm (biosfäärile) UV-A 320< <400 nm (nahale)

Fotokeemia seadused ja põhimõtted (reeglid) 1) Ainult see osa kogu pealelangevast kiirgusest, mida molekul absorbeerib (st neelab) on efektiivne järgneva fotokeemilise ahela initsieerimiseks (algatamiseks) 2) Iga neeldunud footon energiaga E=hv aktiveerib ainult üht molekuli ja on ühe fotokeemilise ahela algataja 3) Iga neeldunud footon annab ainult ühe kindla võimaluse täita madalaimat singletset ja tripletset ergastatud olekut 4) Fotokeemilises protsessis on reeglina oluline vaid madalaim ergastatud energeetiline nivoo

Valguskvant, fotofüüsikalised protsessid Valguskvant ehk footon on kindla energiaga E, sõltuvalt valguse sagedusest ehk lainepikkusest: E = hv v on sagedus h on Plancki konstant 6, 626 10 -34 J. s = …. . k. J. s Valguskvandi neeldumine molekuli AB poolt on esmaseks aktiks AB + hv AB* ja edaspidised protsessid 1) Fotofüüsikalised AB* + CD AB + CD* energia ülekanne AB* + M AB + M füüsikaline kustumine AB* AB + hv 1 luminestsents (2) Fotokeemilised

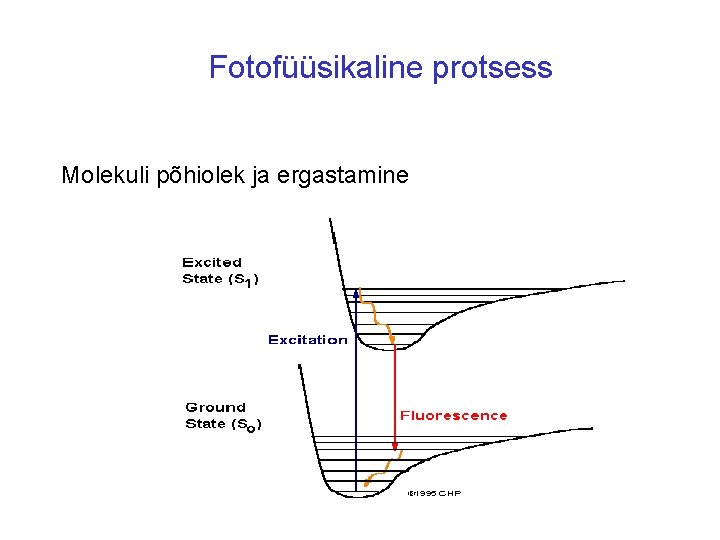
Fotofüüsikaline protsess Molekuli põhiolek ja ergastamine

Fotokeemilised reaktsioonid (üldist) Valguskvandi hv neeldumine molekuli AB poolt on esmaseks aktiks AB + hv AB* A + B AB* + C AC + B AB* AB+ + e dissotsiatsioon asendusreaktsioon ionisatsioon E = NAhv =NAhc/ ( c on valguse kiirus c = v c = 3, 0 x 108 m/s) E = 119627/ k. J/mool 1 mooli ergastamiseks vajalik energia oleks Fotokeemiliselt aktiivne kiirgus on lainepikkusega 200 - 600 nm, mis vastab energiatele piirkonnas 600 – 200 k. J/mol

LÄMMASTIK Õhus on lämmastik molekulaarsena N 2, molekulmass on 28. Ülesanne: Lämmastiku molekuli N 2 sideme energia on 941 k. J/mool. Milline on suurima lainepikkusega footon, millel on küllalt energiat, et dissotsieerida N 2 aatomiteks? h - Plancki konstant c – valguse kiirus 6, 6262. 10 -34 J. s/footon 3 x 108 m/s

Ülesanne Lämmastikku N 2 on õhus ~78 ruumala % hapnikku O 2 ~21% Kas massi-protsentides jäävad arvud samaks või muutuvad ja miks ning kuidas?
 Maaamet
Maaamet Organismide keemiline koostis
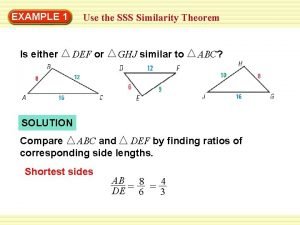
Organismide keemiline koostis How to prove triangles similar
How to prove triangles similar Similar font
Similar font Sss similarity theorem
Sss similarity theorem Angle angle similarity postulate
Angle angle similarity postulate Krooniline apikaalne periodontiit
Krooniline apikaalne periodontiit Taşeli platosu neden seyrek nüfusludur
Taşeli platosu neden seyrek nüfusludur Kamil teke
Kamil teke Teke 2
Teke 2 Ookeanilise maakoore peamine koostisosa
Ookeanilise maakoore peamine koostisosa Fluori elektronskeem
Fluori elektronskeem Naturaalandam
Naturaalandam Bağımsız sıralı cümle nedir
Bağımsız sıralı cümle nedir A regular hexagon lamina has
A regular hexagon lamina has Sine and cosine law
Sine and cosine law Side angle side theorem
Side angle side theorem Red side blue side
Red side blue side The incisal guidance angle varies directly with.
The incisal guidance angle varies directly with. Uil tea side by side
Uil tea side by side Perfect competition side by side graphs
Perfect competition side by side graphs What is server side scripting language
What is server side scripting language Two wheels roll side by side
Two wheels roll side by side Melkgeschirr aufbau
Melkgeschirr aufbau M&a process timeline
M&a process timeline Movement of mandible muscles
Movement of mandible muscles Welding symbols iso
Welding symbols iso Side by side stuff
Side by side stuff Glass will break first on the weaker side, the side:
Glass will break first on the weaker side, the side: Videocon refrigerator temperature settings
Videocon refrigerator temperature settings Oklahoma gang
Oklahoma gang 30 of the best far side cartoons of all time
30 of the best far side cartoons of all time Engine on half power ahead - steer 182 degrees port side.
Engine on half power ahead - steer 182 degrees port side. Cna chapter 10 positioning transfers and ambulation
Cna chapter 10 positioning transfers and ambulation Male reproductive system labelled
Male reproductive system labelled Quarter moon
Quarter moon Keva silver plus benefits
Keva silver plus benefits Auxiliary motion definition
Auxiliary motion definition Propranolol side effects
Propranolol side effects Antonina bureacenco
Antonina bureacenco Engineering curves
Engineering curves Dark side of leadership
Dark side of leadership Money side up
Money side up It is a small round knob on the side of the microscope
It is a small round knob on the side of the microscope Demand side economics
Demand side economics Apical side of epithelial cells
Apical side of epithelial cells Potassium sparing diuretics mechanism of action
Potassium sparing diuretics mechanism of action