IKATAN KIMIA Definisi Tarikan antara sesama atom yang

























- Slides: 27

IKATAN KIMIA

Definisi Tarikan antara sesama atom yang cukup kuat untuk mempertahankan atom-atom tersebut dalam unit-unit yang dapat dideteksi Hal ini terjadi akibat interaksi elektron pada permukaan atom yang membentuk susunan elektron baru diseputar inti yang memiliki energi potensial total yang lebih rendah dari pada atom terisolasi (tunggal)

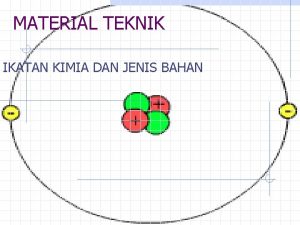
IONIK dan KOVALEN Ikatan kimia terbentuk melalui penggunaan elektron bersama atau pengalihan elektron di antara atom Bila elektron berpindah dari satu atom ke atom yang lain dihasilkan ikatan ionik Bila elektron digunakan bersama di antara atom dihasilkan ikatan kovalen Molekul nyata menunjukkan adanya suatu kontinum dari ikatan ionik murni sampai ikatan kovalen murni dan kebanyakan memiliki sifat campuran antara ionik dan kovalen. Ikatan yang terjadi karena perpindahan muatan secara parsial ialah kovalen polar

Energi ionisasi dan Afinitas ELektron Energi ionisasi (IE) adalah energi minimum yang diperlukan untuk mengambil satu elektron dari satu atom, molekul atau ion yang berada dalam keadaan dasar. Afinitas elektron (EA) merupakan perubahan energi menjadi negatif yang terjadi bila elektron ditambahkan ke dalam atom

Elektronegatifitas Elektronegativitas merupakan ukuran kecendrungan atom atau molekul untuk menarik elektron ke dirinya sendiri dalam suatu ikatan kimia Perbandingan nilai elektronegatifitas dua atom menyiratkan apakah keduanya akan membentuk ikatan ionik, kovalen atau kovalen polar

IKATAN IONIK

IKATAN IONIK Terbentuk antara atom-atom yang memiliki selisih elektronegativitasnya besar, misalnya Na dan F Ion bermuatan berlawanan distabilkan oleh gaya tarik Coulomb diantara kedua ion; magnitudo energi stabilisasi dapat diperkirakan dengan menghitung energi potensial Coulomb antara ion-ion

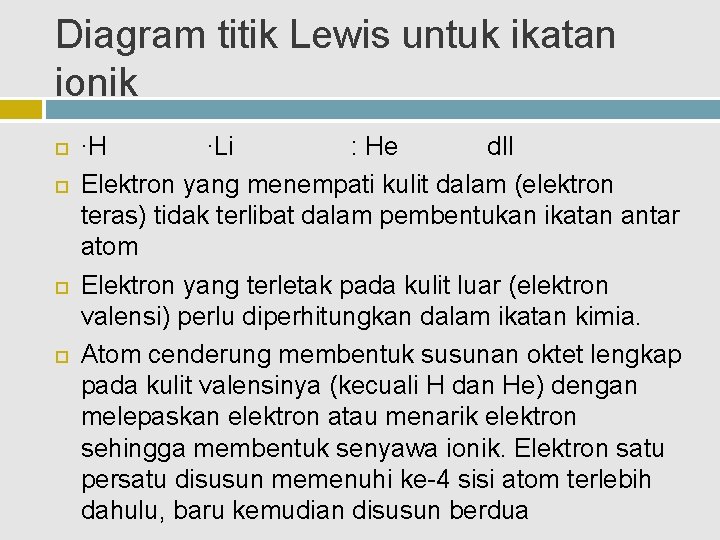
Diagram titik Lewis untuk ikatan ionik ∙H ∙Li : He dll Elektron yang menempati kulit dalam (elektron teras) tidak terlibat dalam pembentukan ikatan antar atom Elektron yang terletak pada kulit luar (elektron valensi) perlu diperhitungkan dalam ikatan kimia. Atom cenderung membentuk susunan oktet lengkap pada kulit valensinya (kecuali H dan He) dengan melepaskan elektron atau menarik elektron sehingga membentuk senyawa ionik. Elektron satu persatu disusun memenuhi ke-4 sisi atom terlebih dahulu, baru kemudian disusun berdua

Nama dan Rumus Senyawa Ionik Kation dari gol I dan II dinamai dengan nama yang sama dengan atomnya seperti natrium dan kalsium Kation gol III, IV dan V sering membentuk beberapa ion stabil, maka ditambahkan angka romawi dalam tanda kurung sesudah nama logamnya seperti besi (II), besi (III) Anion monoatomik dinama dengan menambahkan akhiran -ida seperti klorida, dan oksida Senyawa oksanion yang memiliki dua jenis ion diberikan akhiran -at dan -it Bila lebih dari jenis ion diberi awalan per- dan hipo -

Energi Stabilisasi Coulomb K K + + e. IE = +419 k. J/mol F + e- F EA = -328 k. J/mol Dibutuhkan energi lain untuk memindahkan satu elektron dari atom kalium ke atom fluorin; energi yang harus diinvestasikan untuk membentuk K+ lebih besar dibandingkan energi yang dilepaskan bila F- terbentuk Jika demikian, bagaimana ikatan ionik terbentuk?

Energi Stabilisasi Coulomb Sewaktu dua ion berlawanan saling mendekat, gaya coulomb akan saling tarik menarik Ketika dua ion mendekat, terbentuk interaksi ion positif dan negatif yang menghasilkan energi Coulomb yang negatif, sehingga energi total akan menurun Pada jarak yang cukup pendek, tarik menarik Coolumb jauh lebih besar daripada energi yang diperlukan untuk memindahkan elektron sehingga ikatan ionik akan terbentuk

IKATAN KOVALEN

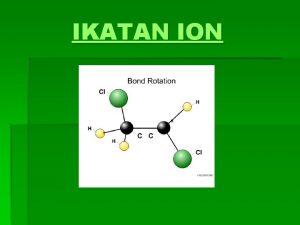
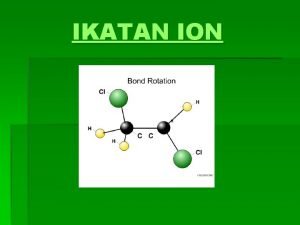
Sifat Ikatan Kimia Kovalen Ikatan kovalen dibentuk oleh dua atom dengan nilai elektronegativitas yang sama atau mirip, keduanya berbagi elektron dan membentuk ikatan antara kedua atom Sifat penting dalam ikatan kovalen adalah panjang ikatan dan energi ikatan Ikatan kovalen juga memiliki orde ikatan, contohnya C-C, C=C, C C

Pasangan elektron bersama Molekul 2 yang memiliki elektronegativitas relatif sama, sehingga tidak dimungkinkan terjadinya perpindahan elektron, bagaimana terjadinnya ikatan? Elektron dianggap sebagai titik bermuatan negatif yang berinteraksi dengan dua inti hidrogen. Gaya tersebut cenderung mendekatkan kedua inti, dengan demikian memperkuat ikatan Model Lewis menggambarkan ikatan kovalen sebagai pasangan elektro-valensi bersama yang terletak diantara kedua inti

Pasangan elektron bersama Pasangan elektron juga dapat digambarkan dengan garis pendek H∙ — Cl Pasangan elektron tak bersama disebut pasangan menyendiri dan mereka tidak berpartisipasi dalam pembentukan ikatan Model diagram Lewis tidak menunjukkan geometri ruang molekul. Bentuk 3 D molekul kebanyakan tidak planar Ikatan kovalen juga terbentuk lebih dari 1 pasangan elektron (ikatan rangkap 2 atau 3)

IKATAN KOVALEN POLAR

Ikatan Kovalen Polar Berdasarkan pengamatan dalam laboratorium, ikatan kimia tidak sepenuhnya polar atau kovalen. Hal ini ditunjukkan dengan perpindahan muatan secara parsial. Ikatan kovalen polar berdasarkan kemampuan salah satu atom untuk menarik elektron ke dirinya dari atom lain tanpa melakukan perpindahan secara sempurna. Kemampuan ini dihitung dengan membandingkan nilai elektronegativitas dari kedua atom

Selisih Elektronegativitas Nilai mutlak dari selisih elektronegativitas kedua atom yang berikatan ini menyatakan tingkat polaritas ikatannya (lihat tabel 3. 7). Selisih yang besar (lebih besar dari 2. 0) berarti bahwa ikatan itu ionik dan pengalihan elektron terjadi secara sempurna atau nyaris sempurna ke atom yang lebih elektronegatif. Selisih yang kecil (kurang dari 0. 4) menandakan bahwa ikatan pada umumnya adalah kovalen, dengan elektron dalam ikatan terbagi merata. Nilai pertengahan dari selisih nini menyatakan terjadinya ikatan kovalen polar dengan sifat

Momen Dwikutub Momen dwikutub merupakan ukuran yang berguna untuk sifat ionik dan selisih elektronegativitas. Momen dwikutub —> persen sifat ionik tidak selalu menunjukkan 100% ionik. Hal ini terjadi karena: (satu) sumbangan kovalen menghasilkan pemakaian bersama di antara atom-atom; (kedua) distribusi muatan elektron diseputar salah satu ion terdistorsi oleh medan listrik dari ion lainnya (polarisasi).

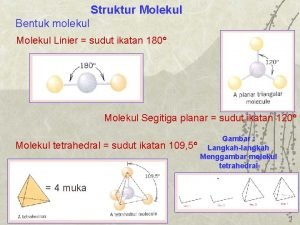
Bentuk molekul : Teori VSEPR

Bentuk Molekul Keberhasilan reaksi bisa saja bergantugn pada bentuk tiga dimensi dan orientasi relatif molekul-molekul tersebut serta identitas kimianya Bentuk molekul menentukan aktivitas kimia senyawa/unsur Bentuk molekul atau geometri diatur oleh energinya, molekul memiliki geometri yang memberinya energi potensial terendah. VSEPR = valence shell electron-pair repulsion = teori tolakan pasangan-elektron kulit valensi

Bilangan Oksidasi

Jumlah bilangan oksidasi (biloks) atom dalam molekul netral adalah 0, dan biloks ion sama dengan muatan ion itu Atom logam alkali mempunyai biloks +1, atom alkali tanah +2 dalam senyawa Fluorin mempunyai biloks -1 dalam senyawanya. Halogen lain memiliki biloks -1 dalam senyawa, terkecuali halogen tersebut disertai oksigen, maka halogen mempunyai biloks +

Hidrogen mempunyai biloks +1 dalam senyawa, terkecuali hidrida logam seperti Li. H, biloks H -1 Oksigen ditentukan biloks -2 dalam senyawa. Perkecualian untuk persenyawaan dengan fluorin biloks +2 dan senyawa yang mengandung ikatan O-O biloksnya -1

Penamaan Senyawa Kovalen Biner

Gunakan awalan Yunani untuk menunjukkan jumlah atom setiap unsur dalam rumus molekul senyawa Tuliskan biloks dari nama unsur pertama dengan angka romawi dan letakkan dalam tanda kurung sesudah nama unsur itu

Terima kasih Question Please
 Sudut ikatan kimia
Sudut ikatan kimia Teknik ikatan menggunakan bahan
Teknik ikatan menggunakan bahan Pengertian struktur lewis
Pengertian struktur lewis Gaya tarikan dan dorongan
Gaya tarikan dan dorongan Definisi ikatan datif
Definisi ikatan datif Ikatan elektrovalen
Ikatan elektrovalen Contoh ayat tolong menolong
Contoh ayat tolong menolong Peta konsep peduli
Peta konsep peduli Prinsip dasar menyayangi sesama
Prinsip dasar menyayangi sesama Interaksi sesama manusia
Interaksi sesama manusia Persaudaraan sesama mukmin didasari
Persaudaraan sesama mukmin didasari Sebutkan keuntungan perilaku husnuzan terhadap diri sendiri
Sebutkan keuntungan perilaku husnuzan terhadap diri sendiri Jelaskan pengertian cabang ilmu kimia termokimia
Jelaskan pengertian cabang ilmu kimia termokimia Besarnya dorongan atau tarikan
Besarnya dorongan atau tarikan Gaya tarikan adalah
Gaya tarikan adalah Dalam ilmu pengetahuan alam tarikan atau dorongan disebut
Dalam ilmu pengetahuan alam tarikan atau dorongan disebut Sehorizontal mungkin adalah
Sehorizontal mungkin adalah The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Kelemahan teori atom thomson
Kelemahan teori atom thomson Ikatan monosakarida
Ikatan monosakarida Kedudukan pintu khemah hendaklah
Kedudukan pintu khemah hendaklah Ikatan dan kegunaannya
Ikatan dan kegunaannya Interaksi positif antara tamadun
Interaksi positif antara tamadun Nama kelompok untuk tugas
Nama kelompok untuk tugas Perubahan kimia
Perubahan kimia Ciri-ciri perubahan materi
Ciri-ciri perubahan materi Materi adalah segala sesuatu yang mempunyai …
Materi adalah segala sesuatu yang mempunyai … Faktor faktor yang mempengaruhi kesetimbangan kimia
Faktor faktor yang mempengaruhi kesetimbangan kimia