Grupos Funcionales Un grupo funcional es un tomo













- Slides: 30

Grupos Funcionales Un “grupo funcional” es un átomo o conjunto de átomos, distintos de carbono e hidrógeno, que le confieren a una molécula orgánica características específicas. Estas características son la reactividad y propiedades químicas de cada molécula orgánica.

ESCALA DE PRIORIDADES: �Ácidos carboxílicos > anhídridos > ésteres > haluros de ácido > amidas > nitrilos > aldehídos > cetonas > alcoholes > aminas > éteres > alquenos > alquinos > haluros > nitro > alcanos -COOH > R-COOCO-R > -COO- > R-COX > -CONH 2 > CN > -CHO > -CO- > -OH > -NH 2 > -O- > -C=C- > -C≡C - > -X-, -NO 2, -R

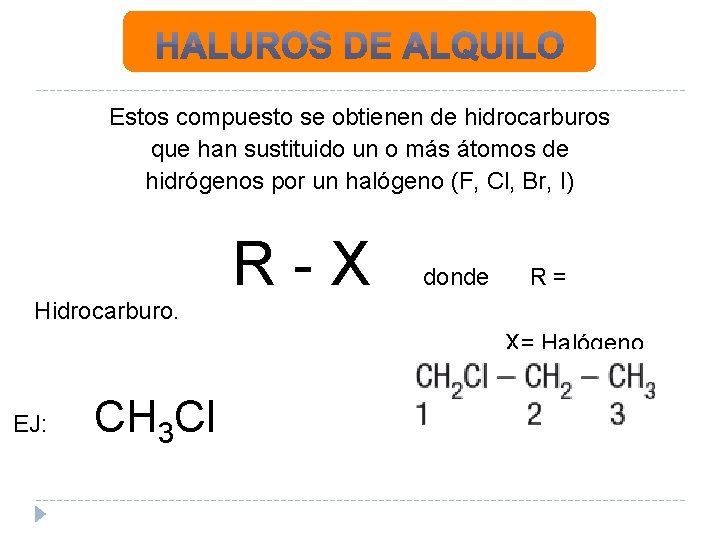
Estos compuesto se obtienen de hidrocarburos que han sustituido un o más átomos de hidrógenos por un halógeno (F, Cl, Br, I) Hidrocarburo. R-X donde R= X= Halógeno. EJ: CH 3 Cl


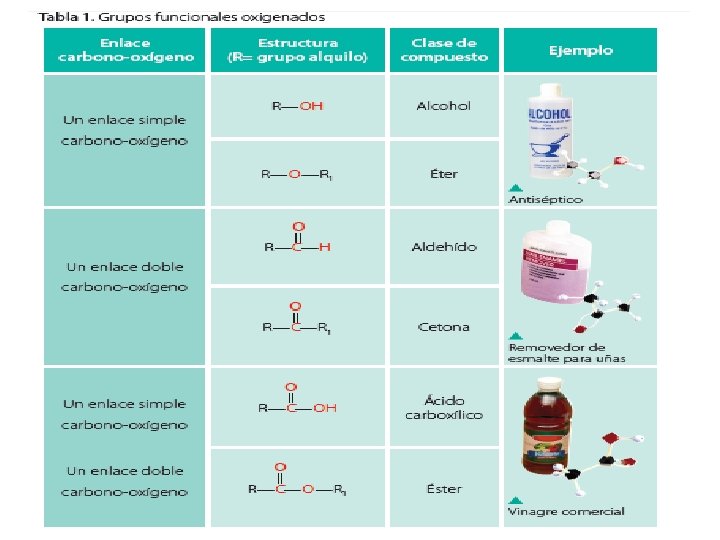
Compuestos Orgánicos Oxigenados Compuestos que contienen uno o varios átomos de oxígenos, unidos a través de enlaces covalentes simples o dobles. Es uno de los elementos más importantes en la Química Orgánica, pues es el agente oxidante para el metabolismo de alimentos y crucial en la respiración celular de los organismos aeróbicos.

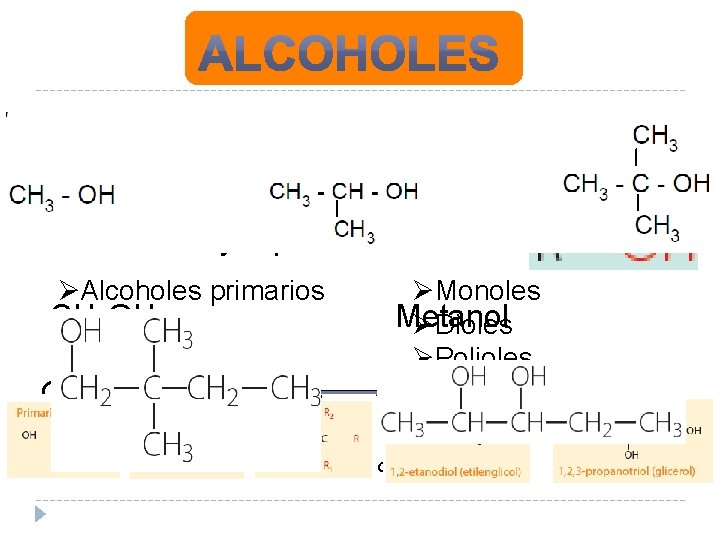
la cantidad la posición se del cambia. Según ØSegún Nomenclatura: el sufijo “ANO” de grupo alcohol se por “OL” clasifican en: Ejemplos ØAlcoholes primarios CH ØAlcoholes 3 OH secundarios ØAlcoholes terciarios CH 3 CH 2 OH grupos alcoholes se clasifican en: ØMonoles Metanol ØDioles ØPolioles Etanol Se obtienen por oxidación de hidrocarburos alifáticos.

PROPIEDADES FÍSICAS ØHasta 11 átomos de C son líquidos a temperatura ambiente (desde butanoles hasta decanoles que son más viscosos). ØLos alcoholes forman puentes de hidrógeno con el agua. Los de bajo peso molecular son totalmente solubles en ella. A medida que crece la cadena alifática, decrece la solubilidad de los alcoholes en agua y aumenta en solventes orgánicos (apolares)

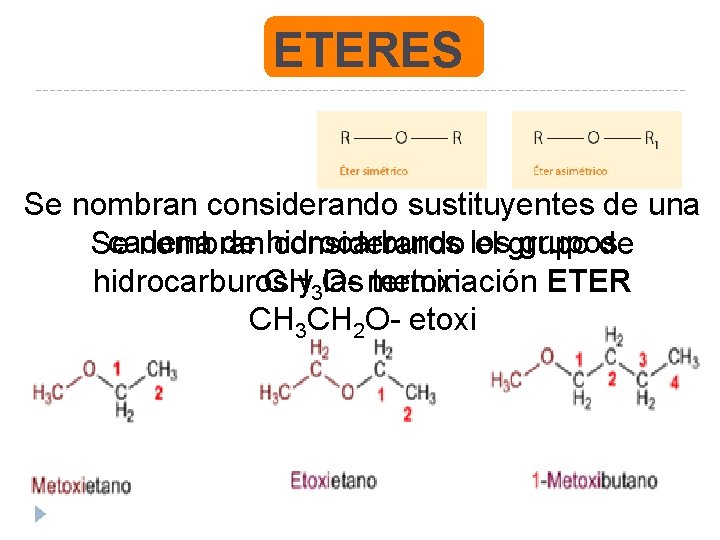
ETERES Se nombran considerando sustituyentes de una cadena de hidrocarburos grupos Se nombran considerando los el grupo de CHy 3 Ohidrocarburos las metoxi terminación ETER CH 3 CH 2 O- etoxi

PROPIEDADES FÍSICAS ØSustancias Polares, incoloras, volátiles e inflamables. ØBajos puntos de ebullición en comparación a un alcohol con el mismo numero de carbonos. ØNo forman puentes de hidrógeno entre ellos, pero si con otras moléculas.

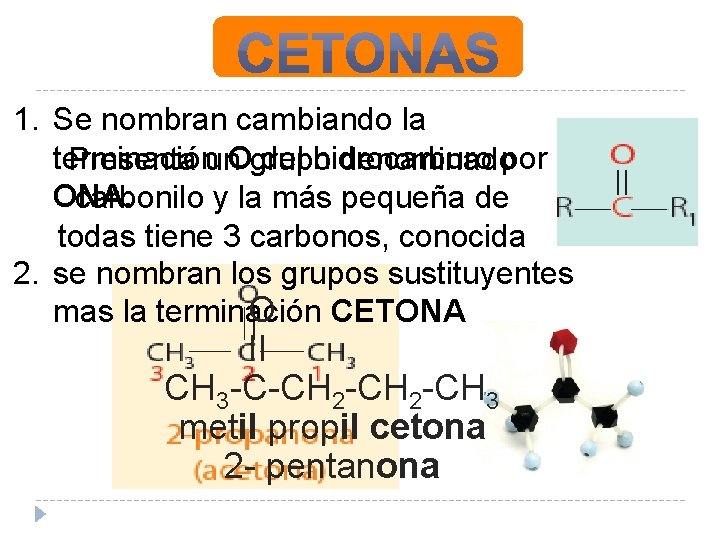
1. Se nombran cambiando la terminación del hidrocarburo Presenta un. Ogrupo denominadopor ONA. carbonilo y la más pequeña de todas tiene 3 carbonos, conocida 2. se nombran los grupos sustituyentes como: O mas la terminación CETONA II CH 3 -C-CH 2 -CH 3 metil propil cetona 2 - pentanona

PROPIEDADES FÍSICAS ØLas Cetonas son menos reactivas que los aldehídos y se usan mucho como disolventes, debido a que forman puentes de hidrógeno. ØAl tener el grupo carbonilo son moléculas muy polares, con elevados ptos de ebullición en comparación con HC de masa molar similar. La acetona hierve a 56ºC y es la cetona de uso más extendido. Debido a que disuelve una gran cantidad de sustancias orgánicas.

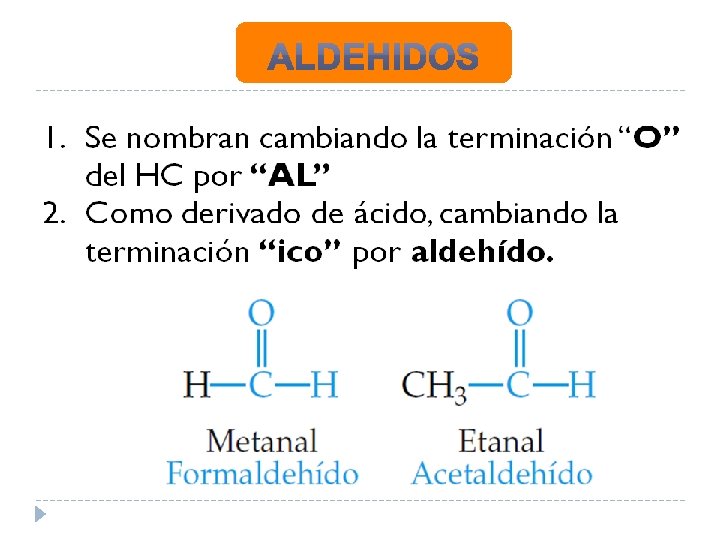
En estos compuestos el grupo carbonilo tiene al menos un átomo de hidrogeno unido a él. Esta función es extrema, obtenida por la oxidación parcial de alcoholes

PROPIEDADES FÍSICAS ØMuchos compuestos en la naturaleza poseen un grupo funcional aldehído, tal es el caso de los sabores de vainilla y la canela. ØSon moléculas polares por la presencia del grupo carbonilo, disolventes polares y puntos de ebullición mas bajos que los alcoholes.

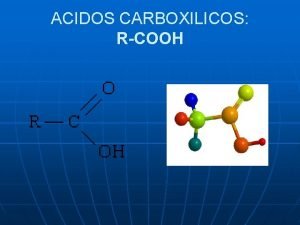
ACIDOS CARBOXILICOS Este grupo está formado por comunes. una molécula También presentan nombres Emplea el nombre que en donde uno de del los alcano oxígenos forma un corresponde a con la cadena mas larga que doble enlace el carbono. Fórmico HCOOH (Metanoico) incluye al grupo ácido. Presente en las hormigas Este se conoce como(Etanoico) Grupo Carboxilo. Acético CH 3 COOH Metanoico HCOOH Presente en el vinagre Etanoico CH 3 COOH Butanoico CH 3 CH 2 COOH (Butírico) Ácido + Propanoico CH 3 CH 2 COOH Presente en la mantequilla Butanoico CH 3 CH 2 COOH R - COOH Y muchos más que Pentanoico se encuentran distribuidos en la naturaleza. CH 3 CH 2 CH 2 COOH

PROPIEDADES FÍSICAS � Forman Puentes de hidrógeno con el agua y los de muy bajo peso molecular (hasta 4 Carbonos) son solubles en ella. �A medida que aumenta la longitud de la cadena, disminuye la solubilidad en agua. � Aumentando sus puntos de ebullición por sobre alcoholes de la misma masa. � Son clasificados como ácidos débiles.

ESTERES Este grupo es derivado de los ácidos carboxílicos que reaccionan con alcohol. Formado por una átomo de carbono unido por un doble enlace a un átomo de oxígeno, más otro átomo de oxígeno. R 1 - COO - R 2 O R 1 -C-O-R 2 También alrededor de esta molécula hay dos cadenas hidrocarbonadas.

Queda el nombre compuesto por dos partes: 1. Una con el nombre de esta cadena con terminación ato y la segunda con el nombre de la otra cadena con terminación ilo. 2. Se unen ambos nombres con la preposición de Terminación ato R 1 - COO - R 2 Terminación ilo

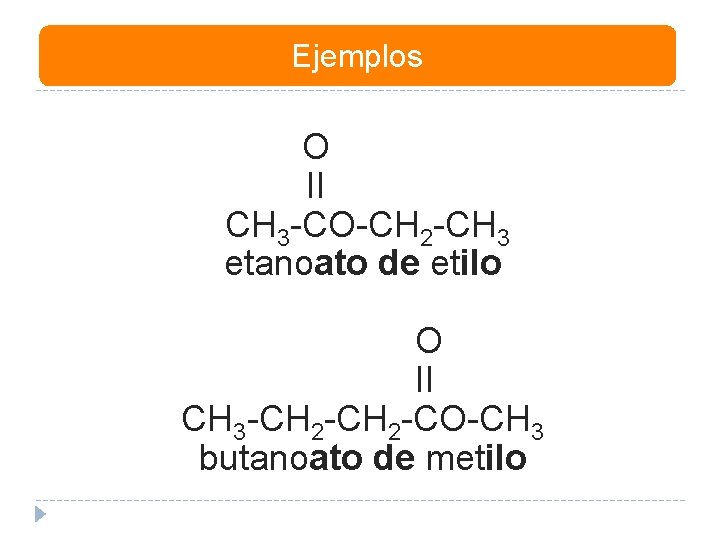
Ejemplos O II CH 3 -CO-CH 2 -CH 3 etanoato de etilo O II CH 3 -CH 2 -CO-CH 3 butanoato de metilo

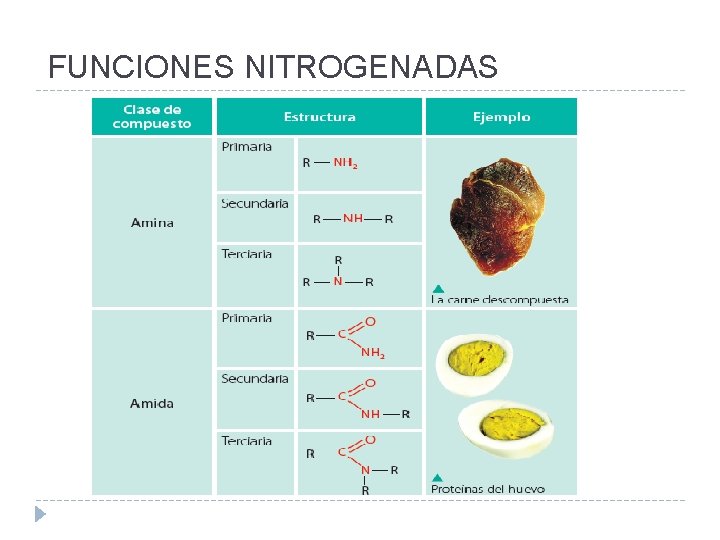
FUNCIONES NITROGENADAS

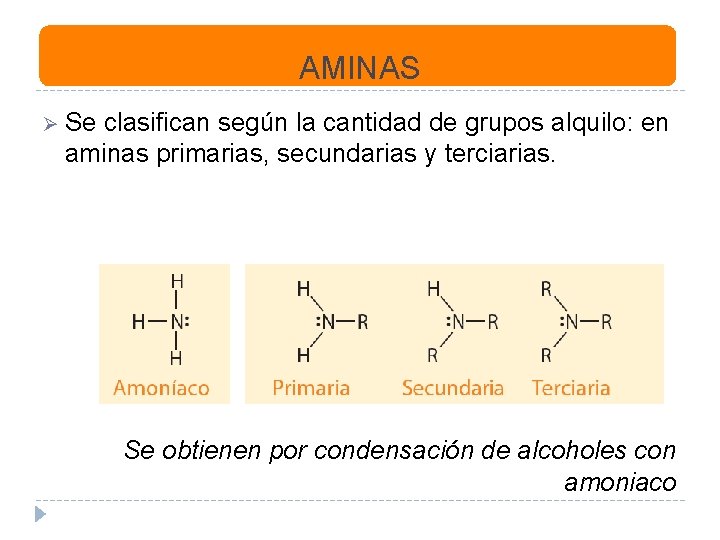
AMINAS Ø Se clasifican según la cantidad de grupos alquilo: en aminas primarias, secundarias y terciarias. Se obtienen por condensación de alcoholes con amoniaco

Primera forma de nombrar una amina � � Al nombre del alcano se le quita la o al final y se le agrega la terminación amina. Es importante fijarse en la numeración de donde está el grupo amino. CH 3 -NH 2 metanamina CH 3 -CH 2 -NH 2 etanamina

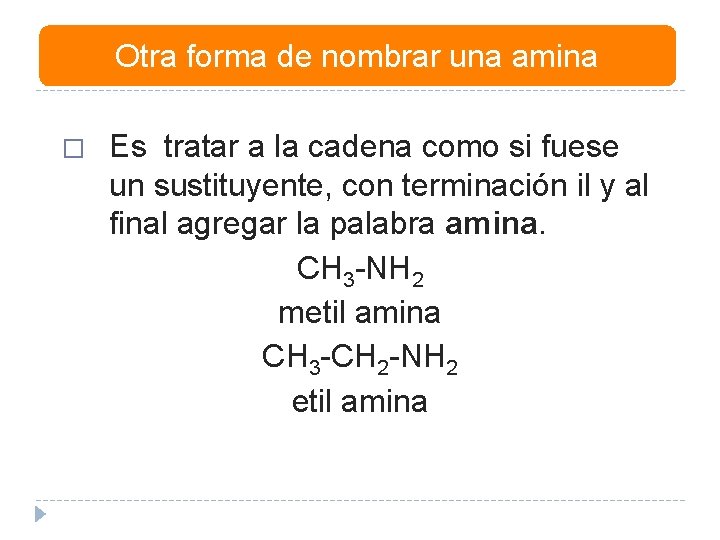
Otra forma de nombrar una amina � Es tratar a la cadena como si fuese un sustituyente, con terminación il y al final agregar la palabra amina. CH 3 -NH 2 metil amina CH 3 -CH 2 -NH 2 etil amina

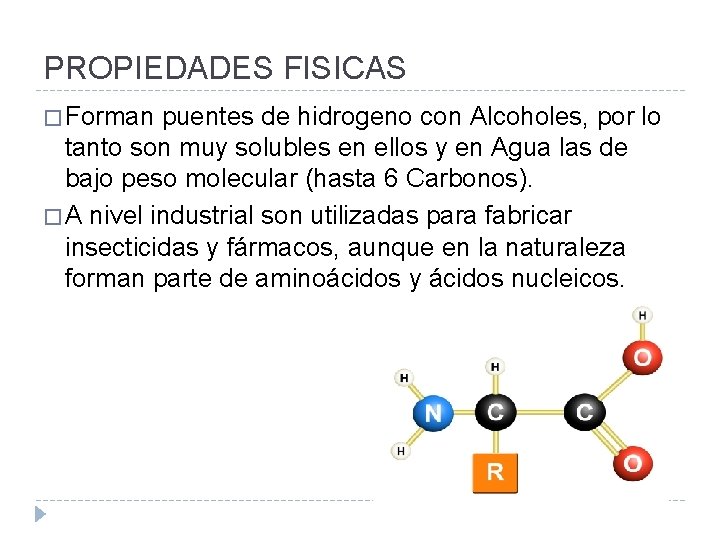
PROPIEDADES FISICAS � Forman puentes de hidrogeno con Alcoholes, por lo tanto son muy solubles en ellos y en Agua las de bajo peso molecular (hasta 6 Carbonos). � A nivel industrial son utilizadas para fabricar insecticidas y fármacos, aunque en la naturaleza forman parte de aminoácidos y ácidos nucleicos.

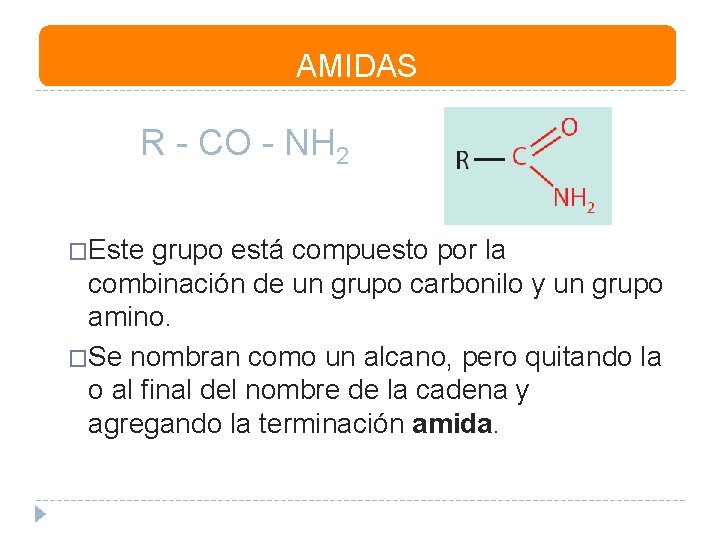
AMIDAS R - CO - NH 2 �Este grupo está compuesto por la combinación de un grupo carbonilo y un grupo amino. �Se nombran como un alcano, pero quitando la o al final del nombre de la cadena y agregando la terminación amida.

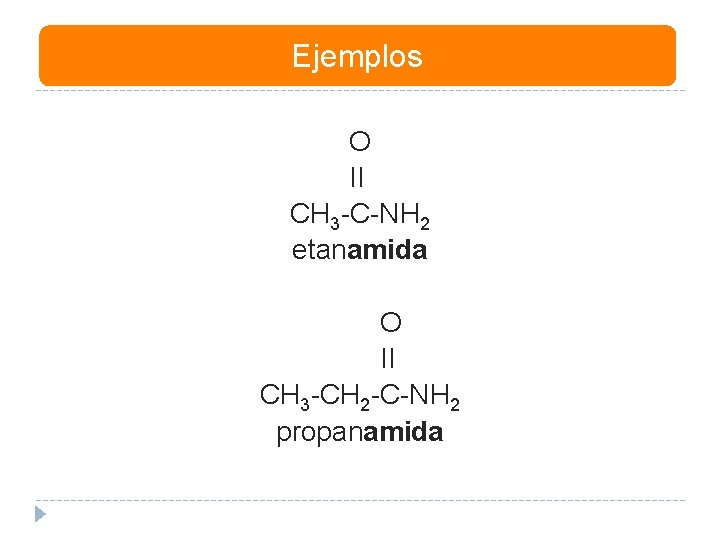
Ejemplos O II CH 3 -C-NH 2 etanamida O II CH 3 -CH 2 -C-NH 2 propanamida


ESCALA DE PRIORIDADES: �Ácidos carboxílicos > anhídridos > ésteres > haluros de ácido > amidas > nitrilos > aldehídos > cetonas > alcoholes > aminas > éteres > alquenos > alquinos > haluros > nitro > alcanos -COOH > R-COOCO-R > -COO- > R-COX > -CONH 2 > R-CN > -CHO > -CO- > -OH > -NH 2 > -O- > -C=C- > C≡C- > -X-, R-NO 2, -R

NOMENCLATURA CON MÁS DE UN GRUPO FUNCIONAL. � Se identifica cuál es la función principal (la primera en el nombre de preferencia). Es la que da el nombre al compuesto. � Las funciones secundarias se nombran como prefijos usando el nombre del grupo (“oxo” para carbonilo, “hidroxi” para hidroxilo). � Ejemplo: CH 3–CHOH–COOH � Función principal: ácido carboxílico � Función secundaria: alcohol � Nombre del grupo: hidroxilo. Prefijo: hidroxi. � Nombre: Ácido 2 hidróxi-propanoico.

� Ácido Carboxi (como sustituyente) HOOC–CH–CH 2–COOH ácido 2, 4 -carboxi-dibutanoico | COOH � Éster alcoxicarbonil (como sustituyente) HOOC–CH 2–COOCH 3 ácido metoxicarbonil etanoico � Amida amido (como sustituyente) CH 3–CH–CH 2–COOH | CONH 2 � Nitrilo ciano (como sustituyente) NC–CH–CH 2–COOCH 3 � Aldehído ácido 3 -amido-butanoico 3 -cianopropanoato de metilo oxo o formil (como sustituyente) OHC–CH 2–CONH 2 3 -oxo-propanamida

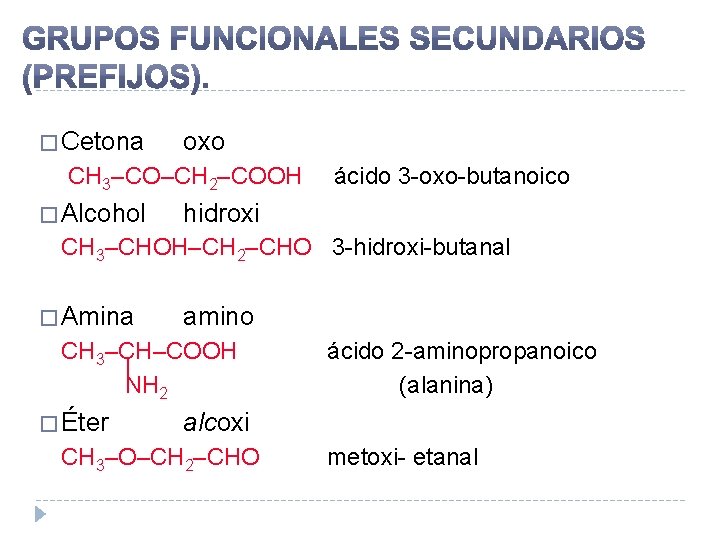
� Cetona oxo CH 3–CO–CH 2–COOH � Alcohol ácido 3 -oxo-butanoico hidroxi CH 3–CHOH–CH 2–CHO 3 -hidroxi-butanal � Amina amino CH 3–CH–COOH | NH 2 � Éter ácido 2 -aminopropanoico (alanina) alcoxi CH 3–O–CH 2–CHO metoxi- etanal
 Requisitos não funcionais
Requisitos não funcionais Requisito funcional e não funcional
Requisito funcional e não funcional Requisitos funcionais e não funcionais
Requisitos funcionais e não funcionais Imagenes de compuestos organicos
Imagenes de compuestos organicos Nombre de la cetona
Nombre de la cetona Un lípido simple está formado por
Un lípido simple está formado por Glucosa grupos funcionales
Glucosa grupos funcionales Cetonas terminacion
Cetonas terminacion Prioridad de grupos funcionales en quimica organica
Prioridad de grupos funcionales en quimica organica Monosacaridos
Monosacaridos Características de los éteres
Características de los éteres Prioridad de grupos funcionales en quimica organica
Prioridad de grupos funcionales en quimica organica Radicales alquilo
Radicales alquilo Site:slidetodoc.com
Site:slidetodoc.com Grupos funcionales
Grupos funcionales Efecto inductivo
Efecto inductivo Grupos funcionales oxigenados y nitrogenados
Grupos funcionales oxigenados y nitrogenados Grupos funcionales nomenclatura
Grupos funcionales nomenclatura Anfipatico
Anfipatico Absorciones ir para grupos funcionales representativos
Absorciones ir para grupos funcionales representativos N metilpentanamida
N metilpentanamida Lines adn
Lines adn Isopropilmetilcetona
Isopropilmetilcetona Cual es el grupo funcional de los alquinos
Cual es el grupo funcional de los alquinos Rcooh+na
Rcooh+na Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Los compuestos nitrogenados
Los compuestos nitrogenados Grupo funcional fosfato
Grupo funcional fosfato Quimica organica
Quimica organica Tipos de glucidos
Tipos de glucidos Nombre de la formula
Nombre de la formula