FIZIKA HEMIJA Hemijska kinetika i ravnotea 32 42





















- Slides: 22

FIZIČKA HEMIJA Hemijska kinetika i ravnoteža (32 -42)

Hemijska kinetika izučava: Promene u sistemu u zavisnosti od vremena tj. tok reakcije i brzine kojima se pojedine komponente sistema približavaju ravnotežnom stanju. Eksplozivne reakcije H+ + OH- H 2 O Reakcije koje traju godinama 2 Fe + 3 O 2 2 Fe 2 O 3 Brzina hemijske reakcije je promena molarne koncentracije u jedinici vremena v = Δc l Δt Na brzinu hemijske reakcije utiču: -Koncentracija -Temperatura -Energija aktivacije -Struktura molekula -Katalizatori Hemijska reakcija se ostvaruje sudarom čestica (molekula i atoma)

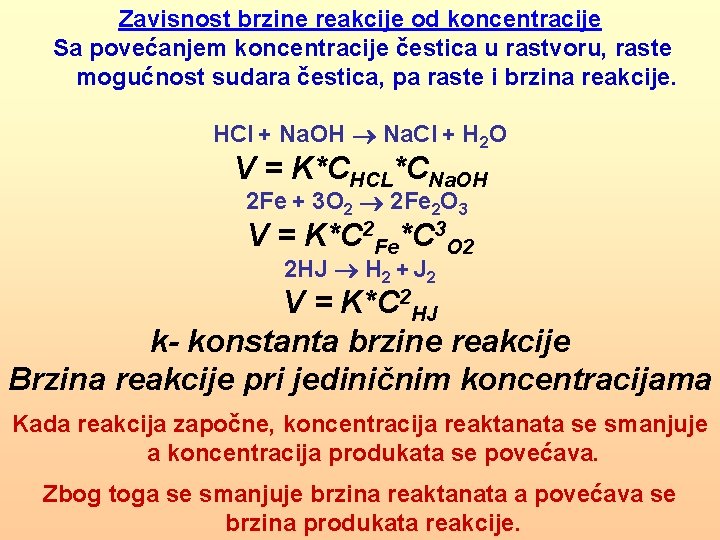
Zavisnost brzine reakcije od koncentracije Sa povećanjem koncentracije čestica u rastvoru, raste mogućnost sudara čestica, pa raste i brzina reakcije. HCl + Na. OH Na. Cl + H 2 O V = K*CHCL*CNa. OH 2 Fe + 3 O 2 2 Fe 2 O 3 V = K*C 2 Fe*C 3 O 2 2 HJ H 2 + J 2 V = K*C 2 HJ k- konstanta brzine reakcije Brzina reakcije pri jediničnim koncentracijama Kada reakcija započne, koncentracija reaktanata se smanjuje a koncentracija produkata se povećava. Zbog toga se smanjuje brzina reaktanata a povećava se brzina produkata reakcije.

Zavisnost brzine reakcije od temperature Zagrevanje utiče na povećanje brzine reakcije. Vant Hofovo pravilo da se pri porastu temperature za 10 C brzina povećava za 2 -4 puta. Sa povišenjem temperature povećava se: • Kinetička energija čestica • Brzina čestica • Broj sudara Što izaziva povećanje brzine hemijske reakcije

Zavisnost brzine od energije aktivacije Do reakcije dolazi samo pri sudaru aktiviranih čestica. Najmanja energija čestica koja je dovoljna da bi došlo do reakcije ENERGIJA AKTIVACIJE Ako je pri sudaru čestica: Energija sudara veća od energije aktivacije Energija sudara manja od energije aktivacije Međusobno mogu reagovati samo oni atomi i molekuli koji imaju energiju jednaku ili veću od energije aktivacije.

Uticaj strukture molekula na brzinu reakcije • Brže reaguju molekuli sličnih struktura • Manji molekuli su pokretljiviji i zbog toga brže reaguju Uticaj katalizatora na brzinu reakcije 1. Katalizatori su supstance koje menjaju brzinu hemijske reakcije a posle reakcije ostaju hemijski nepromenjene. 2. Katalizatori ne mogu izazvati hemijsku reakciju 3. Katalizatori ubrzavaju hemijsku reakciju jer smanjuju energiju aktivacije reaktanata

Ravnoteža u homogenim i heterogenim sistemima U odnosu na prirodu procesa -Hemijska ravnoteža -Fizička ravnoteža U odnosu na osobine sistema postoje ravnoteže u homogenim i heterogenim sistemima. Homogeni deo heterogenog sistema naziva se faza. Između faza postoje uočljive granične površine, tako da se mogu mehanički odvojiti. Na granici između faza dolazi do nagle promene fizičkih svojstava. Faza, homogeni sistem može se sastojati od istih molekula (čista sups. ) ili iz različitih potpuno izmešanih molekula (smeša, rastvor). Heterogeni sistem može imati iste molekule (led-voda-vodena para) ili različite molekule (ulje-voda).

HEMIJSKA RAVNOTEŽA Reverzibilna ili povratna reakcija se može odvijati u dva smera. 2 HJ H 2 + J 2 V 1 = K 1*C 2 HJ V 2 = K 2*CH 2*CJ 2 V 1 = V 2 K 1*C 2 HJ = K 2*CH 2*CJ 2 Konstanta ravnoteže Kc Kc = K 1/K 2=CH 2*CJ 2/ C 2 HJ

Zakon o dejstvu masa U stanju ravnoteže odnos proizvoda molarnih koncentracija produkata i proizvoda molarnih koncentracija reaktanata stalna je vrednost na stalnoj temperaturi za određenu reakciju Jednom uspostavljena ravnoteža se može poremetiti. Faktori koji utiču ne poremećaj ravnoteže reakcije su: • Promena pritiska • Promena koncentracije • Promena temperature

Le Šatelijeov princip: Svaka promena jednog od faktora ravnoteže pomera ravnotežu u onom smeru u kome će se dejstvo te promene suzbiti. Promena pritiska 2 HJ H 2 + J 2 3 H 2+ N 2 2 NH 3 Promena pritiska u prvoj jednačini ne izaziva poremećaj konstante ravnoteže ali u drugoj jednačini izaziva promenu konstante ravnoteže. Razlog: U prvoj jednačini broj molova reaktanata jednak je broju molova produkata reakcije. U drugoj jednačini broj molova reaktanata veći je od broja molova produkata. Ako se poveća pritisak ravnoteža će se pomeriti u desno, doći će do povećanja brzine stvaranja NH 3

Promena koncentracije Ako se poveća koncentracija bilo koje supstance, sistem će težiti da je smanji i ubrzaće reakciju u suprotnom smeru. Ca. CO 3 Ca. O+CO 2 Ako se poveća koncentracija CO 2 Sistem će pomeriti ravnotežu u levo pa će se brzina stvaranja Ca. CO 3 povećati. Ca. CO 3 Ca. O+CO 2 Ako se smanji koncentracija CO 2 Sistem će pomeriti ravnotežu u desno pa će se brzina stvaranja Ca. O povećati.

Promena temperature 3 H 2+ N 2 2 NH 3 + 92, 2 k. J Ako reakcionu smešu zagrevamo ravnoteža se pomera u levo, zbog toga što je reakcija na desno egzotermna. Ako reakcionu smešu hladimo ravnoteža se pomera u desno, zbog toga što je reakcija na desno egzotermna. Le Šatelijeov princip: Svaka promena jednog od faktora ravnoteže pomera ravnotežu u onom smeru u kome će se dejstvo te promene suzbiti.

GIBSOVO PRAVILO FAZA Broj faza (F) Broj komponenata (K) Broj stepena slobode (S) S+F=K+2 Faza, homogeni sistem može se sastojati od istih molekula (čista sups. ) ili iz različitih potpuno izmešanih molekula (smeša, rastvor). Broj komponenata je najmanji broj sastojaka pomoću kojih može da se izrazi sastav svake faze uz dati proces. Broj stepena slobode predstavlja broj promenljivih ravnotežnih faktora (pritisak, temperatura ili koncentracija) koji se mogu menjati a da se pri tom broj faza ne promeni.

FIZIČKA HEMIJA Pojave na granici faza (43 -50)

Površinski napon Granični sloj između dve faze ima različit sadržaj energije u odnosu na slojeve u unutrašnjosti pa su zbog toga fizičkohemijske osobine tog sloja različite. Molekuli koji se nalaze u unutar tečnosti, okruženi su sa svih strana molekulima tako da je zbir svih sila koje deluju na taj molekul jednaka nuli. Molekuli koji se nalaze na površini tečnosti izloženi su dejstvu sila samo sa jedne strane, tako da je rezultanta sila koja teži da molekule sa površine uvuče u unutrašnjost tečnosti. Zbog toga postoji težnja da se površina tečnosti smanji. Pojava da tečnosti teže da smanje svoju površinu naziva se površinski napon. Na površini tečnosti, površina se ponaša kao rastegnuta gumena opna. Sila koja teži da smanji površinu tečnosti posledica je postojanja neuravnoteženih međumolekulskih sila koje deluju na molekule na površini i samim tim

Sila F površinskog napona je sila kojom površina tečnosti deluje na svoju graničnu liniju. F=y*l Prema tome sila površinskog napona zavisi od dužine granične linije (l) i koeficijenta površinskog napona (y), predstavlja silu na jedinicu dužine granične linije u površinskom sloju tečnosti. Neke supstance imaju sposobnost da smanjuju silu površinskog napona i takve supstance nazivamo kapilarno aktivne supstance ili površinski aktivne supstance. Supstance koje povećavaju koeficijent površinskog napona nazivamo površinski inaktivne supstance. Flotacija je mehaničko razdvajanje raznorodnog sitnozrnog materijala, koje se zasniva na različitom fizičko-hemijskom ponašanju površine pojedinih sastojaka prema vodi i do-dacima. Mnoge sitne mineralne čestice se ne kvase i one plivaju po površini dok se druge čestice pod istim uslovima kvase i padaju na dno (dolazi do razdvajanja). Na ovaj način se u rudarstvu od siromašne rude može dobiti bogatiji flotacioni koncentrat.

Adsorpcija je proces prianjanja neke faze uz površinski sloj druge faze. Faza koja se adsorbuje naziva se ADSORBAT. Faza na koju se adsorbuje naziva se ADSORBENS. Ako faza koja se adsorbovala počne sa površine na koju se adsorbovala da prodire u unutrašnjost faze, onda je to ABSORPCIJA. Adsorpcija i absorpcija su pojave koje se zajedničkim imenom nazivaju SORPCIJA. Izdvajanje adsorbata iz adsorbensa, odnosno izdvajanje absorbata iz absorbensa naziva se DESORPCIJA. To je pojava suprotna od sorpcije.

Adsorpcija može biti FIZIČKA i HEMIJSKA. Kod fizičke adsorpcije između čestica deluju slabe privlačne sile. Kod hemijske adsorpcije sile koje deluju između adsorbensa i adsorbata su mnogo jače. Zbog toga je mnogo lakše izvršiti desorpciju fizičke nego hemijske adsorpcije. Količina supstance koja se adsorbuje zavisi od: 1. Prirode i površine adsorbensa 2. Prirode adsorbata 3. Pritiska 4. Koncentracije 5. Temperature Pri povećanju PRITISKA povećava se i količina adsorbovane supstance. Ova zavisnost se može prikazati grafički ADSORPCIONIONE IZOTERME. Sa povećanjem KONCENTRACIJE povećava se i količina adsorbovane supstance i obrnuto

Sa povećanjem TEMPERATURE smanjuje se količina adsorbovane supstance što znači da temperatura negativno utiče na adsorpciju, odnosno pozitivno na desorpciju. Zavisnost adsorpcije od pritiska, koncentracije i temperature data je jednačinom koja se naziva Frojndlihova jednačina adsorpciona izoterma. PRIMENA ADSORPCIJE: Iz gasne smeše lakše se adsorbuju oni gasovi koji se lakše kondenzuju, odnosno supstance koje imaju nižu temperaturu ključanja. Taj fenomen je primenjen kod gasmaske.

HROMATOGRAFIJA U hromatografiji se primenjuje adsorpcija i raspodela supstance između dva rastvarača. Hromatografska metoda predstavlja razdvajanje komponente neke smeše zbog toga što one u nejednakoj meri prelaze u drugu fazu sa kojom se mešaju. Hromatografskom metodom može da se vrši razdvajanje komponente iz smeše ili identifikacija određene komponente smeše. Princip hromatografskog razdvajanja sastoji se u tome što se smeša rastvorena u rastvaraču prevodi preko nepokretne faze. Pri tome se supstance iz smeše različito raspoređuju između rastvarača i druge faze. METODE. ADSORPCIONA HROMATOGRAFIJA PODEONA HROMATOGRAFIJA NA HARTIJI GASNA HROMATOGRAFIJA JONOIZMENJIVAČKA HROMATOGRAFIJA

ADSORPCIONA HROMATOGRAFIJA: Razdvajanje supstanci na osnovu njihovog različitog afiniteta prema istom adsorbensu. PODEONA HROMATOGRAFIJA: Razdvajanje supstanci raspodelom sastojaka smeše između dva rastvarača. HROMATOGRAFIJA NA HARTIJI: Razdvajanje supstanci usled različitih brzina kojom se sastojci zbog kapilarnih sila kreću sa rastvaračem uz hromatografsku traku od papira. GASNA HROMATOGRAFIJA: Razdvajanje gasne smeše propuštanjem kroz hromatografsku kolonu. U koloni se sastojci zadržavaju različito vreme i izlaze u različitim vremenskim intervalima. Na izlazu se automatski identifikuju i beleže na traku.

JONOIZMENJIVAČKA HROMATOGRAFIJA Jonoizmenjivači su jedinjenja koja imaju osobinu da vežu jone iz rastvora a da pri tome oslobađaju istu količinu svojih jona (jonska izmena). Ovu osobinu imaju neke prirodne supstance kao što su alumosilikati (jedinjenja aluminijuma i silicijuma) koji se nazivaju zeoliti. Jonoizmenjivačka hromatografija primenjuje se kod “omekšavanja vode”. Kada se “tvrda voda” (voda koja sadrži jone Ca 2+ i Mg 2+) propusti kroz jonoizmenjivačku kolonu napunjenu zeolitom onda zeolit jone kalcijuma i magnezijuma “uzima” i umesto njih “daje” svoje jone natrijuma (Na+). Pošto tvrdoću čini upravo koncentracija jona kalcijuma i magnezijuma, na taj način dolazi do “omekšavanja” vode jonoizmenjivačkom metodom.
 Hemijska kinetika
Hemijska kinetika Contoh soal kinetika kimia orde 1
Contoh soal kinetika kimia orde 1 Kalijum heksa cijano ferat
Kalijum heksa cijano ferat Hemijska tehnologija
Hemijska tehnologija Sumpor hemijski element
Sumpor hemijski element Reakcija sagorevanja metanola
Reakcija sagorevanja metanola Sistema endocrino slideshare
Sistema endocrino slideshare Hemijska vlakna
Hemijska vlakna Fizicka svojstva masti i ulja
Fizicka svojstva masti i ulja Hemijska svojstva supstance
Hemijska svojstva supstance Teska hemijska industrija
Teska hemijska industrija Hemijska termodinamika
Hemijska termodinamika Fizicka svojstva karboksilnih kiselina
Fizicka svojstva karboksilnih kiselina Uvod u hemiju
Uvod u hemiju Kompleksna jedinjenja hemija zadaci
Kompleksna jedinjenja hemija zadaci Akonitat
Akonitat Fizicko telo primeri
Fizicko telo primeri Dobijanje vodonika
Dobijanje vodonika Heksan heptan oktan nonan dekan
Heksan heptan oktan nonan dekan Analiticka hemija srednja skola
Analiticka hemija srednja skola Opsta hemija 2 tmf
Opsta hemija 2 tmf Hemija osnovni pojmovi
Hemija osnovni pojmovi Organska hemija srednja skola
Organska hemija srednja skola