ESTRUCTURA ATOMICA Demcrito V a C introduce el



























- Slides: 43

ESTRUCTURA ATOMICA

• Demócrito (V a. C. ) introduce el término de átomo como la parte más pequeña de la materia. ÁTOMO sin división

Modelo atómico de Bohr

Bohr propuso una regla extraordinaria que deberían seguir los electrones: Los electrones solo pueden estar en órbitas "especiales". Todas las otras órbitas simplemente no eran posibles. Ellos podrían saltar entre estas órbitas especiales y cuando lo hacían oscilaban un poco. . ¡Y eso produciría la radiación!

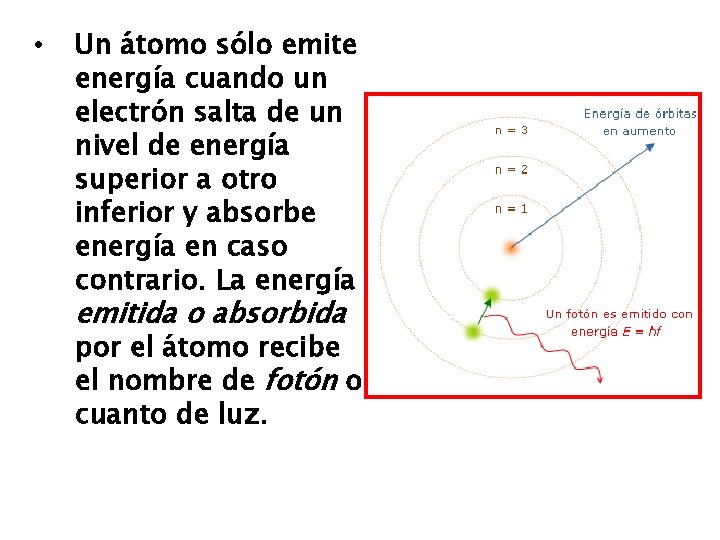
• Un electrón puede cambiar de un nivel a otro dentro de un mismo átomo ganando o perdiendo una cantidad de energía igual a la diferencia existente entre ambos estados. De este modo, todo cambio energético del electrón corresponderá a saltos que haga entre los estados estacionarios.

• Un átomo sólo emite energía cuando un electrón salta de un nivel de energía superior a otro inferior y absorbe energía en caso contrario. La energía emitida o absorbida por el átomo recibe el nombre de fotón o cuanto de luz.

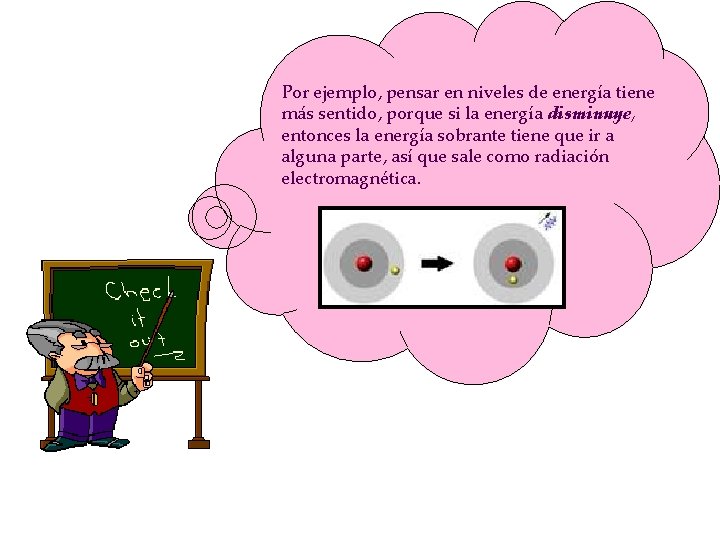
Por ejemplo, pensar en niveles de energía tiene más sentido, porque si la energía disminuye, entonces la energía sobrante tiene que ir a alguna parte, así que sale como radiación electromagnética.

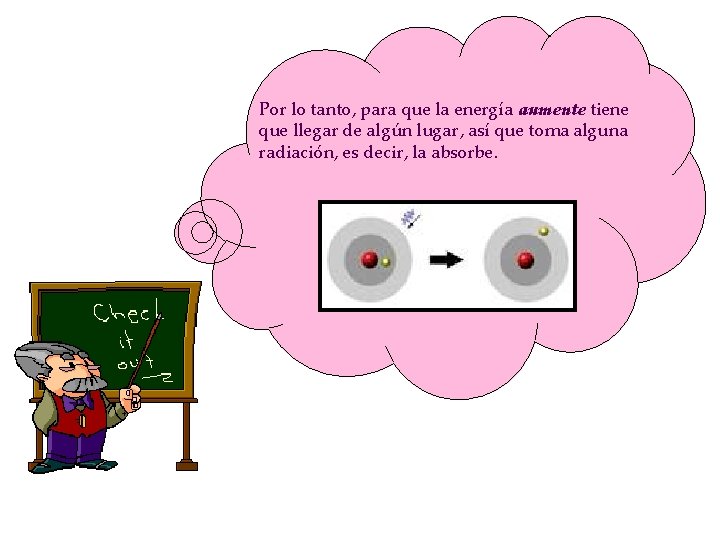
Por lo tanto, para que la energía aumente tiene que llegar de algún lugar, así que toma alguna radiación, es decir, la absorbe.

Otros dos postulados relevantes de Bohr son: ü El electrón sólo gira en determinadas órbitas de radios definidos, llamados también niveles cuantificados de energía. ü Mientras los electrones permanezcan en un mismo nivel de energía (llamados estacionarios por Bohr) no ganan ni pierden energía.

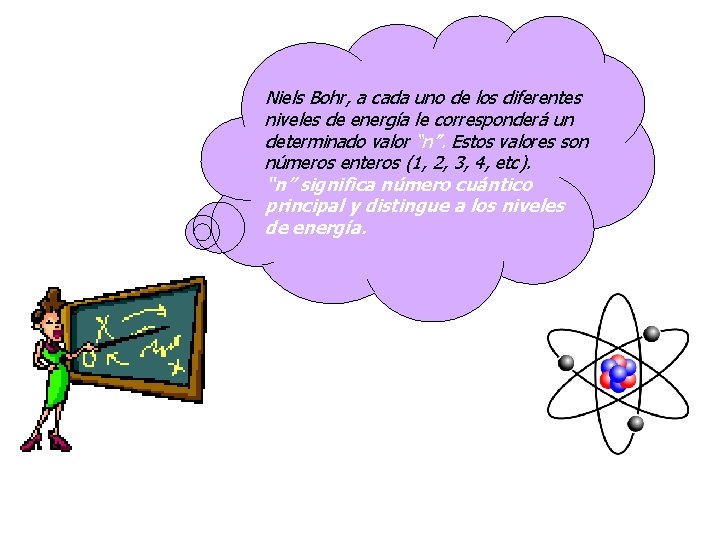
Niels Bohr, a cada uno de los diferentes niveles de energía le corresponderá un determinado valor “n”. Estos valores son números enteros (1, 2, 3, 4, etc). “n” significa número cuántico principal y distingue a los niveles de energía.

Los números cuánticos son valores numéricos que nos indican las características de los electrones de los átomos. Esto está basado en la teoría atómica de Neils Bohr, que es el modelo atómico más aceptado y utilizado en los últimos tiempos por su simplicidad.

Relación del postulado de Bohr con la mecánica cuántica • Bohr en su modelo atómico introdujo introduciendo la teoría de las órbitas cuantificadas, que en la teoría mecánica cuántica consiste en las características que, en torno al núcleo atómico, el número de electrones en cada órbita aumenta desde el interior hacia el exterior.

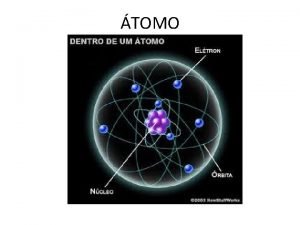
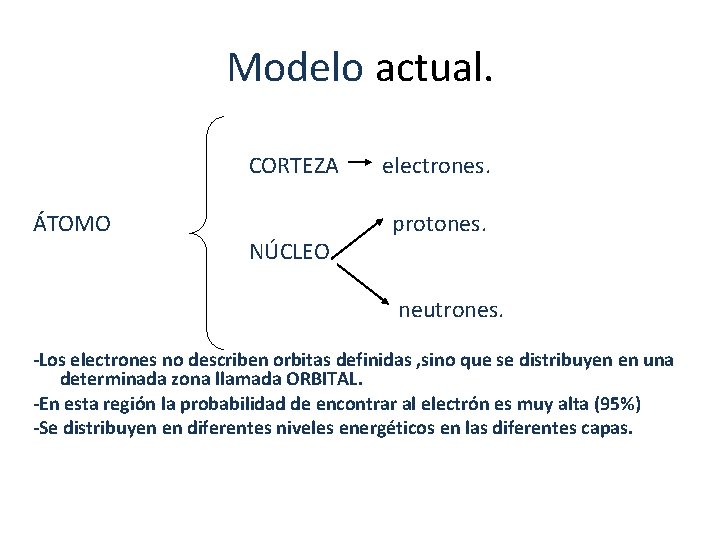
Modelo actual. CORTEZA ÁTOMO NÚCLEO electrones. protones. neutrones. -Los electrones no describen orbitas definidas , sino que se distribuyen en una determinada zona llamada ORBITAL. -En esta región la probabilidad de encontrar al electrón es muy alta (95%) -Se distribuyen en diferentes niveles energéticos en las diferentes capas.

ORBITAL Es la región del espacio en la cual existe mayor probabilidad de encontrar al electrón (debido a su comportamiento como onda, es difícil conocer en forma simultánea su posición exacta y su velocidad), por lo tanto, sólo existe la probabilidad de encontrarlo en cierto momento y en una región dada en el átomo. Representación de un orbital donde se encuentra al electrón. En ellos existe un 90 -99% de probabilidad de encontrar al electrón. En la figura se representa un ORBITAL "s"

• Todo átomo está formado por dos partes, que son: • a) Núcleo atómico: corresponde a la zona central. En él se encuentra la mayor masa del átomo. • b) Corteza atómica: corresponde a la zona que rodea al núcleo. Es la parte más voluminosa del átomo.

a) Protones (p+) • Están en el núcleo del átomo. • Tienen carga eléctrica positiva. • Tienen una masa significativa. b) Neutrones (n) • Se encuentran en el núcleo del átomo. • No tienen carga eléctrica. • Tienen masa muy similar a la de los protones. • Son los responsables de mantener unidos los protones en el núcleo. c) Electrones (e-) • Se encuentran en la corteza del átomo. • Giran alrededor del núcleo a gran velocidad • Tienen carga eléctrica negativa • Su masa es muy ínfima en relación a la masa de las otras sub-partículas.

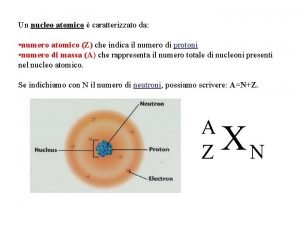
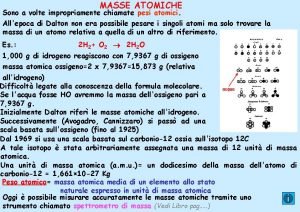
Numero atómico y de masa • Todos los átomos se pueden identificar por el numero de protones y neutrones que contienen. • Numero Atómico (Z): es el numero de protones en el núcleo del átomo de un elemento. • Átomo neutro Nº protones = Nº electrones ( también indica numero de electrones) • La tabla periódica se ordena de acuerdo al Numero Atómico de los elementos. • Numero de Masa (A) es el numero total de protones y neutrones presentes en el núcleo de un átomo de un elemento. (excepción H) A=Z+n

• Isótopos: átomos que tienen el mismo numero atómico pero diferente numero de masa. Ejemplo isótopos del Hidrogeno (hidrogeno, deuterio y tritio). 1 1 H 2 1 H 3 1 H • Por lo tanto la diferencia entre dos isótopos de un elemento es el número de neutrones en el núcleo. • Si conocemos el número de masa y el número atómico podemos calcular el número de neutrones que seria igual: Número de neutrones = Número de masa - Número atómico


CONFIGURACIÓN ELECTRÓNICA Consiste en distribuir a los electrones en los niveles, subniveles y orbitales del átomo. La finalidad es la de conocer cuántos electrones exteriores (en el último nivel de energía) tiene y de ese modo deducir las propiedades químicas del elemento en cuestión. a) El número atómico siempre indica el número de electrones para cada elemento. b) Existe un número máximo de electrones en cada subnivel c) Los subniveles se van llenando en forma que se van completando los subniveles de menor energía.

DISTRIBUCIÓN DE LOS ELECTRONES EN LA CORTEZA. • los electrones se distribuyen en diferentes niveles, que llamaremos capas. Con un número máximo de electrones en cada nivel o capa. N° máx electrones= 2 n 2 Nivel 1 2 3 4 Numero máximo de electrones 2 8 18 32

Ø Orbital: región donde existe la mayor probabilidad de encontrar al electrón Ø En cada orbital sólo puede haber hasta dos electrones que deben tener giros o espines opuestos. Ø Para representar gráficamente un orbital se emplea y una flecha para representar el electrón Tipos de orbitales

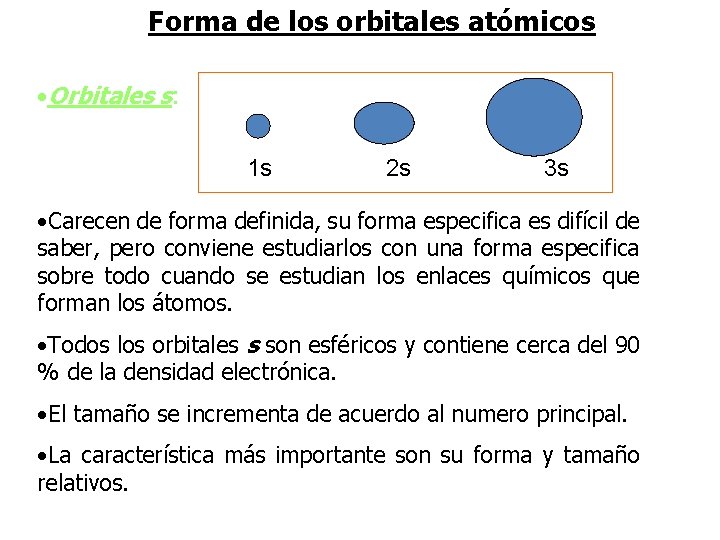
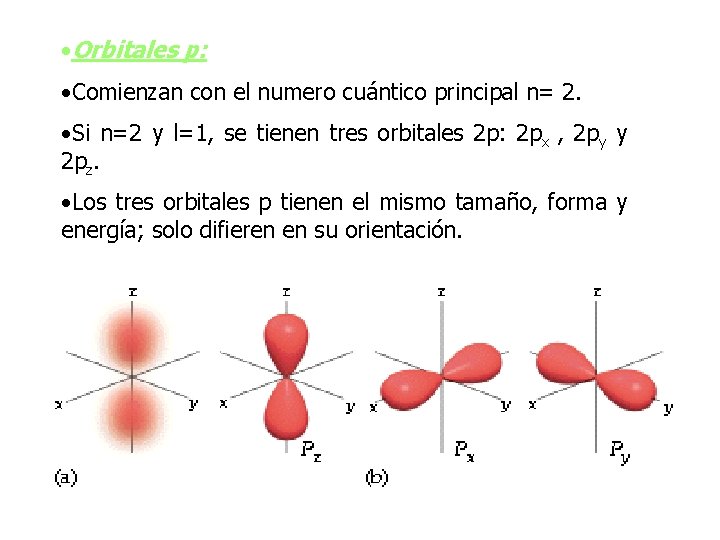
Forma de los orbitales atómicos • Orbitales s: 1 s 2 s 3 s • Carecen de forma definida, su forma especifica es difícil de saber, pero conviene estudiarlos con una forma especifica sobre todo cuando se estudian los enlaces químicos que forman los átomos. • Todos los orbitales s son esféricos y contiene cerca del 90 % de la densidad electrónica. • El tamaño se incrementa de acuerdo al numero principal. • La característica más importante son su forma y tamaño relativos.

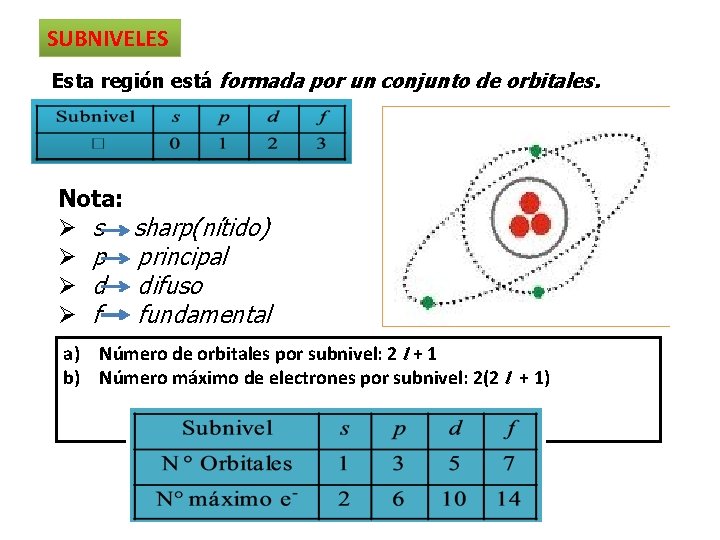
SUBNIVELES Esta región está formada por un conjunto de orbitales. Nota: Ø s Ø p Ø d Ø f sharp(nítido) principal difuso fundamental a) Número de orbitales por subnivel: 2 l + 1 b) Número máximo de electrones por subnivel: 2(2 l + 1)

• Orbitales p: • Comienzan con el numero cuántico principal n= 2. • Si n=2 y l=1, se tienen tres orbitales 2 p: 2 px , 2 py y 2 pz. • Los tres orbitales p tienen el mismo tamaño, forma y energía; solo difieren en su orientación.

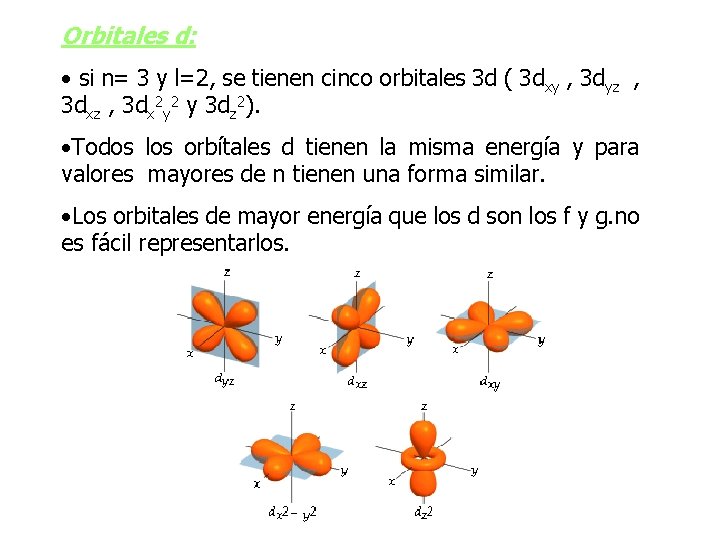
Orbitales d: • si n= 3 y l=2, se tienen cinco orbitales 3 d ( 3 dxy , 3 dyz , 3 dx 2 y 2 y 3 dz 2). • Todos los orbítales d tienen la misma energía y para valores mayores de n tienen una forma similar. • Los orbitales de mayor energía que los d son los f y g. no es fácil representarlos.

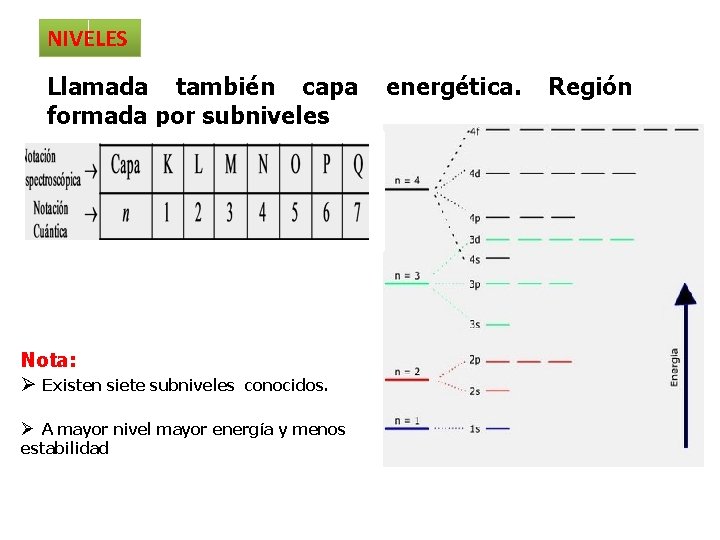
NIVELES Llamada también capa formada por subniveles Nota: Ø Existen siete subniveles conocidos. Ø A mayor nivel mayor energía y menos estabilidad energética. Región

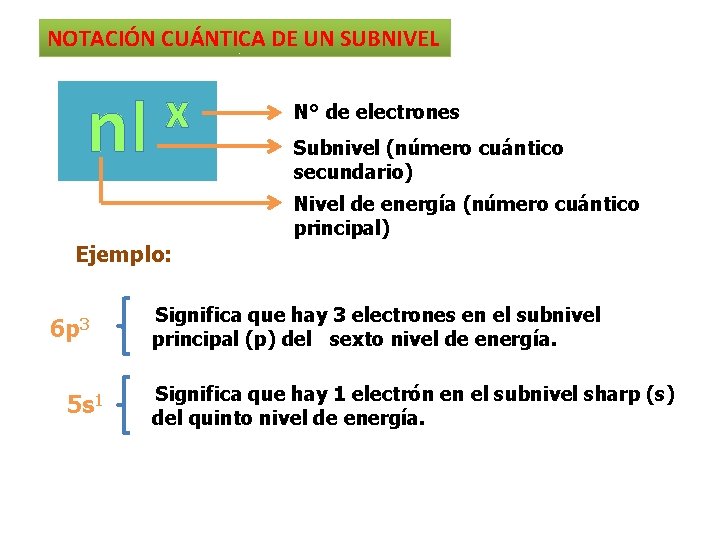
NOTACIÓN CUÁNTICA DE UN SUBNIVEL nl x N° de electrones Subnivel (número cuántico secundario) Nivel de energía (número cuántico principal) Ejemplo: 6 p 3 5 s 1 Significa que hay 3 electrones en el subnivel principal (p) del sexto nivel de energía. Significa que hay 1 electrón en el subnivel sharp (s) del quinto nivel de energía.

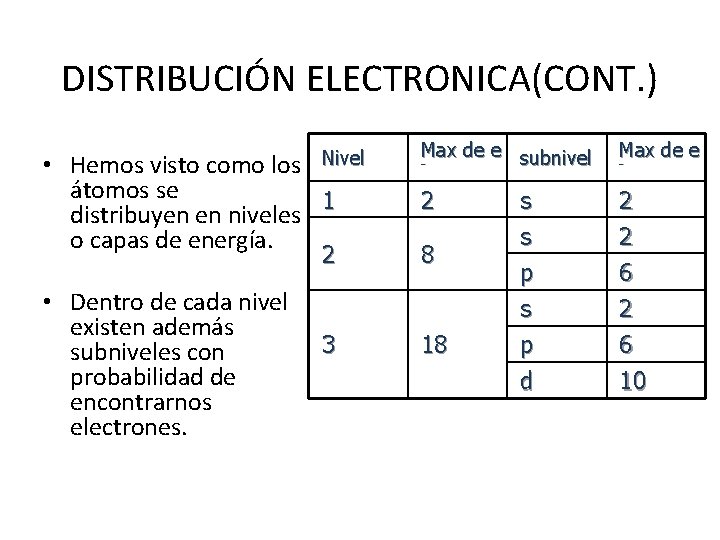
DISTRIBUCIÓN ELECTRONICA(CONT. ) Nivel • Hemos visto como los átomos se 1 distribuyen en niveles o capas de energía. • Dentro de cada nivel existen además subniveles con probabilidad de encontrarnos electrones. Max de e subnivel - Max de e 2 s s 2 2 p s 6 2 p d 6 10 2 8 3 18 -

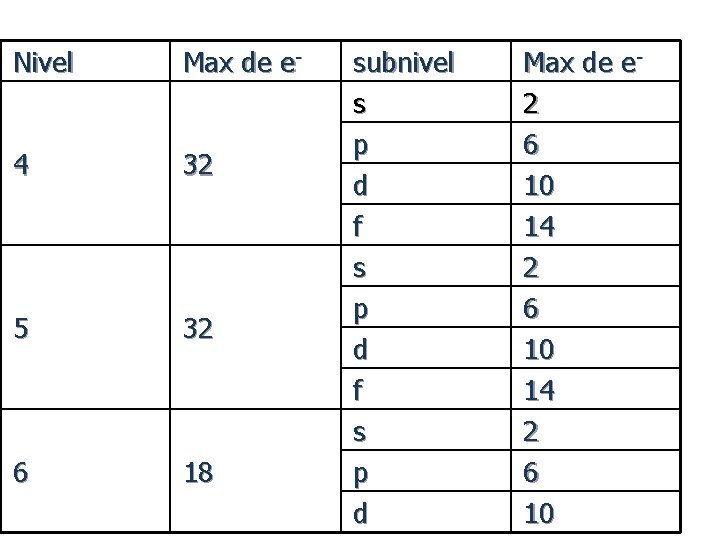
Nivel Max de e- 4 32 5 32 6 18 subnivel s p d f s p d Max de e 2 6 10 14 2 6 10

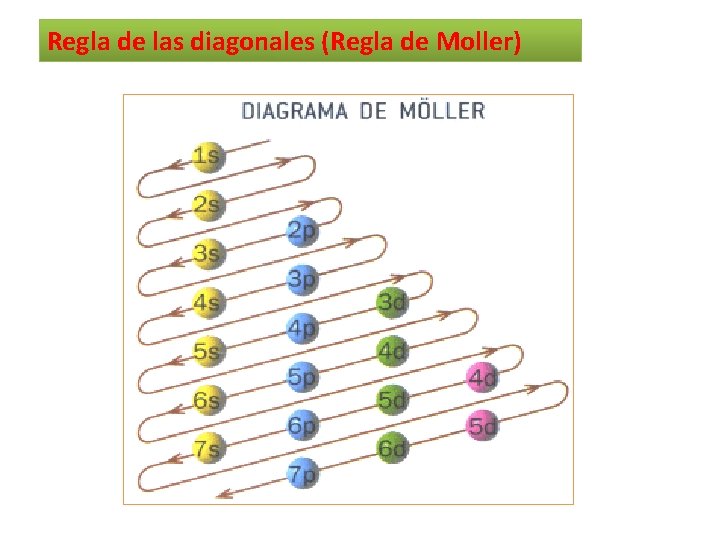
Regla de las diagonales (Regla de Moller)

Si empezamos por la línea superior y seguimos la flecha obtenemos el siguiente orden: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 14 5 d 106 p 67 s 25 f 146 d 107 p 6 Ejemplo: Escribir las configuraciones electrónicas por subniveles para los siguientes átomos. Ø 9 F : Ø 15 P : Ø 20 Ca: Ø 30 Zn: Ø 38 Sr : 1 s 22 p 5

Configuración Electrónica abreviada Abreviación de la configuración de un gas noble. Los gases nobles son: helio (2 He), neón (10 Ne), argón (18 Ar), kriptón (36 Kr), xenón (54 Xe) y radón (86 Rn). Ejemplo: Realizar la C. E simplificada de los siguientes átomos. Ø 13 Al : [10 Ne] 3 s 2 3 p 1 Ø 34 Se : Ø 53 I Ø 82 Pb : :

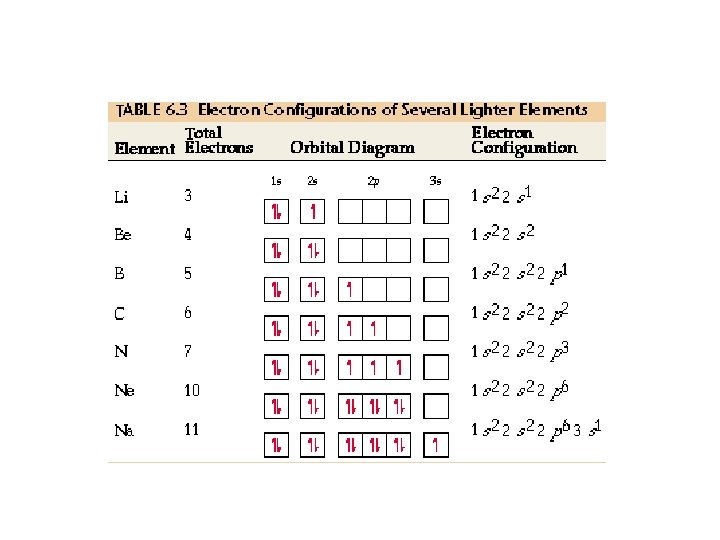
Principio de Máxima Multiplicidad (Regla de Hund) La regla de Hund es una regla empírica obtenida por Friedrich Hund que enuncia lo siguiente: “ Al distribuir electrones en orbitales del mismo subnivel, primero se trata de ocupar todos estos orbitales antes de terminar de llenarlos, esto es, los electrones deben tener igual sentido de spin (espines paralelos) antes de aparearse. Ejemplo: Indique la C. E por orbitales para los siguientes átomos Ø 7 N : 1 s 22 p 3 Ø 16 S : =>

Formación de iones más probables. • Un ión perderá o ganará electrones , hasta que se estabilice. • La forma más común de estabilización es la de formar estructuras electrónicas de gas noble. • ¿PORQUÉ DE GAS NOBLE? Los gases nobles son los elementos que menos tienden a perder o ganar electrones , no reaccionan apenas, solo bajo condiciones extremas. Por tanto todos los átomos tienden a adquirir una estructura electrónica similar a la de estos.

Formación de iones más probables. • Porque buscan lograr la estabilidad, como la piedra que cae rodando por una montaña logra su estabilidad cuando se detiene, cada elemento de la tabla periódica logra su estabilidad cuando adquiere la estructura electrónica del gas noble(último grupo del S. P. ) más cercano. • Quedando el último nivel de energía de cada uno de éstos átomos con ocho electrones. • Excepto los átomos que se encuentran cerca del Helio, que completan su último nivel con sólo dos electrones. • Por ésta razón se denomina a ésta REGLA DEL OCTETO

Ejemplos de formación de iones más probables. 11 Na -Podemos observar que el Nº atómico del SODIO está más cerca del Nº atómico del Neón. -Si el SODIO pierde un electrón (una carga negativa) , adquiere configuración de Neón. -Entonces deja de ser neutro. -1 e 22 s 2 p 63 s 1 Na : 1 s 11 Na+

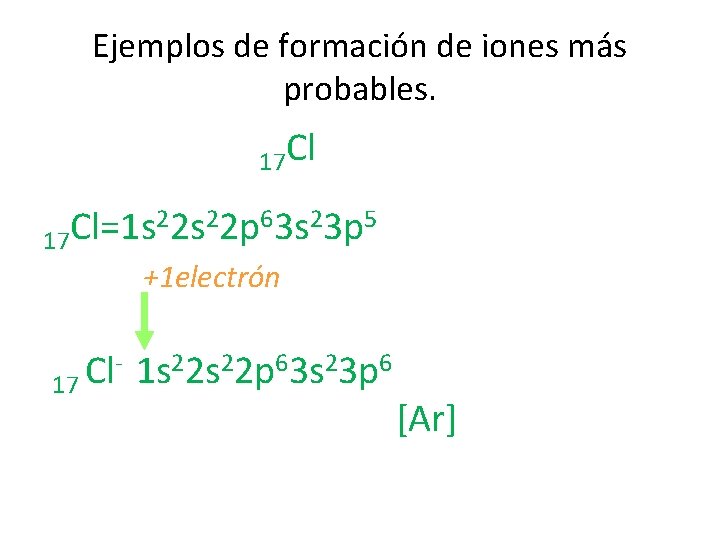
Ejemplos de formación de iones más probables. 17 Cl 22 s 22 p 63 s 23 p 5 Cl=1 s 17 +1 electrón - 1 s 22 p 63 s 23 p 6 Cl 17 [Ar]

Ejemplo: Realizar la C. E de los siguientes cationes. Ø 20 Ca +2 Ø 26 Fe+3


CONFIGURACIÓN ELECTRÓNICA EXTERNA (CEE) Configuración electrónica del último nivel de energía. Conjunto de los subniveles de energía que se encuentran en los niveles de energía incompletos de ese elemento. 1) Si la CE termina en s o p se cuentan todos los electrones del n mayor. Ej; 20 Ca – 16 S 2) Si la CE termina en d o en f se cuentan los electrones del n mayor y los del d ó del f. Ej 28 Ni (CEE: 4 s 2 3 d 8) – 30 Zn (4 s 23 d 10) 3) Si la CE termina en p pero hay orbitales d o f completos e intermedios entre el s y el p, NO se cuentan los orbitales d para la CEE Ej: 35 Br (CEE: 4 s 2 4 p 5)

EJEMPLO: Cloro • • • CLORO: 17 electrones 1 s 2 2 p 6 3 s 2 3 p 5 1º nivel: 2 electrones 2º nivel: 8 electrones 3º nivel: 7 electrones En la tabla periódica podemos leer: 2 - 8 - 7

EJEMPLO: Manganeso • • MANGANESO: 25 electrones 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 5 1º nivel: 2 electrones 2º nivel: 8 electrones 3º nivel: 13 electrones 4º nivel: 2 electrones En la tabla periódica podemos leer: 2 - 8 - 13 - 2
 Demcrito
Demcrito Demcrito
Demcrito Particulas fundamentales del atomo
Particulas fundamentales del atomo Democrito teoria atomica
Democrito teoria atomica Mañana llovera es una proposicion
Mañana llovera es una proposicion Massa isotópica
Massa isotópica Microscopia electrica
Microscopia electrica Constante de avogadro
Constante de avogadro Modelo atómico de bohr características
Modelo atómico de bohr características Massa atomica
Massa atomica Legge di proust
Legge di proust Molul de atomi
Molul de atomi Erwin schrödinger modelo atomico
Erwin schrödinger modelo atomico Espectrometria de massa
Espectrometria de massa Teoria atomica della materia
Teoria atomica della materia Icp
Icp Partículas subatómicas
Partículas subatómicas La primera teoria atomica
La primera teoria atomica Tabela periodica numero atomico
Tabela periodica numero atomico Democrito de abdera teoria
Democrito de abdera teoria Masa atmica
Masa atmica Massa molar formula
Massa molar formula Notacion atomica
Notacion atomica Massa atomica relativa definizione
Massa atomica relativa definizione Masa atomica a carbonului
Masa atomica a carbonului Características de los modelos atómicos de rutherford
Características de los modelos atómicos de rutherford Molarità
Molarità Osapre
Osapre Ordem de grandeza exemplos
Ordem de grandeza exemplos Spettroscopia atomica
Spettroscopia atomica Densidade atomica planar
Densidade atomica planar Spettroscopia di emissione
Spettroscopia di emissione Legge proust
Legge proust Chimica piu capitolo 8 soluzioni
Chimica piu capitolo 8 soluzioni Unidade de medida u
Unidade de medida u Coefficienti stechiometrici frazionari
Coefficienti stechiometrici frazionari Notacion atomica
Notacion atomica Introduce yourself using science
Introduce yourself using science Logistics equipment introduce
Logistics equipment introduce Ayna taskunu
Ayna taskunu Ladies and gentlemen greeting
Ladies and gentlemen greeting Write short bio about yourself
Write short bio about yourself Citing text evidence sentence starters
Citing text evidence sentence starters Let me introduce myself. my name is valentine
Let me introduce myself. my name is valentine