Elektrokmia Elektromos egysgek Elektrolzis Faraday I II Galvnelemek



![Galvánelemek [cellák] (és elektródok) termodinamikája (heterogén egyensúlyi elektrokémia) 1) Elektrokémiai cellák: galvánelem vs. elektrolízis Galvánelemek [cellák] (és elektródok) termodinamikája (heterogén egyensúlyi elektrokémia) 1) Elektrokémiai cellák: galvánelem vs. elektrolízis](https://slidetodoc.com/presentation_image_h/83b01e23b6ad6a1cd937cd2380b7281e/image-4.jpg)




















































- Slides: 73

Elektrokémia • • • Elektromos egységek Elektrolízis (Faraday I. -II. ) Galvánelemek Elektródpotenciálok (Nernst egyenlet) Korrózió, korrózióvédelem

Elektromos egységek • • áramerősség Töltés Feszültség Teljesítmény Energia Ellenállás Vezetés I Q U P E R G amper coulomb volt watt joule ohm siemens

Faraday törvényei: I. Az elektrolízis során az elektródfolyamatban képződő anyag tömege arányos az elektrolizáló áram erősségének és az időnek a szorzatával, vagyis az áthaladt elektromos töltésmennyiséggel. II. Az elektrolizáló cellán áthaladt töltés és az elektródreakcióban résztvevő elektronok anyagmennyisége arányos egymással. E kettő hányadosa a Faraday-állandóval egyenlő, értéke 9, 65× 10000 C/ mol.
![Galvánelemek cellák és elektródok termodinamikája heterogén egyensúlyi elektrokémia 1 Elektrokémiai cellák galvánelem vs elektrolízis Galvánelemek [cellák] (és elektródok) termodinamikája (heterogén egyensúlyi elektrokémia) 1) Elektrokémiai cellák: galvánelem vs. elektrolízis](https://slidetodoc.com/presentation_image_h/83b01e23b6ad6a1cd937cd2380b7281e/image-4.jpg)
Galvánelemek [cellák] (és elektródok) termodinamikája (heterogén egyensúlyi elektrokémia) 1) Elektrokémiai cellák: galvánelem vs. elektrolízis 2) Galvánelemek: a standard cellapotenciál és a standard reakció-szabadentalpia: – ν F E = ΔG - cellapotenciál és az összetétel (reakcióhányados) kapcsolata: E = E – (RT/νF) ln Q (Nernst-e. ) - a galvánelem egyensúlyban: RT ln K = ν F E - galvánelemek típusai, gyakorlati alkalmazások, 3) Elektródok. Az elektródpotenciál Nernst egyenlete: E = E + (RT/νF) ln ai - elektródok és elektródreakciók, elektródtípusok

1) Az elektrokémiai cellákban elektron-átmenettel járó redoxi folyamatokat térben elkülönítünk (sav-bázis reakciókat térben elkülöníteni nem lehet). A cella részei (heterogén rendszer): • két (fém)elektród (anód és katód) merül • ionos oldatba (elektrolitba) Ezek együttese az elektródtér. Ha ezt térben két részre osztjuk, közéjük sóhíd vagy diafragma kell. Két típus: - spontán galvánelem vs. - kikényszerített elektrolízis [Az elekrolitikus disszociáció is kémiai változás, de nem jár oxidációs szám változással, csak töltéselkülönüléssel, s egyazon oldattérben játszódik le. ]

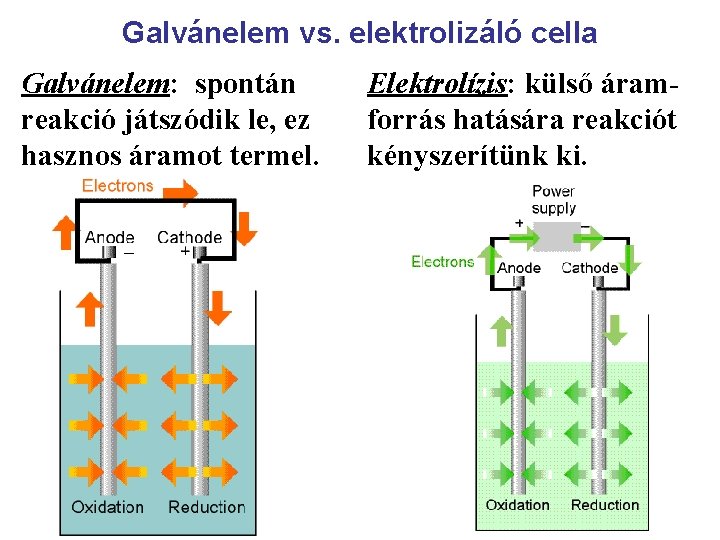
Galvánelem vs. elektrolizáló cella Galvánelem: spontán reakció játszódik le, ez hasznos áramot termel. Elektrolízis: külső áramforrás hatására reakciót kényszerítünk ki.

Az áramjárta galvánelem, ill. elektrolizáló cella sincs termodinamikai egyensúlyban. A cellában kémiai (redoxi) reakció megy végbe, - ez mindig e- -átmenet, néha atom-átmenet is, - redukció (e– -felvétel) és oxidáció (e– -leadás) - a redukció és az oxidáció itt térben elkülönül, - az elektrolit-oldatban ionvezetés van, - a külső körben fémes elektronvezetés van. Vigyázat! az oxidálószer egy másik anyagot oxidál, miközben maga redukálódik! Fordítva is igaz: a redukálószer egy másik anyagot redukál, miközben maga oxidálódik!

A galvánelemben: Elektrolizáló cellában: Az anódon: - spontán oxidáció van, - kikényszerített oxidáció, - az oxidációs szám nő, - az (1) anyag elektront - az anód elektront vesz ad le az anódnak, fel az (1) anyagtól, - az anód a negatív pólus. - az anód a pozitív pólus, az anionok itt válnak le. A katódon: - spontán redukció van, - kikényszerített redukció, - oxidációs szám csökken, - a (2) anyag elektront - a katód elektront ad le vesz fel a katódtól, a (2) anyagnak, - a katód a pozitív pólus. - a katód a negatív pólus, a kationok itt válnak le.

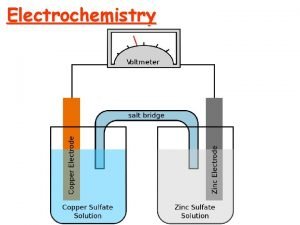
2) Galvánelem: kémia és termodinamika Egyszerű kísérlet: réz-szulfátoldatba merített cink rúdra vörös fémréz válik ki, (s bár ezt nem látjuk) egyúttal cinkionok mennek oldatba: ekkor ugyan- abban a térben zajlik le a réz redukciója és a cink oxidációja: Zn(s) +Cu 2+(aq) → Zn 2+(aq) + Cu(s)

Bontsuk fel első logikus lépésként az előző Zn(s) + Cu 2+(aq) → Zn 2+(aq) + Cu(s) reakciót egy oxidációra és egy redukcióra: Zn(s) → Zn 2+(aq) + 2 e– red 1 → ox 1 + e– oxidáció: e–-leadás anód: – elektród anódos oxidáció Cu 2+(aq) + 2 e– → Cu(s) ox 2 + e– → red 2 redukció: e–-felvétel katód: + elektród katódos redukció jelölése: (bal) vagy (1) jelölés: (jobb) vagy (2) Mindkét oldal egy-egy redoxipár: ox + νe– → red

Az elektrokémiában célszerűen mindkét folyamatot redukcióként írjuk fel: –{Zn 2+(aq) + 2 e– → Zn(s)} Cu 2+(aq) + 2 e–→ Cu(s) A bruttó reakció most két redukció különbsége: jobb – bal Ez célszerű írásmód (egyúttal persze logikus is): Ecella = Ejobb elektród – Ebal elektród mert így Ecella mindig pozitív, összhangban a spontán cellareakció negatív ΔG értékével.

A galváncella részei és felírásmódja: A galvánelem, galváncella vagy elektrokémiai cella = 2 félcella vagy 2 félreakció vagy 2 elektród felírásmódja: (–) Zn(s)│Zn. SO 4(aq) ║ Cu. SO 4(aq)│Cu(s) (+) Jelölésmód: │ fázishatár (szilárd/oldat, szilárd/gáz) ║ határfelület – diffúziós potenciál nélkül ⋮ elektrolitok érintkezése A diffúziós potenciál sóhíddal kiküszöbölhető.

A galváncella potenciálja A galvánelemben elektromos potenciál (potenciálkülönbség) jön létre: ez a cellapotenciál. A cellapotenciál és a reakció-szabadentalpia kapcsolata – ν F E = Δr. G A kapcsolat származtatása (levezetése): - a reakció maximális hasznos munkája: Δr. G - az elektromos töltés munkája (fizika): –ν F E a galvánelemben a kettő egyenlő: Δr. G = –ν F E

A reverzíbilis reakciókban ΔG konkrét értéke a Q egyensúlyi hányadostól függ: ΔGr = ΔG + RT ln. Q, Így a cellareakcióra írhatjuk: –ν F E = ΔG + RT ln. Q E = – ( ΔG /νF) – (RT/νF) ln. Q. Legyen: – ( ΔG /νF) = E , a standard cellapotenciál. Végül: E = E – ( RT / v. F ) ln Q (Nernst-egyenlet cellára)

Egyensúlyban (amikor E = 0) Q éppen az egyensúlyi állandó: K. Ebből kapjuk a standard cellapotenciál és az egyensúlyi állandó kapcsolatát: E = ( RT/νF ) ln K Összegezhetjük a cellapotenciál, az egyensúlyi állandó és a reakció-szabadentalpia együttes kapcsolatát: νF E = RT ln K = – ΔG ez az egyensúlyi elektrokémia, az egyensúlyok tana és a termodinamika „egyesített” kapcsolata.


A cellapotenciál és más termodinamikai függvényértékek (H, S) kapcsolata: Alap: az E hőmérséklet-függése. Ismert a termodinamikából: (∂G/∂T)p = –S akkor behelyettesítéssel: ∂(–νFE/∂T) = –S, ami érvényes standard értékekre is: S : a E jól mérhető T-függéséből nyerhető. ΔH : mivel ΔG = ΔH – T ΔS , így ΔH = – νF {E – T(∂ E /∂T)p } ΔG , S és ΔH termodinamikai standard függvényértékek elektrokémiai adatokból is nyerhetők.

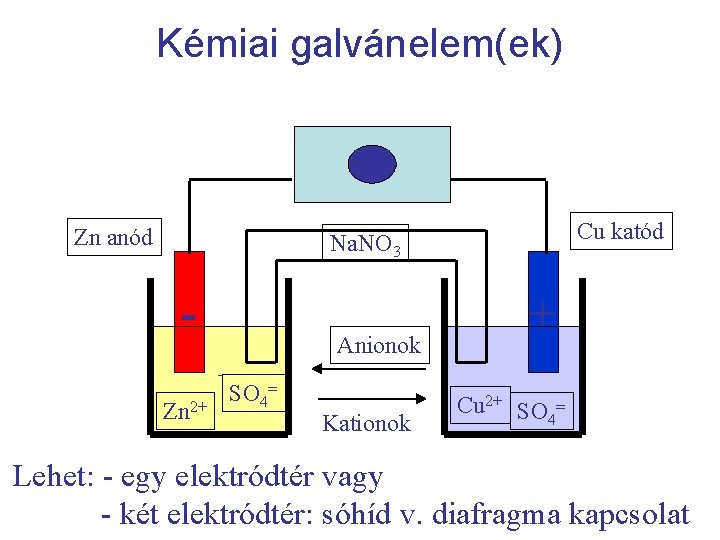
Kémiai galvánelem(ek) V Zn anód Cu katód Na. NO 3 - Anionok - Zn 2+ SO 4= Kationok + Cu 2+ SO 4= Lehet: - egy elektródtér vagy - két elektródtér: sóhíd v. diafragma kapcsolat

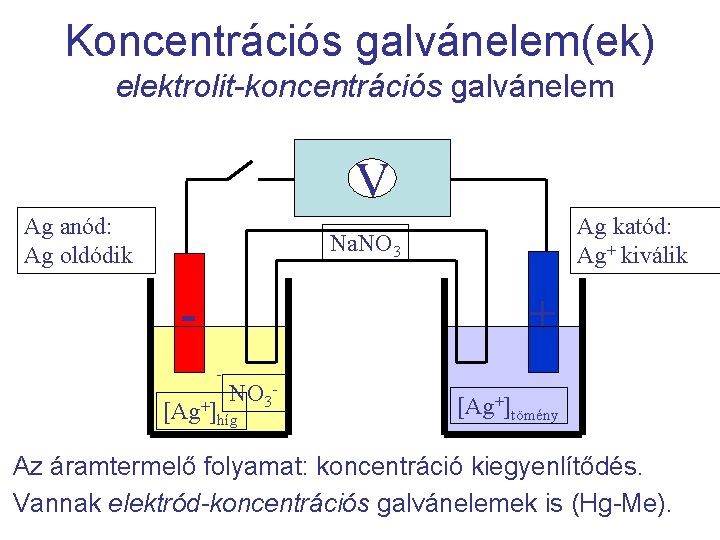
Koncentrációs galvánelem(ek) elektrolit-koncentrációs galvánelem V Ag anód: Ag oldódik Ag katód: Ag+ kiválik Na. NO 3 + - NO 3 - [Ag+]híg [Ag+]tömény Az áramtermelő folyamat: koncentráció kiegyenlítődés. Vannak elektród-koncentrációs galvánelemek is (Hg-Me).

A koncentrációs galvánelemben: 1 nagyságrendnyi koncentráció (aktivitás) különbség 59 m. V cellapotenciált eredményez (25 o. C-on). A biológiai sejtfal két oldalán 20 -30 -szoros [K+] különbség kb. 77 m. V potenciálkülönbséget okoz – ez is egy koncentrációs galvánelem. Ez a membránpotenciál játszik szerepet az idegimpulzusok vezetésében.

Galváncellák olvadékokban Ritkán valósítanak meg ilyen felépítést. Az olvadék elektrolízis fontosabb: pl. Al-előállítás. Galváncellák oldószer nélkül Technikailag az oldószer kellemetlen: pl. kifolyik, hőérzékeny, környezetszennyező. Példákat lásd a gyakorlati galvánelemeknél.

A terheletlen (árammentes: I = 0) galvánelem elektródjai közötti potenciál gyakori neve: elektromotoros erő (e. m. e. ) A galvánelemben addig tud munkát végezni (áramot adni), amíg távol van az egyensúlytól. Amint (a benne lejátszódó reakció) elérte az egyensúlyi helyzetet, az e. m. e. = 0 lesz, áramot nem ad, (a hétköznapokban: „kimerült”). A folyamat (elvileg mindig) megfordítható: az elemet „feltöltjük”: ez az akkumulátor esete.

A cellapotenciál mérése A cellapotenciálok mérése: - terhelésmentesen (áramkivétel nélkül): e. m. e. - terheléssel (fogyasztóval, áramkivétellel): kapocsfeszültség – változó (csökkenő) Az elektromotoros erő (e. m. e. ) mérése: - kompenzációs módszerrel (teljesen árammentes) klasszikus: Du. Bois–Reymond–Poggendorf - nagy belső-ellenállású (R>1010 ohm) V-mérővel Ez ma általános laborműszer (a p. H mérő is ilyen). A gyakorlatban 0 ≤ 3 V nagyságú feszültségeket kell mérni kb. 0, 1 m. V (azaz 10 -4 pontossággal).

A működő, áramtermelő galváncellában (I > 0) ún. E´ kapocsfeszültség lép fel (másik neve: működési potenciál), amely mindig kisebb, mint az árammentes (I = 0) cellában mérhető E egyensúlyi cellapotenciál (ennek gyakori neve: e. m. e. ). E’ = ΔΦJ – ΔΦB = E – ΔΦJ – ΔΦB – IRs. Az IRs (ohmikus) tag az áram okozta oldatbeli hőtermelést adja meg, ami a galváncella használata során energia veszteséget okoz.

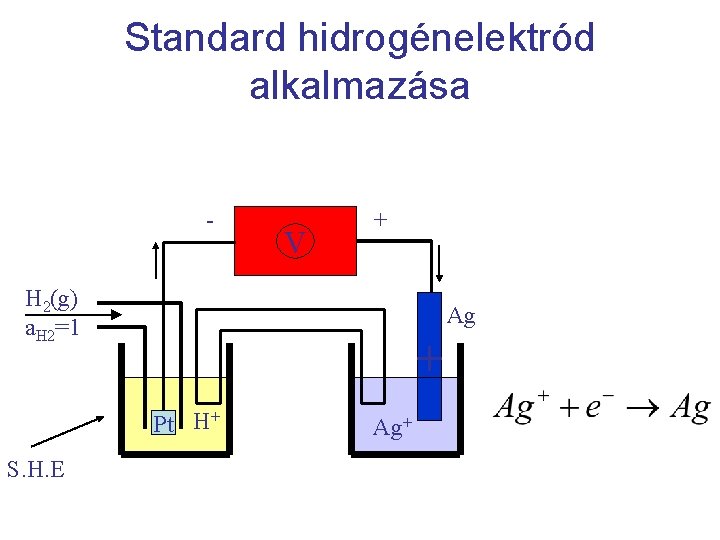
3) Elektródok A cellapotenciál és az elektródpotenciálok kapcsolata, azaz az elektródpotenciál formális értelmezése: a cellapotenciál két elektródpotenciál különbsége E = Ejobb – Ebal Önmagában egyetlen elektród (abszolút) potenciálja nem mérhető (és pontosan nem is számítható). A probléma célszerű és eredményes megoldása: az elektróddal egy olyan galvánelemet készítünk, melynek baloldali elektródja a standard hidrogénelektród (SHE).

Standard hidrogénelektród alkalmazása - V + H 2(g) a. H 2=1 Ag + Pt H+ S. H. E Ag+

Az elektródpotenciál mérése Elvi vonatkoztatási elektród a SHE: E = 0, 000 V körülményes, kényelmetlen, veszélyes (H 2 gáz!) Gyakorlati vonatkoztatási elektródok: stabilis, körülményektől független potenciálú, jól kezelhető, másodfajú elektródokat használunk Ø Ag(s) | Ag. Cl(s) | Cl–(aq) (ezüst/ezüstklorid) E = + 0, 22 V Ø Pt | Hg(l) | Hg 2 Cl 2(s) | Cl–(aq) telített-kalomel-e. E = + 0, 27 V

Az elektródpotenciálok skálája Mivel az SHE potenciálja megegyezés szerint minden hőmérsékleten = 0, 000 V, azaz a Pt│H 2(g)│H+(aq) [=SHE] minden T-en E = 0 ezért a galvánelem e. m. e-je a vizsgált (jobboldali) elektród potenciáljával egyezik meg. Eredmény: vannak pozitív és negatív elektródpotenciálok kb. +3 Volt és – 2 Volt tartományban: az elektródok feszültségi sora

Standard elektródpotenciálok (vízben, 298 K-on): S 2 O 8= + 2 e- → 2 SO 4= + 2, 05 V Ce 4+ + e- → Ce 3+ +1, 61 V Fe 3+ + e- → Fe 2+ + 0, 77 V I 2 + 2 e- → 2 I- + 0, 54 V Cu 4+ + 2 e- → Cu + 0, 34 V Ag. Cl + e- → Ag + Cl- + 0, 22 V 2 H+ + 2 e- → H 2(g) 0 V Zn 2+ + 2 e- → Zn – 0, 76 V K+ + e- → K – 2, 93 V oxidál redukál

Fémek elektrokémiai sora: Arany alig redukál Platina Ezüst Higany Réz (Hidrogén) Ólom Nikkel Vas Cink Króm Aluminium Magnézium Kalcium Nátrium Kálium nagyon redukál savval sem reagálnak erős savval lassan reagálnak savval gyorsan reagálnak vízgőzzel lassan reagálnak hideg vízzel gyorsan reagálnak

Galvánelemek (kémiai áramforrások) a gyakorlatban a) Galvánelem (primer elem, battery): egyszer használatos, „kimerül” (eléri td-i egyensúlyát), nem eldobandó! b) Akkumulátor (szekunder elem, rechargeable battery): sok(száz)szor újratölthető (gépkocsi, hallókészülék …) c) Tüzelőanyagcella: áramtermelés égés során – folyamatos anyagbetáplálással Jelentőségük: • energiaforrás tetszőleges helyen és időben – erőmű (+távvezeték) vagy generátor nélkül • rendkívül egyszerű kezelés (amatőröknek is) • hordozhatók (táskarádió, karóra, mobil, pacemaker stb. )

Minősítésük: • feszültség (sorbakapcsolással növelhető) • kapacitás (mérettel változtatható) • áramkivétel (párhuzamos kapcsolás növeli) • teljesítmény/súly viszony • hatásfok • feszültségtartás (terhelésre és időben) • gyors/lassú terhelhetőség • feltöltési ciklus (akkuknál) • hőmérséklet-tartomány • környezet-terhelés (Hg, Cd mentes!) • ár

a) Gyakorlati galvánelemek: • Leclanché-elem • Lúgos mangánoxid elem • Lítium-elem • Higanyoxid-elem • (Daniell-elem) • (Volta-oszlop)

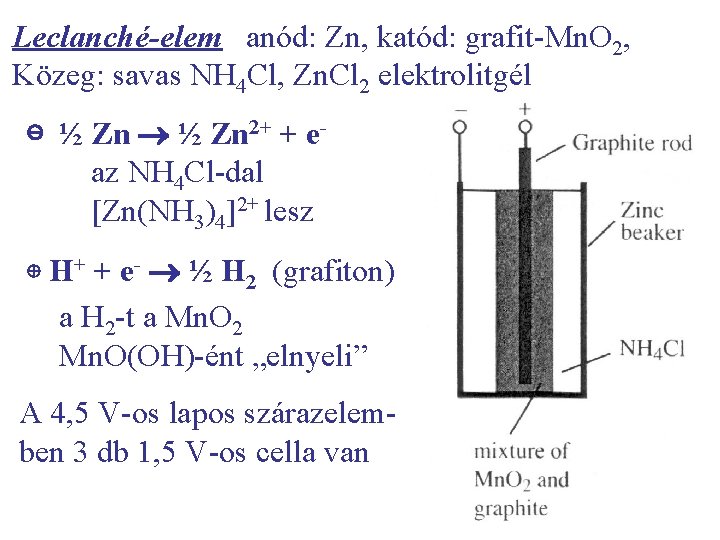
Leclanché-elem anód: Zn, katód: grafit-Mn. O 2, Közeg: savas NH 4 Cl, Zn. Cl 2 elektrolitgél ⊝ ½ Zn 2+ + e- az NH 4 Cl-dal [Zn(NH 3)4]2+ lesz ⊕ H+ + e- ½ H 2 (grafiton) a H 2 -t a Mn. O 2 Mn. O(OH)-ént „elnyeli” A 4, 5 V-os lapos szárazelemben 3 db 1, 5 V-os cella van

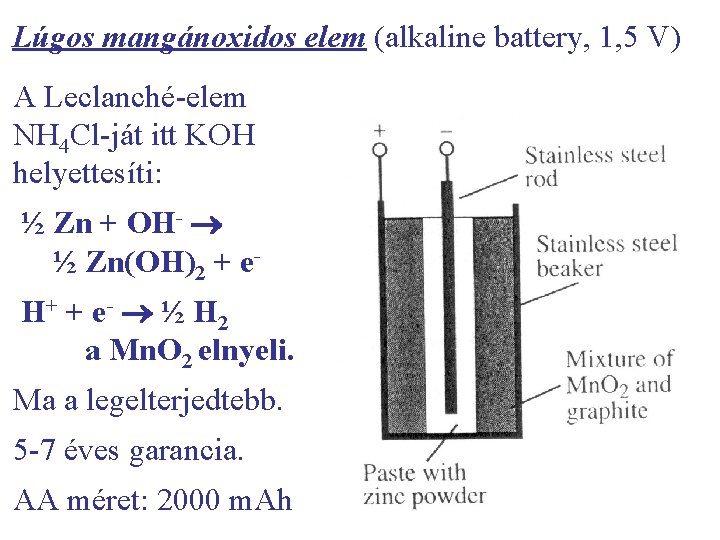
Lúgos mangánoxidos elem (alkaline battery, 1, 5 V) A Leclanché-elem NH 4 Cl-ját itt KOH helyettesíti: ½ Zn + OH- ½ Zn(OH)2 + e- H+ + e- ½ H 2 a Mn. O 2 elnyeli. Ma a legelterjedtebb. 5 -7 éves garancia. AA méret: 2000 m. Ah

A 9 voltos elem:

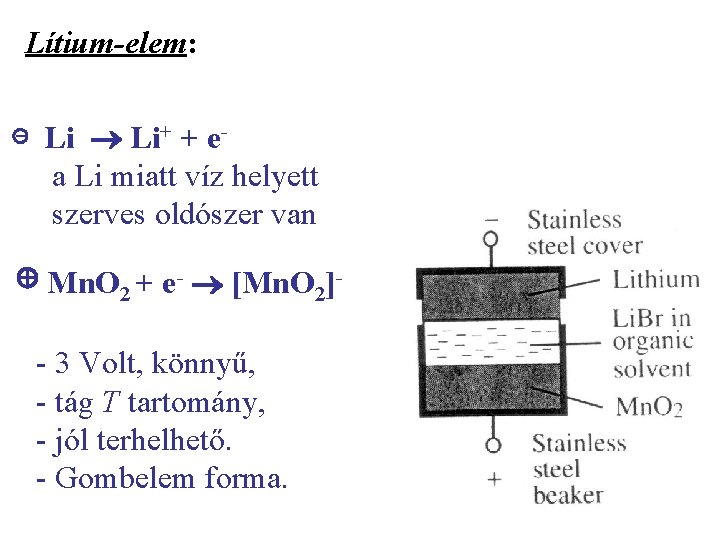
Lítium-elem: ⊝ Li Li+ + e- a Li miatt víz helyett szerves oldószer van ⊕ Mn. O 2 + e- [Mn. O 2]- - 3 Volt, könnyű, - tág T tartomány, - jól terhelhető. - Gombelem forma.

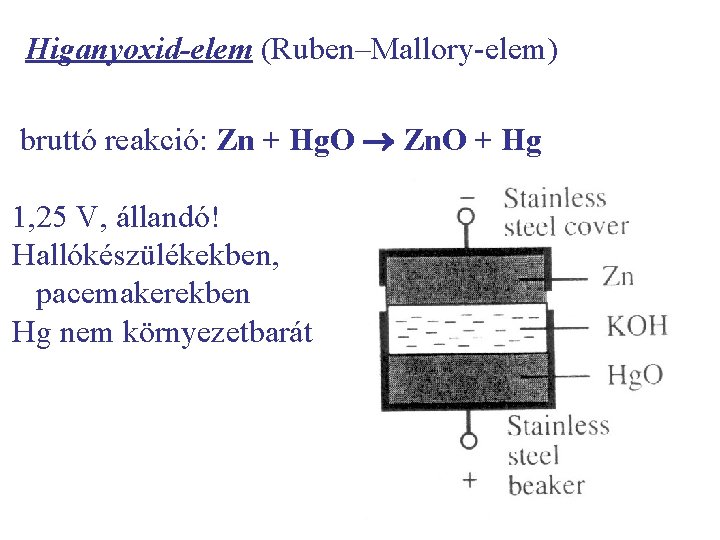
Higanyoxid-elem (Ruben–Mallory-elem) bruttó reakció: Zn + Hg. O Zn. O + Hg 1, 25 V, állandó! Hallókészülékekben, pacemakerekben Hg nem környezetbarát

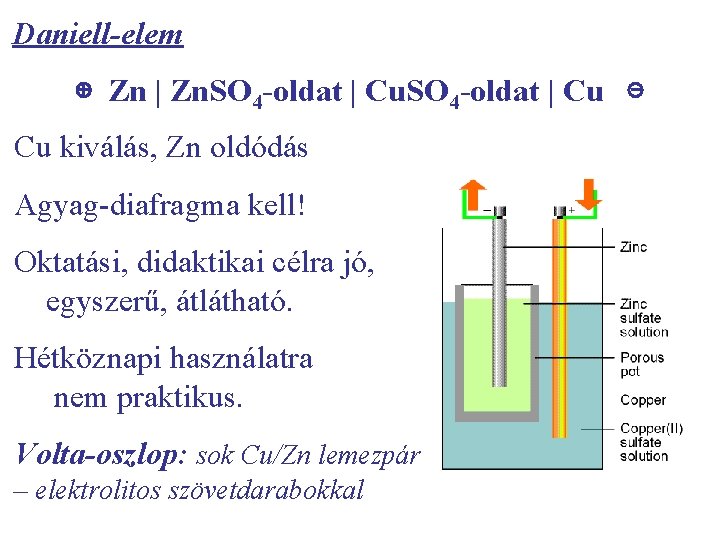
Daniell-elem ⊕ Zn | Zn. SO 4 -oldat | Cu ⊝ Cu kiválás, Zn oldódás Agyag-diafragma kell! Oktatási, didaktikai célra jó, egyszerű, átlátható. Hétköznapi használatra nem praktikus. Volta-oszlop: sok Cu/Zn lemezpár – elektrolitos szövetdarabokkal

c) Tüzelőanyag cellák Kémiai energia elektromos energia: hőerőműben közvetett (2 lépcsős) úton: max. kb. 40% Tüzelőanyag cella: speciális berendezésben az égésből közvetlenül áramot termel (75 -90%). A hidrogén+oxigén reakcióját (KOH-ban) 2 H 2(g) + O 2(g) 2 H 2 O(l) térben elkülönítik (katalizátor, T = 70– 140 o. C) : anódreakció: 2 H 2(g) + 4 OH- 4 H 2 O + 4 e- katódreakció: O 2(g) + 2 H 2 O(l) + 4 e- 4 OHMás (természetbeli) anyagok (metán, etán) oxidációjával is működnek igen jó tüzelőanyag cellák.

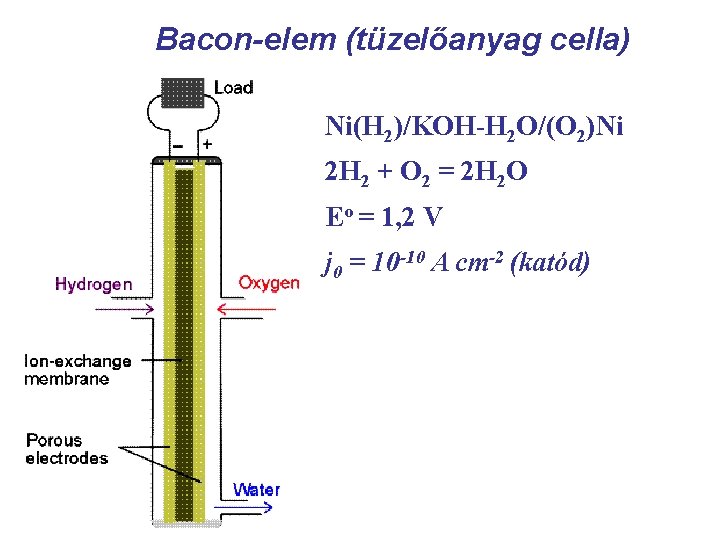
Bacon-elem (tüzelőanyag cella) Ni(H 2)/KOH-H 2 O/(O 2)Ni 2 H 2 + O 2 = 2 H 2 O Eo = 1, 2 V j 0 = 10 -10 A cm-2 (katód)

3) Elektródok A cellapotenciál és az elektródpotenciálok kapcsolata, azaz az elektródpotenciál formális értelmezése: a cellapotenciál két elektródpotenciál különbsége E = Ejobb – Ebal Önmagában egyetlen elektród (abszolút) potenciálja nem mérhető (és pontosan nem is számítható). A probléma célszerű és eredményes megoldása: az elektróddal egy olyan galvánelemet készítünk, melynek baloldali elektródja a standard hidrogénelektród (SHE).

Az elektródpotenciálok skálája Mivel az SHE potenciálja megegyezés szerint minden hőmérsékleten = 0, 000 V, azaz a Pt│H 2(g)│H+(aq) [=SHE] minden T-en E = 0 ezért a galvánelem e. m. e-je a vizsgált (jobboldali) elektród potenciáljával egyezik meg. Eredmény: vannak pozitív és negatív elektródpotenciálok kb. +3 Volt és – 2 Volt tartományban: az elektródok feszültségi sora

A cellapotenciál mérése A cellapotenciálok mérése: - terhelésmentesen (áramkivétel nélkül): e. m. e. - terheléssel (fogyasztóval, áramkivétellel): kapocsfeszültség – változó (csökkenő) Az elektromotoros erő (e. m. e. ) mérése: - kompenzációs módszerrel (teljesen árammentes) klasszikus: Du. Bois–Reymond–Poggendorf - nagy belső-ellenállású (R>1010 ohm) V-mérővel Ez ma általános laborműszer (a p. H mérő is ilyen). A gyakorlatban 0 ≤ 3 V nagyságú feszültségeket kell mérni kb. 0, 1 m. V pontossággal.

Az elektródpotenciál mérése Elvi vonatkoztatási elektród a SHE: E = 0, 000 V körülményes, kényelmetlen, veszélyes (H 2 gáz!) Gyakorlati vonatkoztatási elektródok: stabilis, körülményektől független potenciálú, jól kezelhető, másodfajú elektródokat használunk Ø Ag(s) | Ag. Cl(s) | Cl–(aq) (ezüst/ezüstklorid) E = + 0, 22 V Ø Pt | Hg(l) | Hg 2 Cl 2(s) | Cl–(aq) telített-kalomel-e. E = + 0, 27 V

Az eletródpotenciál függése az összetételtől: a Nernst-formula A definíció elve az SHE-re vonatkoztatott potenciál: Pt | H 2(g) | H+(aq) ║Ag+(aq) | Ag(s) A cellareakció: H 2(g) + 2 Ag+(aq) → 2 H+(aq) + 2 Ag(s) A cella Nernst-egyenlete a Q-val kifejezve: E = E – RT/2 F ln. Q = E (Ag+/Ag) – RT/2 F ln. Q SHE = 0, majd 2 -vel egyszerűsítve: E(Ag+/Ag) = E (Ag+/Ag) + RT/F ln a(Ag+) Ez az (Ag+/Ag) elektród Nernst-egyenlete. Általában (első fajú): Ei = Ei + (RT/νF) ln ai

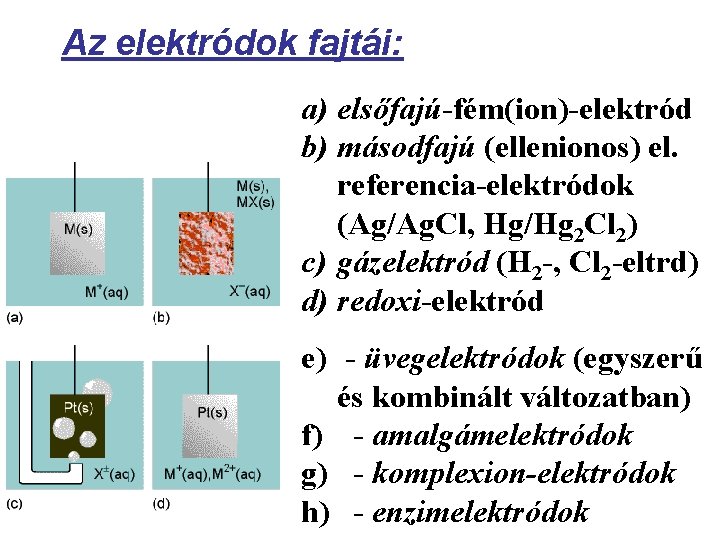
Az elektródok fajtái: a) elsőfajú-fém(ion)-elektród b) másodfajú (ellenionos) el. referencia-elektródok (Ag/Ag. Cl, Hg/Hg 2 Cl 2) c) gázelektród (H 2 -, Cl 2 -eltrd) d) redoxi-elektród e) - üvegelektródok (egyszerű és kombinált változatban) f) - amalgámelektródok g) - komplexion-elektródok h) - enzimelektródok

Elsőfajú elektródok Az elektród potenciálját a fém saját ionjainak aktivitása határozza meg: Ei = Ei + (RT/νF) ln ai Másodfajú elektródok A potenciált a fém egy rosszul oldodó sójának anionja (az ellenion) határozza meg, pl. Ag/Ag. Cl MX(s) M+(aq) + X-(aq) Ks = a. M+ a. XNagy és állandó [X-] tartásával potenciáljuk állandó: ezért referencia elektródként használhatók. Potenciáljuk mérésével Ks meghatározható.

Gázelektródok H+(aq) + e- → ½ H 2 (g) Q = (f. H 2/pθ) / a. H+ E(H+/H 2) = RT/F ln a. H+= – (RT/F) ln 10 × p. H A standard H-gáz elektród az elektródpotenciál-skála önkényesen választott 0 pontja. Pontos, de kezelése nehézkes. Ezért is jók a másodfajú referencia el-k.

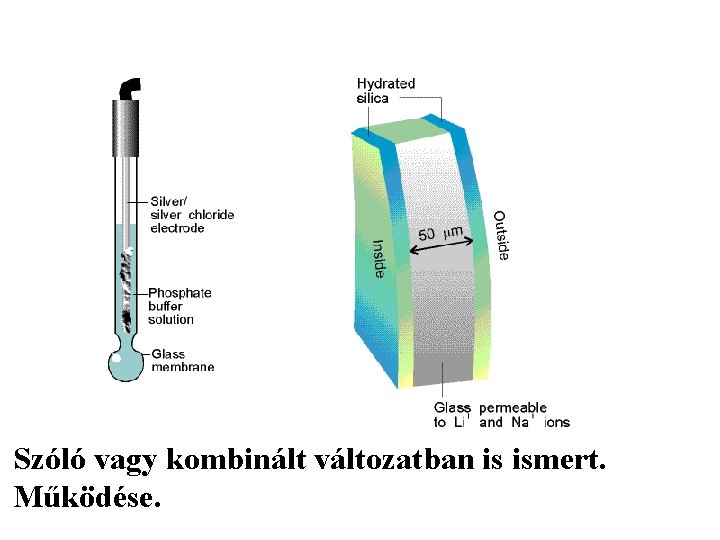
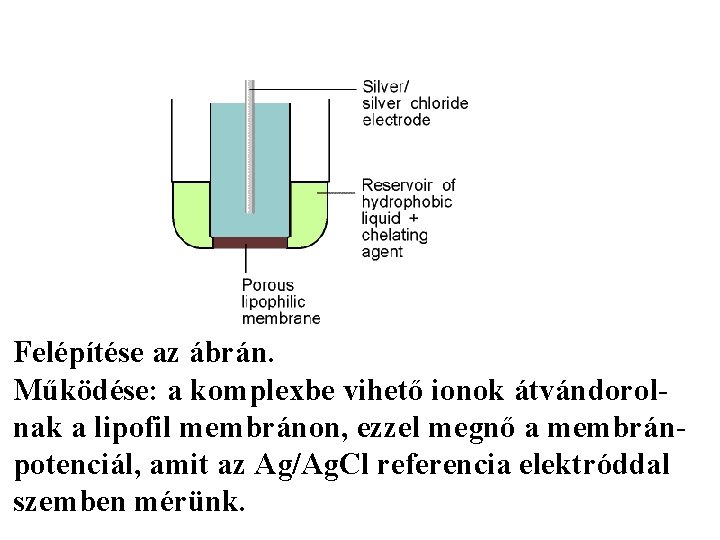
Üvegelektródok Szóló vagy kombinált változatban is ismert. Működése.

Ionszelektív elektródok Felépítése az ábrán. Működése: a komplexbe vihető ionok átvándorolnak a lipofil membránon, ezzel megnő a membránpotenciál, amit az Ag/Ag. Cl referencia elektróddal szemben mérünk.

Redoxi elektródok Sajátos névkisajátítás (régről megmaradt) Ei = Ei + (RT/νF) ln aox/ared Egyazon oldatban két különböző oxidációs állapotú (fém)ion (pl. Fe 3+/Fe 2+) van és inert Pt-elektród. Amalgámelektródok A fémek higannyal képzett amalgámjai is lehetnek elektródok: ezek potenciálja az amalgám fémkoncentrációjától függ. [Elektrolízis: összehasonlítás volt, mert nem egyensúly). ]

Korrózió

A korrózió fogalma • A korrózió kémiai vagy elektrokémiai folyamatok következtében létrejövő károsodás, mely a korróziós közeg és a szerkezeti anyag között zajlik le.

Oldási potenciál • A fémek oldatbameneteli hajlandóságát az oldási potenciál fejezi ki.

Oldási potenciál • A fémeket oldási potenciájuk szerint sorba rendezhetjük. Minden elem a sorban utána elhelyezkedőt képes kiszorítani vizes oldatából. Az oldási potenciálsorban a hidrogénhez viszonyított helyzet szerint beszélhetünk a hidrogénnél kevésbé nemes, és nemesebb fémekről. Li; Mg; Al; Ti; Zn; Mn; Cr; Fe; Ni; Sn; Pb; H 2; Cu; Ag; Pt; Au

A korrózió mint kémiai és elektrokémiai folyamat két fő változatát különböztetjük meg. Ezek: ÞHidrogén fejlődéssel ÞOxigén fogyasztással járó

Hidrogén fejlődéssel járó korrózió • A hidrogénnél kevésbé nemes fémek p. H 7 savas oldatokban képesek a hidrogént kiszorítani, így az oldódásuk H 2 fejlődése mellett történik.

• A reakció sebessége az oldat H+ ionkoncentráció, tehát a p. H függvénye. A folyamat általános egyenlete: Me + 2 H+ Me++ + H 2 • Itt egy elektrokémiai folyamatról van szó, amely az anódon lejátszódó oxidációból (a megtámadott fém oxidációja) és az elektrolitként ható korróziós közeg redukciójából tevődik össze.

Oxigén fogyasztással járó korrózió • Ha a vizes oldatban a H+ ion koncentráció alacsony, akkor a korróziót jelentő kémiai reakció Me + 2 H 2 O + O 2 2 Me (OH)2 2 Me++ + 4 OHIlyen mechanizmussal oldódnak a hidrogénnél nemesebb fémek pl. a Cu, savas közegben, a hidrogénnel kevésbé nemes fémek semleges vagy lúgos közegben. és ezzel a mechanizmussal rozsdásodik a vas.

Oxigén fogyasztással járó korrózió • a vas rozsdásodása során a reakcióból keletkező oxidációs termék tovább oxidálódik Fe. OOH vízben oldhatatlan vas-oxi -hidroxiddá

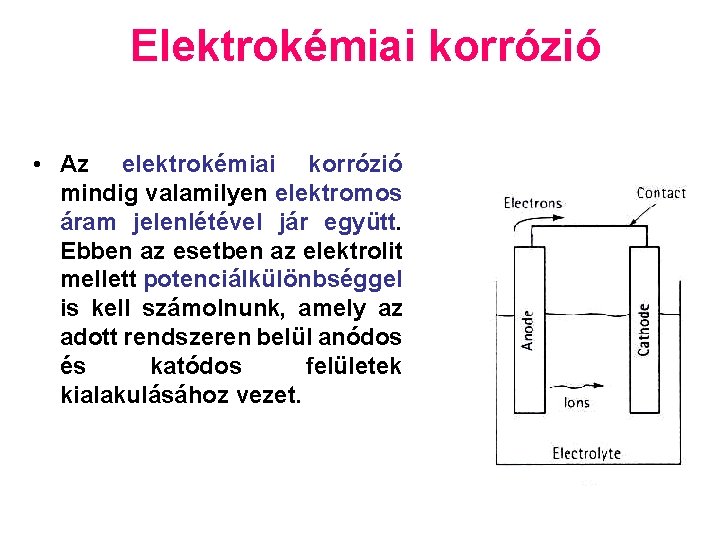
Elektrokémiai korrózió • Az elektrokémiai korrózió mindig valamilyen elektromos áram jelenlétével jár együtt. Ebben az esetben az elektrolit mellett potenciálkülönbséggel is kell számolnunk, amely az adott rendszeren belül anódos és katódos felületek kialakulásához vezet.

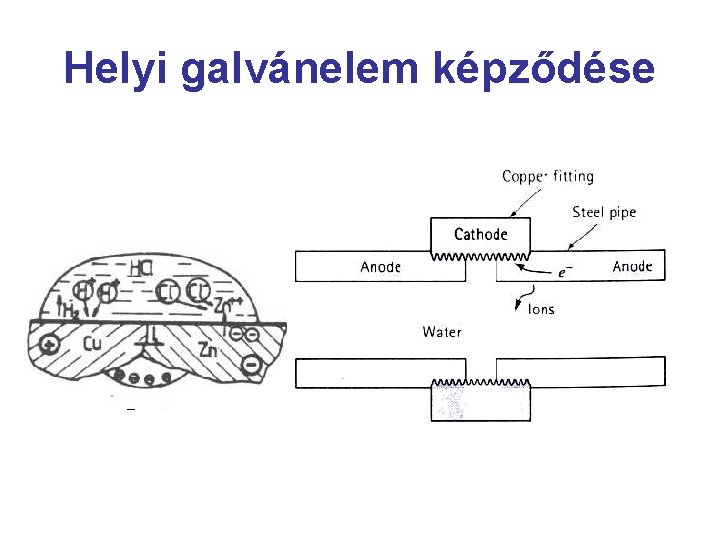
Helyi galvánelem képződés • a korróziós folyamatok lényegében elektrokémiai folyamatok, mert a fém oldatbamenetelekor galvánáram indul meg.

Helyi galvánelem képződése • Sárgaréz

Mi segíti elő a helyi galvánelem kialakulását? · adott szerkezeten belül különböző szerkezeti anyagok jelenléte pl. Al és acél · adott ötvözet heterogén szövete pl. sárgaréz Cu és Zn · homogén szerkezeten belüli inhomogenitások pl. dúsulások

Mi segíti elő a helyi galvánelem kialakulását? 2 ·hidegen alakított, és felkeményedett és az eredeti szilárdságú részek (ez magyarázza, hogy a mélyhúzott karosszérialemezek erősebben alakított részei hajlamosabbak a korrózióra)

Mi segíti elő a helyi galvánelem kialakulását? • Az elektrolit különböző mértékű szellőzöttsége • passzívréteg, korróziós réteg jelenlétéből

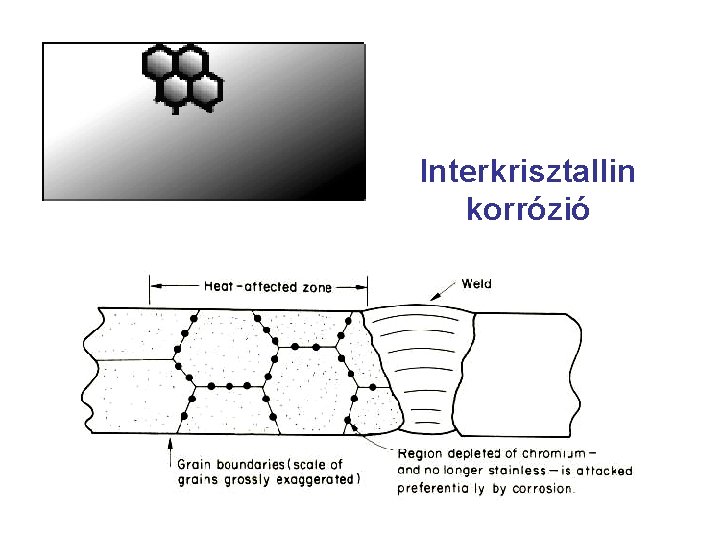
A korrózió fajtái, megjelenési formái • • Egyenletes felületi korrózió lyukkorrózió réskorrózió interkrisztallin korrózió feszültségi korrózió szelektív korróziós kifáradás

Egyenletes felületi korrózió

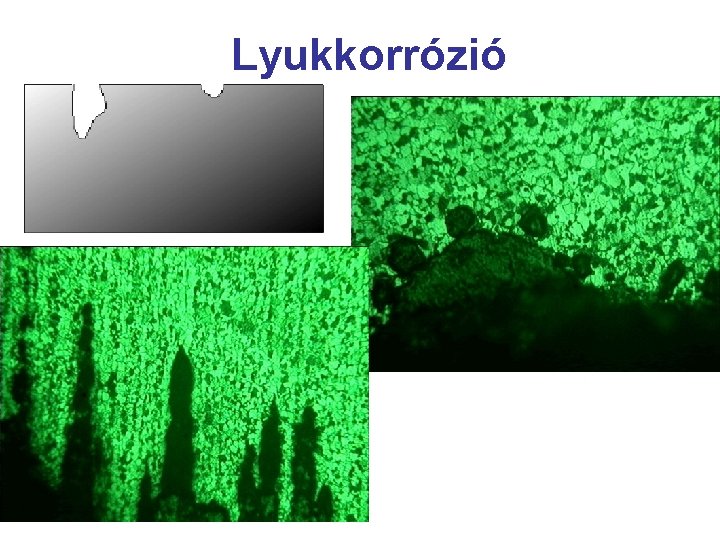
Lyukkorrózió

Interkrisztallin korrózió feszültségi korrózió

Feszültségi korrózió

Biológiai korrózió
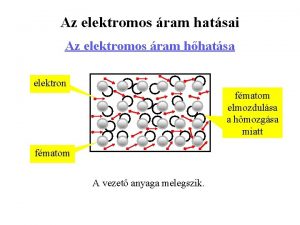
 Elektromos áram kémiai hatása
Elektromos áram kémiai hatása Elektromos fluxus
Elektromos fluxus Elektromos halak
Elektromos halak Viz bontasa elektromos arammal egyenlet
Viz bontasa elektromos arammal egyenlet Elektromos fluxus
Elektromos fluxus Elektromos loler
Elektromos loler Ebonitrúd
Ebonitrúd 1831 faraday
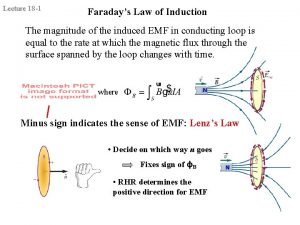
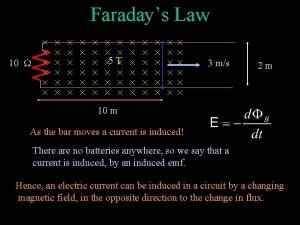
1831 faraday Faraday's law
Faraday's law Le flux
Le flux Electrochem equations
Electrochem equations Gabbia di faraday
Gabbia di faraday Legge di faraday
Legge di faraday Faraday
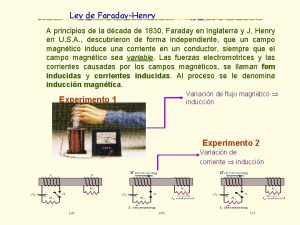
Faraday Faraday law of electromagnetic induction
Faraday law of electromagnetic induction Elektrolyse kupfersulfat platinelektroden
Elektrolyse kupfersulfat platinelektroden Características de un campo magnético.
Características de un campo magnético. Faraday's law mcq
Faraday's law mcq Faraday's law
Faraday's law Faraday's law
Faraday's law Blvsinθ
Blvsinθ Faraday's constant
Faraday's constant Faraday capacitance
Faraday capacitance Faraday's law vs lenz's law
Faraday's law vs lenz's law Michael faraday
Michael faraday Energy transformation of electric kettle
Energy transformation of electric kettle Maxwell equation vacuum
Maxwell equation vacuum Faraday cartoon
Faraday cartoon Faraday kanunu
Faraday kanunu Proprietà magnetiche della materia zanichelli
Proprietà magnetiche della materia zanichelli Gauss yasası nedir
Gauss yasası nedir Ampere gauss
Ampere gauss Aragoos
Aragoos Faradaysches gesetz induktion
Faradaysches gesetz induktion What is the emf
What is the emf Fardays law
Fardays law Faraday
Faraday What is faraday
What is faraday Michael faraday james clerk maxwell
Michael faraday james clerk maxwell Ley de ohm
Ley de ohm Legge di faraday lenz
Legge di faraday lenz Aplikasi hukum faraday
Aplikasi hukum faraday Rumus ggl induksi
Rumus ggl induksi Faraday's law uses
Faraday's law uses Faraday
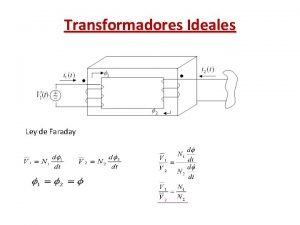
Faraday Faraday law of induction
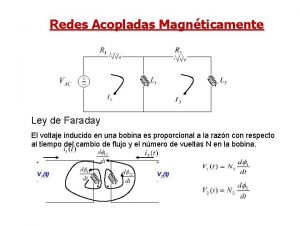
Faraday law of induction Ley de faraday
Ley de faraday Ley de faraday-henry
Ley de faraday-henry Maxwell equation for time varying field
Maxwell equation for time varying field B.v.l formülü
B.v.l formülü Michael faraday menyatakan bahwa
Michael faraday menyatakan bahwa Peta konsep medan magnet
Peta konsep medan magnet Dipool veld
Dipool veld Loi de faraday
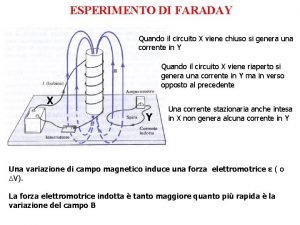
Loi de faraday Explain faraday's experiment of electromagnetic induction
Explain faraday's experiment of electromagnetic induction özindüksiyon katsayısı formülü
özindüksiyon katsayısı formülü Q=ixt
Q=ixt Faraday's law units
Faraday's law units Legge di faraday
Legge di faraday Lc circuit
Lc circuit Sebuah magnet batang jatuh sepanjang sumbu cincin
Sebuah magnet batang jatuh sepanjang sumbu cincin Ley de faraday
Ley de faraday Nernst denklemi
Nernst denklemi Faraday
Faraday Antecedentes de la electrostática
Antecedentes de la electrostática Rumus induksi magnetik
Rumus induksi magnetik Faraday törvénye
Faraday törvénye Application of faraday's law
Application of faraday's law Faradays constant
Faradays constant Michael faraday newington butts, londres, royaume-uni
Michael faraday newington butts, londres, royaume-uni Ley de faraday ejemplos
Ley de faraday ejemplos Chapter 31 faraday law ofinduction
Chapter 31 faraday law ofinduction Faraday
Faraday Faraday e maxwell
Faraday e maxwell