ELEKTROKIMIA Elektrolisis a Pada Anoda terjadi oksidasi Ion




















- Slides: 24

ELEKTROKIMIA Elektrolisis a. Pada Anoda (+) : terjadi oksidasi Ø Ion OH ¯ dioksidasi menjadi H 2 O & O 2 4 OH ¯(aq) → 2 H 2 O ( l ) + O 2 (g) + 4 e¯ Ø Ion sisa asam yang mengandung oksigen tidak dioksidasi, yang dioksidasi air. 2 H 2 O ( l ) → 4 H+(aq) + O 2 (g) + 4 e¯ Ø Ion sisa asam yang lain dioksidasi menjadi molekul. Contoh: 2 Cl ¯(aq) → Cl 2 (g) + 2 e¯

b. Pada Katoda (–) : terjadi reduksi ØIon H+ direduksi menjadi H 2. 2 H+(aq) + 2 e¯ → H 2 (g) Ø Ion logam alkali (IA) & alkali tanah (IIA) tidak direduksi, yang direduksi air. 2 H 2 O (aq) + 2 e¯ → H 2 (g) + 2 OH ¯(aq) ØIon logam lain direduksi. Contoh: Al 3+ (aq) + 3 e¯ → Al (s) Ni 2+ (aq) + 2 e¯ → Ni (s) Ag+(aq) + e¯ → Ag (s)

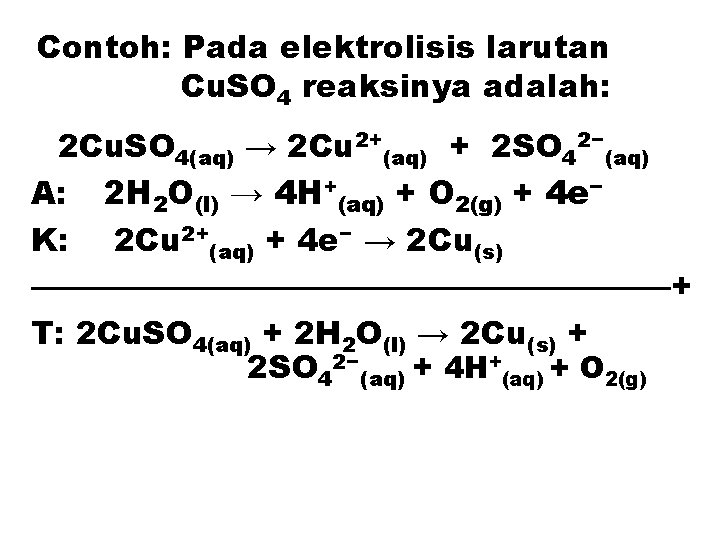
Contoh: Pada elektrolisis larutan Cu. SO 4 reaksinya adalah: 2 Cu. SO 4(aq) → 2 Cu 2+(aq) + 2 SO 42−(aq) A: 2 H 2 O(l) → 4 H+(aq) + O 2(g) + 4 e− K: 2 Cu 2+(aq) + 4 e− → 2 Cu(s) ——————————+ T: 2 Cu. SO 4(aq) + 2 H 2 O(l) → 2 Cu(s) + 2 SO 42−(aq) + 4 H+(aq) + O 2(g)

Hukum Faraday (Michael Faraday: 1834) Hukum Faraday I: Contoh soal: Larutan Cu. SO 4 dielektrolisis menggunakan arus listrik 0, 5 A selama 30 menit. Berapa massa Cu dan O 2 yang dihasilkan ? (Ar Cu = 64, O = 16)

Jawab: 64 g/mol x 0, 5 A x 30 menit x 60 dt/menit massa Cu = ————————— 2 x 96 500 C/mol = 0, 298 g 16 g/mol x 0, 5 A x 30 menit x 60 dt/menit massa O = ————————— 2 x 96 500 C/mol = 0, 0746 g

Hukum Faraday II: Pada elektrolisis dengan listrik sama, perbandingan massa zat = perbandingan massa ekivalennya (Ar/n) Contoh: Laruran Cu. SO 4 dan larutan Ag 2 SO 4 dielektrolisis dengan jumlah listrik yang sama. a. Berapa perbandingan massa Cu dan Ag yang dihasilkan ? b. Jika dihasilkan Cu = 0, 32 g, maka berapa gram Ag yang dihasilkan ? (Ar Cu = 64, Ag = 108).

Jawab: a. WCu : WAg = (Ar/n)Cu : (Ar/n)Ag = (64/2) : (108/1) = 32 : 108 b. WCu / WAg = 32 / 108 WAg = WCu / (32 / 108) = 0, 32 / (32 / 108) = 1, 08 g

Sel Galvani a. Sel kimia dengan transference. Contohnya sel Daniell. Kutub (–): Zn (s) → Zn 2+ (aq) + 2 e¯ (Oksidasi) E°oks = + 0, 76 V 2+ Kutub (+): Cu (aq) + 2 e¯ → Cu (s) (Reduksi) E°red = + 0, 34 V ——————————————— + Total: Zn (s) + Cu 2+ (aq) → Zn 2+ (aq) + Cu (s) (Redoks) E°sel = + 1, 10 V E°sel = E° reduksi + E° oksidasi = E°reduksi kutub positif – E°reduksi kutub negatif

Contoh: Sel elektrokimia dengan transference menggunakan elektroda Fe dalam larutan Fe. SO 4 dan elektroda Zn dalam larutan Zn. SO 4. Jika Zn 2+/Zn = – 0, 76 V, Fe 2+/Fe = – 0, 44 V, maka: a. Tuliskan reaksi yang terjadi dan hitung berapa E°sel yang dihasilkan ? b. Manakah elektroda positip dan negatifnya, Fe atau Zn ?

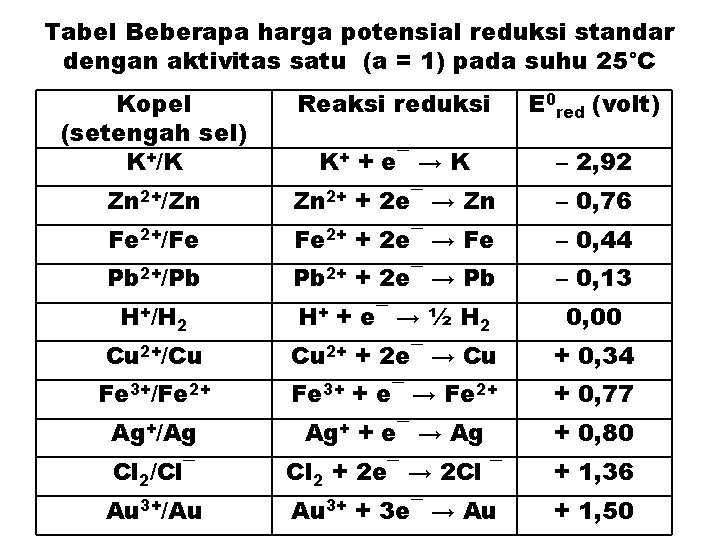
Tabel Beberapa harga potensial reduksi standar dengan aktivitas satu (a = 1) pada suhu 25°C Kopel (setengah sel) K+/K Reaksi reduksi E 0 red (volt) K+ + e¯ → K – 2, 92 Zn 2+/Zn Zn 2+ + 2 e¯ → Zn – 0, 76 Fe 2+/Fe Fe 2+ + 2 e¯ → Fe – 0, 44 Pb 2+/Pb Pb 2+ + 2 e¯ → Pb – 0, 13 H+/H 2 H+ + e¯ → ½ H 2 0, 00 Cu 2+/Cu Cu 2+ + 2 e¯ → Cu + 0, 34 Fe 3+/Fe 2+ Fe 3+ + e¯ → Fe 2+ + 0, 77 Ag+/Ag Ag+ + e¯ → Ag + 0, 80 Cl 2/Cl¯ Cl 2 + 2 e¯ → 2 Cl ¯ + 1, 36 Au 3+/Au Au 3+ + 3 e¯ → Au + 1, 50

Contoh soal: Hitunglah E°sel untuk reaksi: Zn / Zn 2+ (a = 1) // Pb 2+ (a = 1) / Pb Jawab: E°sel = E° Zn/Zn 2+ + E° Pb 2+/Pb = – (– 0, 76 V) + (– 0, 13 V) = + 0, 63 V

Sel kimia tanpa transference, contoh: Ø Sel Accu Pb(s) + SO 42¯(aq) → Pb. SO 4(s) + 2 e¯ Pb. O 2(s) + SO 42¯(aq) + 4 H+(aq) + 2 e¯ → Pb. SO 4(aq) + 2 H 2 O(l) ———————————— + Pb(s) + Pb. O 2(s) + 2 H 2 SO 4(aq) → 2 Pb. SO 4(s) + 2 H 2 O(l)

ØSel Leclanche (sel kering) Zn (s) → Zn 2+ (aq) + 2 e¯ 2 Mn. O 2 (s) + H 2 O ( l ) + 2 e¯ → Mn 2 O 3 (s) + 2 OH ¯(aq) ——————————— + Zn (s) + 2 Mn. O 2 (aq) + H 2 O ( l ) → Zn 2+(aq) + 2 OH ¯ (aq) + Mn 2 O 3 (s) Terjadi juga reaksi lain, yaitu OH¯ yang terbentuk bereaksi dengan NH 4 Cl menghasilkan NH 3, selanjutnya NH 3 yang terjadi diikat Zn 2+ 2 NH 4 Cl (aq) + 2 OH ¯(aq) → 2 NH 3 (aq) + 2 Cl ¯(aq) + 2 H 2 O ( l ) Zn 2+(aq) + 4 NH 3 (g) + 4 Cl ¯(aq) → [Zn(NH 3)4]Cl 2 (s)

Pada batu baterai biasa yang menggunakan anoda logam Zn, katoda batang C, dan elektrolitnya pasta berair dari campuran NH 4 Cl, Mn. O 2, dan serbuk C, reaksi oksidasi dan reduksi yang terjadi adalah: Zn (s) → Zn 2+ (aq) + 2 e¯ 2 Mn. O 2 (s) + 2 H 2 O ( l) + 2 e¯ → 2 Mn. O(OH) (s) + 2 OH ¯(aq) ——————————— + Zn (s) + 2 Mn. O 2 (aq) + 2 H 2 O ( l ) → Zn 2+(aq) + 2 Mn. O(OH) (s) + 2 OH ¯ (aq)

Reaksi lainnya yaitu OH ¯ yang terbentuk bereaksi dengan NH 4+ menghasilkan NH 3, selanjutnya NH 3 yang terjadi diikat Zn 2+ 2 NH 4+ (aq) + 2 OH ¯ (aq) → 2 NH 3 (aq) + 2 H 2 O ( l ) Zn 2+ (aq) + 2 NH 3 (g) + 2 Cl ¯ (aq) → [Zn(NH 3)2]Cl 2 (s) Pada batu baterai alkaline, sebagai anoda digunakan Zn, sebagai katoda Mn. O 2, dan sebagai elektrolitnya KOH. Potensial listrik yang dihasilkan ± 1, 5 volt. Reaksi oksidasi reduksi yang terjadi adalah:

Zn 2+(aq) + 2 OH ¯ (aq) → Zn(OH)2 (s) + 2 e¯ 2 Mn. O 2 (s) + 2 H 2 O ( l ) + 2 e¯ → 2 Mn. O(OH) (s) + 2 OH ¯(aq) ——————————— + Zn (s) + 2 Mn. O 2 (aq) + 2 H 2 O ( l ) → Zn(OH)2 (s) + 2 Mn. O(OH) (s) Pada baterai perak oksida - zink seperti yang biasa digunakan pada arloji, sebagai anoda digunakan Zn, sebagai katoda digunakan Ag 2 O, dan sebagai elektrolitnya KOH. Potensial listrik yang dihasilkan ± 1, 5 volt. Reaksi oksidasi dan reduksi yang terjadi adalah:

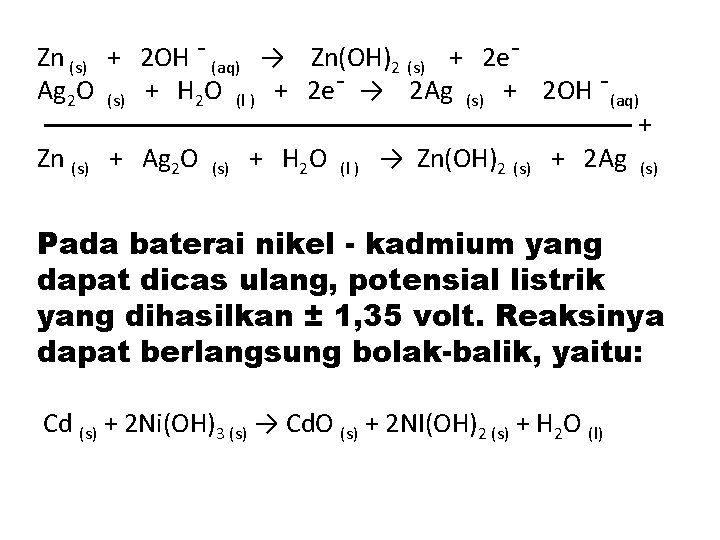
Zn (s) + 2 OH ¯ (aq) → Zn(OH)2 (s) + 2 e¯ Ag 2 O (s) + H 2 O (l ) + 2 e¯ → 2 Ag (s) + 2 OH ¯(aq) ——————————— + Zn (s) + Ag 2 O (s) + H 2 O (l ) → Zn(OH)2 (s) + 2 Ag (s) Pada baterai nikel - kadmium yang dapat dicas ulang, potensial listrik yang dihasilkan ± 1, 35 volt. Reaksinya dapat berlangsung bolak-balik, yaitu: Cd (s) + 2 Ni(OH)3 (s) → Cd. O (s) + 2 NI(OH)2 (s) + H 2 O (l)

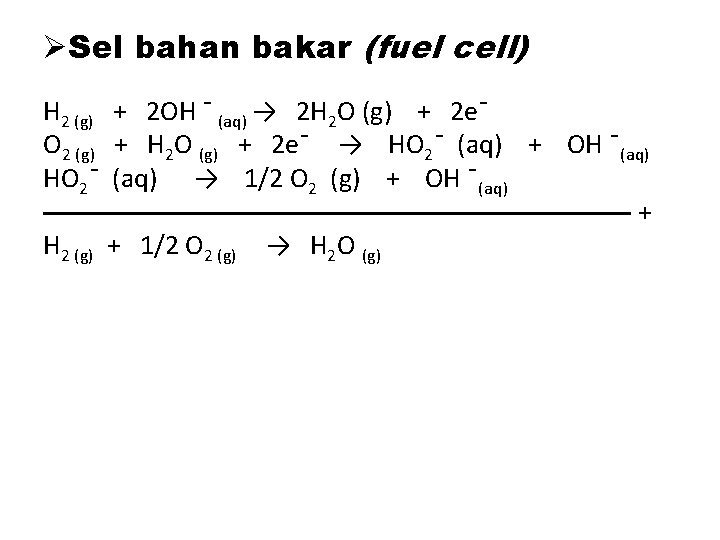
ØSel bahan bakar (fuel cell) H 2 (g) + 2 OH ¯ (aq) → 2 H 2 O (g) + 2 e¯ O 2 (g) + H 2 O (g) + 2 e¯ → HO 2¯ (aq) + OH ¯(aq) HO 2¯ (aq) → 1/2 O 2 (g) + OH ¯(aq) ——————————— + H 2 (g) + 1/2 O 2 (g) → H 2 O (g)

Soal latihan: 1. Larutan Cu. SO 4 dielektrolisis menggunakan arus listrik 0, 5 A selama 1 jam. Berapa gram Cu yang diendapkan pada katoda? (Ar Cu = 64) 2. Laruran Cu. SO 4 dan larutan Ni. SO 4 dielektrolisis dengan jumlah listrik yang sama. Jika Cu yang dihasilkan 0, 32 g, maka berapa gram Ni yang dihasilkan ? (Ar Cu = 64, Ni = 59).

3. Larutan Zn. SO 4 dielektrolisis menggunakan arus listrik 0, 5 A selama 1 jam. a. Tuliskan reaksi yang terjadi ! b. Berapa gram Zn yang diendapkan pada katoda? (Ar Zn = 65) 4. Berapa gram Ni yang diendapkan pada elektrolisis larutan Ni. SO 4 jika digunakan arus listrik 20 000 C ?

5. Berapa waktu yang diperlukan untuk elektrolisis larutan Ag. NO 3 menggunakan arus listrik 0, 5 A agar diperoleh 0, 1 gram endapan Ag ? 6. Berapa waktu yang diperlukan untuk elektrolisis 10 m. L larutan Ag. NO 3 0, 001 M menggunakan arus listrik 1, 5 A sampai elektrolisis terhenti karena semua perak telah mengendap ?

7. Jika campuran larutan Cu. SO 4 dan Ni. SO 4 dielektrolisis sehingga dihasilkan 0, 1 gram endapan, maka berapa gram Cu dan berapa gram Ni yang telah diendapkan dari larutan tersebut ? 8. Larutan Cu. SO 4, Au. Cl 3, dan Ag. NO 3 yang terpisah masing-masing dielektrolisis dengan arus listrik 0, 5 A dalam waktu yang sama. Jika Cu yang diendapkan sebanyak 0, 1 gram, maka masing-masing berapa gram Au dan Ag yang diendapkan ?

9. Masing-masing pasangan reaksi berikut aktivitasnya satu (a = 1). Masing-masing tentukan reaksi (i) atau (ii) yang dapat berlangsung, kemudian hitunglah potensial sel yang dihasilkan ! a. (i). Cu/Cu 2+//Ag+/Ag atau (ii). Ag/Ag+//Cu 2+/Cu b. (i). Cu/Cu 2+//Pb 2+/Pb atau (ii). Pb/Pb 2+//Cu 2+/Cu c. (i). Pb/Pb 2+//Ag+/Ag atau (ii). Ag/Ag+//Pb 2+/Pb d. (i). Zn/Zn 2+//Ag+/Ag atau (ii). Ag/Ag+//Zn 2+/Zn

10. Sel elektrokimia dengan transference / jembatan garam K 2 SO 4 menggunakan elektroda Fe dalam larutan Fe. SO 4 dan elektroda Zn dalam larutan Zn. SO 4. a. Tuliskan reaksi yang terjadi dan hitung berapakah potensial sel yang dihasilkan ? b. Manakah elektroda positip dan negatifnya, Fe atau Zn ?
 Sel elektrokimia dengan transference
Sel elektrokimia dengan transference Tuliskan persamaan reaksi proses pengkaratan pada besi
Tuliskan persamaan reaksi proses pengkaratan pada besi Energi bebas gibbs elektrokimia
Energi bebas gibbs elektrokimia Rumus elektrolisis
Rumus elektrolisis Elektrolisis
Elektrolisis Umocňování desetinných čísel
Umocňování desetinných čísel Ciriciri reaksi oksidasi
Ciriciri reaksi oksidasi Gametogenesis pada tumbuhan tingkat tinggi
Gametogenesis pada tumbuhan tingkat tinggi Uniones intramoleculares
Uniones intramoleculares Vapor pressure intermolecular forces
Vapor pressure intermolecular forces Ion dipolo
Ion dipolo Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Reaksi oksidasi adalah
Reaksi oksidasi adalah Elektroliza hcl
Elektroliza hcl Disocija
Disocija Mikrotalasna dijatermija
Mikrotalasna dijatermija Pembentukan pirit
Pembentukan pirit Contoh oksidasi
Contoh oksidasi Biloks cl
Biloks cl Soal titrasi redoks
Soal titrasi redoks Respirasi menghasilkan
Respirasi menghasilkan Diketahui reaksi 2hi + 2hno2
Diketahui reaksi 2hi + 2hno2 Oksidasi
Oksidasi Reaksi oksidasi alkohol
Reaksi oksidasi alkohol Oksidasi senyawa organik
Oksidasi senyawa organik