Elektrolisis Edi Nasra S Si M Si Sel









- Slides: 14

Elektrolisis Edi Nasra, S. Si. , M. Si

Sel Volta e 1, 10 volt Zn - Zn 2+ 0, 1 M Zn 2+ + 2 e + Cu 2+ 0, 1 M Cu 2+ + 2 e Cu Cu

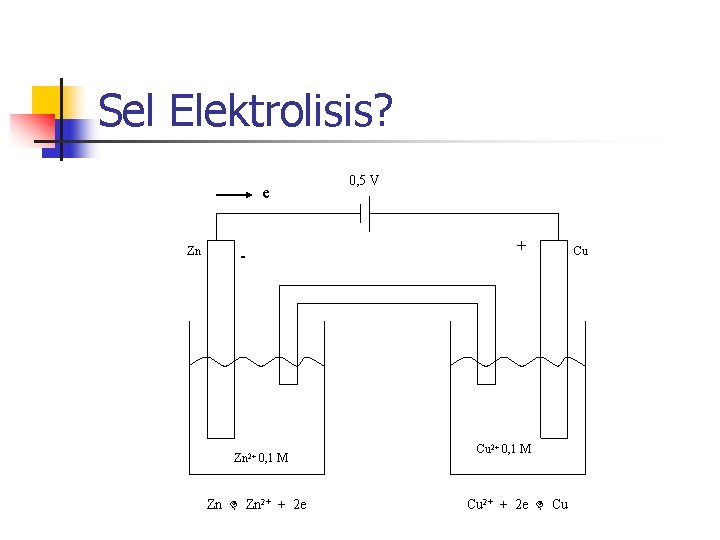
Sel Elektrolisis? e Zn - Zn 2+ 0, 1 M Zn 2+ + 2 e 0, 5 V + Cu 2+ 0, 1 M Cu 2+ + 2 e Cu Cu

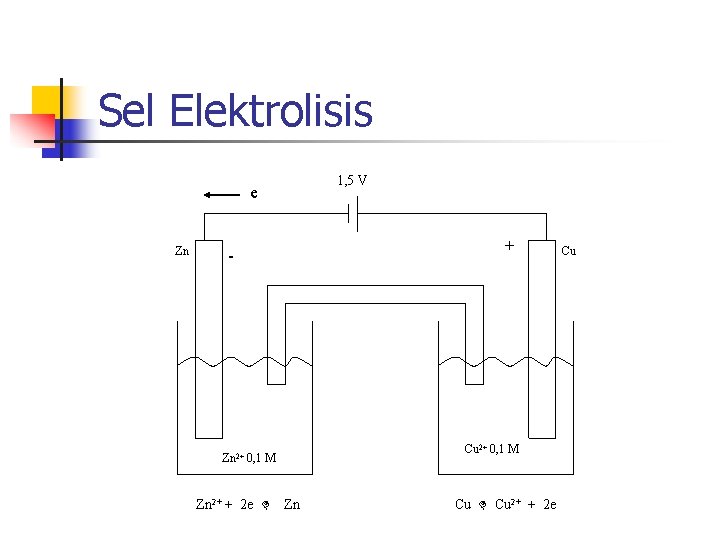
Sel Elektrolisis 1, 5 V e Zn + - Cu 2+ 0, 1 M Zn 2+ + 2 e Zn Cu 2+ + 2 e Cu

Potensial Elektrolisis Wapp = Ea – Ek + i. R Wapp = potensial elektrolisis Ea = potensial anoda Ek = potensial katoda I = arus R = hambatan sel

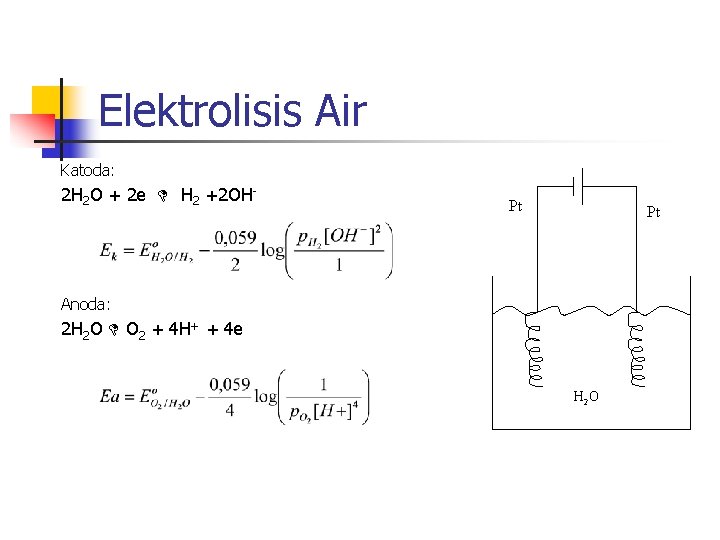
Elektrolisis Air Katoda: 2 H 2 O + 2 e H 2 +2 OH- Pt Pt Anoda: 2 H 2 O O 2 + 4 H+ + 4 e H 2 O

Potensial elektroda Katoda: Anoda:

Potensial lebih pembentukan gas n n n Gas H 2 dan O 2 sebelumnya tidak ada dalam larutan Diperlukan energi lebih untuk menghasilkan gas Pada katoda diperlukan energi ekstra untuk membentuk gas H 2, sehingga reaksi terjadi pada potensial yang lebih negatif dari – 0, 417 V (Ek - k) Pada anoda diperlukan energi ekstra untuk membentuk gas O 2, sehingga reaksi terjadi pada potensial yang lebih positif dari 0, 817 V (Ea + a) Eapp = (Ea + a) - (Ek - k) + i. R Eapp = Ea – Ek + a + i. R

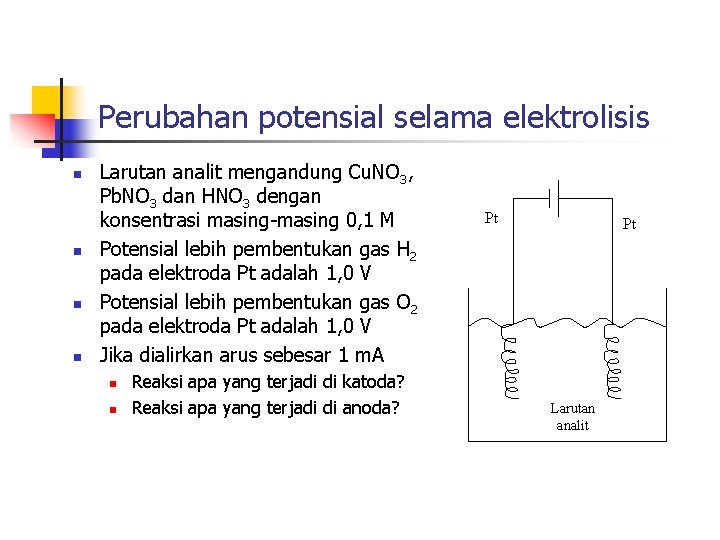
Perubahan potensial selama elektrolisis n n Larutan analit mengandung Cu. NO 3, Pb. NO 3 dan HNO 3 dengan konsentrasi masing-masing 0, 1 M Potensial lebih pembentukan gas H 2 pada elektroda Pt adalah 1, 0 V Potensial lebih pembentukan gas O 2 pada elektroda Pt adalah 1, 0 V Jika dialirkan arus sebesar 1 m. A n n Reaksi apa yang terjadi di katoda? Reaksi apa yang terjadi di anoda? Pt Pt Larutan analit

Reaksi yang mungkin? Katoda: Cu 2+ + 2 e Cu Pb 2+ + 2 e Pb 2 H+ + 2 e H 2 2 H 2 O + 2 e H 2 + 2 OHAnoda: 2 H 2 O O 2 + 4 H+ + 4 e

Potensial reduksi

Reaksi pada elektroda Urutan reaksi pada katoda: n Reduksi Cu 2+ (Ek =0, 308 V) n Reduksi Pb 2+ (Ek =-0, 155 V) n Reduksi H+ (Ek =-0, 059 -1, 000=-1, 059 V) n Reduksi H 2 O (Ek =-0, 063 -1, 000=-1, 063 V) Reaksi pada anoda: Oksidasi H 2 O

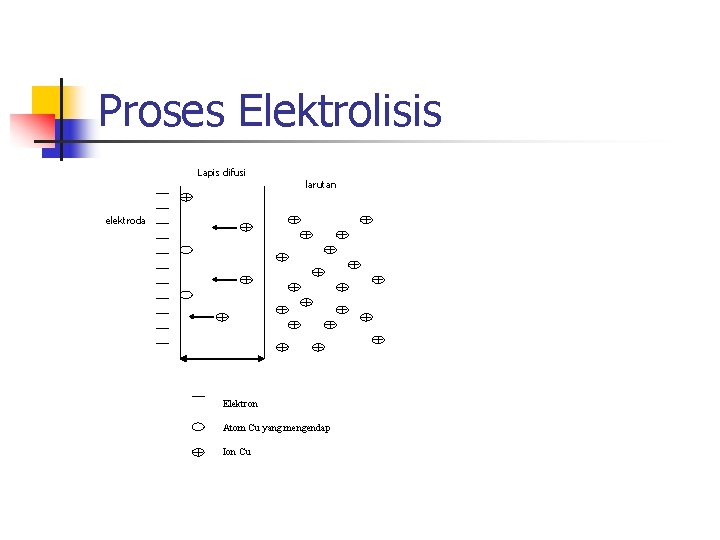
Proses Elektrolisis Lapis difusi larutan elektroda Elektron Atom Cu yang mengendap Ion Cu

Pemisahan secara elektrolisis Berapa potensial katoda pada saat 99, 99 %Cu 2+ telah mengendap? Konsentrasi Cu 2+ yang tersisa dalam larutan 0, 01% x 0, 1 M = 10 -5 M
 Edi nasra
Edi nasra Notasi sel volta
Notasi sel volta Perbedaan sel prokariotik dan sel eukariotik
Perbedaan sel prokariotik dan sel eukariotik Rumus elektrolisis
Rumus elektrolisis Elektrolisis
Elektrolisis Mocniny desetinných čísel
Mocniny desetinných čísel Nasra tower dar es salaam
Nasra tower dar es salaam Reserch gate
Reserch gate Peristiwa sel telur dibuahi oleh sel sperma disebut
Peristiwa sel telur dibuahi oleh sel sperma disebut Sel haiwan dan tumbuhan
Sel haiwan dan tumbuhan Tidak memiliki membran inti sel
Tidak memiliki membran inti sel Perbezaan sel haiwan dan sel tumbuhan
Perbezaan sel haiwan dan sel tumbuhan H. e. butt grocery company edi
H. e. butt grocery company edi Edi
Edi Edi koffi
Edi koffi