DNAnn zolasyonu ve Analizi POLAKRLAMT JEL ELEKTROFOREZ PAGE












































- Slides: 55

DNA’nın İzolasyonu ve Analizi POLİAKRİLAMİT JEL ELEKTROFOREZİ: PAGE Doç. Dr. Uğur ŞEN

DNA Genetik bilgiyi taşıyan çift sarmal moleküldür. 5 C’lu şeker, fosfat ve bazları içeren nükleotidlerden oluşur. Doğadaki canlıların tümüne yakın kısmında genetik materyal DNA’dır.

DNA hücre içerisinde, *Çekirdek, *Mitokondri ve *Kloroplastlarda bulunmaktadır.

İnsan genomik DNA’sı 3 x 109 nukleotid uzunluğundadır. Genomik DNA bütün nükleusu bulunan hücrelerde bulunur ve bu hücreler genomik DNA analizleri için kullanılabilir. Örneğin; prenatal tanı için amniyotik sıvıdaki fetal hücrelerden veya koryonik hücrelerde genomik DNA elde edilebilir.

Erişkinlerde periferal kandaki lökositler en kolay ulaşılabilen DNA kaynağıdır. EDTA’lı tüplere alınan 10 ml kan yaklaşık olarak 108 beyaz kan hücresi içerir ve bu miktar hücreden elde edilecek genomik DNA pek çok genetik test için yeterlidir.

DNA’nın Özellikleri, Negatif yüklüdür, Suda çözünebilir, Alkolde çözünmez.

DNA İZOLASYON YÖNTEMLERİNDE BİRBİRİNİ İZLEYEN ÜÇ TEMEL AŞAMA BULUNMAKTADIR: 1 - Hücrenin parçalanması ile yüksek molekül ağırlıklı DNA’nın açığa çıkması, 2 -Denatürasyon veya proteoliz ile DNA-protein kompleksinin ayrılması ve DNA’nın çözünür duruma getirilmesi, 3 -DNA’nın basit enzimatik ve/veya kimyasal yöntemlerle proteinler, RNA ve diğer makromoleküllerden ayrılması, ***DNA’nın analizi

Denatürasyon: Çift zincirli DNA molekülü yüksek p. H veya yüksek sıcaklık etkisinde bırakıldığında sarmal yapısında çözünmeler meydana gelir. Renatürasyon: Koşullar tekrar normal duruma getirildiğinde iki iplik sarmal yapıyı oluşturmak üzere birleşir. Yani denatürasyon geri dönüşümlüdür.

DNA saflaştırma metotlarının belirlenmesinde kromozom DNA’sı ve kromozom dışı DNA’lar olmak üzere iki ana grup temel almıştır. Kromozom ve plazmide DNA’ların saflaştırılmasında birbirinden ayrılmasında DNA’ların moleküler yapısı oldukça önemlidir.

●Kromozom DNA’sının izolasyonu *Bakterilerden kromozom (genom) DNA’sı izolasyonu, *Mayalardan kromozom DNA’sı izolasyonu, *Memelilerden kromozom DNA’sı izolasyonu, *Bitkilerden kromozom DNA’sı izolasyonu ●Kromozom dışı DNA’nın izolasyonu *Plazmid DNA’sı izolasyonu *Organel DNA’sı izolasyonu






DNA’nın Analizi Nükleik asitlerin nanogram veya mikrogram düzeyindeki miktarlarının belirlenmesinde absorbsiyon temeline dayanan spektrofotometrik yöntemler kullanılır Ayrıca nükleik asitlerin doğrudan görüntülenmesinde özgün dizilerde kesim yapan restriksiyon endonükleaz enzimlerinin etkisi sonucu oluşan farklı boyutlardaki DNA parçalarının saptanmasında elektroforetik yöntemler kullanılır.






1 ml EDTA’lı kan+4 ml hücre parçalama çözeltisi 15 dk 0ºC inkübasyon 3000 xg’de 10 dk santrifüj Çökelti+4 ml parçalama çözeltisi 3000 xg’de 10 dk santrifüj Çökelti+1 ml çekirdek parçalayıcı çözeltisi+ 25μl %10 SDS+15 μl proteinaz K(20 mg/ml)+ 200 μl d. H 2 O 37ºC gece boyu inkübasyon

1 ml d. H 2 O + 5 ml 5 M Na. Cl 10000 xg 20 dk santrifüj Üst sıvı + 2 hacim soğuk etanol eklenir DNA pipet ucuyla alınır, 300μl d. H 2 O içerisinde çözülür.

Hücre Parçalama Çözeltisi 155 m. M NH 4 Cl 10 m. M KHCO 3 0. 1 m. M EDTA Çekirdek Parçalama Çözeltisi (p. H: 8. 2) 10 m. M Tris-HCl 400 m. M Na. Cl 2 m. M EDTA SDS: %10 gr/ml stok olarak hazırlandı. Proteinaz K: 20 mg/ml stok olarak hazırlandı. TE Çözeltisi 10 Mm Tris-Cl p. H: 7, 4 0, 1 m. M EDTA

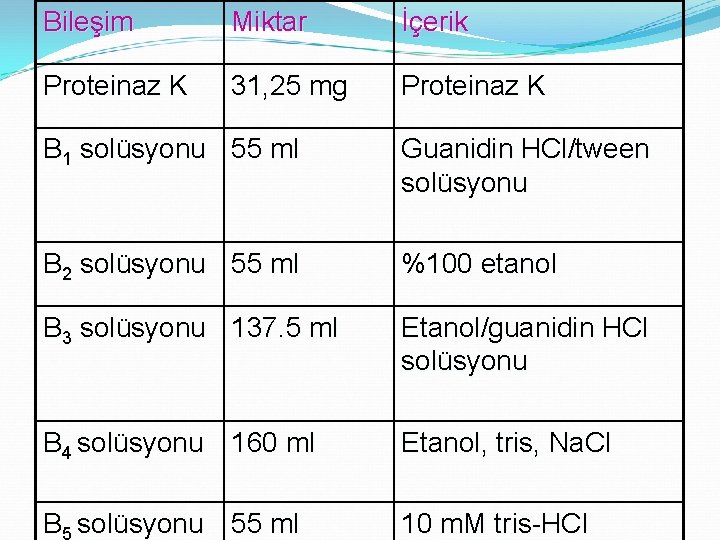
Bileşim Miktar İçerik Proteinaz K 31, 25 mg Proteinaz K B 1 solüsyonu 55 ml Guanidin HCl/tween solüsyonu B 2 solüsyonu 55 ml %100 etanol B 3 solüsyonu 137. 5 ml Etanol/guanidin HCl solüsyonu B 4 solüsyonu 160 ml Etanol, tris, Na. Cl B 5 solüsyonu 55 ml 10 m. M tris-HCl

*Enzimler(RNase) RNA’yı yok etmek için, *Enzimler (Proteases) DNA molekülüne bağlı olarak bulunan proteinleri yok etmek için, *İzopropanol ve etanol: Nükleik asitlerin çöktürülmesinde, *Amonyum sülfat ve sodyum sülfat: Proteinlerin çöktürülmesinde, *Etil asetat, Toluen, SDS membran yapısını bozmada, ***İzole edilen DNA +4°C’da uzun süre saklanabilir.

POLİAKRİLAMİT JEL ELEKTROFOREZİ: PAGE

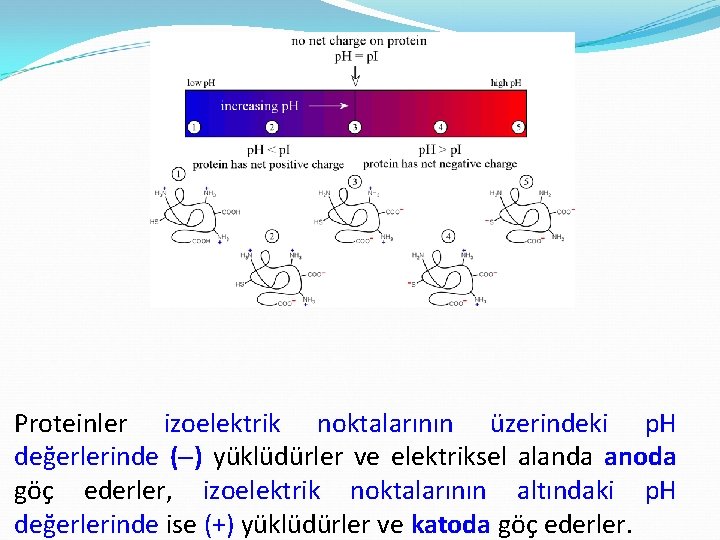
Proteinler izoelektrik noktalarının üzerindeki p. H değerlerinde ( ) yüklüdürler ve elektriksel alanda anoda göç ederler, izoelektrik noktalarının altındaki p. H değerlerinde ise (+) yüklüdürler ve katoda göç ederler.

Bu özellikleri nedeniyle protein karışımlarının ayrılmasında elektroforez yönteminden geniş çapta yararlanılır. Bu teknik proteinlerin elektrik alanda göçüne dayanır.

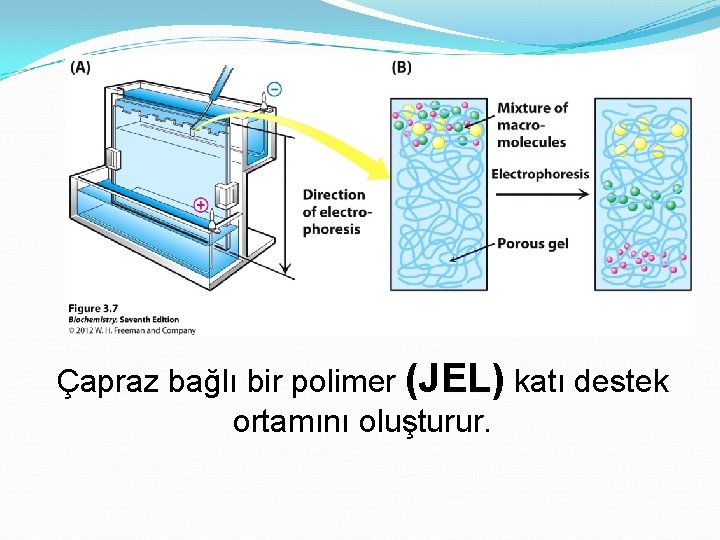
Çapraz bağlı bir polimer (JEL) katı destek ortamını oluşturur.

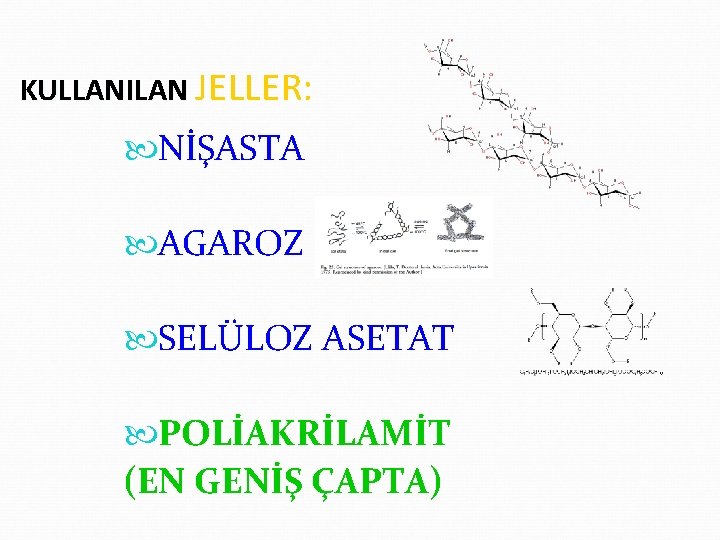
KULLANILAN JELLER: NİŞASTA AGAROZ SELÜLOZ ASETAT POLİAKRİLAMİT (EN GENİŞ ÇAPTA)

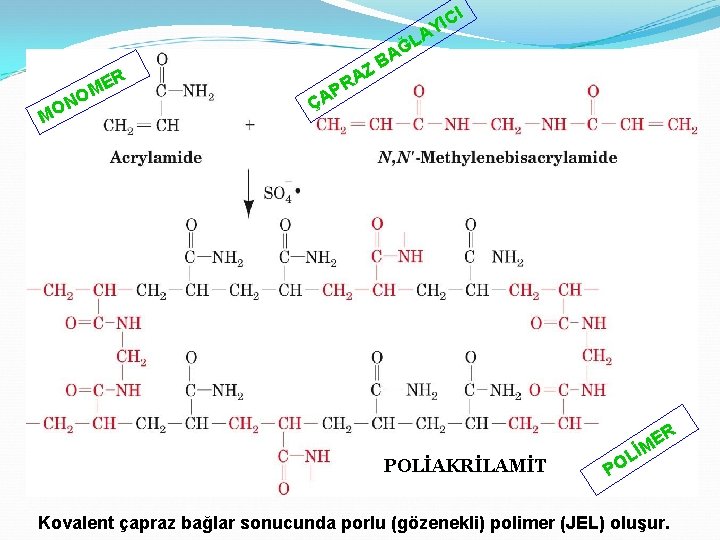
I IC Y A R ME O N O M Z A PR L Ğ BA ÇA POLİAKRİLAMİT R E M İ L O P Kovalent çapraz bağlar sonucunda porlu (gözenekli) polimer (JEL) oluşur.

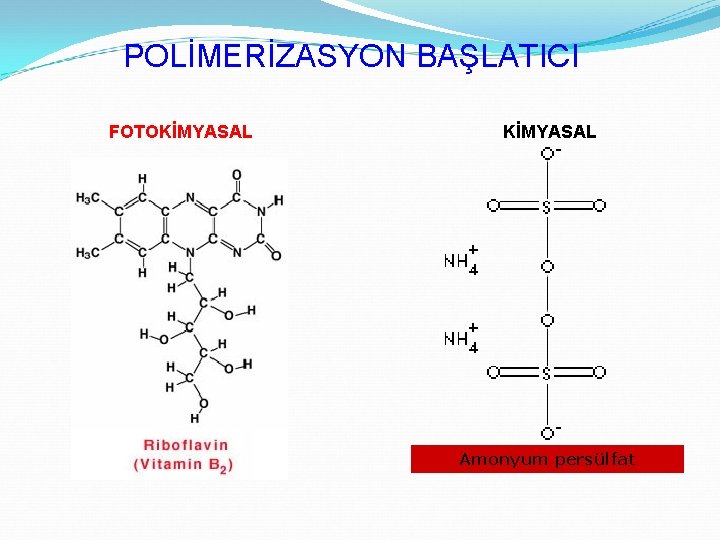
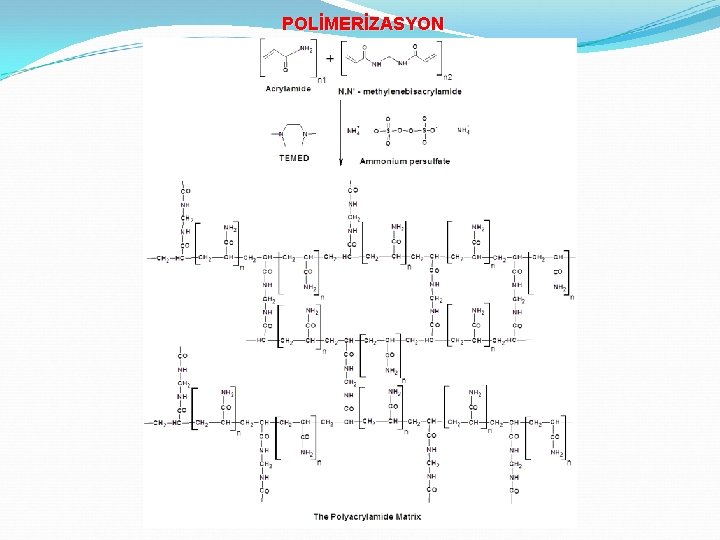
POLİMERİZASYON BAŞLATICI FOTOKİMYASAL Amonyum persülfat

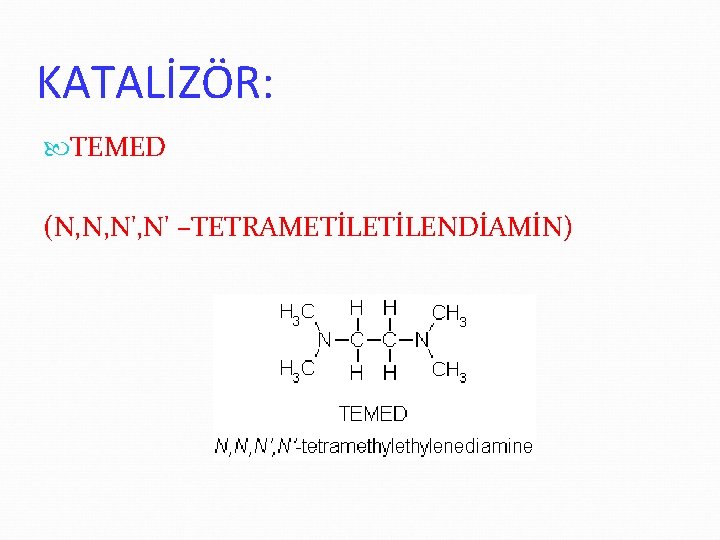
KATALİZÖR: TEMED (N, N, N' –TETRAMETİLENDİAMİN)

POLİMERİZASYON



Poliakrilamit jelde por büyüklüğü, akrilamit ve bis içeriğini ifade eden % T ve % Cbis terimleri ile belirlenir. % T, total akrilamit % si (ağırlık/hacim); % Cbis ise bis’in monomere oranı (ağırlık/ağırlık) olup formüllere göre hesaplanırlar:

Akrilamid (g) + Bis (g) % T = --------------------- x 100 Hacim (ml) Bis (g) % Cbis= ---------------- x 100 Akrilamid (g) + Bis (g)

Bu formüllere göre: %20 T ve %5 Cbis içeren bir jelde %20 total akrilamit (akrilamit + bis) bulunur ve total akrilamitin % 5’i bis’tir. %T arttıkça por çapı küçülür. %5 Cbis her türlü % T koşulunda optimum por büyüklüğünün oluşmasına yol açar.

Çeşitli akrilamit konsantrasyonlarında ayrımı yapılabilecek polipeptit ağırlıkları Akrilamit konsantrasyonu 15 pp. ağırlığı(k. Da) 12 -43 10 16 -68 7. 5 36 -94 5 57 -212

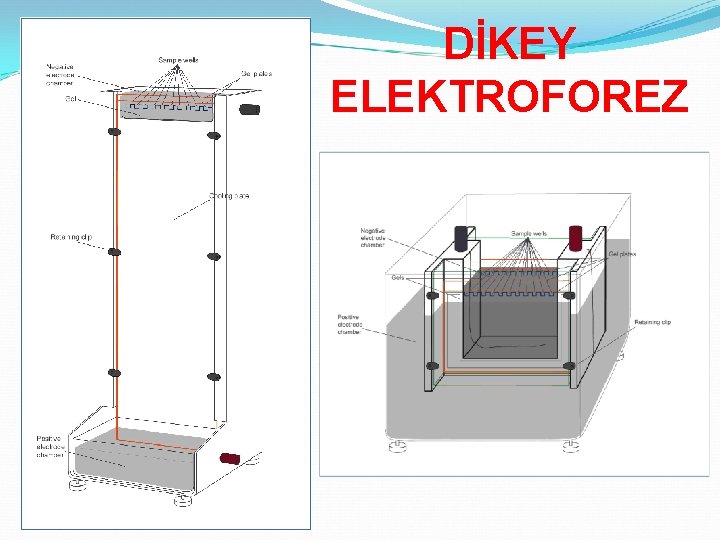
DİKEY JEL ELEKTROFOREZ SİSTEMLERİ TÜP JEL ELEKTROFOREZ SİSTEMLERİ

GÜÇ KAYNAĞI

DİKEY ELEKTROFOREZ

Kullanılan prosedüre göre hazırlanan monomer karışımı, elektroforez aletinin jel dökme aparatında, jelin çeşitli kalınlık ve ebatta hazırlanabilmesine olanak veren, sandviç şeklinde hazırlanmış iki cam (jel kaseti) arasına veya jel tüplerine doldurulur, tarak takılır ve polimerizasyona bırakılır.

Oksijen polimerizasyonu engellediğinden, monomer karışımının havası alınmalıdır. Bu da karışımdan inert bir gaz geçirerek, vakum uygulayarak ya da ultrasonik su banyosunda bekletilerek sağlanır.

Jel karışımı tüp ya da kaset içine döküldüğünde, üst yüzeydeki gerilim nedeniyle ortaya çıkan eğimli yüzey, bant dağılımının bozuk olmasına yol açar. Bunu önlemek için, polimerizasyon başlamadan önce jelin yüzeyi çok ince bir su veya su ile doyurulmuş 2 -butanol tabakası ile kapatılır.

Hazırlanan kaset aletin tank bölümüne yerleştirilir. Bu yerleştirimden sonra tamponla temas ettirilen jelden elektrik akımının geçmesi sağlanır.


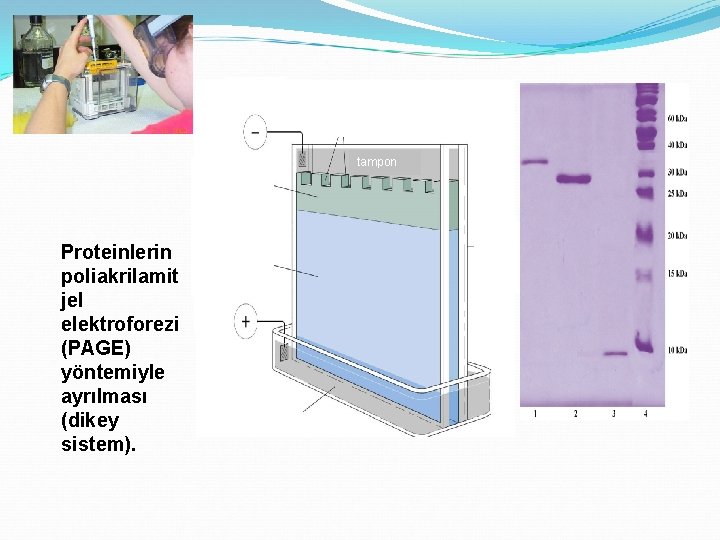
katot Yükleme jeli Kuyucuklar (cepler) tampon Ayırma jeli Proteinlerin poliakrilamit jel elektroforezi (PAGE) yöntemiyle ayrılması (dikey sistem). plastik conta anot tampon

Elektroforezde kesiksiz (“continuous”) ve kesikli (“discontinuous”) olmak üzere 2 farklı tampon sistemi kullanılabilir. Kesiksiz sistemde tek bir ayırıcı jel vardır; tanklarda ve jelde aynı tampon kullanılır. Kesikli sistemde ise jel farklı tamponlarla hazırlanmış iki kısımdan oluşur: (1) Büyük porlu yükleme (“stacking”) jeli; (2) Küçük porlu ayırma (“separating”) jeli.

Bu sistemde kullanılan tank tamponları da jel tamponlarından farklıdır. Bu farklılık jel boyunca bir p. H ve voltaj gradientinin oluşumuna yol açar. Böylece daha seyreltik örneklerle çalışılabilir ve daha iyi bir ayrışım elde edilir.

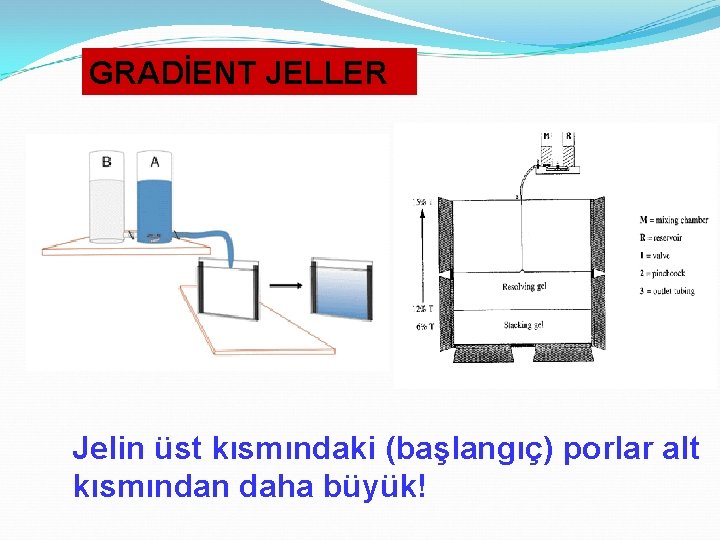
GRADİENT JELLER Jelin üst kısmındaki (başlangıç) porlar alt kısmından daha büyük!

Elektrik akımı geçirmek üzere anot ve katot bağlantıları yapılır ve güç kaynağı çalıştırılır: Protein elektroforezinde elektriksel parametrelerden biri, genellikle akım sabit tutulur. Bu durumda proteinlerin göç hızı da sabittir, ancak direnç artıkça ısı açığa çıkar. İşlem sabit voltajda gerçekleştirilirse, direnç artıkça göç hızı düşer, ancak ısı artmaz.

İŞLEM TAMAMLANDIĞINDA: Boyama yapılarak ayrılan proteinler gözle görünür hale getirilir. En çok kullanılan boyar madde “Coomassie blue” dur. Daha duyarlı bir boyama tekniği ise gümüş boyamadır. Jel boyandıktan sonra fotoğrafı çekilebilir, ya da densitometre ile taranarak analiz edilebilir. Jelde ayrılmış radyoaktif örneklerin analizi için otoradyografi yöntemlerinden yararlanılır. Membrana transfer (“blot-transfer”) teknikleri de son yıllarda geniş çapta kullanım alanı bulmaktadır. (Western blotting ve immünoblotting)
 Dani+jel+jel+rag
Dani+jel+jel+rag Immunfiksasyon elektroforez nedir
Immunfiksasyon elektroforez nedir Kapiller elektroforez
Kapiller elektroforez Apa format powerpoint title page
Apa format powerpoint title page Transparan film örtüler
Transparan film örtüler Birtok jel
Birtok jel Atom jel
Atom jel Femore jel
Femore jel Tyndall etkisi
Tyndall etkisi Wollen jelentése
Wollen jelentése Ma függvény
Ma függvény Melyik a kisebb nagyobb jel
Melyik a kisebb nagyobb jel Gottron jel
Gottron jel Russell's sign picture
Russell's sign picture Fizikai jelek
Fizikai jelek Gottron papula
Gottron papula A nyelvi jel és jelrendszer
A nyelvi jel és jelrendszer Hepsiburada swot analizi
Hepsiburada swot analizi Migros swot analizi
Migros swot analizi Kavram ağları
Kavram ağları Tekis shakllarning proyeksiyalari
Tekis shakllarning proyeksiyalari Bolton analizi tablosu
Bolton analizi tablosu Coca cola pazar payı
Coca cola pazar payı Hastane risk analizi
Hastane risk analizi Sosyal beceriler
Sosyal beceriler Pims analizi
Pims analizi Geri zincirleme örnekleri
Geri zincirleme örnekleri Pims analizi
Pims analizi Tows analizi örnekleri
Tows analizi örnekleri Diş fırçalama beceri analizi
Diş fırçalama beceri analizi Fıçı göğüs
Fıçı göğüs Eds wds
Eds wds Kovaryans analizi
Kovaryans analizi L matris risk skoru
L matris risk skoru Doğrusal trend analizi
Doğrusal trend analizi Panel veri örnekleri
Panel veri örnekleri Pazara nüfuz etme stratejisi örnek
Pazara nüfuz etme stratejisi örnek Ilgi yakınlık diyagramı
Ilgi yakınlık diyagramı 103 analizi nedir
103 analizi nedir Günlük yaşam becerileri 1. kademe
Günlük yaşam becerileri 1. kademe Diş fırçalama beceri analizi
Diş fırçalama beceri analizi Afinite diyagramı
Afinite diyagramı Yemek yeme beceri analizi örnekleri
Yemek yeme beceri analizi örnekleri ölçüt bağımlı ölçü aracı örnekleri
ölçüt bağımlı ölçü aracı örnekleri Gereksinim analizi örneği
Gereksinim analizi örneği Farkn
Farkn Dikey yüzde analizi
Dikey yüzde analizi Galaktokinaz
Galaktokinaz Kodlama cetveli örneği
Kodlama cetveli örneği Ham kül
Ham kül Becerinin yapısal analizi
Becerinin yapısal analizi Performans güçleri analizi nedir
Performans güçleri analizi nedir Görüşme formu örneği
Görüşme formu örneği X tipi matris örnek
X tipi matris örnek Sistem analizi nedir
Sistem analizi nedir Fütz analizi
Fütz analizi