DEGRADO E CONSERVAZIONE DEI MATERIALI 1I MATERIALI PROPRIETA






































- Slides: 42

DEGRADO E CONSERVAZIONE DEI MATERIALI 1)I MATERIALI: PROPRIETA’ CHIMICO-FISICHE PER LA COMPRENSIONE DEI PRINCIPALI PROCESSI DI DEGRADO E DEGLI INTERVENTI CONSERVATIVI 2)TECNICHE DI INDAGINE SPETTROSCOPICA Simona Bettini simona. bettini@unisalento. it 0832299445/3492125131

Che cos’è la CHIMICA? La chimica è quella scienza che si occupa dello studio della materia e delle sue trasformazioni

Che cos’è la MATERIA? La materia è tutto ciò che occupa uno spazio ed ha una massa ed un certo volume. Essa è costituita da minuscole particelle che possono aggregarsi in modo diverso. Per questo la materia si presenta in differenti stati. . .


Gli elementi sono sostanze che non possono essere ulteriormente decomposte e sono Costituiti da atomi aventi le stesse proprietà. I composti sono combinazioni di elementi in rapporti ben definiti.


COSA GOVERNA LA FORMAZIONE DEI COMPOSTI?






ELETTRONEGATIVITA’









Gli STATI D’AGGREGAZIONE della materia La materia si può trovare in tre diversi stati di aggregazione: • Solido • Liquido • Aeriforme

Stato aeriforme: 1) GAS 2) VAPORI Nei corpi aeriformi le particelle hanno un legame molto debole tra loro. Per questo non hanno né forma, né volume propri e tendono ad occupare tutto lo spazio a loro disposizione. Inoltre assumono la forma del contenitore.

Lo stato LIQUIDO Un corpo allo stato liquido ha un volume definito, ma assume la forma del recipiente che lo contiene.

Lo stato SOLIDO Un corpo solido ha forma e volume proprio. L’unico modo per cambiare la forma di un solido è applicare una forza così intensa da spezzare i legami provocando la rottura dell’oggetto.

Gli oggetti allo stato solido sono indeformabili, occupano uno spazio ben preciso, quindi hanno un volume fisso

Solidi cristallini e solidi amorfi Solidi cristallini § particelle disposte regolarmente nello spazio § anisotropia § punto di fusione ben definito Solidi amorfi § disposizione disordinata delle particelle § isotropia § punto di fusione non ben definito

I solidi amorfi sono in realtà dei liquidi ad elevata viscosità. La viscosità è la resistenza che un liquido incontra a fluire. Perché un liquido scorra, le sue molecole devono poter scivolare le une sulle altre. In generale, più forti sono le attrazioni intermolecolari, più il liquido è viscoso. IL VETRO E’ UN SOLIDO AMORFO

Anisotropia è una parola di origine greca; è il contrario di isotropia che significa “stesse proprietà” Un solido si dice anisotropo se le proprietà quali conducibilità elettrica, indice di rifrazione, conducibilità termica, ecc. . sono diverse a seconda della direzione in cui vengono misurate. L’anisotropia è conseguenza della asimmetria dei reticoli lungo le tre direzioni dello spazio; molti solidi cristallini risultano tuttavia isotropi perché i loro macrocristalli sono, in realtà, costituiti da un gran numero di microcristalli disposti casualmente. Per rilevare l’anisotropia occorre fare le misure su monocristalli.

CLASSIFICAZIONE DEI SOLIDI CRISTALLINI • • Solidi ionici Solidi covalenti Solidi molecolari Solidi metallici

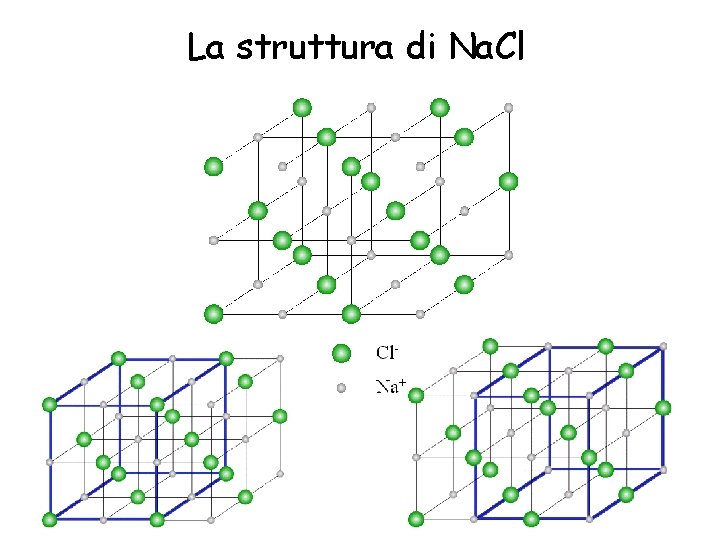
Caratteristiche dei solidi ionici Nei nodi del reticolo cristallino dei solidi ionici si alternano, con regolarità, ioni positivi e negativi • Temperatura di fusione relativamente alta • Fragilità alla trazione • Sfaldamento diagonale rispetto ai piani reticolari • Allo stato fuso conducono la corrente elettrica • Solubili in acqua • In soluzione acquosa conducono la corrente Esempi: Cloruro di sodio

La struttura di Na. Cl

Conducibilità e temperatura di fusione §La conducibilità delle soluzioni acquose e allo stato fuso deriva dalla presenza degli ioni liberi quando il reticolo viene demolito. §La temperatura di fusione relativamente alta si spiega con la forza del legame ionico Le proprietà meccaniche Sono funzione delle dimensioniche e delle cariche dei singoli ioni. Per cationi piccoli la coesione del sistema è maggiore e la durezza raggiunge valori elevatissimi.

Sfaldabilità e solubilità §I solidi ionici si oppongono allo sfaldamento parallelo ai piani reticolari in quanto lo scorrimento genererebbe repulsione fra ioni dello stesso segno. §Lo sfaldamento avviene lungo i piani diagonali contenenti tutti atomi con carica dello stesso segno §La solubilità in acqua è buona perché il reticolo viene distrutto e gli ioni vengono solvatati dall’acqua.

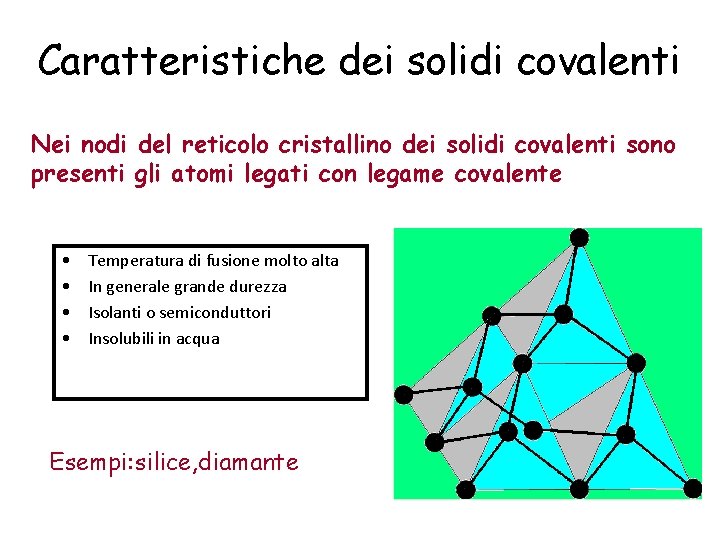
Caratteristiche dei solidi covalenti Nei nodi del reticolo cristallino dei solidi covalenti sono presenti gli atomi legati con legame covalente • • Temperatura di fusione molto alta In generale grande durezza Isolanti o semiconduttori Insolubili in acqua Esempi: silice, diamante

Durezza e alto punto di fusione §Il legame covalente è molto forte per cui i reticoli covalenti sono difficili da rompere ciò spiega perché questi solidi hanno , in generale, temperature di fusione molto alte §I legami covalenti sono fortemente direzionati; da ciò deriva la durezza (fatte le debite eccezioni) dei solidi covalenti ed anche la loro fragilità. §Normalmente un solido covalente è trasparente perché la differenza di energia tra i livelli elettronici occupati e quelli liberi è elevata e maggiore dell’energia della luce visibile.

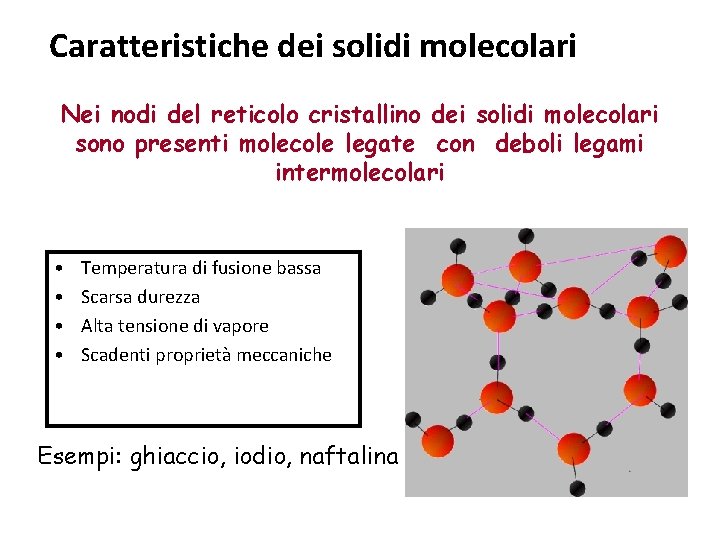
Caratteristiche dei solidi molecolari Nei nodi del reticolo cristallino dei solidi molecolari sono presenti molecole legate con deboli legami intermolecolari • • Temperatura di fusione bassa Scarsa durezza Alta tensione di vapore Scadenti proprietà meccaniche Esempi: ghiaccio, iodio, naftalina

I legami intermolecolari §La bassa temperatura di fusione è conseguenza delle deboli forze esistenti fra le molecole; i legami sono infatti legami intermolecolari e quindi molto più deboli di quelli interatomici; alle stesse ragioni sono imputabili la scarsa durezza e l’alta tensione di vapore. §I solidi molecolari risultano quindi deformabili, non fragili e generalmente non conduttori.

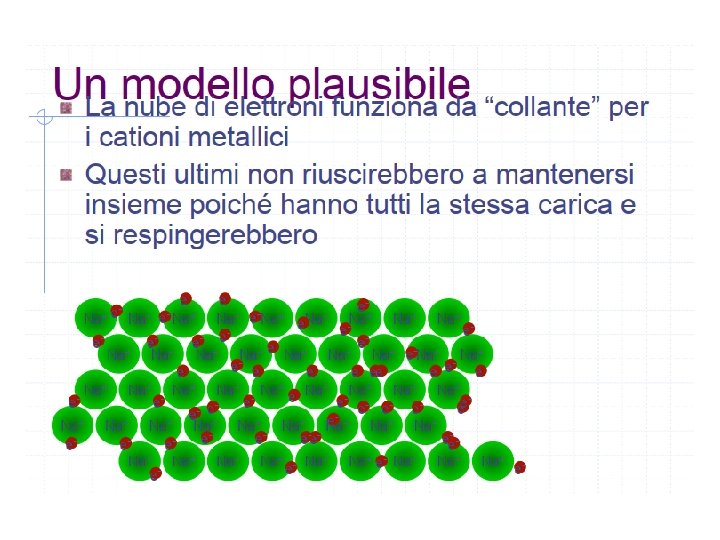
Caratteristiche dei solidi metallici Nei nodi del reticolo cristallino dei solidi metallici sono presenti ioni positivi legati da legame metallico. Il reticolo è avvolto dalla nuvola elettronica • Temperatura di fusione generalmente alta • Elevata densità • Buona conducibilità termica ed elettrica • Lucentezza al taglio

La conducibilità termica §La conducibilità termica ed elettrica dei metalli è spiegabile con il fatto che gli elettroni di valenza che fanno parte della nuvola elettronica che avvolge il reticolo sono liberi di muoversi. §L’elevata densità dei metalli si deve all’impacchettamento compatto; gli atomi si dispongono in modo da lasciare il minor spazio vuoto possibile.

Lavorabilità e temperatura di fusione §La malleabilità e duttilità si devono alla struttura del reticolo cristallino dei metalli; tirando o piegando il reticolo infatti le forze che legano i vari ioni e la nuvola che li avvolge rimangono invariate. §Le alte temperature di fusione sono una conseguenza della forza del legame metallico che rende il reticolo difficile da rompere.

 Classificazione dei materiali
Classificazione dei materiali Proprietà magnetiche dei materiali zanichelli
Proprietà magnetiche dei materiali zanichelli Conservazione dei foraggi
Conservazione dei foraggi Trasporto di un fattore fuori radice
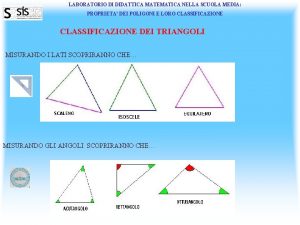
Trasporto di un fattore fuori radice Laboratori matematica scuola media
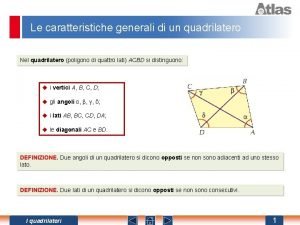
Laboratori matematica scuola media Quadrilateri caratteristiche
Quadrilateri caratteristiche Momento torcente
Momento torcente Callister scienza e ingegneria dei materiali
Callister scienza e ingegneria dei materiali Fendibilità dei materiali
Fendibilità dei materiali Ingegneria dei materiali
Ingegneria dei materiali Schema dalla materia prima al prodotto finito
Schema dalla materia prima al prodotto finito Spinte metallostatiche
Spinte metallostatiche Momento di inerzia
Momento di inerzia Principio di conservazione della quantità di moto
Principio di conservazione della quantità di moto Responsabile della conservazione digitale
Responsabile della conservazione digitale Legge di lavoisier
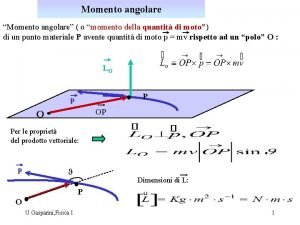
Legge di lavoisier Conservazione momento angolare
Conservazione momento angolare Conservazione digitale zucchetti
Conservazione digitale zucchetti Lavoro ed energia potenziale
Lavoro ed energia potenziale Legge di conservazione dell'energia meccanica
Legge di conservazione dell'energia meccanica Teorema dell'impulso
Teorema dell'impulso Conservazione immagini radiologiche
Conservazione immagini radiologiche Reazione di sintesi
Reazione di sintesi Tempo digestione pasta
Tempo digestione pasta Moto rotatorio
Moto rotatorio Molla
Molla Conservazione degli alimenti
Conservazione degli alimenti è la marcia dei diritti dei bambini
è la marcia dei diritti dei bambini 0 433 triangolo equilatero
0 433 triangolo equilatero Agnus dei agnus dei qui tollis peccata peccata mundi
Agnus dei agnus dei qui tollis peccata peccata mundi Mappa concettuale tavola periodica
Mappa concettuale tavola periodica Punto di flesso orizzontale
Punto di flesso orizzontale Configurazione elettronica li+
Configurazione elettronica li+ Legge di raoult
Legge di raoult Proprietà della moltiplicazione
Proprietà della moltiplicazione Proprietà transitiva
Proprietà transitiva La primitiva di una funzione
La primitiva di una funzione Proprietà intensive
Proprietà intensive Definizione di angolo
Definizione di angolo Aghifoglie
Aghifoglie Soluzioni zanichelli chimica capitolo 14
Soluzioni zanichelli chimica capitolo 14 Proprietà transitiva matematica
Proprietà transitiva matematica Pressione oncotica
Pressione oncotica