CHEMIA OGLNA Klasyfikacja zwizkw nieorganicznych Wojciech Solarski Podrcznik











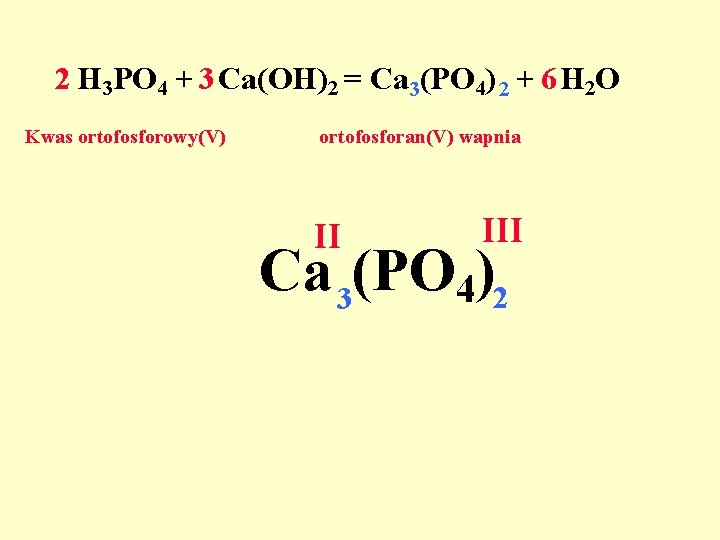







![Stopień utlenienia – wzór strukturalny +1 +4 -2 [H 2 S O 3] O Stopień utlenienia – wzór strukturalny +1 +4 -2 [H 2 S O 3] O](https://slidetodoc.com/presentation_image_h2/a36ce374fa01289447302c6ee7151f4c/image-28.jpg)






- Slides: 43

CHEMIA OGÓLNA Klasyfikacja związków nieorganicznych Wojciech Solarski

Podręcznik: Chemia dla inżynierów, pr. zb. pod red. J. Banaś, W. Solarski, ROZDZ. IV Internet: E-Chemia dla inżynierów www. chemia. odlew. agh. edu. pl

Klasyfikacja związków nieorganicznych TLENKI En. Om WODOROTLENKI KWASY SOLE METALI NIEMETALI

TLENKI METALI Men. Om Wzór Na 2 O Mg. O Ba. O Al 2 O 3 nazwa zalecana tlenek sodu tlenek magnezu tlenek baru tlenek glinu nazwa tradycyjna Pb. O 2 Fe. O Fe 2 O 3 Mn. O Mn 2 O 3 Sn. O 2 Cu 2 O Cu. O tlenek ołowiu(II) tlenek ołowiu(IV) tlenek żelaza(III) tlenek manganu(III) tlenek cyny(IV) tlenek miedzi(II) tlenek ołowiawy tlenek ołowiowy tlenek żelazawy tlenek żelazowy tlenek manganawy tlenek manganowy tlenek cynawy tlenek cynowy tlenek miedziawy tlenek miedziowy tlenek sodowy tlenek magnezowy tlenek barowy tlenek glinowy

TLENKI METALI Men. Om Wzór Na 2 O Mg. O Ba. O Al 2 O 3 nazwa zalecana tlenek sodu tlenek magnezu tlenek baru tlenek glinu nazwa tradycyjna Pb. O 2 Fe. O Fe 2 O 3 Mn. O Mn 2 O 3 Sn. O 2 Cu 2 O Cu. O tlenek ołowiu(II) tlenek ołowiu(IV) tlenek żelaza(III) tlenek manganu(III) tlenek cyny(IV) tlenek miedzi(II) tlenek ołowiawy tlenek ołowiowy tlenek żelazawy tlenek żelazowy tlenek manganawy tlenek manganowy tlenek cynawy tlenek cynowy tlenek miedziawy tlenek miedziowy tlenek sodowy tlenek magnezowy tlenek barowy tlenek glinowy

SYNTEZA TLENKÓW METALI 2 Mg + O 2 = Mg. O 4 Al + 3 O 2 = 2 Al 2 O 3 4 Fe + 3 O 2 = 2 Fe 2 O 3 REAKCJE TLENKÓW METALI K 2 O + H 2 O = 2 KOH Mg. O + H 2 O = Mg(OH)2 Fe 2 O 3 + H 2 O = brak reakcji Fe(OH)3

WODOROTLENKI. Me(OH)n Wzór nazwa systematyczna KOH Na. OH Ca(OH)2 wodorotlenek potasu wodorotlenek sodu wodorotlenek wapnia Sn(OH)2 Sn(OH)4 Fe(OH)2 Fe(OH)3 Co(OH)2 Co(OH)3 Ni(OH)2 Ni(OH)3 wodorotlenek cyny(II) wodorotlenek cyny(IV) wodorotlenek żelaza(III) wodorotlenek kobaltu(III) wodorotlenek niklu(III) nazwa tradycyjna wodorotlenek potasowy wodorotlenek sodowy wodorotlenek wapniowy wodorotlenek cynawy wodorotlenek cynowy wodorotlenek żelazawy wodorotlenek żelazowy wodorotlenek kobaltawy wodorotlenek kobaltowy wodorotlenek niklawy wodorotlenek niklowy

TLENKI NIEMETALI Wzór P 2 O 3 P 2 O 5 N 2 O NO N 2 O 3 NO 2 N 2 O 5 CO CO 2 SO 3 I 2 O 5 nazwa systematyczna nazwa tradycyjna tlenek fosforu(III), tritlenek difosforu trójtlenek fosforu(V), pentatlenek difosforu pięciotlenek fosforu tlenek azotu(I), tlenek diazotu podtlenek azotu(II), tlenek azotu(III), tritlenek diazotu trójtlenek azotu(IV), ditlenek azotu dwutlenek azotu(V), pentatlenek diazotu pięciotlenek azotu tlenek węgla(II), tlenek węgla(IV), ditlenek węgla dwutlenek węgla tlenek siarki(IV), ditlenek siarki dwutlenek siarki(VI), tritlenek siarki trójtlenek siarki tlenek jodu(V), pentatlenek dijodu pięciotlenek jodu

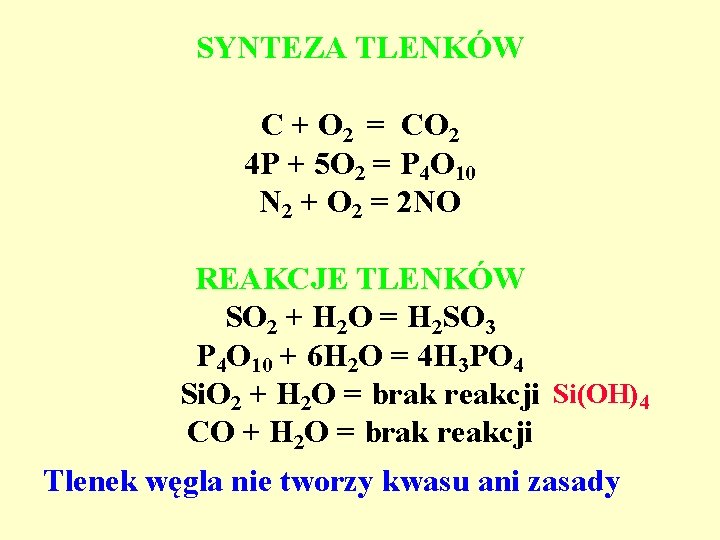
SYNTEZA TLENKÓW C + O 2 = CO 2 4 P + 5 O 2 = P 4 O 10 N 2 + O 2 = 2 NO REAKCJE TLENKÓW SO 2 + H 2 O = H 2 SO 3 P 4 O 10 + 6 H 2 O = 4 H 3 PO 4 Si. O 2 + H 2 O = brak reakcji Si(OH)4 CO + H 2 O = brak reakcji Tlenek węgla nie tworzy kwasu ani zasady

KWASY Hn R Wzór nazwa systematyczna HCl H 2 CO 3 H 2 S kwas chlorowodorowy kwas węglowy kwas siarkowodorowy HNO 2 HNO 3 HCl. O 2 HCl. O 3 HCl. O 4 H 2 SO 3 H 2 SO 4 HMn. O 4 kwas azotowy(III) kwas azotowy(V) kwas chlorowy(III) kwas chlorowy(VII) kwas siarkowy(IV) kwas siarkowy(VI) kwas manganowy(VII) nazwa tradycyjna kwas solny kwas węglowy kwas siarkowodorowy kwas azotawy kwas azotowy kwas podchlorawy kwas chlorowy kwas nadchlorowy kwas siarkawy kwas siarkowy kwas nadmanganianowy

SOLE Mn. Rm Me(OH)m + Hn R = Men Rm + 0, 5(n+m)H 2 O Ca(OH)2 + H 2 S = Ca. S + 2 H 2 O NAZEWNICTWO SOLI BEZTLENOWYCH Wzór nazwa systematyczna S 2 FCl. Br. I- siarczek fluorek chlorek bromek jodek siarczek CN- cyjanek nazwa tradycyjna fluorek chlorek bromek jodek

2 Na. OH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O NAZEWNICTWO SOLI TLENOWYCH Wzór CO 32 NO 3 NO 2 SO 42 SO 32 PO 43 Cr. O 42 Cr 2 O 72 Mn. O 42 - nazwa systematyczna węglan azotan(V) azotan(III) siarczan(VI) siarczan(IV) ortofosforan(V) chromian(VI) dichromian(VI) manganian(VI) nazwa tradycyjna węglan azotyn siarczan siarczyn fosforan chromian dwuchromian nadmanganian

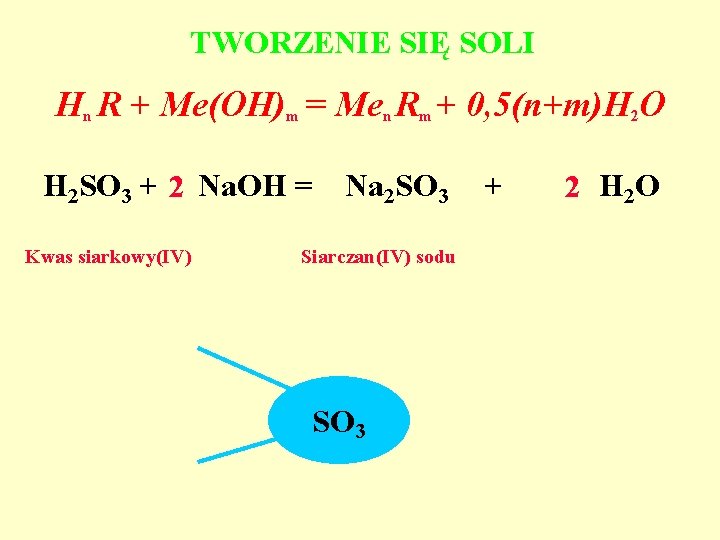
TWORZENIE SIĘ SOLI Hn R + Me(OH)m = Men Rm + 0, 5(n+m)H 2 O H 2 SO 3 + 2 Na. OH = Kwas siarkowy(IV) Na 2 SO 3 Siarczan(IV) sodu SO 3 + 2 H 2 O

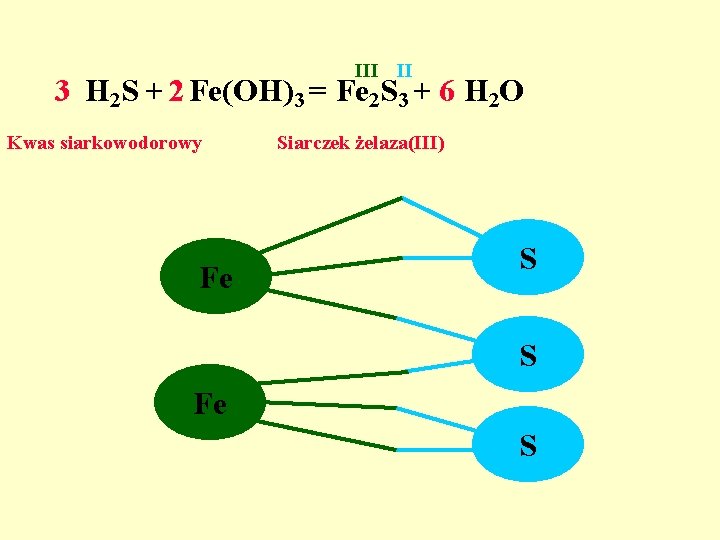
III II 3 H 2 S + 2 Fe(OH)3 = Fe 2 S 3 + 6 H 2 O Kwas siarkowodorowy Fe Siarczek żelaza(III) S S Fe S
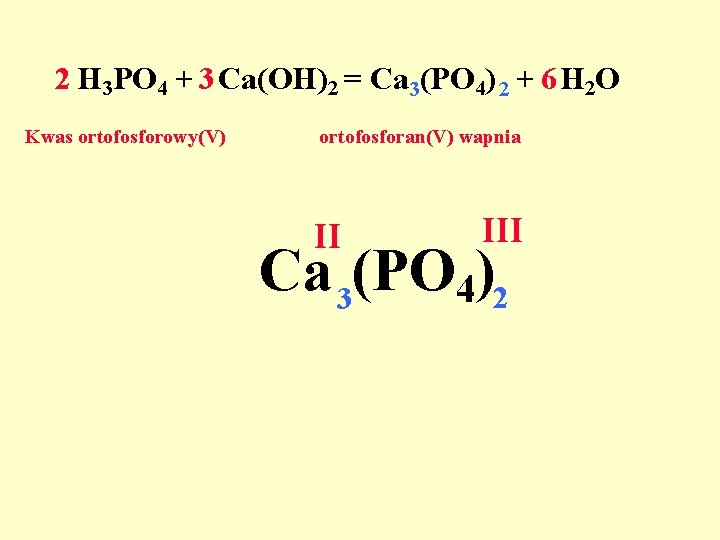
2 H 3 PO 4 + 3 Ca(OH)2 = Ca 3(PO 4) 2 + 6 H 2 O Kwas ortofosforowy(V) ortofosforan(V) wapnia II III Ca 3(PO 4)2

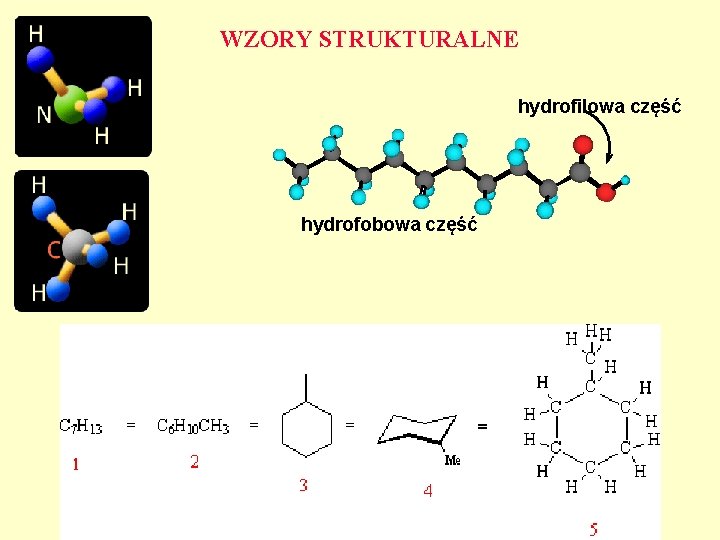
WZORY STRUKTURALNE hydrofilowa część hydrofobowa część

NAZWY SOLI Wzór nazwa systematyczna nazwa tradycyjna Ca. CO 3 węglan wapnia węglan wapniowy Fe. SO 3 siarczan(IV) żelaza(II) siarczyn żelazawy Fe 2(SO 4)3 siarczan (VI) żelaza (III) siarczan żelazowy Na 3 PO 4 ortofosforan(V) sodu fosforan sodowy KNO 2 azotan(III) potasu azotyn potasowy Ba(NO 3)2 azotan(V) baru azotan barowy Cu. S siarczek miedzi(II) siarczek miedziowy Hg. I 2 jodek rtęci(II) jodek rtęciowy Ca(HCO 3)2 wodorowęglan wapnia kwaśny węglan wapniowy

NAZWY SOLI -ek – sól kwasu beztlenowego -an – sól kwasu tlenowego

OTRZYMYWANIE SOLI 1. Reakcja zobojętniania Cu(OH)2 + 2 HCl = Cu. Cl 2 + 2 H 2 O 2 NH 4 OH + H 2 S = (NH 4)2 S + 2 H 2 O

Reakcja zobojętniania Miareczkowanie

Miareczkowanie

OTRZYMYWANIE SOLI 1. Reakcja zobojętniania Cu(OH)2 + 2 HCl = Cu. Cl 2 + 2 H 2 O 2 NH 4 OH + H 2 S = (NH 4)2 S + 2 H 2 O 2. Reakcja kwasu z metalem Fe + 2 HCl = Fe. Cl 2 + H 2 Zn + H 2 SO 4 = Zn. SO 4 + H 2 Au + 2 HCl = nie zachodzi

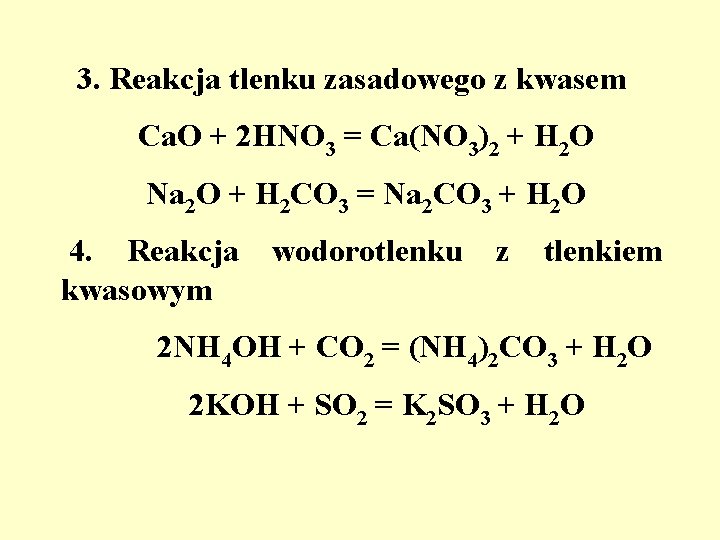
3. Reakcja tlenku zasadowego z kwasem Ca. O + 2 HNO 3 = Ca(NO 3)2 + H 2 O Na 2 O + H 2 CO 3 = Na 2 CO 3 + H 2 O 4. Reakcja kwasowym wodorotlenku z tlenkiem 2 NH 4 OH + CO 2 = (NH 4)2 CO 3 + H 2 O 2 KOH + SO 2 = K 2 SO 3 + H 2 O

5. Reakcja tlenku zasadowego z tlenkiem kwasowym Mg. O + CO 2 = Mg. CO 3 K 2 O + SO 3 = K 2 SO 4 6. W reakcji metalu z niemetalem, np. : Zn + S = Zn. S Ca + Br 2 = Ca. Br 2

Stopień utlenienia Jest to dodatnia lub ujemna liczba będąca hipotetycznym ładunkiem atomu, który istniałby, gdyby cząsteczka w skład, której wchodzi atom zbudowana byłaby z jonów. 1. Stopień utlenienia atomu pierwiastka występującego w stanie wolnym równy jest zeru. 2. Stopień utlenienia atomów pierwiastków o różnej elektroujemności ustala się przypisując pierwiastkowi bardziej elektroujemnemu ładunek ujemny, przy czym wartość tego ładunku jest równa ilości elektronów wiążących. 3. Suma stopni utlenienia atomów w cząsteczce jest równa zeru, a w jonie jest równa ładunkowi jonu. 4. Wodór w większości związków chemicznych występuje na +1 stopniu utlenienia, a tlen na – 2.

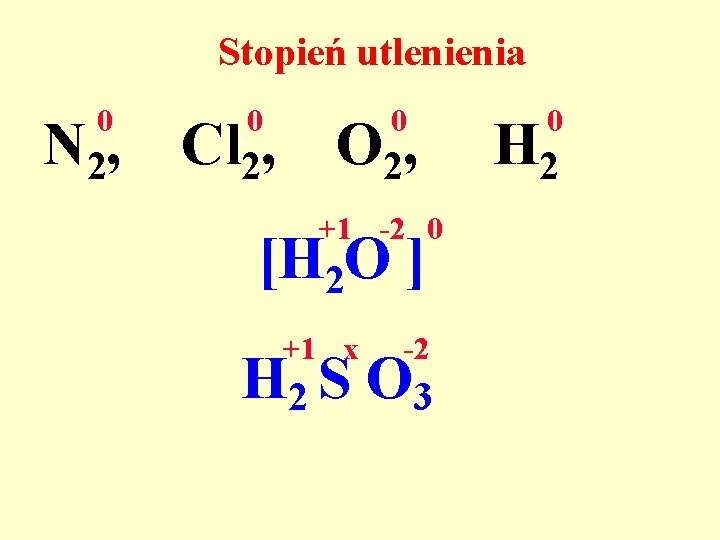
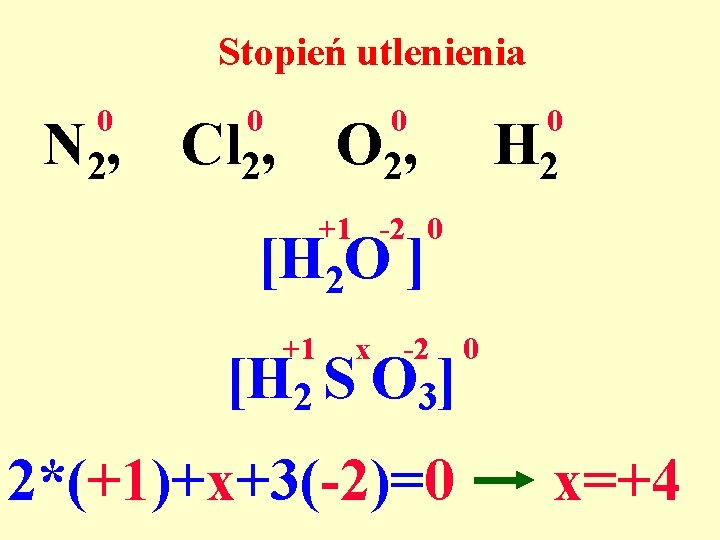
Stopień utlenienia 0 N 2, 0 0 Cl 2, O 2, +1 -2 0 [H 2 O ] +1 x -2 H 2 S O 3 0 H 2

Stopień utlenienia 0 N 2, 0 0 0 Cl 2, O 2, H 2 +1 -2 0 [H 2 O ] +1 x -2 [H 2 S O 3] 2*(+1)+x+3(-2)=0 0 x=+4
![Stopień utlenienia wzór strukturalny 1 4 2 H 2 S O 3 O Stopień utlenienia – wzór strukturalny +1 +4 -2 [H 2 S O 3] O](https://slidetodoc.com/presentation_image_h2/a36ce374fa01289447302c6ee7151f4c/image-28.jpg)
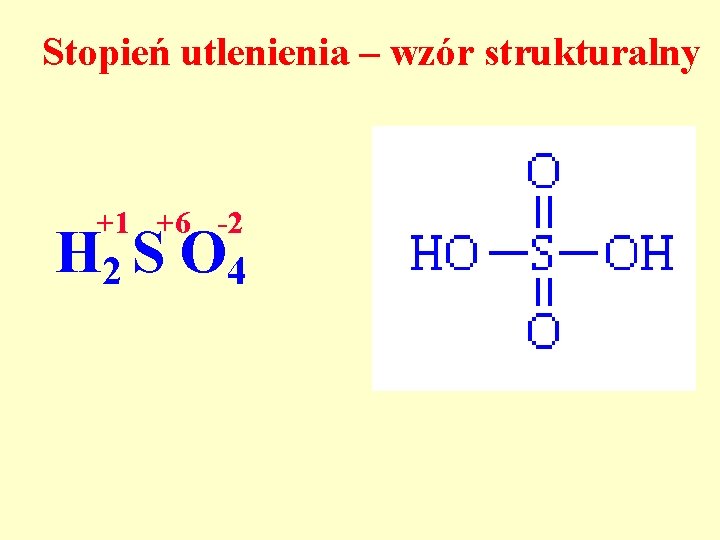
Stopień utlenienia – wzór strukturalny +1 +4 -2 [H 2 S O 3] O S 0 O H

Stopień utlenienia – wzór strukturalny +1 +6 -2 H 2 S O 4

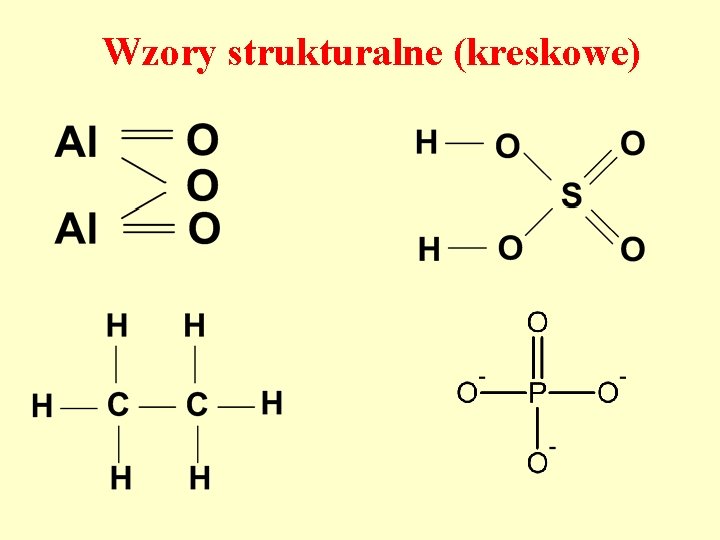
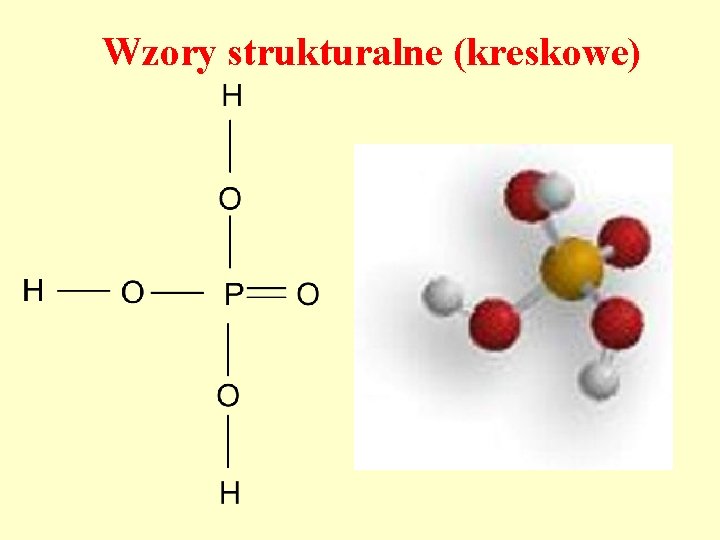
Wzory strukturalne (kreskowe)

Wzory strukturalne (kreskowe)

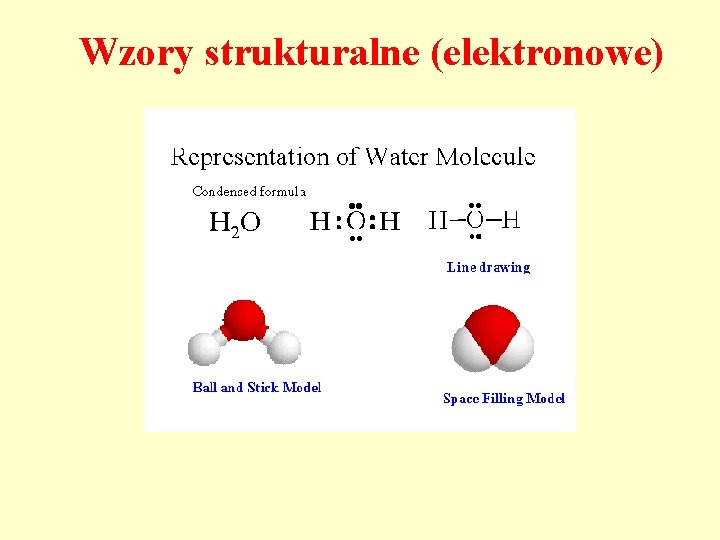
Wzory strukturalne (elektronowe)

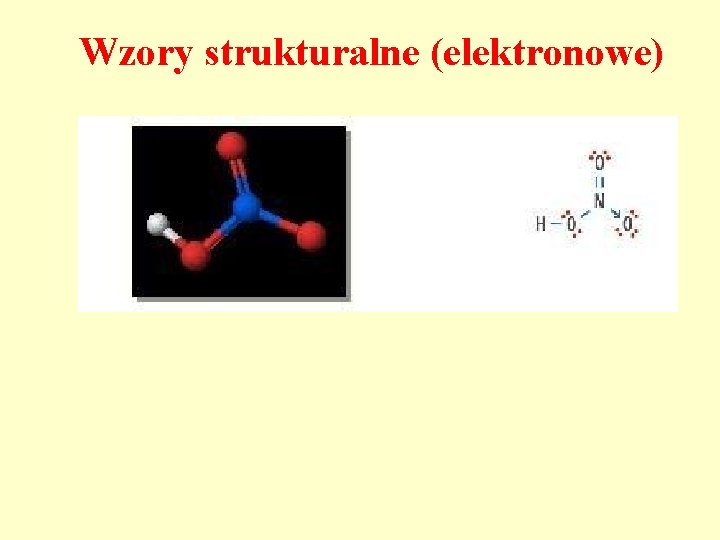
Wzory strukturalne (elektronowe)

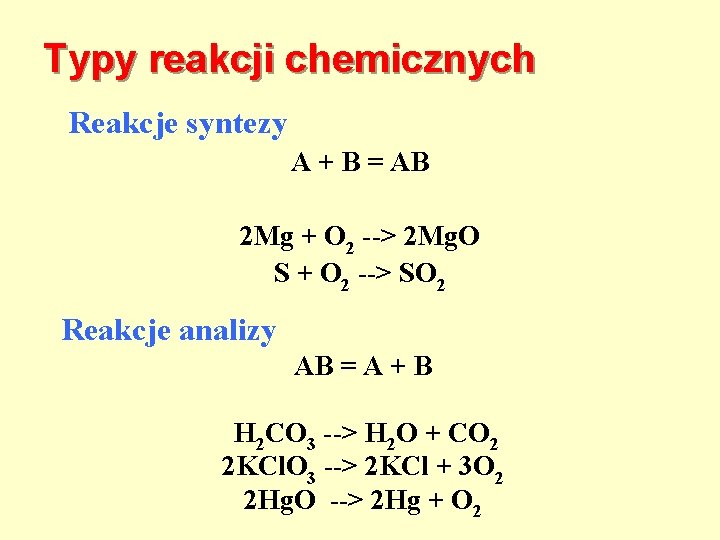
Typy reakcji chemicznych Reakcje syntezy A + B = AB 2 Mg + O 2 --> 2 Mg. O S + O 2 --> SO 2 Reakcje analizy AB = A + B H 2 CO 3 --> H 2 O + CO 2 2 KCl. O 3 --> 2 KCl + 3 O 2 2 Hg. O --> 2 Hg + O 2

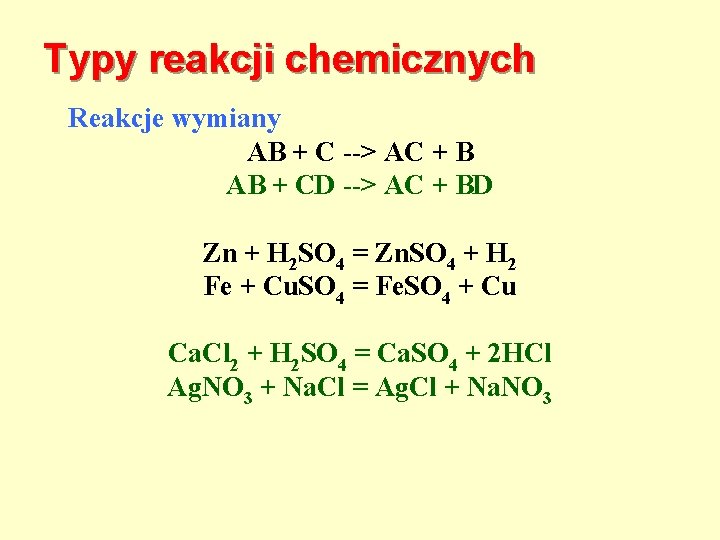
Typy reakcji chemicznych Reakcje wymiany AB + C --> AC + B AB + CD --> AC + BD Zn + H 2 SO 4 = Zn. SO 4 + H 2 Fe + Cu. SO 4 = Fe. SO 4 + Cu Ca. Cl 2 + H 2 SO 4 = Ca. SO 4 + 2 HCl Ag. NO 3 + Na. Cl = Ag. Cl + Na. NO 3

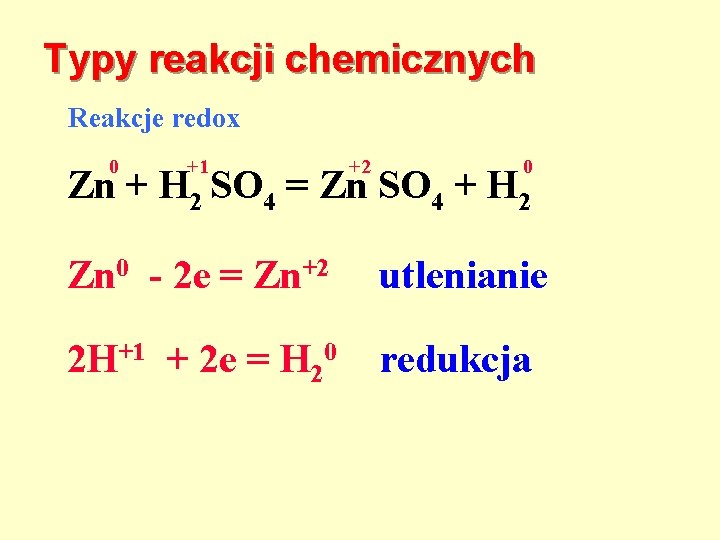
Typy reakcji chemicznych Reakcje redox Zn + H 2 SO 4 = Zn SO 4 + H 2

Typy reakcji chemicznych Reakcje redox 0 +1 +2 0 Zn + H 2 SO 4 = Zn SO 4 + H 2

Typy reakcji chemicznych Reakcje redox 0 +1 +2 0 Zn + H 2 SO 4 = Zn SO 4 + H 2 Zn 0 - 2 e = Zn+2 utlenianie 2 H+1 + 2 e = H 20 redukcja

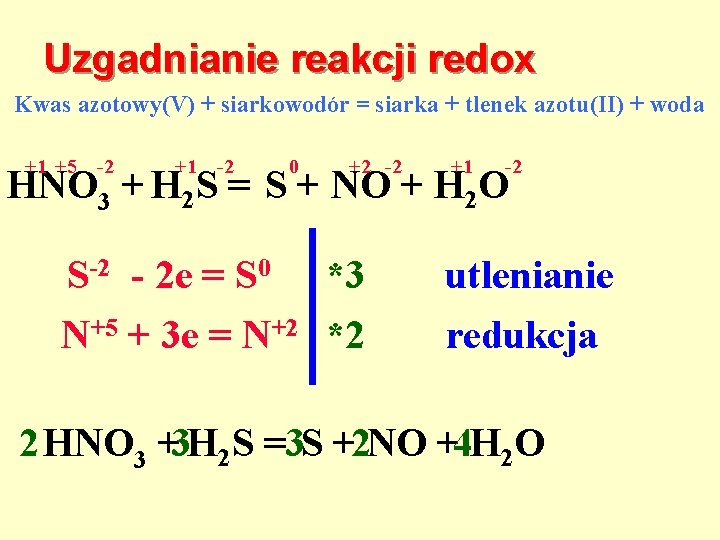
Uzgadnianie reakcji redox Kwas azotowy(V) + siarkowodór = siarka + tlenek azotu(II) + woda +1 +5 -2 +1 -2 0 +2 -2 +1 -2 HNO 3 + H 2 S = S + NO + H 2 O S-2 - 2 e = S 0 *3 N+5 + 3 e = N+2 *2 utlenianie redukcja 2 HNO 3 +3 H 2 S =3 S +2 NO +4 H 2 O

Obliczenia stechiometryczne 2 Mg + O 2 = 2 Mg. O 2 atomy magnezu + 1 cząst. tlenu = 2 cząst. tlenku magnezu 2 * 24 j. m. at magnezu 1* 32 j. m. at. tlenu 2*(24 + 16) j. m. at. tlenku magnezu 1 mol = 23 6, 02*10 2 Mg + O 2 = 2 Mg. O 2 mole magnezu + 1 mol tlenu = 2 mole tlenku magnezu 2 *24 g magnezu + 32 g tlenu = 2 *40 g tlenku magnezu

Przykład obliczeń stechiometrycznych Ile gramów kwasu siarkowego(VI) trzeba zużyć do zobojętnienia 20 g wodorotlenku sodowego? Rozwiązanie 1. Zapis i uzgodnienie reakcji chemicznej H 2 SO 4 + 2 Na. OH = Na 2 SO 4 + 2 H 2 O 2. Obliczenie stosunków masowych reagentów (2*1+32+4*16)g H 2 SO 4 x g H 2 SO 4 - 2*(23+16+1) g Na. OH 20 g Na. OH Potrzeba 24, 5 g kwasu siarkowego(VI)

Przykład obliczeń stechiometrycznych Jaka objętość wodoru (zmierzona w warunkach normalnych) wydzieli się w reakcji 0, 5 kg magnezu z nadmiarem kwasu siarkowego? Rozwiązanie Warunki normalne: p=101325 Pa, T=273 K, Objętość molowa gazu doskonałego w war. norm. V 0= 22, 4 dm 3

Przykład obliczeń stechiometrycznych Jaka objętość wodoru (zmierzona w warunkach normalnych) wydzieli się w reakcji 0, 5 kg magnezu z nadmiarem kwasu siarkowego? Rozwiązanie Mg + H 2 SO 4 = Mg. SO 4 + H 2 Mg = 24 g/mol, H 2 SO 4 = 98 g/mol, Mg. SO 4 = 120 g/mol, H 2 = 2 g/mol 24 g Mg - 22, 4 dm 3 H 2 500 g Mg - x dm 3 H 2 Powstanie 466, 7 dm 3 wodoru
 Wodoroboran
Wodoroboran Moc kwasow
Moc kwasow Wojciech lubas
Wojciech lubas Ahtapol
Ahtapol Wojciech sliwinski
Wojciech sliwinski Bitwa pod racławicami krótka notatka
Bitwa pod racławicami krótka notatka Wojciech wencel
Wojciech wencel Barbara adamiak
Barbara adamiak Metoda robienia filmów rysunkowych
Metoda robienia filmów rysunkowych Wojciech duliński
Wojciech duliński Wojciech rodek
Wojciech rodek Wojciech krawczyk
Wojciech krawczyk Wojciech dadak smierc
Wojciech dadak smierc Wojciech szpankowski
Wojciech szpankowski Opis obrazu juliana fałata jezioro świteź
Opis obrazu juliana fałata jezioro świteź Gawlik malarz
Gawlik malarz Wigilia na syberii malczewski
Wigilia na syberii malczewski Wojciech dworakowski
Wojciech dworakowski Redundancja w bazach danych
Redundancja w bazach danych Wojciech kic
Wojciech kic Silverlight 5
Silverlight 5 Wojciech szpankowski
Wojciech szpankowski Wojciech complak
Wojciech complak Niezawodność definicja
Niezawodność definicja Canaletto camera obscura
Canaletto camera obscura Samm model
Samm model Wojciech wyrzykowski pg
Wojciech wyrzykowski pg Profesor wojciech krajewski
Profesor wojciech krajewski Benzyna otrzymywanie
Benzyna otrzymywanie Mechanizm usuwania brudu
Mechanizm usuwania brudu Dakujem za pozornost chemia
Dakujem za pozornost chemia Chmia
Chmia Budowa atomu
Budowa atomu Odzysk wzorca wzór
Odzysk wzorca wzór Forenzná a kriminalistická chémia uplatnenie
Forenzná a kriminalistická chémia uplatnenie Ustal wzor rzeczywisty alkoholu o masie czasteczkowej 62
Ustal wzor rzeczywisty alkoholu o masie czasteczkowej 62 Logarytm dziesiętny
Logarytm dziesiętny 2-bromopropan + koh
2-bromopropan + koh Dneperska skola
Dneperska skola Wielcy rewolucjoniści nauki chemia
Wielcy rewolucjoniści nauki chemia Stavebné látky rastlinných tiel tvoria
Stavebné látky rastlinných tiel tvoria Iloczyn rozpuszczalności
Iloczyn rozpuszczalności Lipidy chemia
Lipidy chemia Dehydratacja chemia
Dehydratacja chemia


































































